本文内容速览:
随着基因组学研究不断深入以及基因改造工具的日益成熟,植物基因工程和育种正在进入一个快速发展的时代。利用基因编辑工具可以实现精确的遗传改良,从而改善作物表型。目前,将基因编辑元件递送到植物细胞中最常见的方法是农杆菌介导的遗传转化方法,但这种方法需要通过耗时且复杂的植物组织培养和再生过程来获得基因编辑材料,阻碍了双子叶和单子叶植物基因组编辑的常规应用。针对没有转化体系或遗传转化操作复杂且困难的物种,开发无需组织培养或不受基因型限制的递送系统是植物基因编辑亟待解决的关键技术问题。近些年,研究者们通过多方面的测试已经开发出了一些新的系统,可以将基因编辑元件输送到植物胚性或分生组织细胞中,并在不需要组织培养的情况下实现基因编辑。接下来,就和小远一起来看看具体的内容吧。
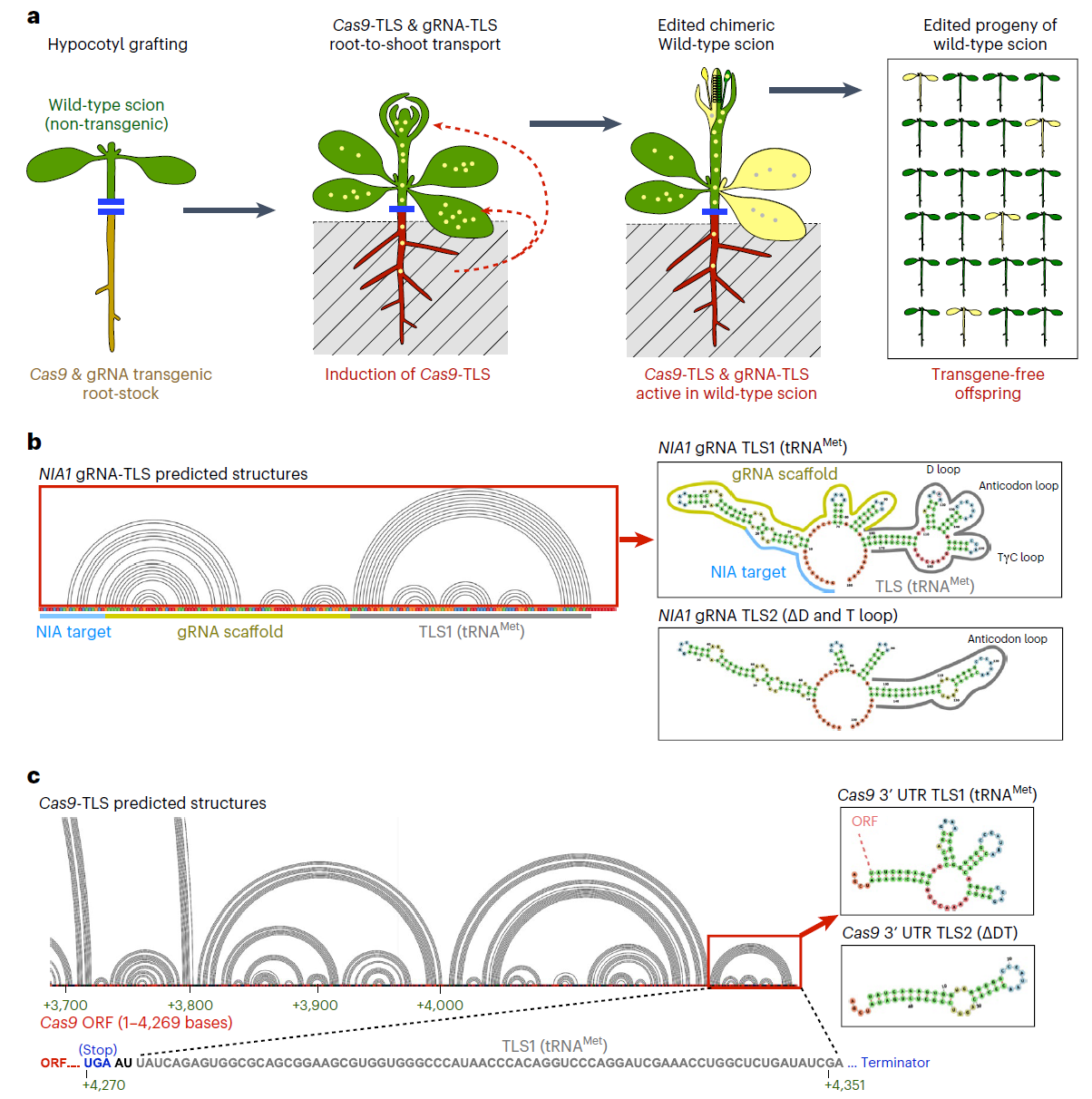
在该论文中,作者首先通过共折叠RNA结构预测证实,TLS基序的折叠不会在gRNA或Cas9融合结构中受到影响(图1)。并且先前的研究报道也表明将相关的TLS元件添加到gRNA中并不会干扰gRNA的功能(Xie et al., 2015; Ellison et al., 2020)。
图1 可移动的CRISPR-Cas9介导的基因编辑方法概览(Yang et al., 2023)。(a)“嫁接-移动”基因编辑系统的操作流程;(b、c)根据共转录折叠预测的gNIA1-TLS和Cas9-TLS的RNA的折叠结构,红色框表示论文中使用的TLS基序。
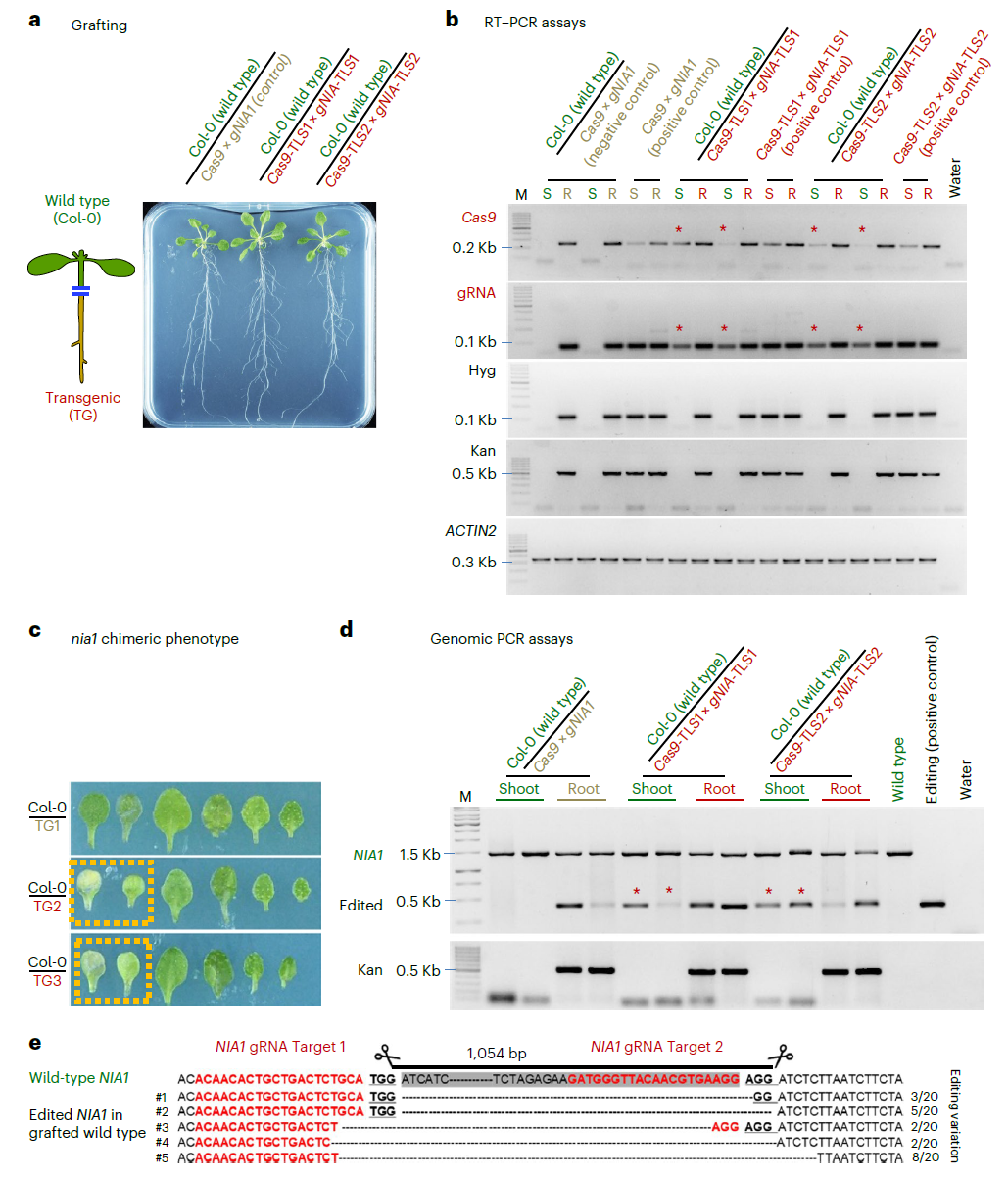
接着作者测试了Cas9转录本和gRNA能否从供体砧木转移至野生型接穗中,通过RT-PCR检测发现在表达Cas9-TLS1和gNIA1-TLS1或Cas9-TLS2和gNIA1-TLS2的砧木嫁接实验中,在嫁接的野生型接穗中检测到了Cas9-TLS和gNIA1-TLS转录本,这一结果表明TLS元件可以介导Cas9和gRNA的长距离转移。同时作者在接穗中还观察到nia1突变体的预期表型,通过基因组PCR和Sanger测序证实野生型接穗中可以检测到NIA1的缺失突变(图2)。从野生型拟南芥嫁接植株的后代中作者检测到了nia1突变体,这表明该方法可以在拟南芥中产生可遗传的编辑。
图2 Cas9-TLS和gNIA1-TLS可以从根部移动到接穗中对NIA1进行编辑(Yang et al., 2023)。(a)嫁接三周后从培养基中收集拟南芥地上部(S)和根(R)的样品;(b)RT-PCR检测转基因根和野生型接穗中Cas9与gNIA1的转录情况;(c)嫁接植物中嵌合突变体nia1叶片的褪绿表型;(d)利用基因组PCR检测NIA1编辑片段,标有星号的PCR扩增表示野生型接穗中CRISPR-Cas9成功诱导突变;(e)利用Sanger测序进一步证实了移动的CRISPR-Cas9成功实现了基因编辑。
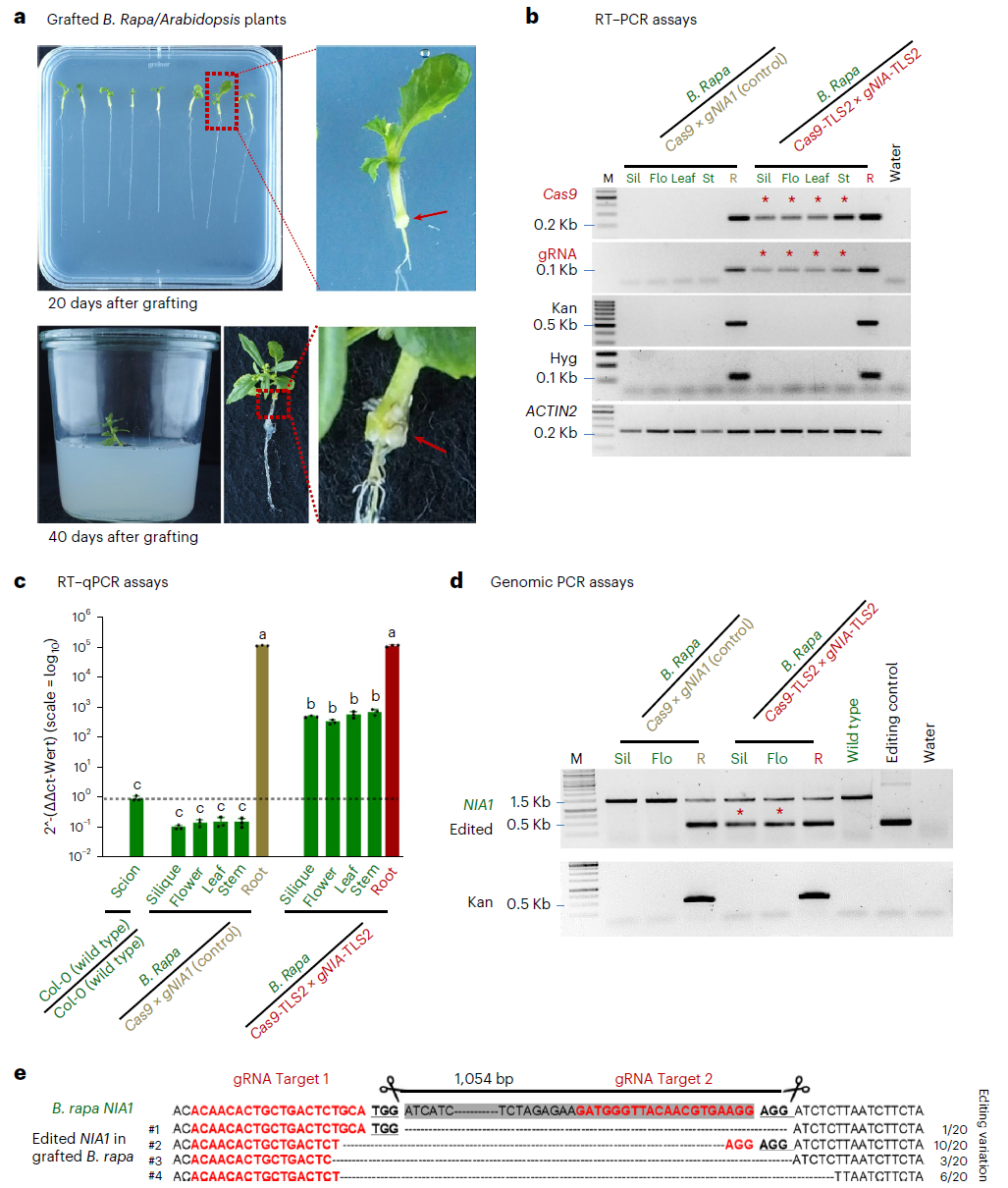
随后作者将野生型芸薹接穗跨物种嫁接到Cas9-TLS和gRNA-TLS转基因拟南芥砧木上,对该方法进行了进一步的试验。结果显示这种新型基因编辑系统可以有效地促进Cas9和gRNA转录本从拟南芥砧木转移到野生型芸薹接穗中实现基因编辑。这一结果说明该系统可以在跨物种的长距离基因编辑中应用。
图3 Cas9和gNIA1-TLS2在芸薹/拟南芥嫁接植物中可移动且具有功能性(Yang et al., 2023)。(a)芸薹/拟南芥嫁接植物(嫁接后20天和40天)的表型;(b)RT-PCR检测Cas9和gNIA1在砧木(拟南芥)及接穗(芸薹)的果荚、花、叶和茎中的转录情况;(c)RT-qPCR检测结果证明Cas9-TLS可以在砧木和接穗之间移动;(d)利用基因组PCR检测果实和花中的NIA1编辑片段;(e)Sanger测序结果进一步证实了移动的CRISPR-Cas9可以实现芸薹基因组编辑。
2021年5月,中国农业科学院油料作物研究所胡琼课题组和成都农林科学院付绍红课题组联合在Plant Biotechnology Journal杂志上发表了一篇题为“Direct Modification of Multiple Gene Homoeologs in Brassica oleracea and Brassica napus Using Doubled Haploid Inducer-Mediated Genome Editing System”的研究论文,该研究报道了一种不依赖遗传转化的甘蓝和油菜基因编辑技术,通过直接授粉的方式对甘蓝和油菜的基因进行编辑,即可获得不含转基因成分的突变体材料。
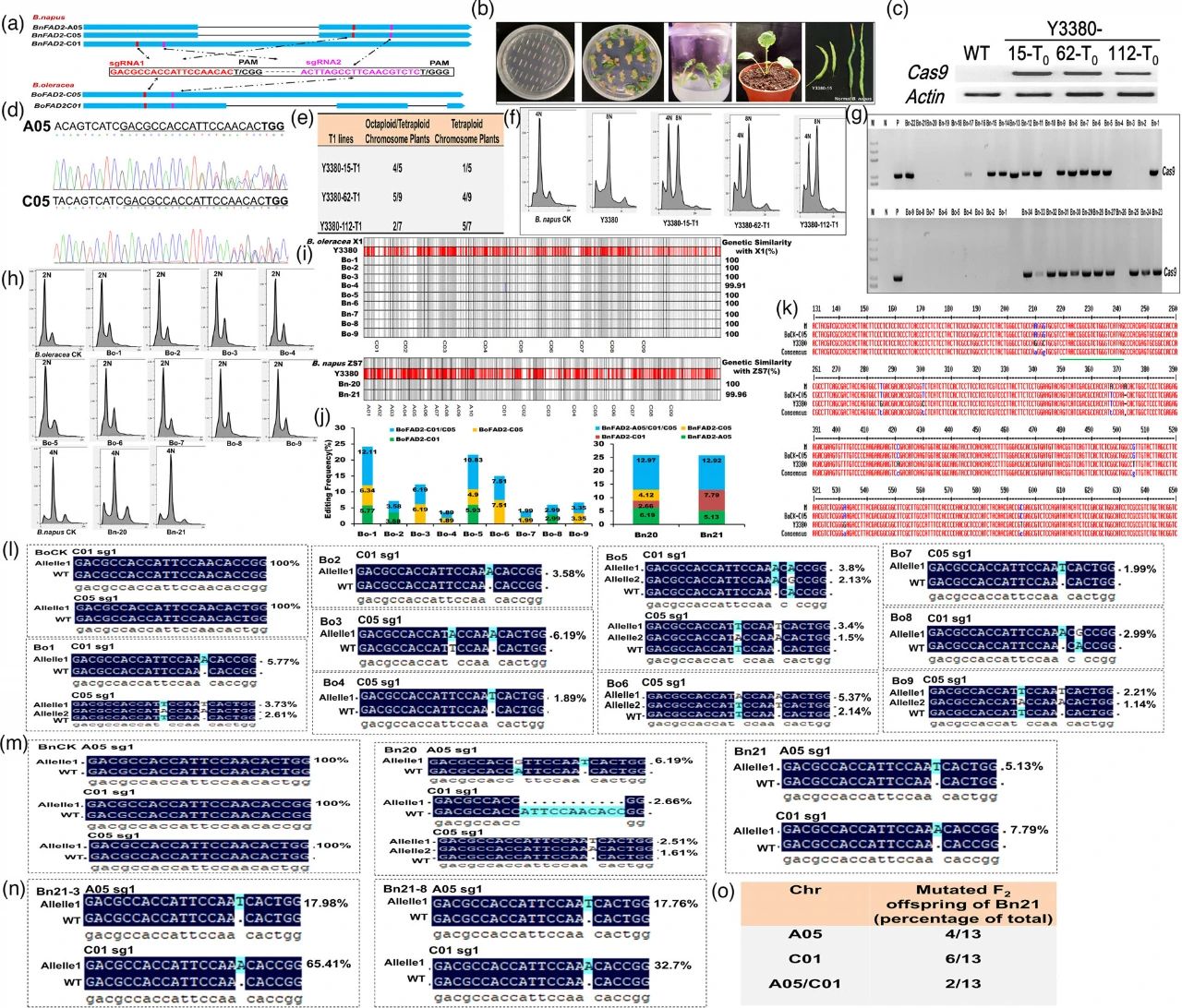
在该论文中,作者首先将基因编辑载体转化到芸薹属双单倍体诱导系Y3380中,然后利用Y3380作为基因编辑元件的传送介质,通过授粉的方式对育种材料甘蓝X1和油菜ZS7的FAD2基因进行基因编辑。在甘蓝和油菜的后代中,可以检测到多个同源序列发生编辑,且产生的突变可以稳定遗传。此外,结合流式细胞术检测发现突变体材料的倍性分别与其母本(甘蓝X1或油菜ZS7)一致,因此后期不需要再进行人工加倍。总之,该方法可以有效的克服基因型依赖性,加速甘蓝和油菜的基因功能研究。
图4 双单倍体诱导系介导的甘蓝和油菜中的多个同源基因的基因编辑(Li et al., 2021)。(a)设计了两个sgRNA用于靶向两个BoFAD2和三个BnFAD2同源基因的保守区;(b)Y3380的遗传转化;(c)RT-PCR分析三个转基因Y3380植株中的Cas9表达;(d)评估该CRISPR/Cas9系统在Y3380-15的T0植物中的功效;(e、f)Y3380-15、Y3380-62和Y3380-112的T1植物的流式细胞术分析;(g)使用Cas9特异性引物通过PCR检测筛选不含CRISPR/Cas9载体的后代;(h)双单倍体植株的DNA定量;(i)使用Bnapus 50K Illumina Infinium SNP 阵列对9个B.oleracea和2个B.napus后代进行基因分型分析;(j)对B.oleracea和B.napus双单倍体后代的不同FAD2同源基因中发生的编辑频率进行统计分析;(k)通过TA克隆方法验证Hi-Tom测序结果;(l-o)对B.oleracea(l)、B.napus(m)和F2代Bn-21(n)中Y3380-CRISPR/Cas9诱导的突变进行Hi-Tom测序分析。
2020年6月,明尼苏达大学Daniel F. Voytas课题组在Nature Plants杂志上发表了一篇题为“Multiplexed heritable gene editing using RNA viruses and mobile single guide RNAs”的研究论文,该研究开发了一种使用TRV载体表达可移动的sgRNA,在植物中实现高效基因编辑的方法。
在该论文中,作者基于先前的研究报道,了解到FT在叶片维管束组织中进行转录后,会转移至茎尖分生组织诱导植物开花(Jackson et al., 2012)。因此假设,将FT与sgRNA融合,那么sgRNA就有可能随FT从叶片向茎尖分生组织移动,并以较高的效率产生可遗传的基因编辑。
为了验证sgRNA能否随FT移动,作者将FT与靶向烟草PDS基因的sgRNA融合后一起构建到了TRV载体中。借助农杆菌侵染将载体转入表达SpCas9的转基因烟草叶片中,培养约2.5周后烟草新生叶片上开始出现白色斑点,随着植株的不断生长,这种表型在新叶上更加突出。这一结果表明该方法可以成功的在烟草上起作用,高通量测序结果也表明烟草上出现的白化表型是由于PDS功能缺失所致的。为了测试PDS的编辑能否遗传到下一代,作者对来自受感染亲本的幼苗进行了检测,结果显示约65%的后代幼苗中至少有一个PDS等位基因突变(图5)。
图5 使用TRV载体表达可移动的sgRNA进行可遗传的基因编辑(Ellison et al., 2020)。(a)TRV载体示意图;(b)利用改造后的TRV载体进行基因编辑的实验操作流程;(c)农杆菌侵染后约2.5周的本氏烟植株的表型;(d)农杆菌侵染后约10周的本氏烟植株的表型,左侧为对照组,右侧为实验组;(e)靶向PDS的移动sgRNA在侵染叶片上方第八片叶子中的编辑效率的统计结果;(f)PDS基因突变在后代中遗传情况;(g)与普通的sgRNA相比,可移动的sgRNA可以产生更高比例的双等位基因突变和杂合突变;(h)本氏烟幼苗的PDS基因编辑表型;mFT:突变的FT,Truncated FT:截短的FT。
随后作者通过构建含有多个可移动sgRNA的载体,来测试该方法在多基因编辑中的作用。结果显示,在后代中可以鉴定到在多个目标基因座处发生突变的植物(图6)。
图6 使用TRV载体表达可移动的sgRNA进行多基因编辑(Ellison et al., 2020)。(a)三种TRV2载体的示意图;(b)凝胶电泳结果显示基因编辑植株的一些后代出现了大片段缺失的情况;(c)对侵染后的本氏烟的十个子代进行基因分型;(d)多重RNA病毒载体在多个基因座中产生可遗传的编辑。
大麦条纹花叶病毒载体
大麦条纹花叶病毒(Barley stripe mosaic virus, BSMV)是一种正链RNA病毒,由RNAα、RNAβ和RNAγ三部分组成。在先前的研究中,该病毒已被设计用于sgRNA的递送,并在Cas9转基因小麦以及玉米叶片中实现了对宿主基因的编辑(Hu et al., 2019),但是其进行可遗传编辑的能力仍有待探索。
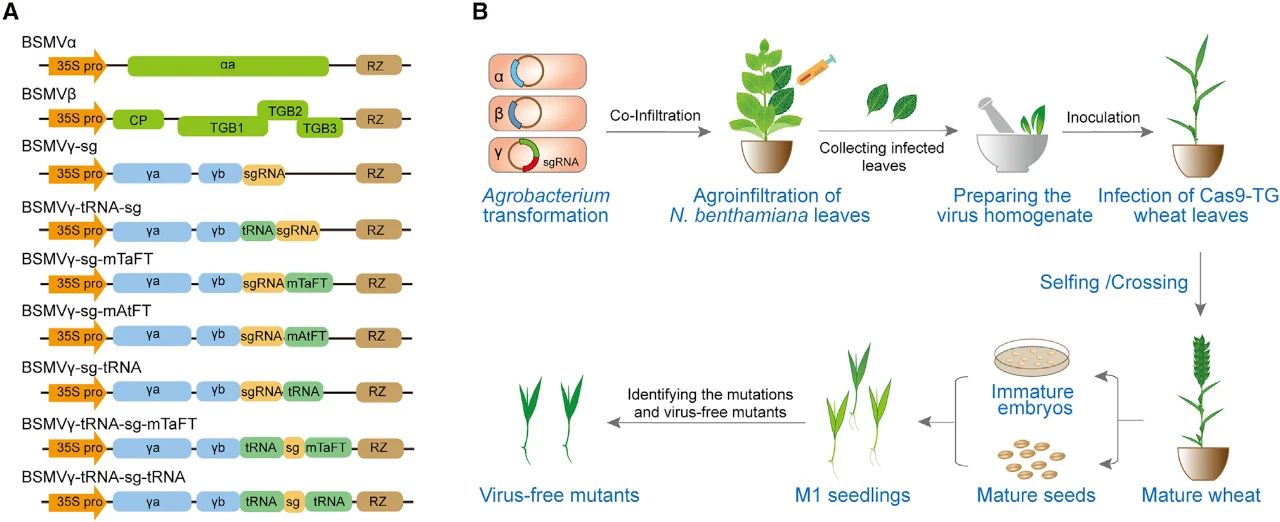
2021年7月,中科院遗传发育所王延鹏课题组和中国农业大学张永亮课题组联合在Molecular Plant杂志上发表了一篇题为“Highly efficient heritable genome editing in wheat using an RNA virus and bypassing tissue culture”的研究论文,该研究设计了一种基于BSMV的sgRNA递送载体BSMV-sg,在小麦中成功建立了高效、可遗传、不需要组织培养的基因编辑元件递送系统。
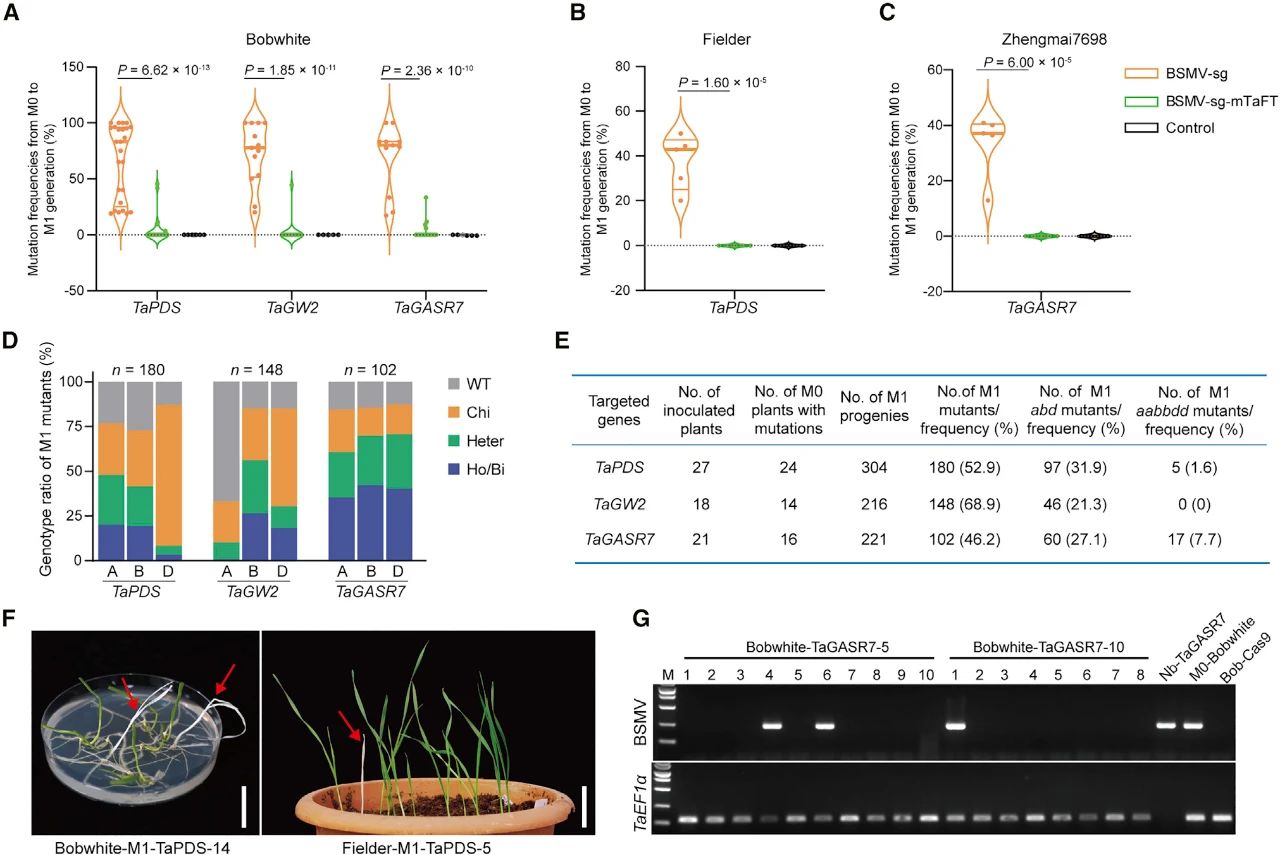
在该论文中,作者首先构建了一系列的BSMV载体,包括在sgRNA的5’或3’端连接tRNA和/或FT RNA移动元件的改造载体。将构建好的载体按照图7所示的接种流程,接种到处于营养生长中后期的Cas9转基因小麦中,待小麦结实后,对子代(M1代)植株进行基因编辑检测。高通量测序结果显示BSMV-sg载体系统可以在Bobwhite、Fielder和郑麦7698这三个不同品种的Cas9转基因小麦的不同靶点,实现高效的可遗传基因编辑,总体效率可达46.2%-68.9%。并且大部分发生编辑的子代植株中不含BSMV(图8)。为了测试该系统在多基因编辑中的效果,作者将携带不同sgRNA的BSMV-sg载体的农杆菌混合后,先接种到本氏烟草中,再用本氏烟接种叶片的提取物来侵染Cas9转基因小麦。对M0和M1代小麦的检测结果显示BSMV-sg可以在小麦中进行多重可遗传编辑。
图7 基于BSMV的基因编辑载体及小麦接种流程(Li et al., 2021)。(A)BSMV基因编辑载体示意图;(B)BSMV-sg介导的小麦基因编辑操作流程示意图。
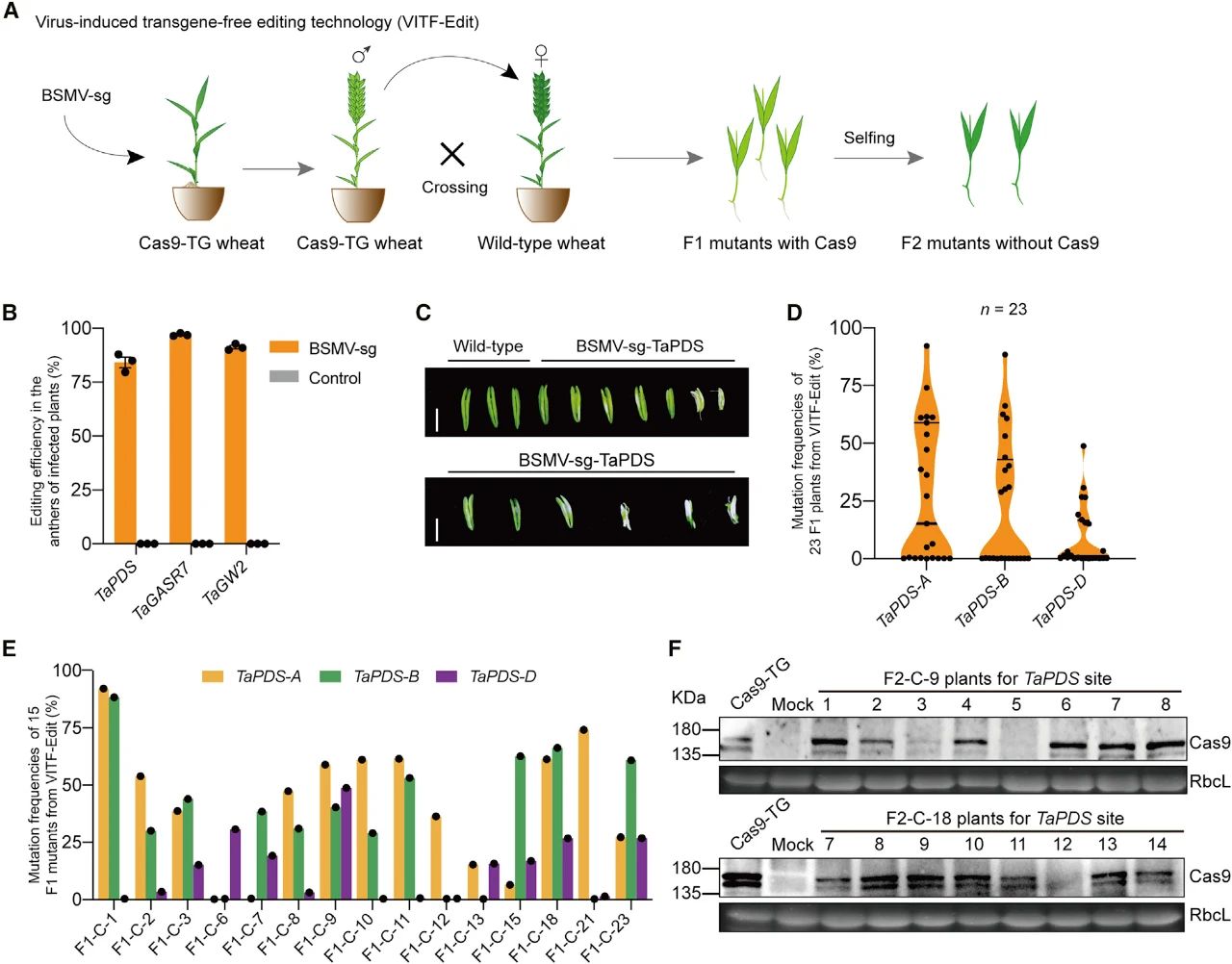
由于BSMV载体容量有限,难以容纳编码Cas9蛋白的核酸序列。因此,该系统需要使用稳定表达Cas9基因的受体植株,为了将Cas9快速的分离出去,作者还开发了一种病毒诱导的无转基因编辑技术(VITF-Edit),通过将BSMV侵染的Cas9转基因小麦花粉与野生型小麦进行杂交,从而生成不含转基因成分的小麦突变体(图9)。
图9 通过将接种BSMV-sg的小麦与野生型小麦杂交获得不含Cas9的突变体(Li et al., 2021)。(A)病毒诱导的无转基因编辑技术(VITF-Edit)的实验流程示意图;(B)接种BSMV-sg的Cas9转基因小麦植株的花药中,TaPDS、TaGASR7和TaGW2这三个基因被高效编辑;(C)接种BSMV-sg-TaPDS的小麦花药的白化表型;(D)VITF-Edit的F1后代中TaPDS的突变频率;(E)VITF-Edit中每个F1突变体中三个基因的突变频率;(F)F2代中无Cas9植物的蛋白质印迹分析。
2024年9月,北海道大学Tetsuya Yamada课题组在Plant Physiology杂志上发表了一篇题为“A DNA-free and genotype-independent CRISPR/Cas9 system in soybean”的研究论文,该研究报道了一种用于大豆基因编辑的新技术,通过利用体内粒子轰击-核糖核蛋白(in planta bombardment-ribonucleoprotein, iPB-RNP)的方法,将CRISPR/Cas9系统的RNP复合物(Cas9蛋白和gRNA结合形成的具有编辑功能的复合物)直接递送到大豆茎尖分生组织(SAM)细胞中,进而实现基因编辑。
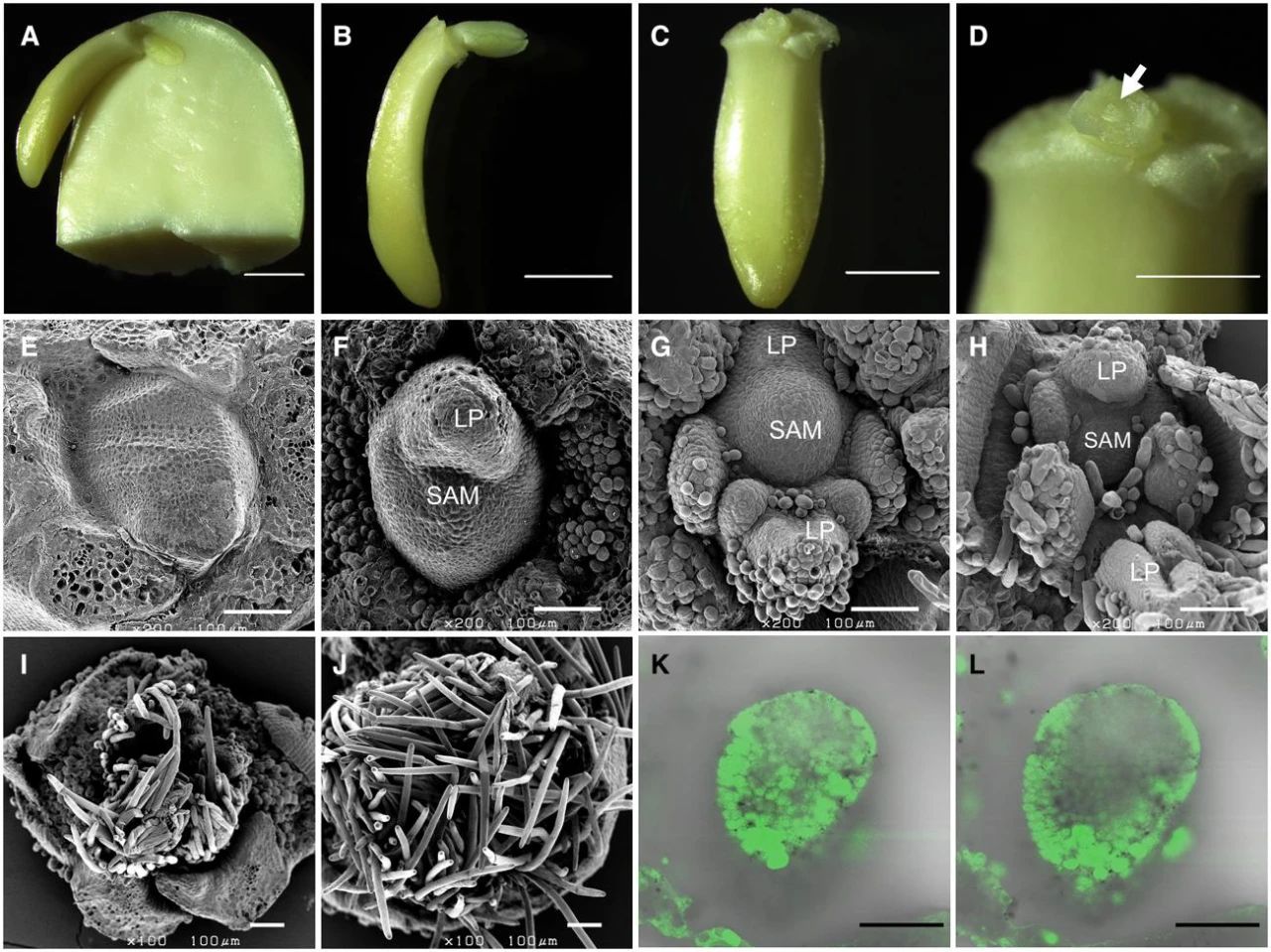
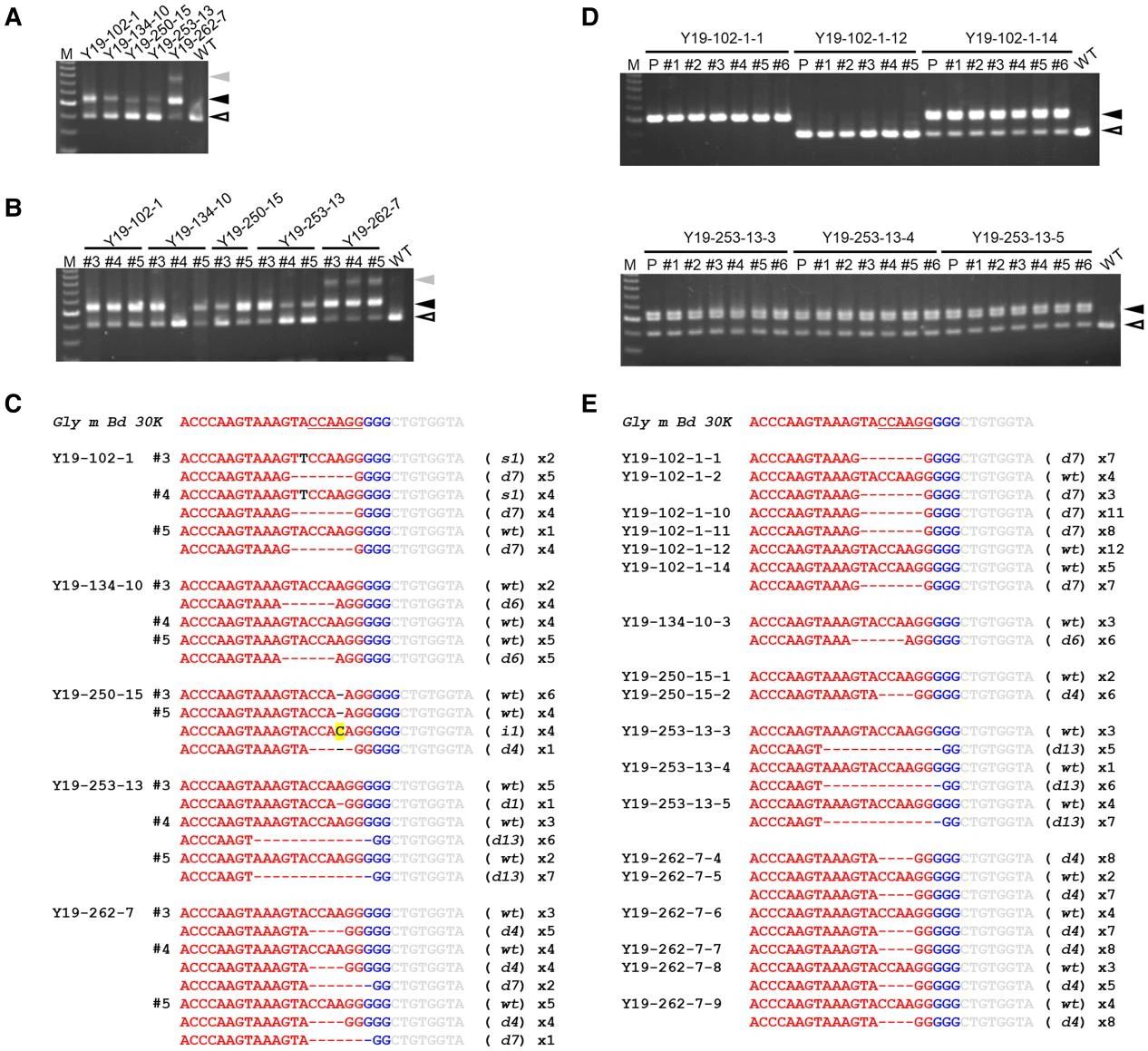
在该论文中,作者首先准备了胚轴,将发芽后的Yukihomare大豆种子子叶和初生单叶去除,使SAM暴露出来(图10),并将靶向Gly m Bd 30K的RNP复合物与金颗粒混合,使RNP复合物附着在金颗粒表面。随后,利用粒子轰击系统将涂覆RNP复合物的金颗粒轰击到大豆的SAM中。将轰击后的胚轴转移至MS培养基中培养至生根发芽,大约两周后就可以转移至土壤中种植直至成熟。利用酶切扩增多态性序列(Cleaved Amplified Polymorphic Sequences, CAPS)和测序对E0和E1代植株的突变情况进行检测,结果显示E0代的突变可以遗传到下一代(图11)。随后将iPB-RNP应用到Enrei、Fukuyutaka、Williams 82和Jack这四个大豆品种的基因编辑中,结果显示可遗传到E1代的突变频率约为所有E0植物的0.4%至4.6%。此外,作者还测试了iPB-RNP在多基因编辑中的作用,检测结果显示该方法可以在两个靶标区域内同时诱导突变。
图10 大豆下胚轴的SAM和Cas9蛋白递送的可视化(Kuwabara et al., 2024)。(A-D)大豆下胚轴,白色箭头指示的是SAM;(E-J)茎尖的扫描电镜结果,去除单叶后,大豆SAM在两天内形成了单个叶原基(LP)(F),随后又形成了其它的叶原基,之后毛状体开始覆盖SAM(I、J);(K、L)茎尖共聚焦激光扫描显微镜拍摄的结果,通过观察GFP荧光定位来确定金颗粒的输送。
图11 利用CAPS和测序分析检测E0和E1植株的突变情况(Kuwabara et al., 2024)。(A、B、D)CAPS分析:E0叶片中的大量DNA的CAPS分析(A);E0(B)和E1(D)叶片中的单个DNA分析;(C、E)测序分析:E0(C)和E1(E)植物中靶标及附近区域的测序分析。
小远叨叨
大家都知道利用基因编辑工具可以实现精准的遗传改良,从而改善作物的营养、品质以及性状。但是,目前基因编辑技术的应用还受到很多因素的限制,因此开发无需组织培养且不受基因型限制的基因编辑载体递送方法,可以使更多的植物能够进行基因编辑。在本次推文中小远主要是和大家分享了四种无需组培的基因编辑方法,分别是利用嫁接、授粉、病毒载体和粒子轰击-核糖核蛋白的方法来获得基因编辑材料。相信未来还会有更多的新方法来助力基因编辑领域的发展,大家如果有新的资料也欢迎和小远一起分享哦~
References: