本文内容速览:
泛素化和去泛素化修饰广泛参与了植物的生长发育、胁迫应激和代谢调控等多个过程。泛素化通过将小分子泛素共价结合到目标蛋白上后,目标蛋白质进入蛋白酶体进行降解,这可以调控目标蛋白的活性、位置和相互作用。而去泛素化则通过去除目的蛋白上已结合的泛素,恢复蛋白质的稳定性和功能,确保细胞功能的正常运作。泛素化与去泛素化的动态平衡影响着基因的表达调控、信号转导和细胞周期控制等重要过程。在“蛋白翻译后修饰——泛素化”和“蛋白翻译后修饰——泛素化(二)”这两篇文章中,小远已经给大家介绍了泛素化修饰的相关内容,想必大家对“去泛素化”相关的研究也很感兴趣,下面跟着小远一起去看看吧。
1.去泛素化酶
提到去泛素化,就不得不关注该过程中的重要成员“去泛素化酶(Deubiquitinating enzymes, DUBs)”。与泛素化修饰需要E1、E2及E3三种酶共同作用不同,去泛素化的过程只需要DUBs,且DUBs作用的底物蛋白是被泛素修饰的蛋白(图1)。DUBs通过水解泛素分子羧基末端的肽键、异肽键或酯键从而去除底物蛋白中的泛素或通过缩短共轭泛素链来抵消泛素化,进而抑制底物蛋白的降解(Vogel K and Isono E., 2024)。
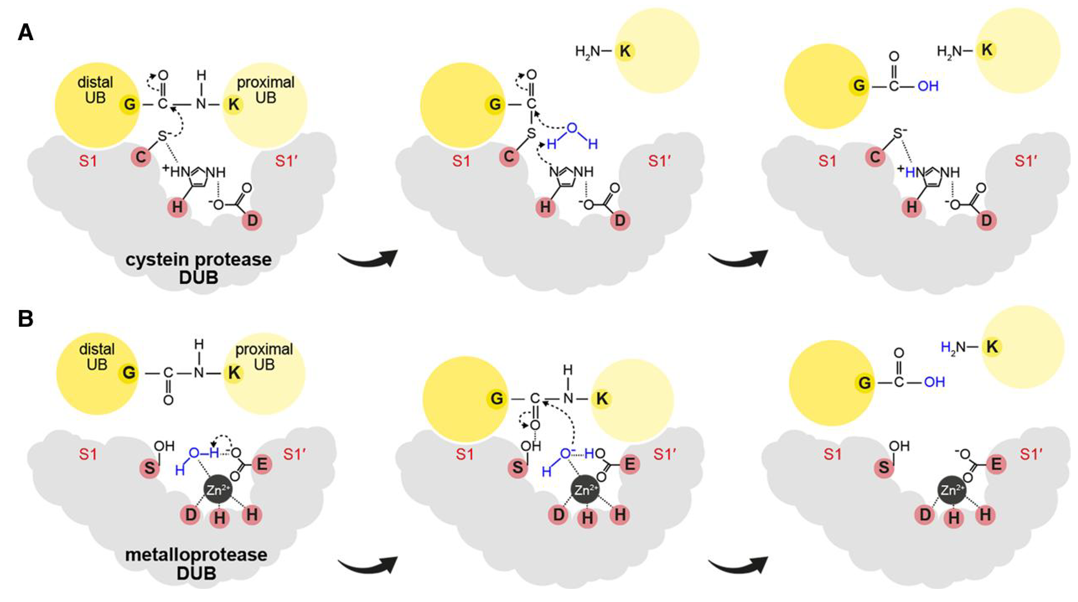
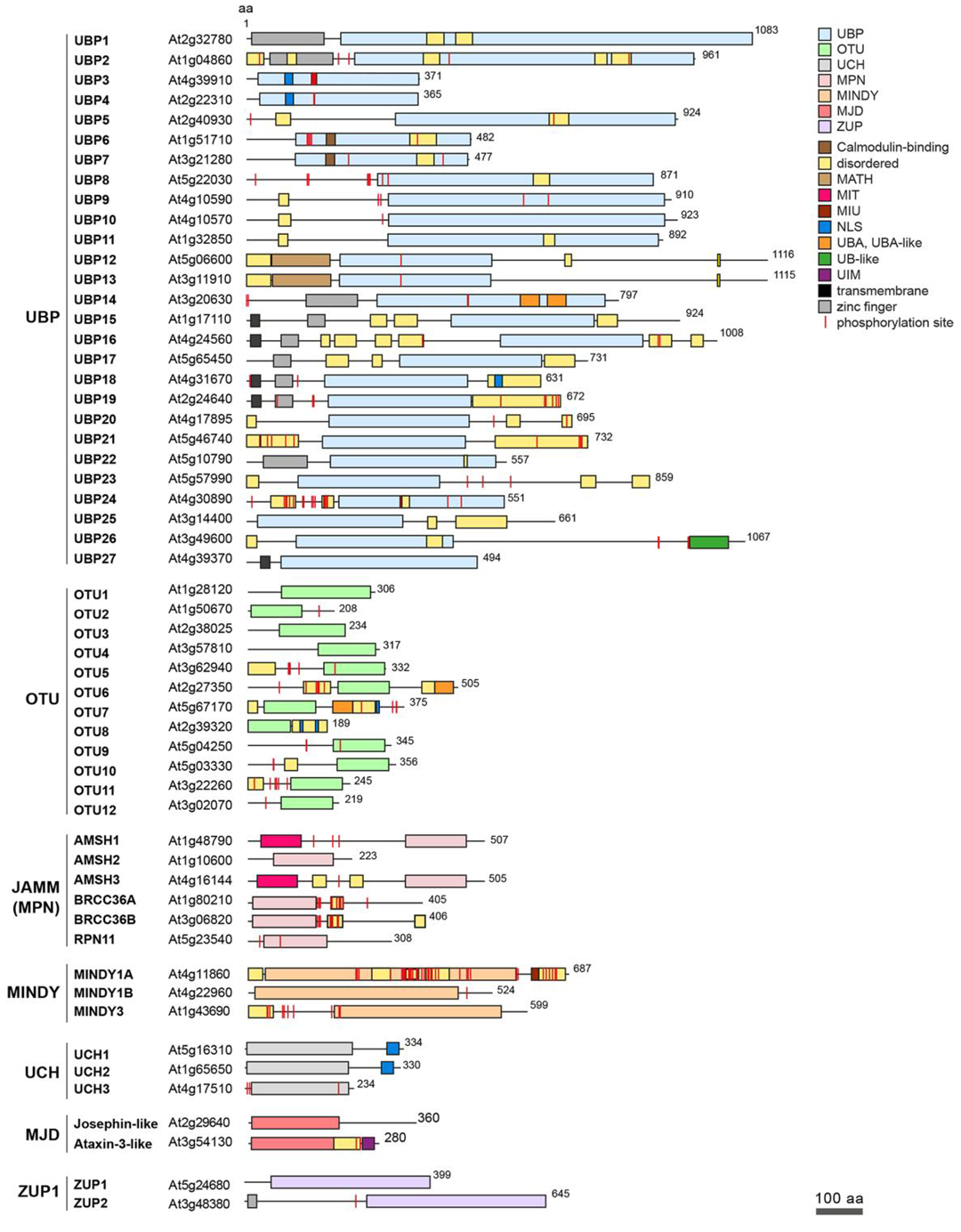
在真核生物中,根据催化机制的不同,DUBs可分为两大类:半胱氨酸蛋白酶家族和金属蛋白酶家族(图2)。其中,半胱氨酸蛋白酶家族包括泛素特异性蛋白酶(USPs)、泛素C端水解酶(UCHs)、Machado‑Joseph结构域蛋白酶(MJDs)、卵巢肿瘤蛋白酶(OUTs)、Motif与泛素分子结合的DUB家族蛋白酶(MINDYs)和含锌指泛素肽酶(ZUP/ZUFSP)六类;而金属蛋白酶家族只包含MPN(+)/JAMM蛋白酶家族(Clague et al., 2019)。根据当前已有的DUBs研究结果, Vogel K和Isono E两位研究者统计了拟南芥中DUBs的种类及其对应的结构域(图3)。
图2 特异性DUBs的催化机制(Vogel K and Isono E., 2024)。(A)以泛素二聚体为底物的半胱氨酸蛋白酶DUBs的催化机制。S1位点结合末端或远端泛素(UB环),而S1’位点结合近端泛素,该泛素有一个游离的C端或与靶蛋白结合。这些结合位点有助于将远端泛素的C端甘氨酸(G)和近端泛素的赖氨酸(K)之间的异肽键定位在活性位点附近。活性位点三联体由半胱氨酸(C)、组氨酸(H)和天冬氨酸(D)组成。在第一步中,半胱氨酸侧链的硫阴离子在异肽键的亲电碳原子上发生亲核攻击。半胱氨酸侧链的硫阴离子被质子化组氨酸侧链稳定,而组氨酸侧链又被天冬氨酸侧链稳定。亲核攻击后,催化位点半胱氨酸的硫原子与异肽键的碳原子之间形成临时键,导致异肽键断裂,近端泛素释放。亲电的碳原子是硫酯键的一部分,可以被来自水分子的亲核氧攻击。随后,来自水的羟基与远端泛素的C端甘氨酸的碳原子结合,将远端泛素从催化侧移除。催化位点组氨酸被来自水分子的第二个质子质子化;(B)金属蛋白酶DUBs的催化机理。远端泛素和近端泛素分别与S1和S1’位点结合,使异肽键靠近活性位点。活性位点包括一个丝氨酸(S)、一个天冬氨酸(D)、两个组氨酸(H)、一个谷氨酸(E)和一个由组氨酸和天冬氨酸配位的锌质子(Zn2+)。在泛素结合之前,活性位点的锌质子与水分子发生反应,这使得水分子处于活性中心,允许它的1个质子与谷氨酸侧链上带负电的氧原子结合,进而形成一个带负电荷的羟基,这个羟基此时处于攻击异肽键的亲电碳的最佳位置。当与泛素结合时,来自异肽键的亲电碳受到来自水的亲核氧的攻击,该反应通过活性位点丝氨酸对异肽键羰基氧原子的暂时稳定促进。水的亲核攻击引起异肽键的水解,导致远端和近端泛素的释放。远端泛素的C末端甘氨酸与来自水分子的羟基结合,而近端泛素赖氨酸侧链的氨基则与来自水分子的质子结合。参与反应的侧链官能团用骨架式表示,共价键用黑色实线表示,非共价键用黑色虚线表示。
图3 拟南芥DUBs的种类及结构域(Vogel K and Isono E., 2024)。
在“蛋白翻译后修饰研究套路”一文中小远给大家介绍了修饰酶和底物蛋白之间的互作关系可以通过常见的验证蛋白-蛋白互作的方法来进行确定,其实验证DUBs与底物蛋白之间的相互作用也是如此。前文提到DUBs可以去除底物蛋白上的泛素分子,那么在研究DUBs时,验证DUBs是否可以去除泛素分子便成为了课题中必不可少的环节,在这里小远给大家介绍2种常用的方法:
体内去泛素化检测
体内去泛素化检测是通过创制敲除、干扰或过表达去泛素酶的转基因株系,在植株体内检测去泛素化酶的功能的一种方法。

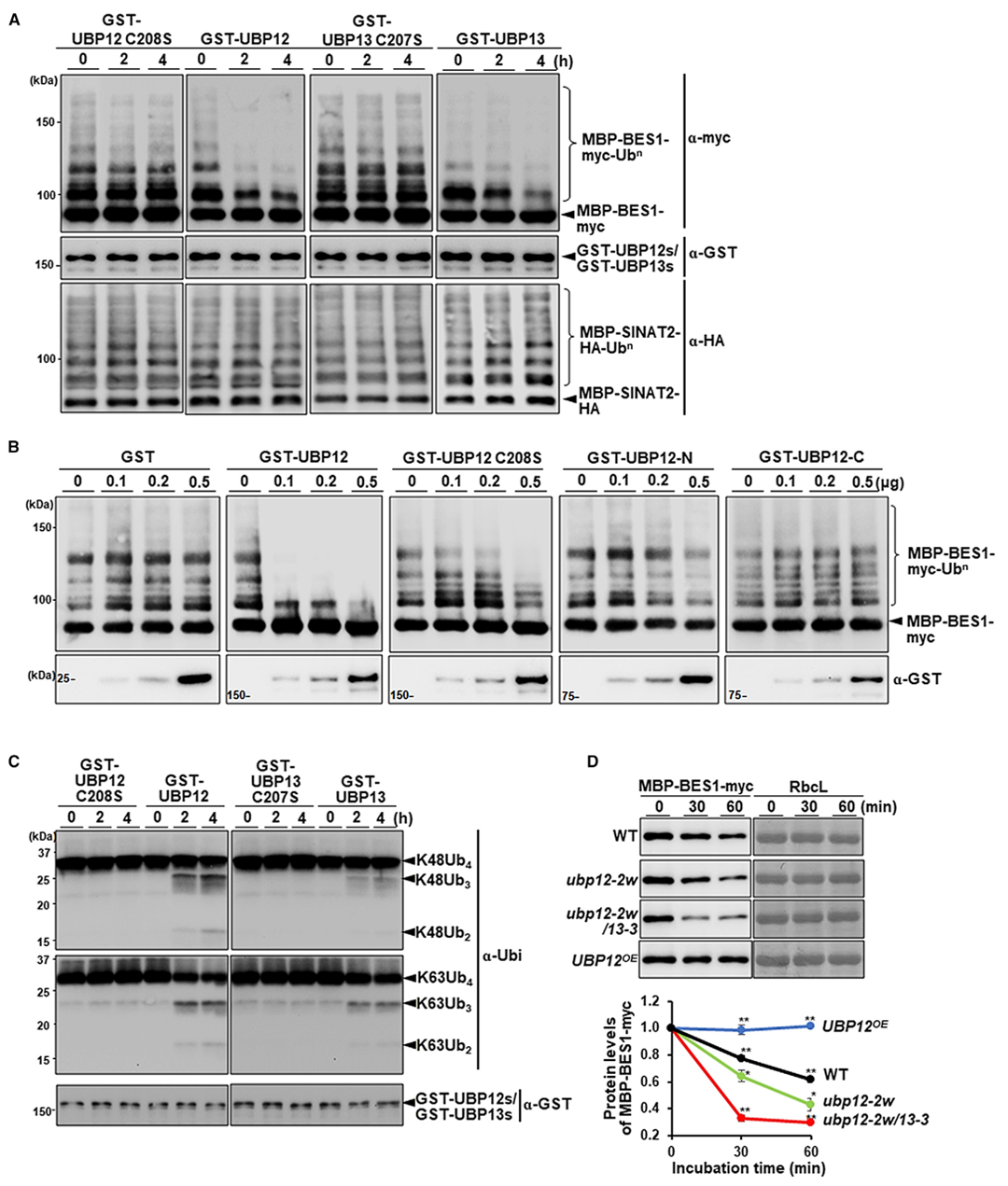
2022年9月,新加坡国立大学蔡南海课题组在Plant Communications杂志上发表了一篇题为“Deubiquitination of BES1 by UBP12/UBP13 promotes brassinosteroid signaling and plant growt”的研究论文,文中作者首先验证了去泛素酶UBP12与BES1之间存在相互作用,于是猜测泛素化的BES1是UBP12作用的底物蛋白。为了验证这一猜想,作者利用E3连接酶SINAT2泛素化BES1,GST-UBP12、GST-UBP13和多泛素化MBP-BES1-myc底物共反应0、2和4h,WB结果表明UBP12和UBP13确实可以在体外去除BES1的泛素化(图5)。
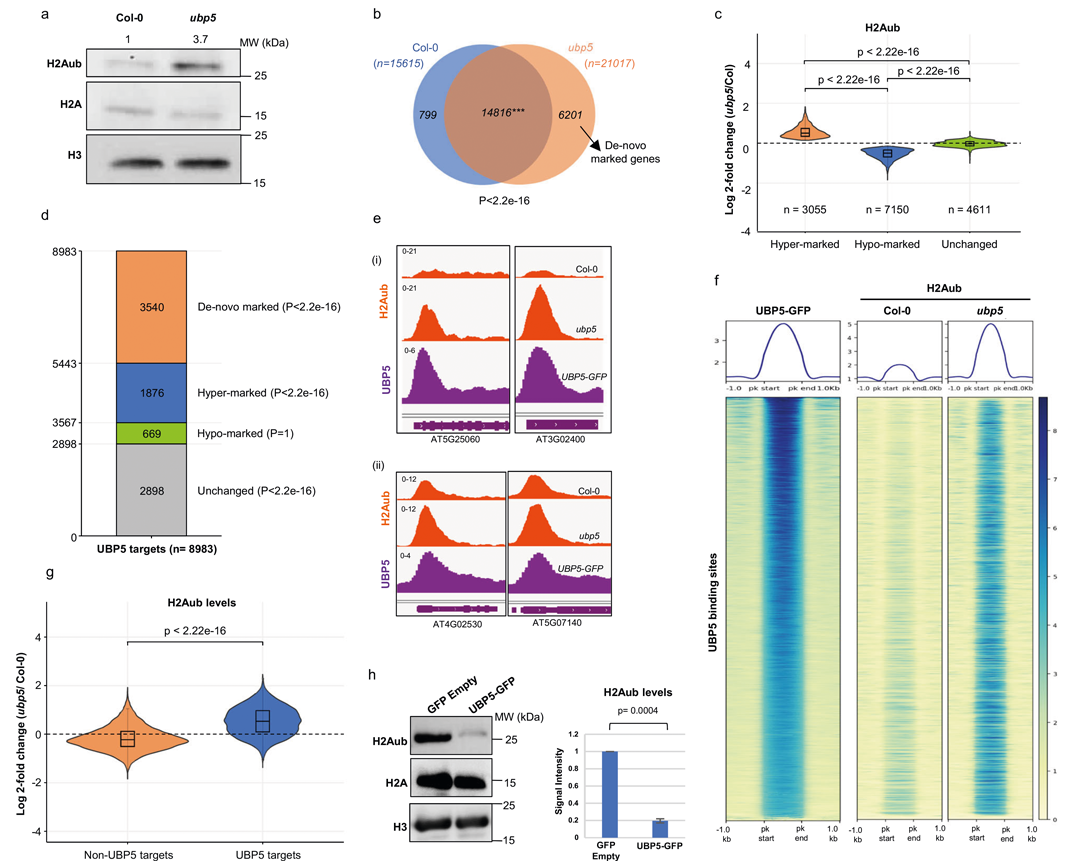
PcG(Polycomb group,PcG)家族蛋白是一类通过调控染色质结构来抑制基因转录的蛋白质复合物,PcG蛋白家族主要可以分为PRC1(Polycomb Repressive Complex 1)和PRC2(Polycomb Repressive Complex 2)两类,其中PCR1主要通过对组蛋白H2A进行泛素化修饰(H2Aub)抑制基因的表达;PCR2则通过对组蛋白H3第27位赖氨酸进行三甲基化修饰(H3K27me3)抑制基因表达。
2024年1月,爱尔兰高威大学Sara Farrona课题组在Nature Communications杂志上在线发表了一篇题为“The UBP5 histone H2A deubiquitinase counteracts PRCs-mediated repression to regulate Arabidopsis development”的研究论文,文中作者通过CRISPR Cas9基因编辑系统创制了拟南芥ubp5缺失突变体,结合转录组数据分析并观察植株表型证明泛素特异性蛋白酶5(UBP5)是一种植物发育调节因子。随后通过Western blot和ChIP-seq实验检测了H2Aub在野生型拟南芥(Col-0)和ubp5突变体植株中的表达水平和全基因组分布,结果表明,相比于Col-0,ubp5中的H2Aub修饰的基因数量大幅提升(图6),表明UBP5可以促进H2A的去泛素化,从而解除转录抑制。
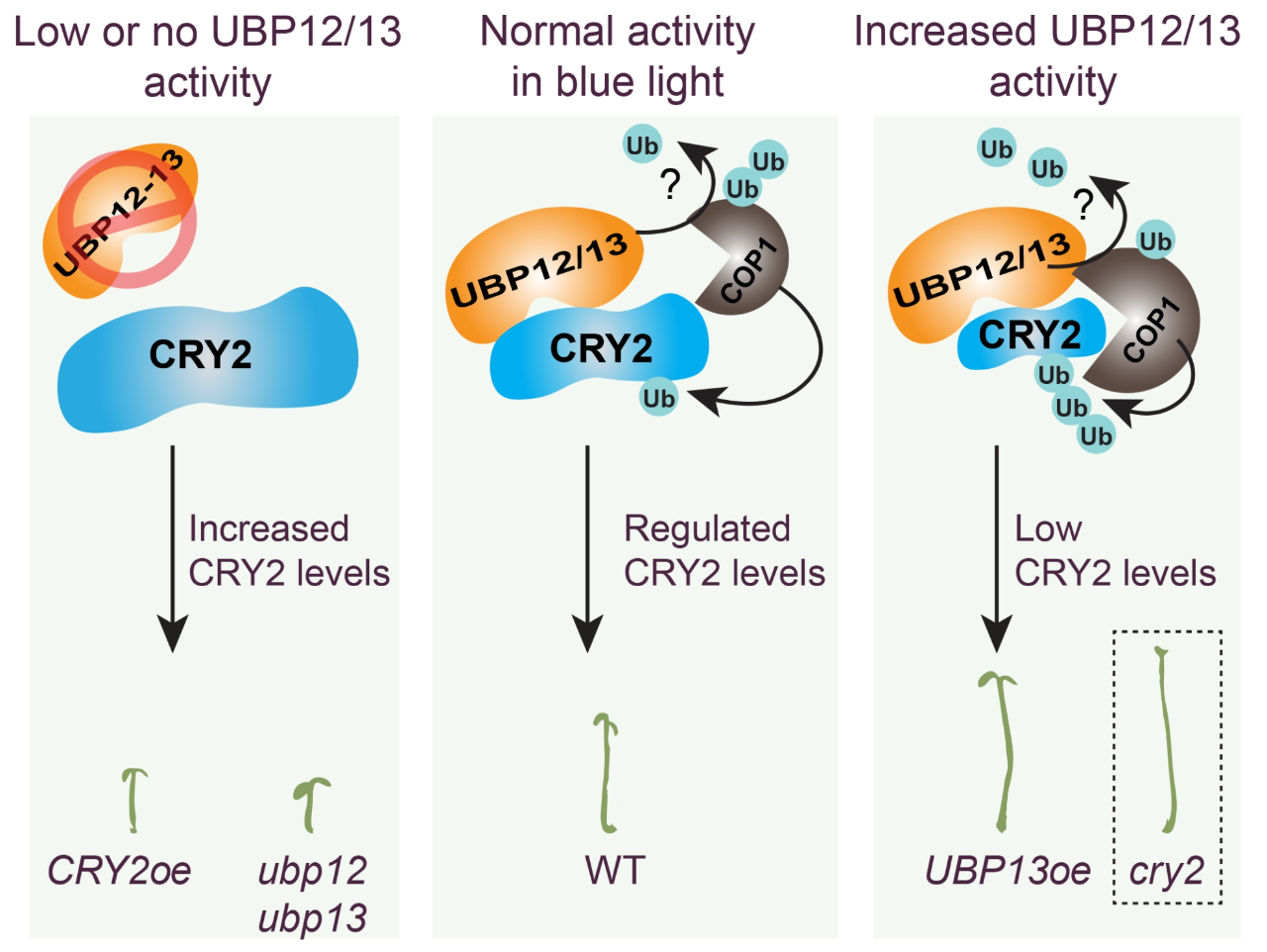
E3泛素连接酶作为26S蛋白酶体的主要组成成分,以高特异性泛素化其底物蛋白,从而使底物蛋白降解;DUBs可以防止底物蛋白降解,维持蛋白的稳定从而使其更好地发挥生物学功能。2022年8月,美国冷泉港实验室Ullas V. Pedmale课题组在Current Biology杂志上发表了一篇题为“UBP12 and UBP13 deubiquitinases destabilize the CRY2 blue light receptor to regulate Arabidopsis growth”的研究论文,文中作者发现拟南芥中的去泛素化酶UBP12和UBP13通过稳定E3泛素连接酶COP1间接调控CRY2的泛素化水平,从而调控拟南芥的下胚轴伸长。
各种生物和非生物胁迫产生的信号被定位于质膜(PM)的受体和转运蛋白感知并将其传递到细胞内,因此PM受体和转运蛋白的数量至关重要。PM蛋白的数量通常受到转录调控、蛋白质转运、翻译后修饰或蛋白质降解的影响,其降解是由泛素化和内体分选复合体(ESCRT)介导的。ESCRT具有泛素结合的亚基从而将泛素化的PM蛋白保留在内体膜上,直至被运输至腔内囊泡中,腔内囊泡与液泡融合,最终导致PM蛋白被液泡膜降解。PM蛋白通过内体降解的途径可以被DUBs调节。
2022年11月,康斯坦茨大学生物学系Erika Isono课题组在Nature Communications杂志上发表了一篇题为“Lipid-mediated activation of plasma membrane-localized deubiquitylating enzymes modulate endosomal trafficking”的研究论文,文中作者首先鉴定了OTU11和OTU12两个定位于质膜的DUBs,随后分析了野生型和out11out12双突突变体拟南芥植株中PIN2-GFP的水平(PIN2是一种跨膜蛋白,其以K63链连接的多泛素化依赖性方式被降解),发现当使用内体转运抑制剂BFA(布雷菲德菌素A )和WM(渥曼青霉素)时,out11out12双突变体植株细胞中更早观察到绿色荧光表明PIN2-GFP更早的积累在BFA小体和WM细胞区室中;黑暗处理时,out11out12双突变体植株中观察到比野生型更多的液泡绿色荧光信号(图8)。以上结果表明OTU11和OTU12参与调节PIN2的泛素化状态、向内体的转运和降解速率。
图8 OTU11和OTU12影响PIN2-GFP的内体转运(Vogel et al.,2022)。(a–c)野生型和otu11otu12植株表皮细胞中PIN2-GFP的共聚焦图像,用50μM BFA(a)、33mΜ WM(b)或在黑暗中(c)处理指定时间;(d-f)对a、b、c中观察到的荧光细胞的定量。
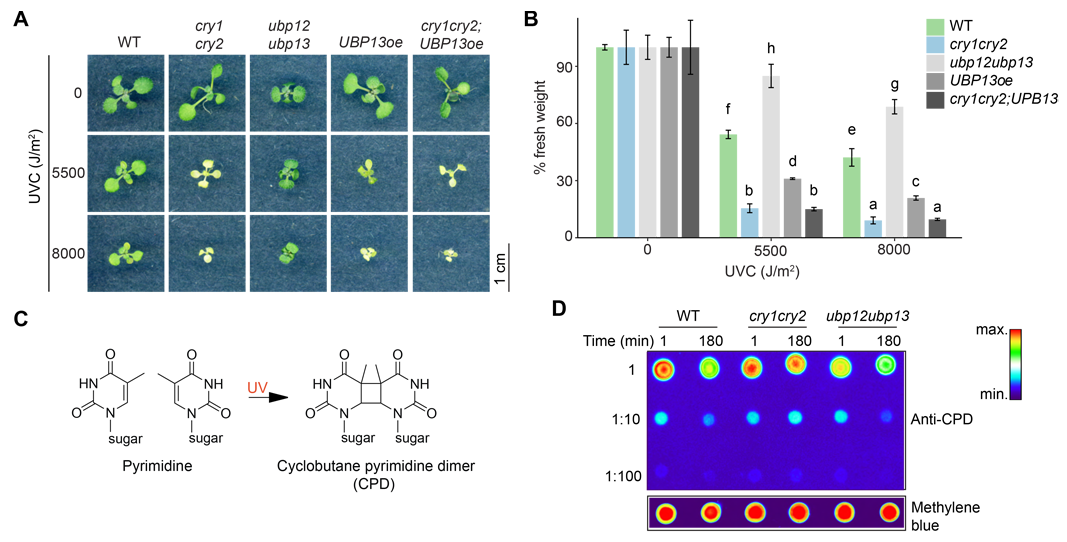
植物作为光依赖性生物,往往会受到阳光中的紫外线辐射和由于过度光照导致叶绿体中产生活性氧,进而造成DNA损伤,预防和修复DNA损伤的反应即为DNA损伤反应(DDR)。泛素化修饰参与调控动植物体内的DDR,在动物体内去泛素化酶USP3使组蛋白H2A去泛素化,负调控DNA损伤修复蛋白的招募(Sharma et al., 2014)。已有的研究表明在模式植物拟南芥中,隐花色素(CRY)感知蓝光从而影响中波段紫外线(UVB)受体UVB8蛋白的活性(Tissot N and Ulm R, 2020),然而植物CRY和DUBs在DDR中的作用机制尚不清楚。
在细胞内受到损伤的细胞器和生物大分子可以通过自噬反应清除。对于选择性自噬而言,自噬受体的泛素化是自噬识别并发挥清除作用的重要机制。线粒体自噬是真核生物中最常见的同时也是研究最为深入的选择性自噬之一,受到损伤的线粒体通过泛素化依赖的方式从细胞中清除(Onishi et al., 2021)。已有的研究表明在人体内USP15和USP30这两种DUBs作为线粒体自噬的负调控因子,抑制去极化线粒体外膜蛋白的泛素化降解(Bingol et al., 2014),在拟南芥中也存在人类USP15的同源DUBs,但是这些同源DUBs如何调控植物线粒体自噬小远目前还没有找到相关的研究文献,如果大家有看到相关文献欢迎发送给小远学习喔,小远之前也写过关于自噬的文章,如果大家感兴趣的话,可以阅读“如何研究蛋白的自噬降解?”进行学习!
虽然泛素化和去泛素化在生物体内保持动态平衡,然而关于去泛素化的研究远远不如泛素化深入,鉴定到的DUBs的数量也远远低于E3泛素连接酶。但是DUBs作为泛素系统中不可缺少的蛋白质酶在泛素的激活、循环利用及调控底物蛋白稳定性中发挥重要作用,显著的影响了植物生长发育过程中的多个生理生化过程。深入研究蛋白质去泛素化的分子机制,可以为植物基因功能的研究提供新的视角和思路,为植物的遗传改良和农业生产提供新的理论基础。
References:
Vogel K, Isono E. Erasing marks: Functions of plant deubiquitylating enzymes in modulating the ubiquitin code[J]. The Plant Cell, 2024: koae129.
Zheng C, Chen J, Wu Y, et al. Elucidating the role of ubiquitination and deubiquitination in osteoarthritis progression[J]. Frontiers in Immunology, 2023, 14: 1217466.
Clague M J, Urbé S, Komander D. Breaking the chains: deubiquitylating enzyme specificity begets function[J]. Nature reviews Molecular cell biology, 2019, 20(6): 338-352.
Zhou Y, Park S H, Soh M Y, et al. Ubiquitin-specific proteases UBP12 and UBP13 promote shade avoidance response by enhancing PIF7 stability[J]. PNAS, 2021, 118(45): e2103633118.
Park S H, Jeong J S, Zhou Y, et al. Deubiquitination of BES1 by UBP12/UBP13 promotes brassinosteroid signaling and plant growth[J]. Plant Communications, 2022, 3(5).
Godwin J, Govindasamy M, Nedounsejian K, et al. The UBP5 histone H2A deubiquitinase counteracts PRCs-mediated repression to regulate Arabidopsis development[J]. Nature Communications, 2024, 15(1): 667.
Lindbäck L N, Hu Y, Ackermann A, et al. UBP12 and UBP13 deubiquitinases destabilize the CRY2 blue light receptor to regulate Arabidopsis growth[J]. Current Biology, 2022, 32(15): 3221-3231. e6.
Vogel K, Bläske T, Nagel M K, et al. Lipid-mediated activation of plasma membrane-localized deubiquitylating enzymes modulate endosomal trafficking[J]. Nature Communications, 2022, 13(1): 6897.
Sharma N, Zhu Q, Wani G, et al. USP3 counteracts RNF168 via deubiquitinating H2A and γH2AX at lysine 13 and 15[J]. Cell cycle, 2014, 13(1): 106-114.
Tissot N, Ulm R. Cryptochrome-mediated blue-light signalling modulates UVR8 photoreceptor activity and contributes to UV-B tolerance in Arabidopsis[J]. Nature communications, 2020, 11(1): 1323.
Hu Y, Rosado D, Lindbäck L N, et al. Cryptochromes and UBP12/13 deubiquitinases antagonistically regulate DNA damage response in Arabidopsis[J]. BioRxiv, 2023.
Onishi M, Yamano K, Sato M, et al. Molecular mechanisms and physiological functions of mitophagy[J]. The EMBO journal, 2021, 40(3): e104705.
Bingol B, Tea J S, Phu L, et al. The mitochondrial deubiquitinase USP30 opposes parkin-mediated mitophagy[J]. Nature, 2014, 510(7505): 370-375.
图文来源:伯远生物公众号