本文内容速览:
关于磷酸化小远在之前的文章中已经介绍过多次(蛋白翻译后修饰——磷酸化(一),蛋白翻译后修饰——磷酸化(二)),一些基本的概念和研究方法大家也都比较清楚了,但是具体如何去做,在你心中是否有清晰的思路?答案未必是肯定的,因此小远结合相关文献给大家整理了一些具体的实验方法与实验思路供大家参考学习,希望大家看完有所启发。磷酸化在科研领域一直处于一个长盛不衰的地位,所以我们对它的学习也应该永不休止!
提到磷酸化,简单来说就是从修饰酶与底物两个方面来考虑,这个在之前的文章中也为大家介绍过,有一些通用的研究手段,小远在这里就不再重复,具体可参考“蛋白翻译后修饰研究套路”这篇文章。不管从哪个方面着手开展实验,最终都会落脚到某一具体的修饰酶和其对应的底物上进行后续的研究,那么后续如何研究?其实其思路基本都需要验证修饰酶是否具有对应的酶活性,以及修饰酶修饰底物具体发生在底物的哪个氨基酸上,接着对可以被修饰的关键氨基酸位点进行突变进一步证明修饰酶确实是在该氨基酸位点上使底物发生了对应的修饰。为了研究底物发生磷酸化/去磷酸化修饰之后具体具有什么功能,还可以模拟磷酸化和去磷酸化进行验证。那么在以上这些过程中具体都涉及哪些实验,下面请看小远为大家整理的相关文献案例。
背景介绍:
SnRK1是一种进化上保守的能量感应蛋白激酶。拟南芥中的两个SnRK1s:SnRK1.1(akin10)和SnRK1.2(akin11),被认为是响应非生物胁迫和能量信号转录网络的中心枢纽(Baena-Gonzalez et al., 2007)。
SnRK1.1的K48和T175是激酶活性所必需的两个氨基酸。SnRK1.1的保守赖氨酸残基(K48)是ATP结合所必需的,T175位于SnRK1.1的激活环(Baena-Gonzalez et al., 2007)。
SnRK1.1K48M-5:表达SnRK1K48M的T-DNA插入突变体。
cMYC-SnRK1K48M-1:以野生型拟南芥为受体材料,转入cMYC-SnRK1K48M-1得到的过表达材料。
实验解析:
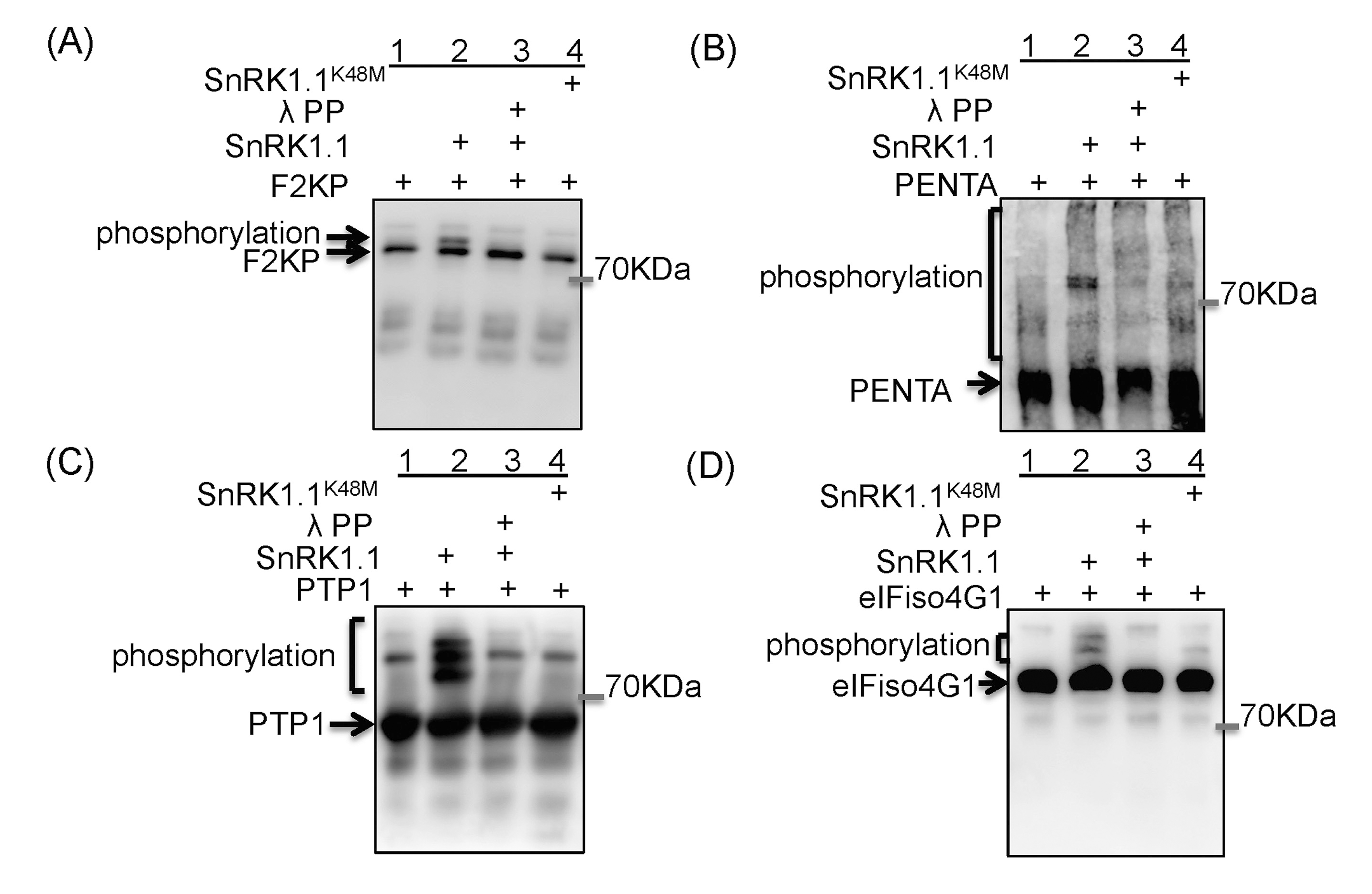
为了确定SnRK1.1在拟南芥淹水中的功能,作者使用iTRAQ检测了Col-0和SnRK1.1K48M-5中磷酸化的变化和细胞蛋白的丰度,发现淹水后磷酸化水平上调的蛋白大部分是SnRK1.1依赖性的,但它们在Col-0和SnRK1.1K48M-5中的蛋白水平在淹水后没有显著变化。
为了测试淹水后磷酸化水平上调的蛋白是否是SnRK1.1的直接靶点,作者选择了四种不同功能类别的候选底物,eIFiso4G1(翻译起始因子)、PENTA(RNA稳定性调节剂)、PTP1(蛋白酪氨酸磷酸酶1,ROS的主要靶点)和F2KP用于体外激酶测定,其中F2KP是一种众所周知的SnRK1.1底物。将这些蛋白与His和S标签融合,并通过大肠杆菌表达系统亲和纯化获得重组蛋白。此外,从Col-0和cMYC-SnRK1K48M-1中免疫沉淀活性SnRK1.1和非活性SnRK1.1K48M蛋白。将四种重组蛋白分别与活性SnRK1.1蛋白(IP-SnRK1.1-S)混合后,通过Phos tag SDS PAGE进行S标签免疫印迹,与仅加入重组蛋白的泳道(泳道1,图1A-D)相比,加了活性SnRK1.1蛋白的四种重组蛋白(泳道2,图1A-D)表现出迁移延迟。为了验证这些蛋白的迁移延迟是由SnRK1.1磷酸化引起的,作者用λ磷酸酶处理IP-SnRK1.1-S和重组蛋白的混合物(泳道3,图1A-D),或者将重组蛋白与非活性SnRK1.1K48M混合(泳道4,图1A-D),eIFiso4G1、PENTA和PTP1仅在活性SnRK1的混合物中表现出迁移延迟,表明这三种蛋白是SnRK1.1的体外底物。
知识补充:
Phos-tag是一种包含了Zn2+或Mn2+的功能性分子,能与磷酸离子特异性结合,形成稳定的化合物。在常规SDS-PAGE胶中加入Phos-tag,降低迁移速度,从而分离出磷酸化与非磷酸化蛋白。Phos-tag SDS PAGE检测蛋白的磷酸化虽然不受抗体限制,但精度不够,在一些文献中还是可以看见此方法的身影,不受抗体限制对于很多科研工作者来说还是很香的。
背景介绍:
FyPP1和FyPP3是编码丝氨酸/苏氨酸蛋白磷酸酶(PP6)的两个同源催化亚基。有报道称Asp-84(D84)与人类PP6的酶活性有关(Kajino et al., 2006)。因此,作者在之前的研究中在拟南芥FyPP1和FyPP3中鉴定出同源的Asp残基(D81),并将其突变为Asn(N)残基(FyPP1D81N和FyPP3D81N)。体外分析表明,突变体磷酸酶几乎失去了所有活性,表明D81确实是FyPP1和FyPP3活性所必需的(Dai et al., 2012)。
f1 f3:FyPP1和FyPP3的T-DNA插入双突变体。
F1DN:以野生型拟南芥为受体材料,转入35S:YFP-FyPP1D81N(35S:YFP-FyPP1D81N/Col)得到的过表达材料。
F3DN:以野生型拟南芥为受体材料,转入35S:YFP-FyPP3D81N(35S:YFP-FyPP3D81N/Col)得到的过表达材料。
F1OE:以野生型拟南芥为受体材料,转入35S:YFP-FyPP1(35S:YFP-FyPP1/Col)得到的过表达材料。
F3OE:以野生型拟南芥为受体材料,转入35S:YFP-FyPP3(35S:YFP-FyPP3/Col)得到的过表达材料。
实验解析:
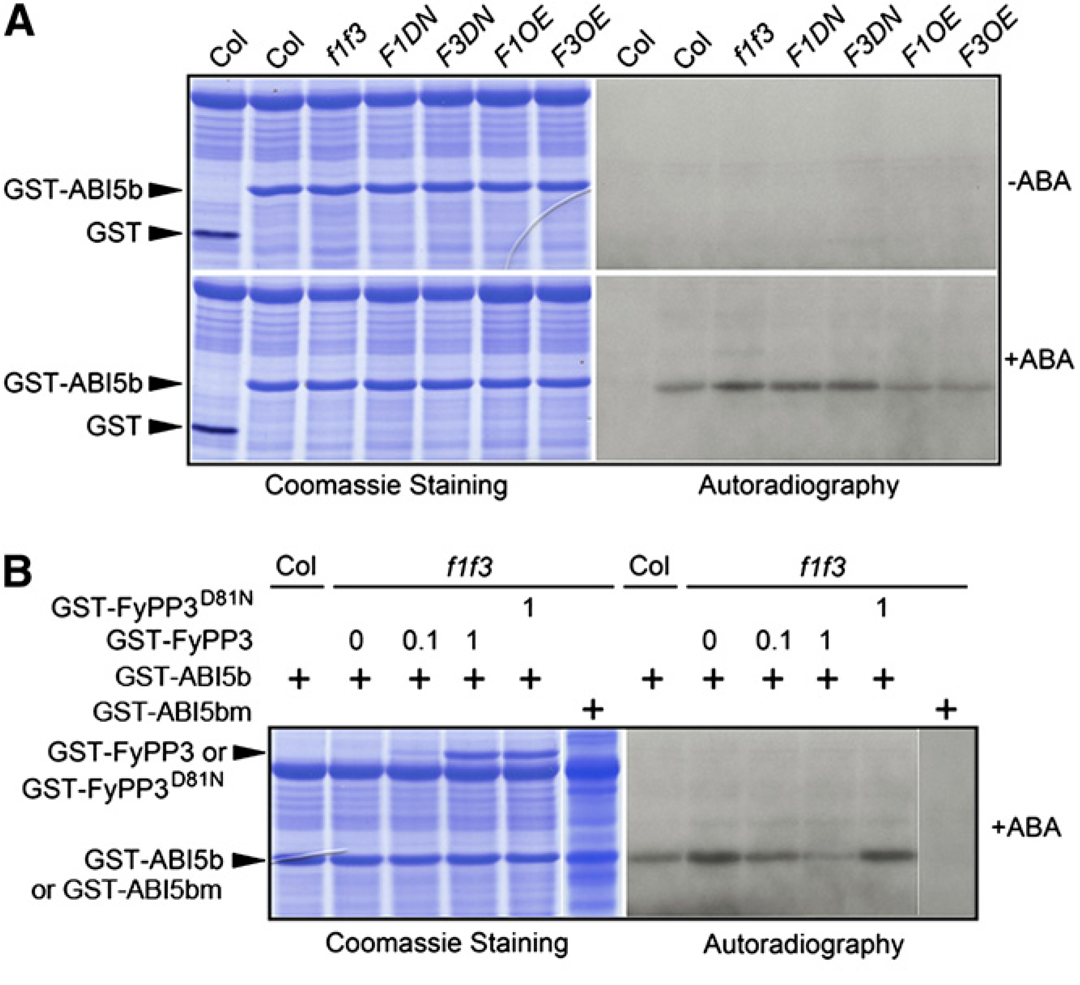
由于FyPP1和FyPP3可以直接与ABI5相互作用,因此作者测试了FyPP1和FyPP3是否可以直接使ABI5去磷酸化。先前有研究报道Ser119-Gln190 ABI5片段(ABI5b)可以被SnRK2.2/2.3/2.6激酶磷酸化(Nakashima et al., 2009)。因此,作者使用从大肠杆菌细胞中纯化的谷胱甘肽-S-转移酶(GST)标记的ABI5b作为底物,以及用ABA或对照溶剂作为激酶源处理过的Col、f1 f3、F1DN、F3DN、F1OE和F3OE幼苗制备的蛋白提取物进行体外磷酸化实验。等量的蛋白提取物和底物在这些实验中共孵育。在未经ABA处理的样本中均未检测到磷酸化的GST-ABI5b(图2A),表明ABI5的磷酸化依赖于ABA,这与之前的报道一致(Fujii et al., 2007;Nakashima et al., 2009)。然而,经过ABA处理后,与Col相比,f1 f3、F1DN和F3DN转基因幼苗蛋白提取物孵育的样品中磷酸化GST-ABI5b的量更高,而F1OE和F3OE幼苗蛋白提取物孵育的样品中磷酸化GST-ABI5b的量略低(图2A)。这些数据表明FyPP1/3活性与GST-ABI5b磷酸化之间存在相关性。
为了证实这一观察结果,作者进行了体外磷酸化/去磷酸化实验。将等量的GST-ABI5b蛋白和ABA处理过的Col或f1 f3幼苗的蛋白提取物进行孵育。作者将纯化的不同数量的野生型PP6磷酸酶(GST-FyPP3)或PP6缺失突变体(GST-FyPP3D81N)蛋白添加到与f1 f3幼苗的蛋白提取物和GST-ABI5b蛋白混合的样品中。结果显示,外源性GST-FyPP3的加入降低了GST-ABI5b的磷酸化量,而GST-FyPP3D81N的加入则没有降低GST-FyPP3蛋白的磷酸化量,并且GST-FyPP3蛋白的加入越多,检测到的GST-ABI5b磷酸化量越少(图2B)。此外,当使用突变体GST-ABI5b(ABI5bS145A或ABI5bm)作为底物时,没有观察到f1 f3突变体提取物的磷酸化带(图2B)。这些数据共同表明FyPP1/3蛋白对ABI5的去磷酸化作用在调节ABI5的磷酸化状态中起关键作用。
图2 FyPP1/3去磷酸化ABI5(Dai et al., 2013)。(A)GST-ABI5b(Ser119-Gln190)的体外激酶测定。在缺乏ABA的情况下,用Col、f1 f3、F1DN、F3DN、F1OE和F3OE幼苗的植物提取物处理后,没有检测到磷酸化的GST-ABI5b。经ABA处理后,与f1 f3、F1DN和F3DN幼苗的植物提取物孵育时,磷酸化GST-ABI5b的数量增加,而与F1OE和F3OE幼苗的植物提取物孵育时,磷酸化GST-ABI5b的丰度降低;(B)GST-FyPP3体外使GST-ABI5b去磷酸化。GST-FyPP3逆转了f1 f3幼苗提取物处理后GST-ABI5b的ABA依赖性去磷酸化。GST-FyPP3表达量的增加使GST-ABI5b磷酸化量减少,而失活磷酸酶(GST-FyPP3D81N)对GST-ABI5b磷酸化状态无影响。实验以ABI5突变体(GST-ABI5bS145A)为阴性对照。
小结:
激酶或磷酸酶对于底物是否有相关的酶活性,文献中用的比较多的方法是通过检测底物的磷酸化水平进行间接证明酶的活性,那么除此之外还有没有什么其它的方法可以用来证明酶的活性呢?答案当然是有的,请看下面的文献案例。
2023年3月,山东大学刘树伟课题组在Molecular Plant杂志上发表了一篇题为“Ca2+-dependent TaCCD1 cooperates with TaSAUR215 to enhance plasma membrane H+-ATPase activity and alkali stress tolerance by inhibiting PP2C-mediated dephosphorylation of TaHA2 in wheat”的研究论文。该工作首次解析了钙离子结合蛋白TaCCD1通过与生长素早期响应蛋白TaSAUR215互作抑制TaPP2C.D1/8的磷酸酶活性从而调控质膜(PM)H+-ATPase的磷酸化水平以促进小麦耐碱性的分子机制,为小麦抗碱育种改良提供了理论依据和基因资源。
文中作者为了证明TaSAUR215可以抑制TaPP2C.D1/8的磷酸酶活性,进行了体外磷酸酶实验,使用对硝基苯磷酸二钠盐(pNPP)作为底物,发现重组TaPP2C.D1/8-Myc蛋白具有磷酸酶活性。当加入重组TaSAUR215-GFP蛋白时,TaPP2C.D1/8的磷酸酶活性被抑制,表明TaSAUR215可以与TaPP2C.D1/8结合并抑制其磷酸酶活性(图3)。 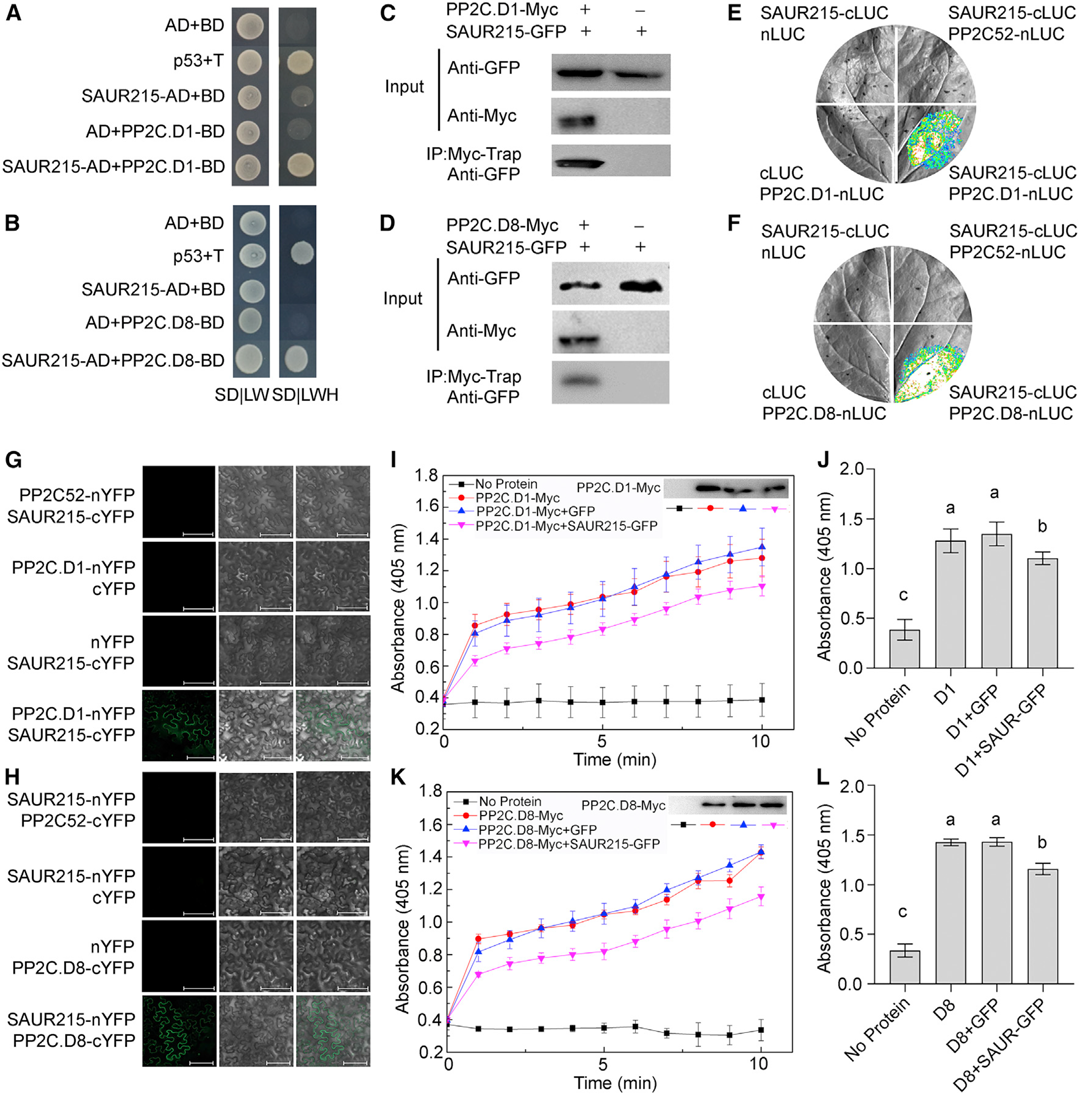
这个案例再次给大家展示了要想证明修饰酶对底物具有修饰作用,首先必须得证明修饰酶与底物之间存在互作,而证明互作的方法最好保证3个以上且最好同时包含体内和体外的实验方法。
知识补充:
分光光度法是一种常用的酶活测定技术,文中TaPP2C.D1/8是一种去磷酸化酶,它可以使磷酸化的蛋白质去磷酸化。对硝基苯磷酸二钠盐(pNPP)可以被TaPP2C.D1/8去磷酸化,变成对硝基苯酚,颜色呈黄色,检测405nm处光吸收值的变化可以间接检测酶活性的变化情况。
验证了激酶或磷酸酶对底物的磷酸化修饰或去磷酸化作用之后,接下来的思路一般就是验证底物上具体哪个氨基酸发生了磷酸化修饰或去磷酸化作用,在这个过程中涉及哪些实验以及如何研究,请看下面的文献案例(由于篇幅有限,这里仅以磷酸化修饰位点的鉴定为例)。
背景介绍:
CPK5/CPK6:钙依赖蛋白激酶(CDPKs)。
MPK3/MPK6:丝裂原活化蛋白激酶。
CPK5CA:CPK5活性变体,缺乏CPK5的C端自抑制和Ca2+结合域。
实验解析:
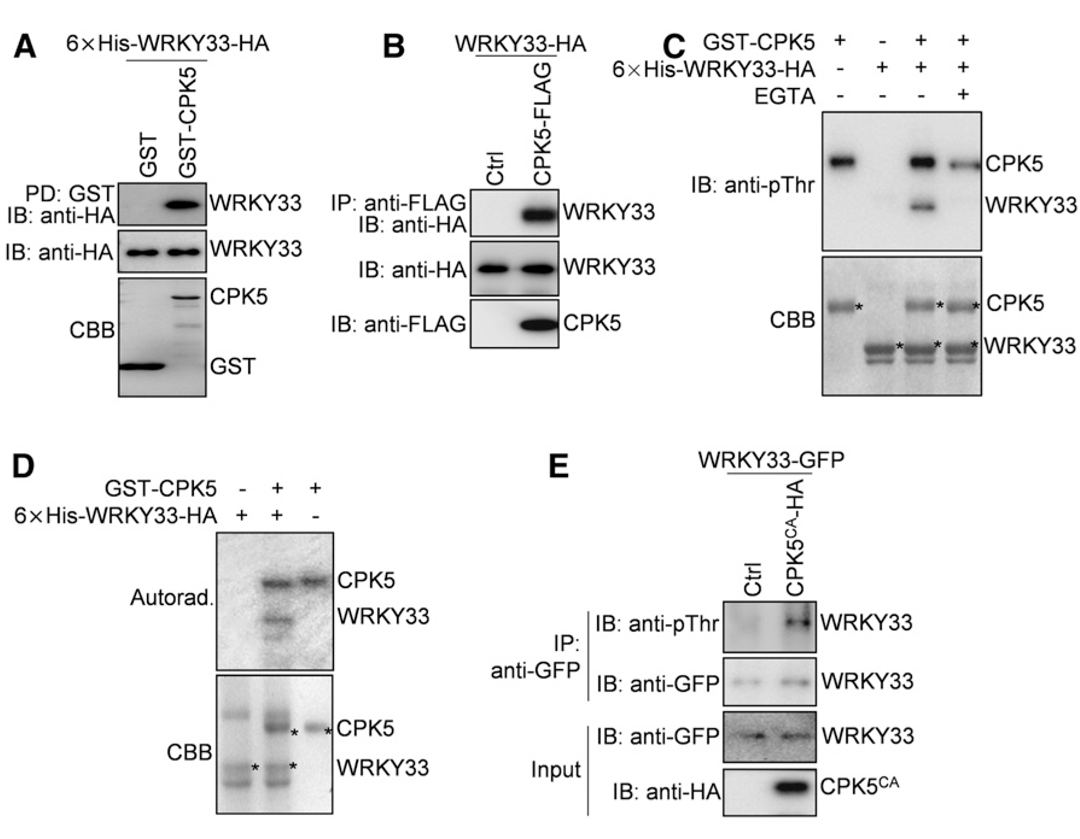
作者之前证明WRKY33可以与自身启动子结合,表明WRKY33的表达是自激活的(Mao et al., 2011)。因此,作者推测CPK5/CPK6对WRKY33表达的正向调控可能是由于CPK5/CPK6磷酸化并激活WRKY33,进而激活其自身和植保素(Camalexin)生物合成基因的表达。为了验证这一假设,作者研究了CPK5是否与WRKY33相互作用。接着通过GST pull-down和Co-IP实验证明了CPK5在体外和体内都与WRKY33相互作用。
为了进一步探索CPK5是否磷酸化WRKY33,作者使用抗磷酸化的苏氨酸抗体(抗pThr)或抗磷酸化的丝氨酸抗体(抗pSer)进行了体外磷酸化实验。如图4C所示,在Ca2+存在的情况下,GST-CPK5强烈磷酸化6×His-WRKY33-HA,该磷酸化可以通过抗pThr抗体检测到,而通过抗pSer抗体没有检测到。在EGTA(Ca2+螯合剂)存在的条件下,GST-CPK5对6×His-WRKY33-HA的磷酸化被阻断,突出了CPK5介导磷酸化的特异性。另一项使用γ-32P标记ATP的磷酸化实验证实了GST-CPK5在体外磷酸化6×His-WRKY33-HA(图4D),这也表明抗pThr抗体可以成功地用于检测CPK5介导的WRKY33磷酸化。因此,作者利用该抗体检测拟南芥原生质体中CPK5是否能磷酸化WRKY33,其中HA标记的CPK5CA与GFP标记的WRKY33在拟南芥原生质体中共表达。如图4E所示,WRKY33-GFP在拟南芥原生质体中被共表达的CPK5CA-HA磷酸化。总之,这些结果表明CPK5在体外和体内磷酸化WRKY33。除了CPK5,基于GST pull-down、Co-IP和磷酸化实验,CPK6还与WRKY33相互作用并使其磷酸化,这与CPK5和CPK6在调节植保素生物合成中的冗余作用一致。
图4 CPK5在体外和体内与WRKY33相互作用并对其磷酸化(Zhou et al., 2020)。(A)GST pull-down实验证明CPK5与WRKY33在体外互作;(B)Co-IP实验证明CPK5与WRKY33在体内互作;(C、D)CPK5在体外磷酸化WRKY33;(E)在拟南芥原生质体中,CPK5磷酸化WRKY33。
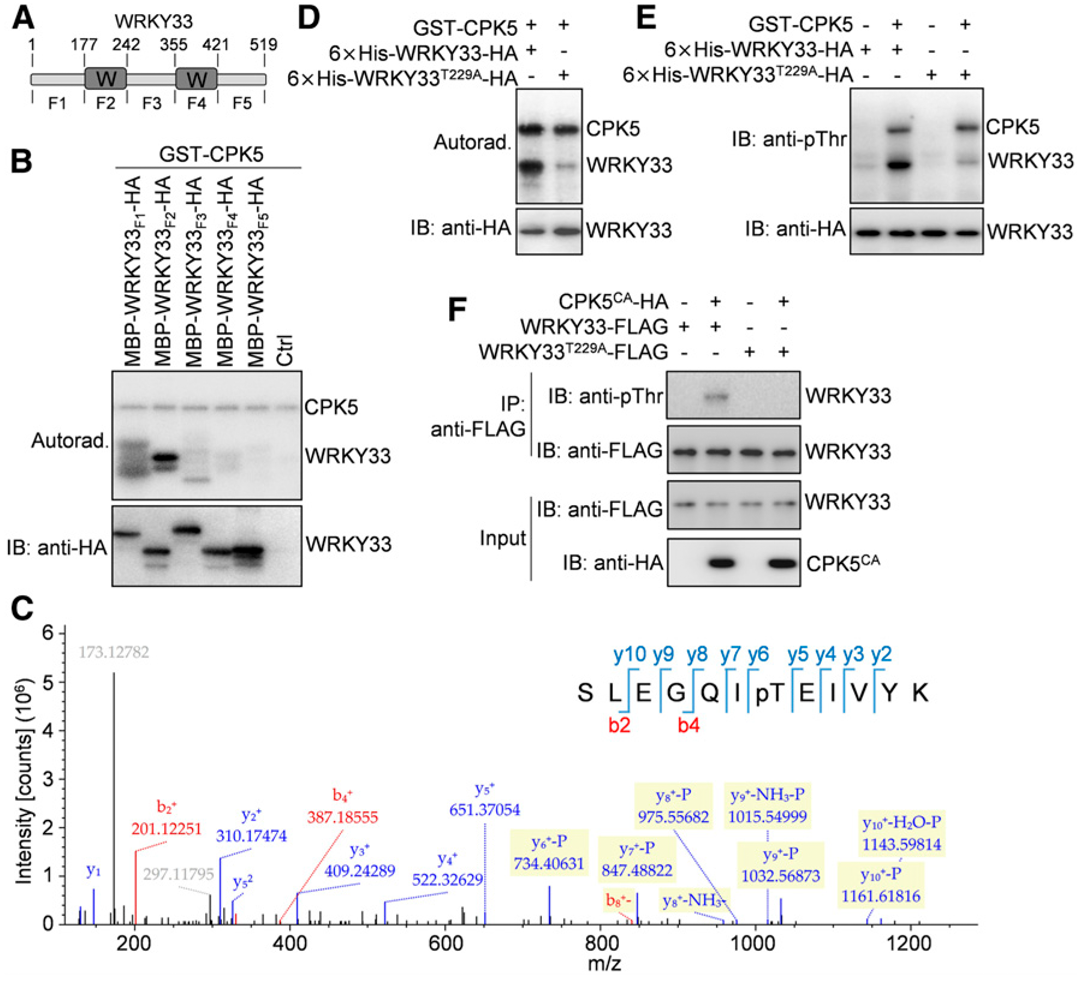
CDPKs被称为丝氨酸/苏氨酸蛋白激酶,同时WRKY33蛋白中存在几个丝氨酸和苏氨酸残基。为了绘制被CPK5/CPK6磷酸化的WRKY33残基图谱,作者将WRKY33蛋白分成5个片段,分别是WRKY33F1(氨基酸1~177)、WRKY33F2(氨基酸178~242)、WRKY33F3(氨基酸243~355)、WRKY33F4(氨基酸356~421)和WRKY33F5(氨基酸422~519;图5A)。WRKY33的两个WRKY结构域分别位于WRKY33F2和WRKY33F4片段中。体外磷酸化实验显示,GST-CPK5强烈磷酸化麦芽糖结合蛋白(MBP)/HA双标记的WRKY33F2,而重组的WRKY33F1被GST-CPK5非常弱地磷酸化,而其他三个WRKY33片段未被GST-CPK5磷酸化(图5B),这表明被CPK5磷酸化的WRKY33残基主要位于WRKY33F2中。液相色谱-串联质谱(LC-MS/MS)分析了包含GST-CPK5和MBP-WRKY33F2-HA蛋白的磷酸化反应,发现CPK5磷酸化WRKY33F2中的Thr-229(图5C)。在体外磷酸化实验中,使用γ-32p标记的ATP或抗pThr抗体(图5D和5E),将全长WRKY33中的Thr-229突变为Ala(T229A),在很大程度上阻断了CPK5对WRKY33的磷酸化(图5D和5E),而在体外GST pull-down实验中,WRKY33中的T229A突变不影响其与CPK5的相互作用。同样,当WRRY33的Thr-229突变为Ala时,拟南芥原生质体中CPK5CA也不能使WRKY33磷酸化(图5F),并且原生质体中WRKY33和CPK5之间的相互作用也不受WRKY33中T229A突变的影响。综上所述,这些数据表明WRKY33中的Thr-229残基是主要的CPK5磷酸化位点。
图5 CPK5磷酸化WRKY33的Thr-229残基(Zhou et al., 2020)。(A)WRKY33蛋白结构示意图。WRKY33包含两个WRKY结构域(W)和另外三个功能未知的区域。氨基酸的位置被标记在上面,下面是用于后续实验的WRKY33片段;(B)WRKY33的N末端WRKY结构域被CPK5磷酸化。在[γ-32P]ATP存在的情况下,通过放射自显影检测GST-CPK5对MBP/HA标记的WRKY33片段的磷酸化作用;(C)WRKY33的Thr-229残基被CPK5磷酸化。对GST-CPK5和MBP-WRKY33F2-HA蛋白磷酸化反应的LC-MS/MS分析显示,CPK5磷酸化WRKY33F2中的Thr-229;(D、E)体外验证WRKY33中Thr-229残基是主要的CPK5磷酸化位点。在[γ-32P]ATP存在(D)或不存在(E)的情况下,GST-CPK5对6×His-WRKY33-HA蛋白野生型和T229A突变型的磷酸化分别通过放射自显影(D)或免疫印迹(E)检测;(F)拟南芥原生质体中WRKY33中Thr-229的突变阻断了其被CPK5CA磷酸化。野生型和T229A突变型WRKY33-FLAG蛋白与CPK5CA-HA在原生质体中共表达。用抗FLAG琼脂糖珠(IP:anti-FLAG)免疫沉淀原生质体提取物中的WRKY33-FLAG蛋白,用抗pThr(IB:抗pThr)或抗FLAG(IB:抗FLAG)抗体进行免疫印迹分析。
这个案例为我们展示了如何寻找底物可以被磷酸化的关键位点,文中首先通过截短的方式将底物蛋白截成好几段,然后利用泛抗体检测哪个片段可以被磷酸化,再将可以被磷酸化的片段进行质谱分析,这样就可以缩小范围以及节约经费,同理去磷酸化也可以按照这样的思路去鉴定关键位点,设置好实验对照就行!另外这个案例中进行了体内磷酸化实验,用到的方法是在拟南芥原生质体中共表达带有不同标签蛋白的酶和底物,然后进行检测,其实更严谨的体内实验是用稳转材料进行实验,具体的案例这里就不再列举了,大家可以参考之前的稳转“转录因子研究套路(二)”的第四部分“在体内实验中,OsPP2C27能否使OsMAPK3去磷酸化?”
鉴定出可以被激酶修饰的关键氨基酸位点之后,除了像上面案例中那样,对关键氨基酸位点进行突变再次证明之外,还能做什么实验呢?我们可以看看下面的文献案例。
背景介绍:
Pst DC3000:丁香假单胞菌。
Flg22:细菌鞭毛蛋白N端一个保守的22个氨基酸的多肽,能够诱导植物天然的免疫反应。
PAMPs:病原体相关的分子模式。
pifq:PIF1、PIF3、PIF4、PIF5的四突变体。
实验解析:
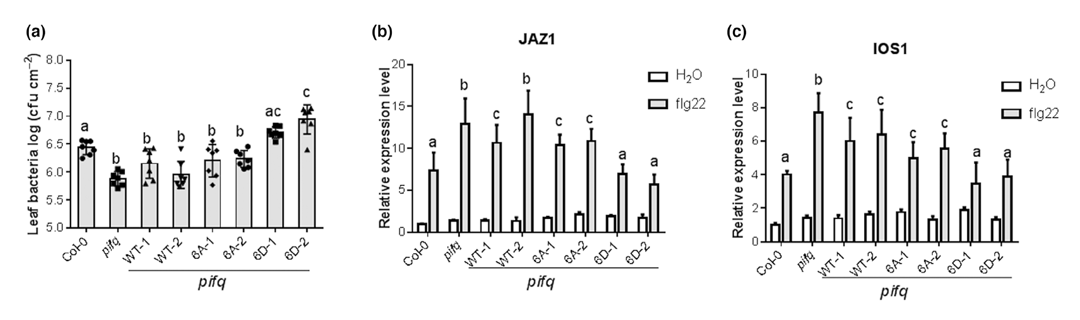
为了确定PAMP诱导的PIF3磷酸化在植物抗性中的作用,作者利用PIF3自身启动子,在pifq背景下产生了表达全长野生型(PIF3WT)、非磷酸化型(PIF36A)和模拟磷酸化型(PIF36D)PIF3的转基因植株。当接种Pst DC3000后,与PIF3WT/pifq和PIF36A/pifq转基因植株相比,模拟磷酸化的转基因植株(PIF36D/pifq)对Pst DC3000的敏感性增加(图6a)。为了进一步研究PIF3磷酸化在防御反应中的作用,作者选择了两个调节PIF3的防御相关基因:IOS1和JAZ1,并检测了flg22刺激后它们在转基因植株中的表达。IOS1和JAZ1的表达在PIF36A株系和PIFWT株系之间无显著差异(图6b、c)。然而,这两个基因在模拟磷酸化的PIF36D/pifq转基因植株中的表达低于PIF3WT/pifq植株,进一步表明PIF3的磷酸化负调控flg22引发的免疫反应(图6b、c)。
图6 PIF3的磷酸化负调控对Pst DC3000的抗性和防御基因的表达(Zhao et al., 2023)。
从这个案例可以看出,要想知道被磷酸化之后的蛋白到底具有什么功能,可以以该基因的突变体为受体材料构建一个持续磷酸化的过表达材料进行研究,进而判断对应的功能或者发挥的作用,很多文献中都有这样的做法,你也可以用起来噢。另外对于去磷酸化也可以构建模拟去磷酸化的转基因材料进行研究,具体的案例就不再展示了,这里给大家推荐一篇文献:A Molecular switch for FLOWERING LOCUS C activation determines flowering time in Arabidopsis,大家感兴趣可以自己去下载阅读。利用体外实验或瞬时转化模拟磷酸化/去磷酸化在上面的案例中有涉及到,因此具体的案例这里也不再展示了。
知识补充:
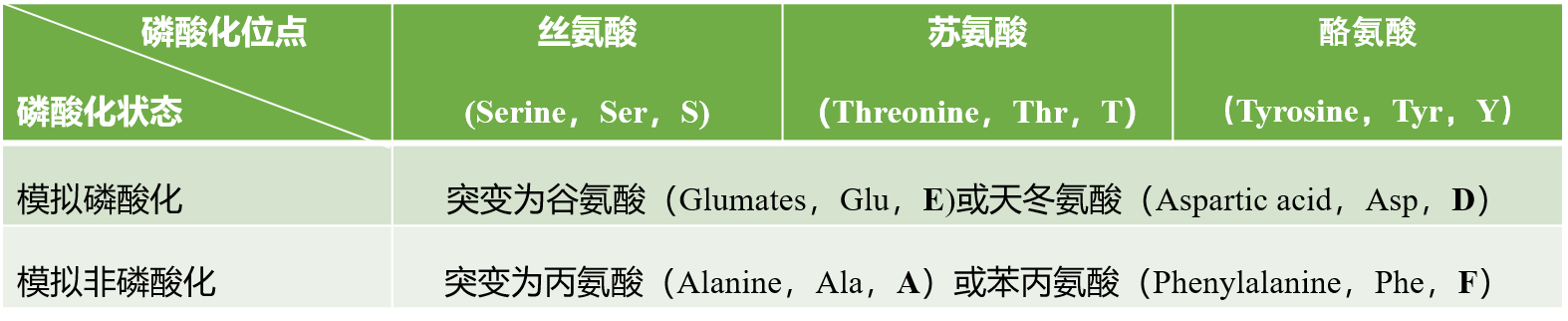
1)表征磷酸化/去磷酸化修饰的突变氨基酸
我们知道Ser、Thr和Tyr残基上的磷酸化较常见,特别是Ser。文献中常见的表征这3种氨基酸磷酸化修饰的定点突变见下表。
上面列举的案例中,不管是验证关键氨基酸位点还是模拟持续磷酸化,对磷酸化位点进行突变基本都是按照这个表中的方式进行突变的,并不是随意突变的,所以大家要清楚这一点。
2)表征磷酸化/去磷酸化修饰的原理
蛋白质的磷酸化导致磷酸基团受体氨基酸残基上增加了净负电荷(pSer,pThr和pTyr带2个负电)。而取代的酸性氨基酸(Glu和Asp)的负电荷侧链在一定程度上模拟了蛋白质中磷酸基团的添加,且长度相似。为了使得实验结果准确,除了构建模拟磷酸化的突变体外,模拟非磷酸化的点突变构建也是必需的,即磷酸基团受体氨基酸残基被一个不带电的和不能磷酸化的氨基酸残基所取代,Ala和Phe是目前已成功模拟非磷酸化的氨基酸。
References:
Baena-González E, Rolland F, Thevelein J M, et al. A central integrator of transcription networks in plant stress and energy signalling[J]. Nature, 2007,
Cho H Y, Wen T N, Wang Y T, et al. Quantitative phosphoproteomics of protein kinase SnRK1 regulated protein phosphorylation in Arabidopsis under submergence[J]. Journal of Experimental Botany, 2016, 67(9): 2745-2760.
Cui M, Li Y, Li J, et al. Ca2+-dependent TaCCD1 cooperates with TaSAUR215 to enhance plasma membrane H+-ATPase activity and alkali stress tolerance by inhibiting PP2C-mediated dephosphorylation of TaHA2 in wheat[J]. Molecular Plant, 2023, 16(3): 571-587.
Dai M, Xue Q, Mccray T, et al. The PP6 phosphatase regulates ABI5 phosphorylation and abscisic acid signaling in Arabidopsis[J]. The Plant Cell, 2013, 25(2): 517-534.
Dai M, Zhang C, Kania U, et al. A PP6-type phosphatase holoenzyme directly regulates PIN phosphorylation and auxin efflux in Arabidopsis[J]. The Plant Cell, 2012, 24(6): 2497-2514.
Fujii H, Verslues P E, Zhu J K. Identification of two protein kinases required for abscisic acid regulation of seed germination, root growth, and gene expression in Arabidopsis[J]. The Plant Cell, 2007, 19(2): 485-494.
Kajino T, Ren H, Iemura S, et al. Protein phosphatase 6 down-regulates TAK1 kinase activation in the IL-1 signaling pathway[J]. Journal of Biological Chemistry, 2006, 281(52): 39891-39896.
Nakashima K, Fujita Y, Kanamori N, et al. Three Arabidopsis SnRK2 protein kinases, SRK2D/SnRK2. 2, SRK2E/SnRK2. 6/OST1 and SRK2I/SnRK2. 3, involved in ABA signaling are essential for the control of seed development and dormancy[J]. Plant and Cell Physiology, 2009, 50(7): 1345-1363.
Zhao Y, Zheng X, Zhang X, et al. PIF3 is phosphorylated by MAPK to modulate plant immunity[J]. New Phytologist, 2023, 240(1): 372-381.
Zhou J, Wang X, He Y, et al. Differential phosphorylation of the transcription factor WRKY33 by the protein kinases CPK5/CPK6 and MPK3/MPK6 cooperatively regulates camalexin biosynthesis in Arabidopsis[J]. Plant Cell, 2020, 32(8): 2621-2638.
图文来源:伯远生物公众号