本文内容速览:
炎炎夏日,西瓜是我们必不可少的“消暑神器”,在炎热的天气里大口大口地吃瓜,西瓜果实中充足的水分会让人清凉不少,同时其清甜的口感也会让幸福感瞬间提升。那西瓜为什么会这么甜呢?伯小远下面将给大家带来关于西瓜“甜蜜”的故事,一起去看看吧!
西瓜“甜蜜”的起源
西瓜的祖先果实小、果肉坚硬而且味道苦,与如今大家看到的又大又甜的红瓤西瓜相去甚远,而西瓜之所以会变甜是人类驯化的结果。我们对于甜味的偏爱依赖于我们的生存本能。在远古时代食物稀缺的环境下,能够迅速识别出富含能量的食物是生存的关键,而甜味通常意味着食物中含有糖分,是快速获得能量的信号。当食用甜食后,大脑会释放一种名为多巴胺的神经递质,这种物质的释放会带来愉悦感,这种机制使得远古人类选择那些果肉较甜、籽较小的西瓜进行繁殖,并且经过多代人的努力,西瓜逐渐变得越来越甜。
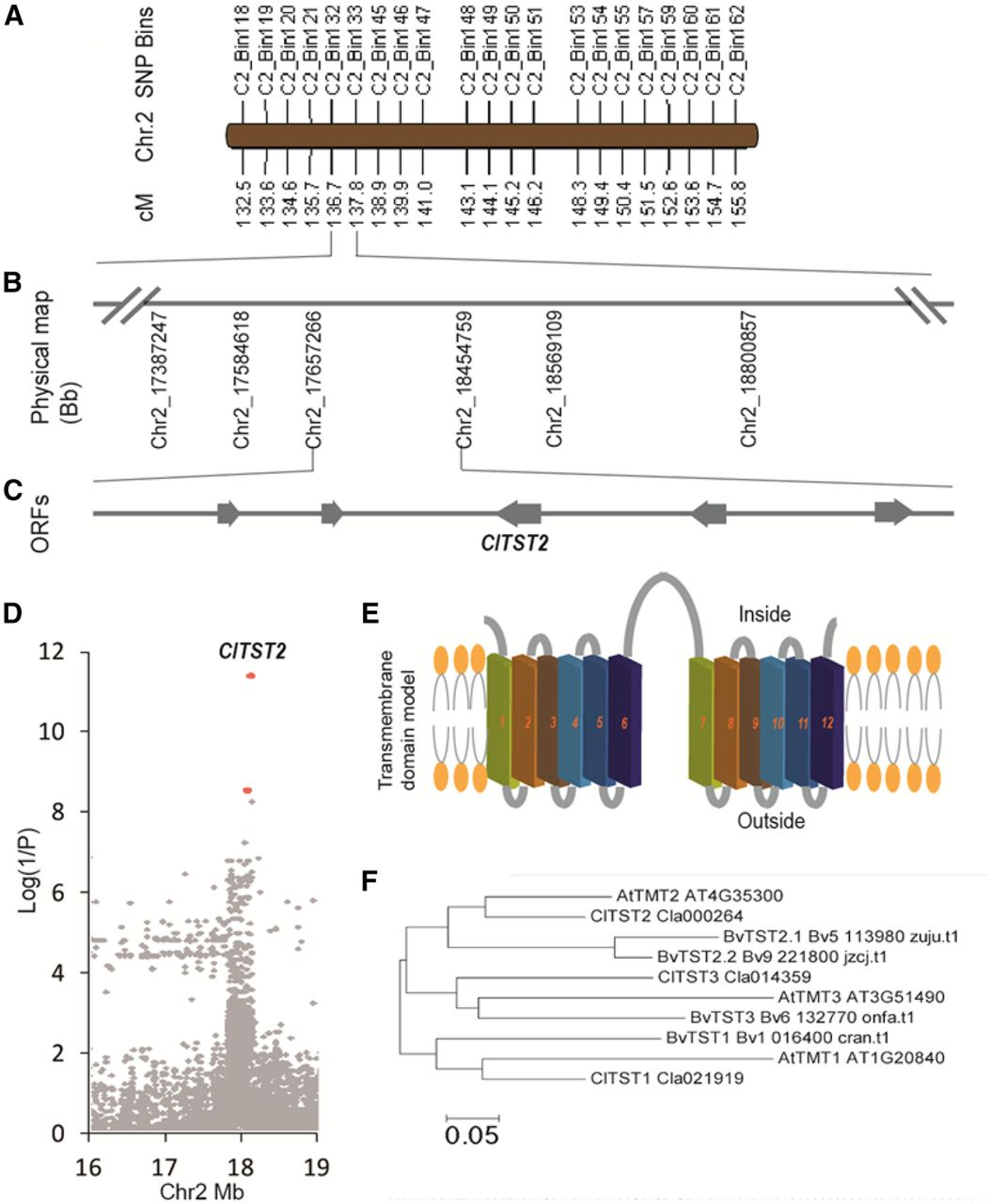
首先,为了定位先前发现的西瓜糖含量QTL QBRX2-1区间(Sandlin et al., 2012; Ren et al., 2014)中的候选基因,作者构建了栽培甜西瓜品种97103和非甜野生西瓜品种PI296341-FR杂交得到的96个重组自交系(RILs)的遗传图谱,并与含糖量QBRX2-1进行关联分析,将QBRX2-1从已发表的2.9Mb缩小到797.4kb的区间内(图4A、B)。结果显示,在该区域发现的21249个单核苷酸多态性(SNPs)中,最重要的SNP位于ClTST2启动子上(图4D)。RT-qPCR结果显示该基因在西瓜果实中高量表达,是最可能控制含糖量QBRX2-1的基因。分子实验和生化检测表明,ClTST2是一种液泡定位的蔗糖和己糖转运蛋白,其表达与西瓜果肉细胞液泡膜糖分的吸收和积累相关。
图4 ClTST2基因的定位、跨膜结构域和系统发育分析(Ren et al., 2018)。(A)西瓜含糖量QTL的SNP bin图(QBRX2-1);(B)基于遗传图谱的QTL关联分析将QBRX2-1从已发表的2.9Mb缩小到797.4kb的物理区间内;(C)RNA-seq结果显示797.4kb的QTL区间内只含有5个表达的开放阅读框(ORF),其中一个是ClTST2;(D)基于400份西瓜品种基因组重测序鉴定的21249个SNP与含糖量QBRX2-1进行关联分析。红点标记的最重要的SNP位于ClTST2的启动子中;(E)ClTST2蛋白有12个跨膜结构域;(F)拟南芥(At)、甜菜(Bv)和西瓜(Cl)中ClTST1、ClTST2和ClTST3的系统发育树。
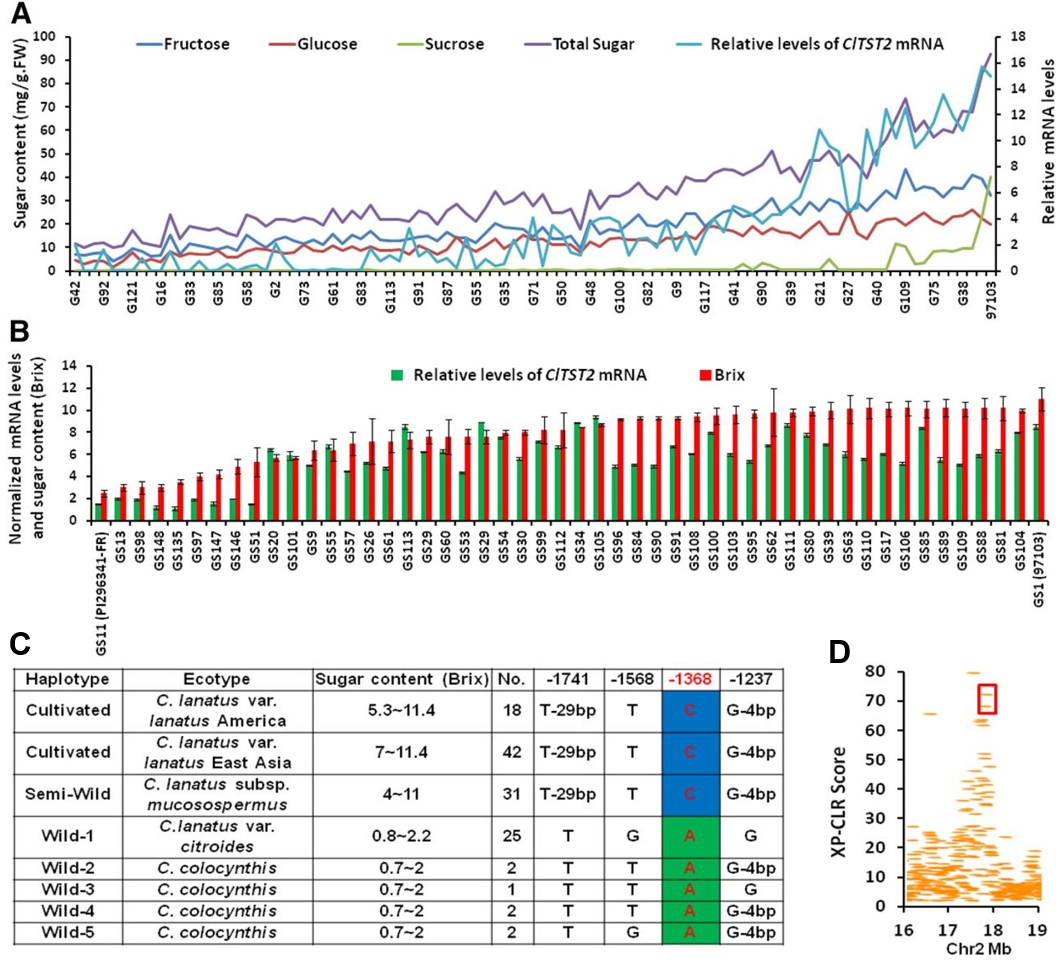
作者测定了多个西瓜品种的果实含糖量和ClTST2的表达水平(图5A、B), 并对ClTST2附近的基因组序列进行了重测序。结果显示,栽培甜西瓜品种97103中ClTST2的表达量是PI296341-FR等非甜西瓜品种的5~10倍,ClTST2的表达与果实糖积累呈正相关,而这种差异与ClTST2启动子区域SNP(-1368bp)的A/C碱基替换有关,栽培甜西瓜品种的-1368bp为C,而非甜野生品种为A(图5C)。大规模的群体分析表明,ClTST2的表达增加是西瓜驯化过程中的一个主要分子事件(图5D)。
图5 西瓜果实的糖含量和ClTST2启动子区域SNP(-1368bp)的A/C碱基替换有关(Ren et al., 2018)。(A)96个RILs成熟果实的糖含量和ClTST2的表达水平;(B)50个西瓜核心种质资源的成熟果实的糖含量和ClTST2的表达水平;(C)栽培、半野生和野生西瓜品种的糖含量与ClTST2启动子单倍型的关系;(D)ClTST2基因组区域的XP-CLR分析。ClTST2在红色框中的40kb区域内,该区域是西瓜驯化过程中具有强烈选择压力的基因组区域。
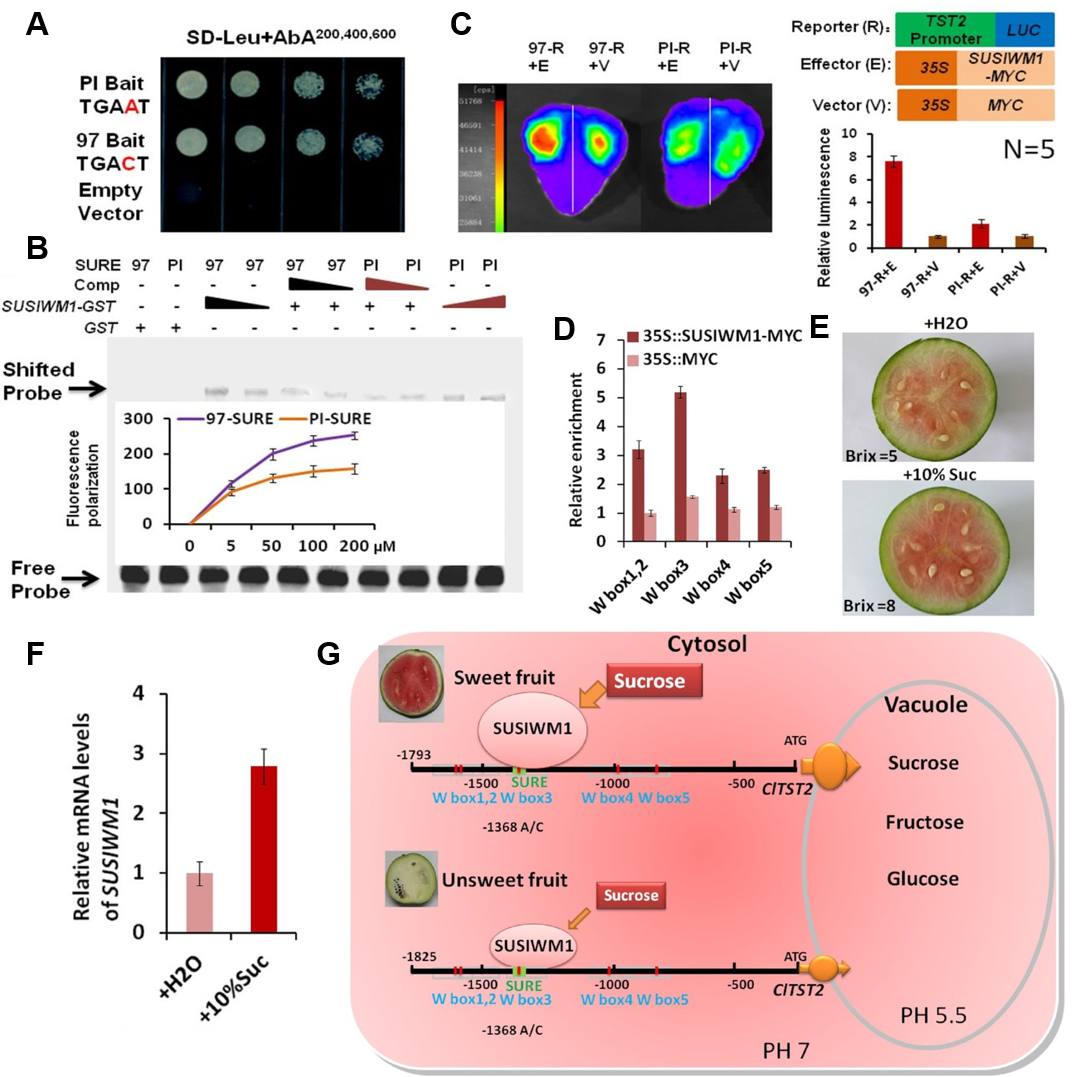
作者推测-1368 SNP会影响ClTST2的上游转录因子与其启动子的结合活性,从而影响ClTST2的表达。为了确定与ClTST2启动子结合的转录因子,以及-1368 SNP是否影响结合活性,作者进行了酵母单杂(Y1H)、凝胶迁移(EMSA)和双荧光素酶报告基因实验(Dual-LUC),发现SUSIWM1转录因子能激活ClTST2的表达,而97103 ClTST2启动子比PI296341-FR的活性更强(图6A-C)。最后,作者构建了SUSIWM1调控ClTST2的模型(图6F)。在97103等高甜品种的果实中,大量的SUSIWM1被招募到含有W box3元件的ClTST2启动子区域,该W box3位于一个糖响应原件(SURE)内,SUSIWM1直接与包含-1368 SNP的SURE结合,激活ClTST2的表达。而在PI296341-FR等低糖品种的果实中,SUSIWM1与ClTST2启动子结合活性降低,ClTST2的表达受限。
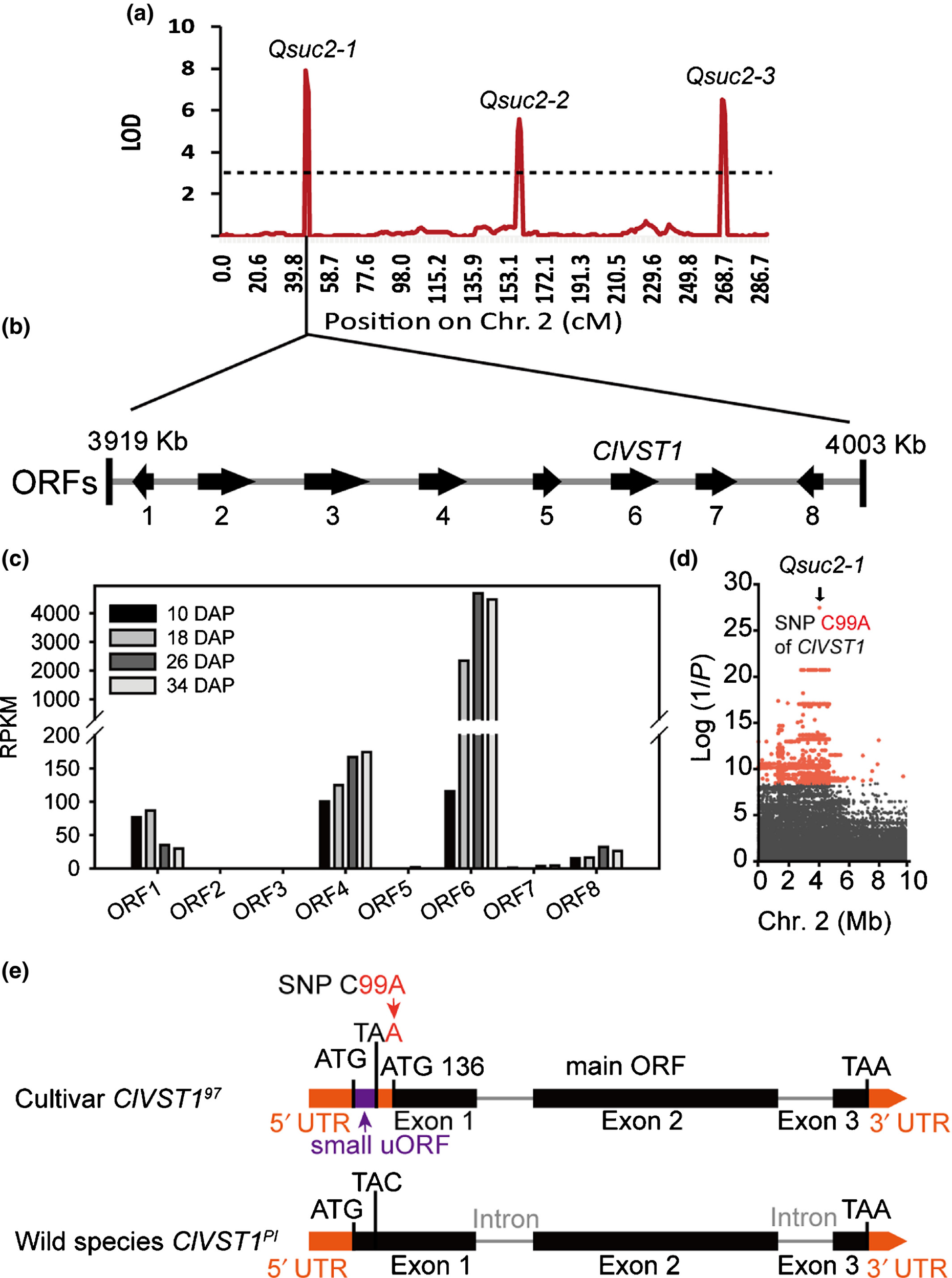
作者利用超高密度SNP遗传图谱将西瓜果实蔗糖含量Qsuc2-1精细定位到2号染色体上84kb的区间内(图7a),该位置包含8个开放阅读框(ORFs)(图7b)。RNA-seq结果显示ClVST1高表达,与授粉10至34天果实发育阶段的糖积累呈正相关,而其他七个ORFs在甜西瓜品种97103中几乎不表达或者与糖积累无关(图7c)。接着,作者将326个西瓜品种的基因组重测序数据与蔗糖含量Qsuc2-1进行关联分析,发现ClVST1编码区SNP C99A是与糖含量最相关的位点(图7d)。SNP C99A使甜西瓜品种的ClVST1第一外显子中出现终止密码子(TAA),导致45个氨基酸被截断,而从136bp的起始密码子开始形成新的ORF(定义为ClVST197),而非甜野生品种ClVST1存在完整的编码序列(定义为ClVST1PI)(图7e)。
图7 ClVST1的定位、关联研究和结构变异(Ren et al., 2020)。(a,b)将蔗糖含量QTL Qsuc2-1的定位(a)到2号染色体上84kb的区间内,该位置包含8个ORFs(b);(c)授粉后10至34天西瓜果实发育过程中8个ORF的表达;(d)在326份西瓜品种中,ClVST1的SNP C99A是与糖含量最相关的位点;(e)SNP C99A导致ClVST1第一外显子中的提前出现终止密码子(TAA),从而使得栽培西瓜中ClVST197 N末端的45个氨基酸被截断。
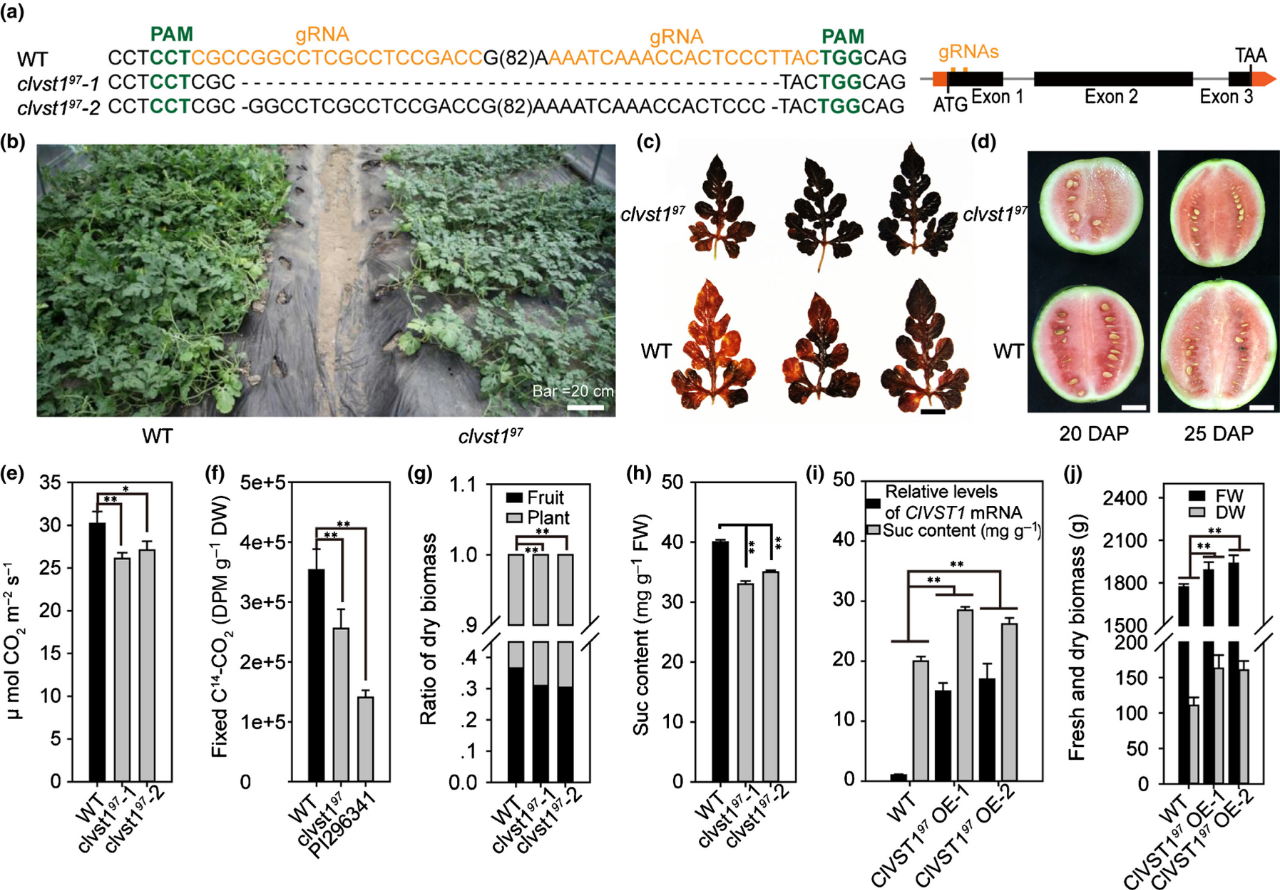
RNA原位杂交显示,ClVST197在西瓜果实维管束韧皮部特异性表达。作者通过CRISPR/cas9敲除ClVST197后,突变体西瓜叶片积累大量淀粉(图8c),而果实中积累的生物产量和糖含量均降低(图8f-h)。反之,将ClVST197基因过表达后能提高半野生西瓜的含糖量和产量(图8i-j)。可见,ClVST1在韧皮部上起到了糖分卸载的作用,具有在库和源之间调节和分配碳水化合物的功能。在这里科普一下,源指生产和输出光合产物的器官,通常是叶片,也包括角果皮、颖壳、叶鞘和茎的绿色部分。源的主要功能是进行光合作用,生产有机物。库指接纳和储存光合产物的器官,如穗、果实、块根或块茎等。库的主要功能是储存和利用从源器官运输来的有机物。源库关系在植物生长和发育中起着重要作用,影响植物的生长发育和产量形成。
图8 ClVST197影响西瓜叶片的淀粉含量和果实中糖的转运(Ren et al., 2020)。(a)利用CRISPR/Cas9使ClVST197的第一个外显子中有118个nt的缺失或C/T替换;(b)与野生型(WT)相比,clvst97突变体植株的主枝较短,侧枝较少;(c)与WT相比,clvst97突变体叶片的淀粉积累增加;(d)与WT相比,clvst97突变体的果实尺寸较小,成熟延迟;(e)clvst97突变体的光合效率降低;(f)clvst97突变体果实中的C14-CO2减少;(g)8周龄clvst97突变体果实和植物的干生物量比;(h)clvst97突变体果实的蔗糖含量降低;(i)与WT相比,ClVST197 -OE的果实中ClVST197的表达水平增加和蔗糖含量增加。(j)与WT相比,ClVST197–OE在授粉34天后的果实干生物量增加。
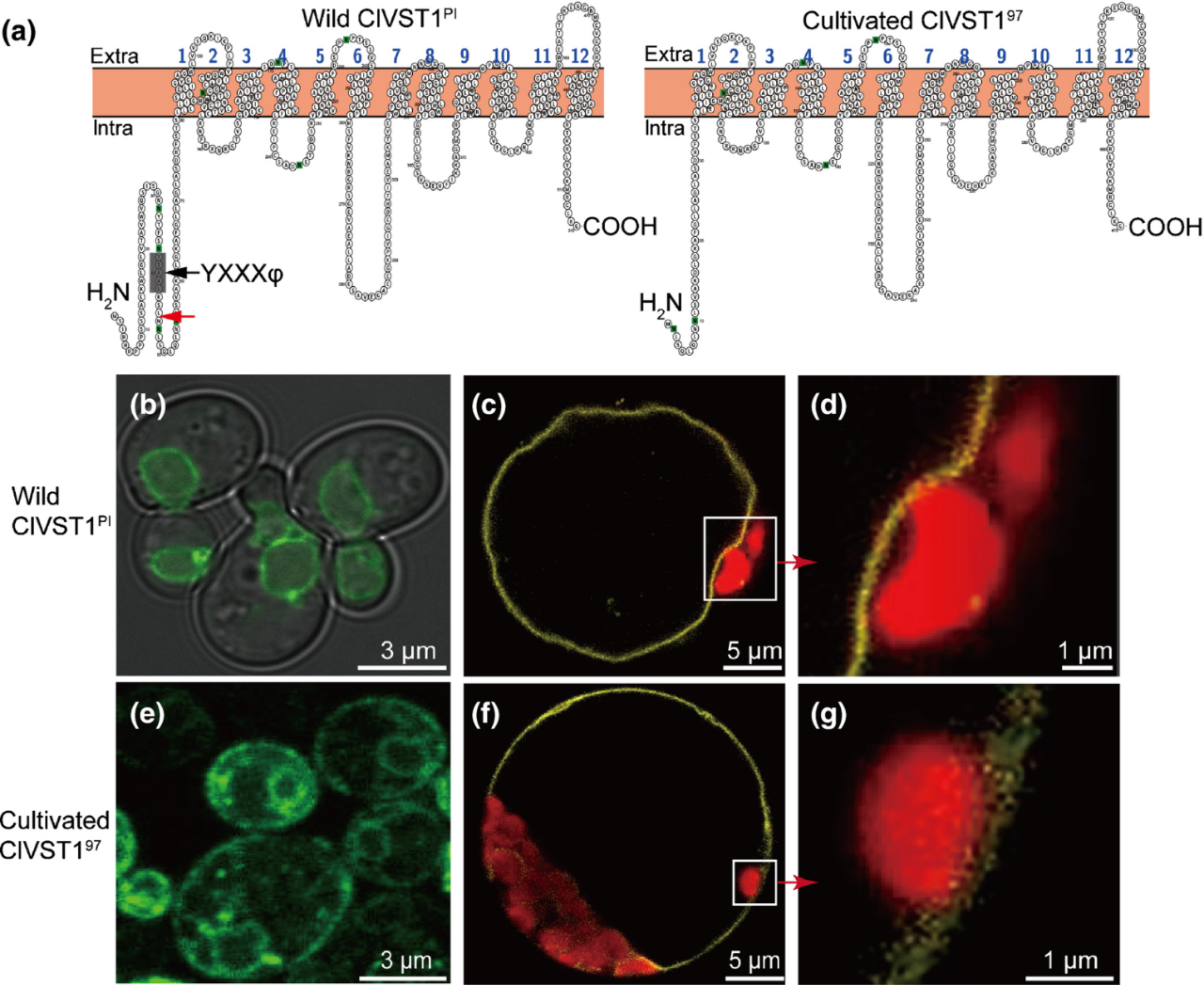
亚细胞定位实验表明,西瓜野生品种的ClVST1PI位于西瓜果实液泡膜,而SNP C99A位点导致栽培品种丢失内膜定位信号肽,使ClVST197定位到细胞膜(图9)。体外糖转运功能证实,只有栽培西瓜ClVST97具有糖转运活性,说明ClVST197是栽培西瓜获得性基因。驯化选择分析发现,ClVST1是从西瓜半野生到栽培种过程中重要的驯化基因。
ClAGA2 和ClSWEET3
棉籽糖家族低聚糖(RFOs)是西瓜等葫芦科植物中维管束运输的主要糖分,主要包括棉籽糖(Raf)、水苏糖(Sta),其水解和运输的方式尚未完全阐明。2021年2月,许勇教授课题组在The Plant Cell发表一篇题为“Evolutionary gain of oligosaccharide hydrolysis and sugar transport enhanced carbohydrate partitioning in sweet watermelon fruits”的研究论文,作者全面且系统地解析了西瓜果实RFOs的水解并转运到果肉细胞储存的分子机制。
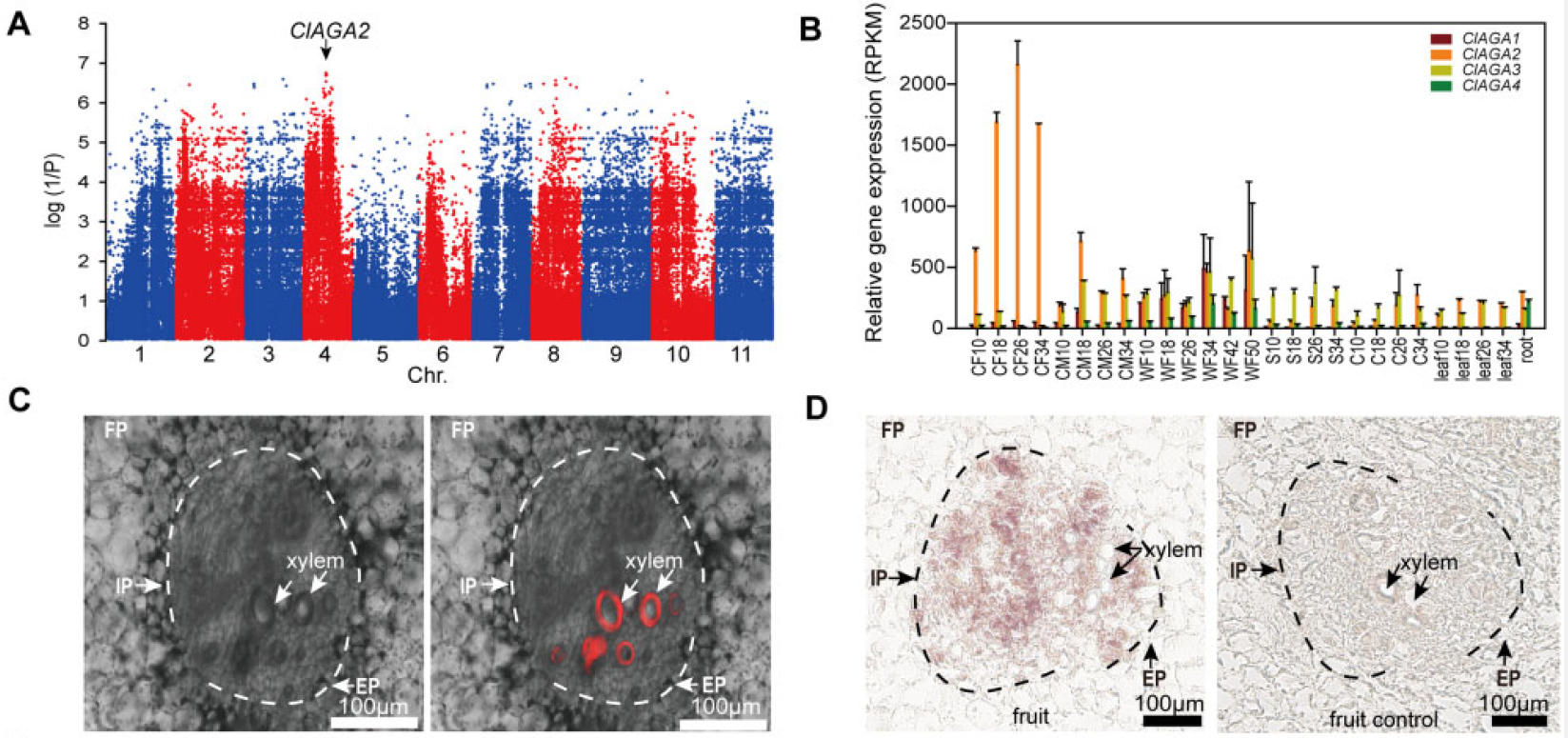
首先,作者巧妙地将野生和栽培西瓜果实相互嫁接到枝干上,发现RFOs在栽培西瓜果实中水解,但在野生祖先物种的果实中滞留。由于栽培西瓜果实中的RFOs含量低于野生祖先西瓜,作者对Raf含量进行了全基因组关联研究(GWAS)(图10A),在4号染色体上发现了显著相关的SNPs,位于ClAGA2的启动子-159(C-T)和-170(C-T)位点。ClAGA2编码碱性α-半乳糖苷酶,可能是调控西瓜果实中RFOs水解的关键酶。RNA原位杂交结果显示ClAGA2在维管束中特异性表达(图10C、D)。
图10 ClAGA2的定位和表达模式(Ren et al., 2021)。(A)135份西瓜品种Raf含量性状的GWAS分析。用黑色箭头标记的显著相关的SNP位于ClAGA2的启动子中;(B)ClAGA家族基因在不同发育阶段的RNA-Seq表达情况;(C、D)RNA原位杂交结果显示该基因在维管束中特异性表达。
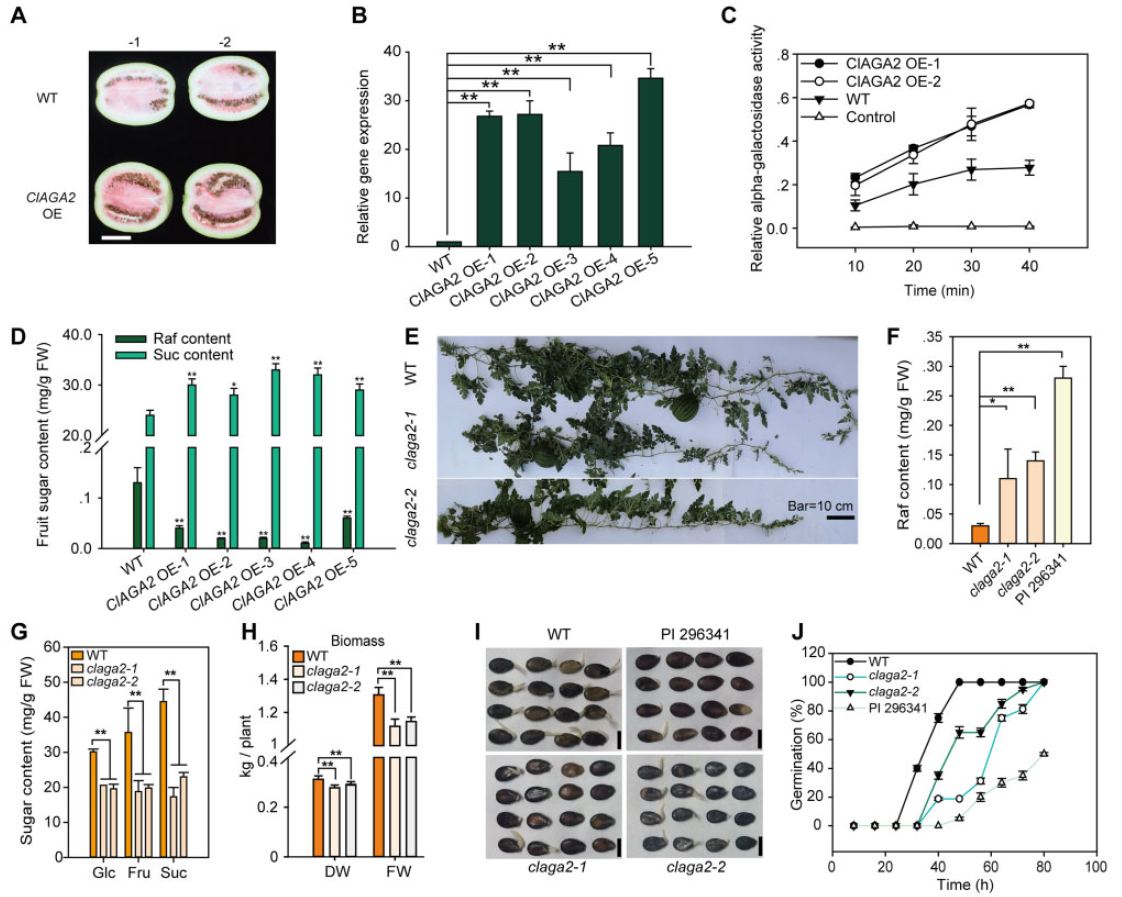
为了进一步探索ClAGA2的功能,作者在野生西瓜中过表达ClAGA2。与野生西瓜的果实相比,含有一个转基因拷贝的ClAGA2过表达西瓜的果实更早变红(图11A),ClAGA2转录本丰度和α-半乳糖苷酶活性增加(图11C),同时Raf含量降低,蔗糖含量显著增加(图11D)。接着,作者使用CRISPR/Cas9技术获得了栽培品种ZZJM突变体clgag2。clgag2果实中Raf含量几乎增加到野生西瓜的水平(图11F),同时葡萄糖、果糖和蔗糖含量显著降低(图11G),生物量减少(图11G),同时clgag2突变体出现种子发芽延迟的现象(图11I-J)。这些结果表明ClAGA2调控西瓜果实中Raf的水解。
图11 ClAGA2增强了西瓜中糖分的水解(Ren et al., 2021)。(A)与WT相比,ClAGA2过表达会加速果实着色;(B)授粉34天后ClAGA2 OE和WT中ClAGA2的相对表达水平;(C)ClAGA2过表达增加了α-半乳糖苷酶活性;(D)ClAGA2过表达加速了Raf水解和糖积累;(E)在授粉18天后,两个claga2突变株系的表型;(F)claga2突变体、WT和PI 296341中的Raf含量;(G)授粉30天后,claga2突变体的果实葡萄糖、果糖和蔗糖含量;(H)在claga2突变体和WT的生物量;(I)WT、claga2突变体和PI 296341种子在28℃的黑暗条件下孵育80小时后的发芽情况;(J)claga2突变体和野生型的种子发芽率。
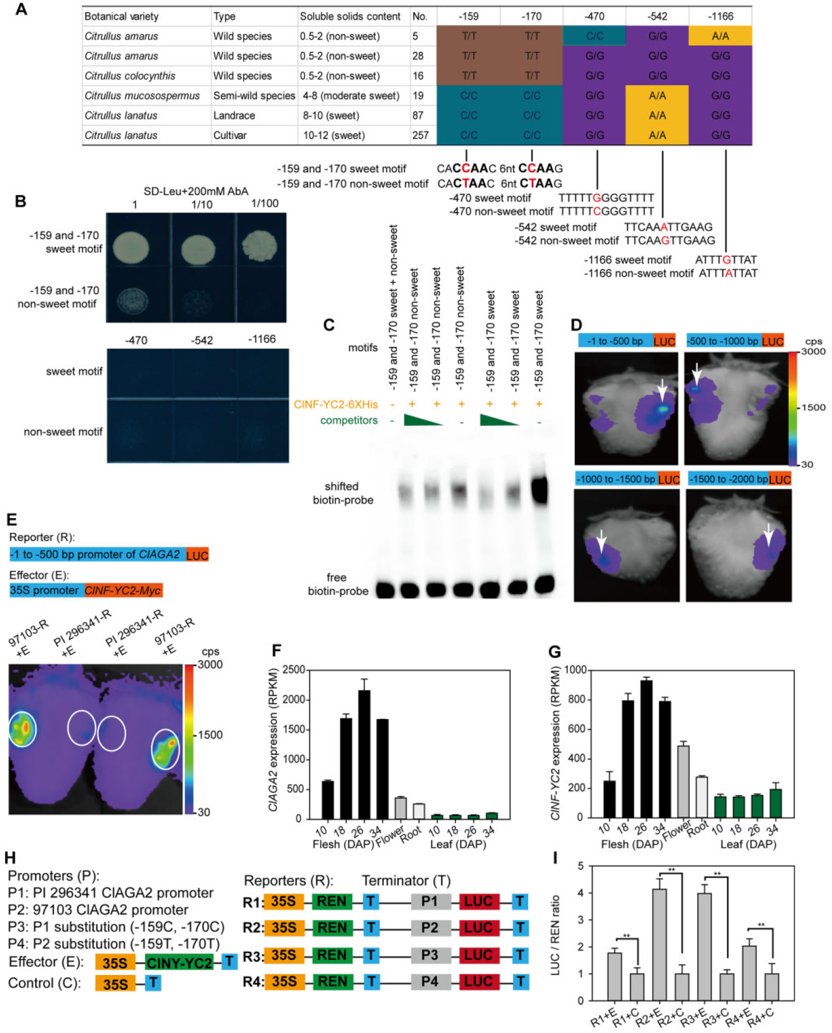
图12 ClNF-YC2调控ClAGA2的表达(Ren et al., 2021)。(A)ClAGA2启动子的单倍型;(B-I)Y1H、EMSA、Dual-LUC实验结果表明ClNF-YC2可以与ClAGA2启动子的调控元件结合,ClAGA2启动子中SNPs -159(C-T)和-170(C-T)可以影响结合活性。
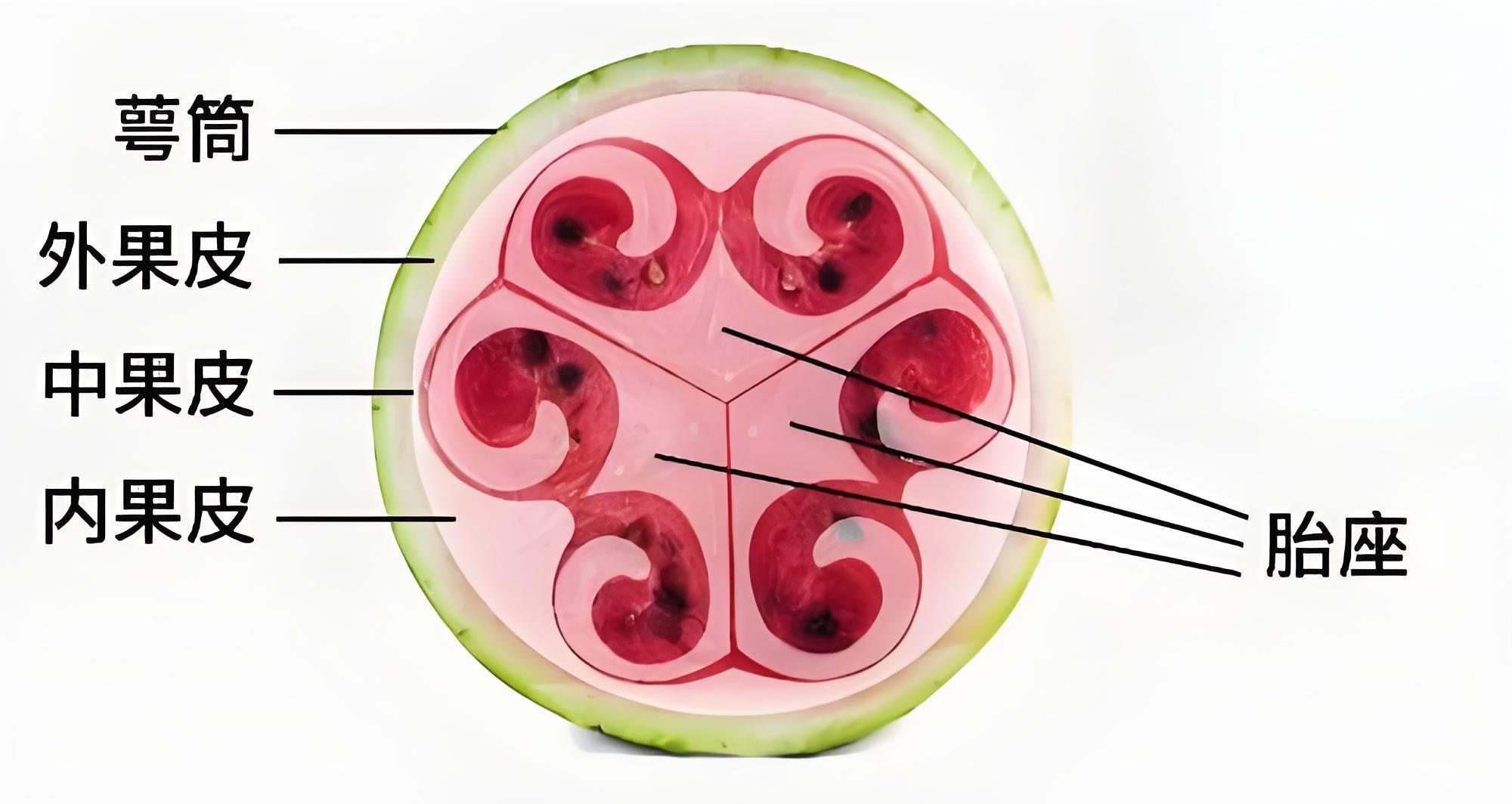
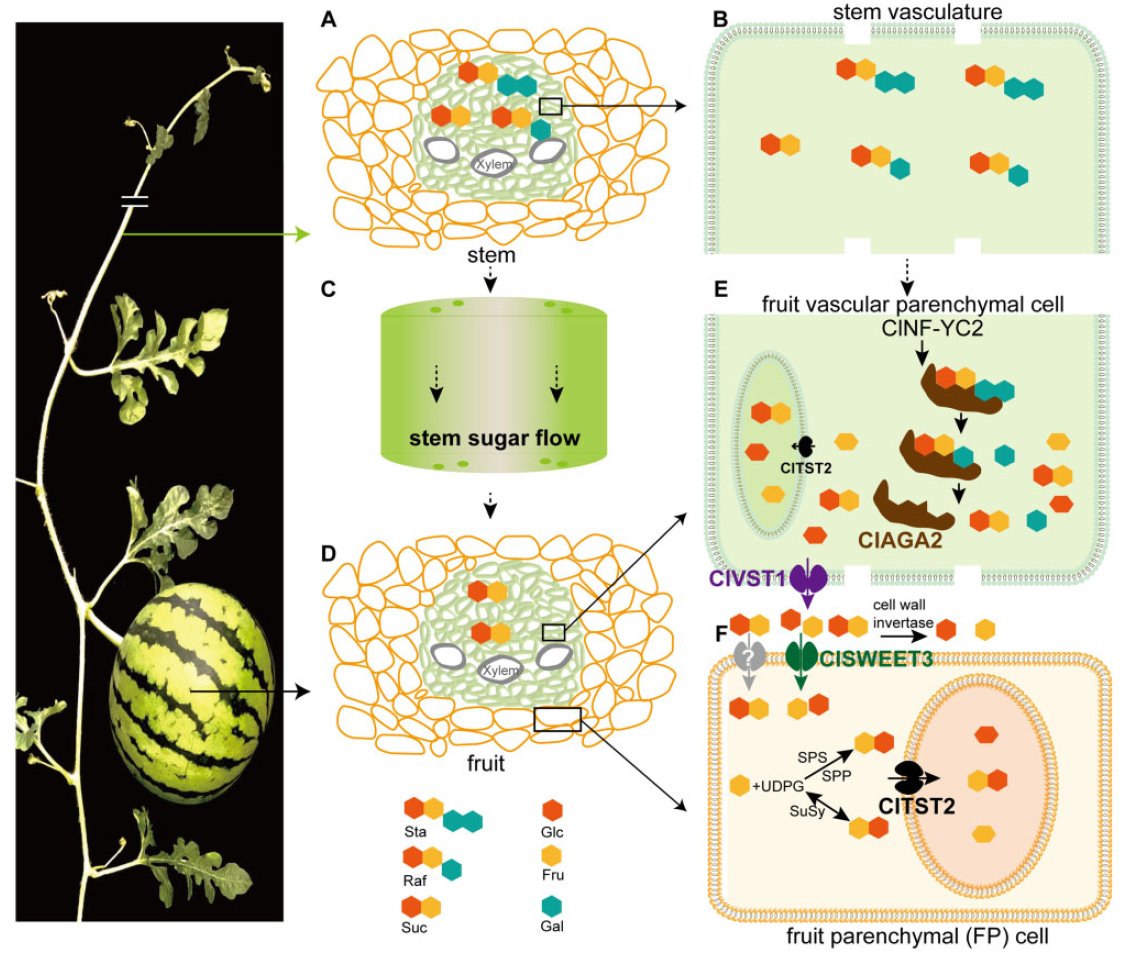
为了全面解析西瓜低聚糖水解和糖转运的基因调控网络,作者利用转录组学、生理生化检测和分子实验,发现了质膜定位的己糖转运蛋白ClSWEET3参与糖分从果肉细胞外到胞内的转运。结合前面的研究,作者最终提出西瓜果实RFOs水解和糖转运的模型(图13),从RFOs水解到果实液泡储存糖分共经历了四个关键环节:1)在西瓜茎或果实维管束运输的RFOs在果实维管束的薄壁细胞中被ClAGA2水解为蔗糖;2)ClVST2将蔗糖从果实维管束的薄壁细胞卸载到细胞间隙;3)细胞间隙的已糖需经过果肉细胞质膜上的ClSWEET3将其转运吸收到果肉细胞内;4)果肉细胞中糖分最终由ClTST2运输到果肉细胞液泡中完成储存。
图13 西瓜果实RFOs水解和糖转运的模型(Ren et al., 2021)。(A) 棉籽糖、水苏糖以及蔗糖是茎中主要的转运糖;(B)(A)中维管束薄壁细胞的放大图;(C)糖在茎中流动;(D) 维管束薄壁细胞和果实薄壁细胞;(E)RFOs在果实的维管束薄壁细胞中被ClAGA2水解;ClVST1将蔗糖从果实的维管束薄壁细胞中卸载到细胞间隙中;(F) ClSWEET3将己糖从细胞间隙运输到果实薄壁细胞进行储存,最终ClTST2将糖分储存在液泡中。
同时,综合上述实验结果,ClAGA2、ClVST1、ClSWEET3和ClTST2四个关键节点基因呈现分步驯化的特征。其中,ClAGA2和ClVST1、ClTST2在野生、半野生和栽培材料之间均存在关键的变异位点。利用这些变异位点,许勇教授课题组进一步建立了高效的分子标记辅助育种技术体系,将野生西瓜抗病、硬脆果肉等优良性状与栽培西瓜高糖的优良品质结合,选育出“京美10K”等中大果型品种,具有抗病、易栽培、不易裂瓜空心、果型正、品质优、口感脆硬、耐储运、丰产性强等优点,在全国黄淮海、东北及东南亚国家大面积推广超过500万亩,推动了简约化栽培的新一轮品种更新换代,解决了从缅甸种植长途贩运到东北的难题。
References:
Ren Y, McGregor C, Zhang Y, et al. An integrated genetic map based on four mapping populations and quantitative trait loci associated with economically important traits in watermelon (Citrullus lanatus)[J]. BMC plant biology, 2014, 14: 1-11.
Sandlin K, Prothro J, Heesacker A, et al. Comparative mapping in watermelon [Citrullus lanatus (Thunb.) Matsum. et Nakai][J]. Theoretical and applied genetics, 2012, 125: 1603-1618.
Guo S, Zhao S, Sun H, et al. Resequencing of 414 cultivated and wild watermelon accessions identifies selection for fruit quality traits[J]. Nature genetics, 2019, 51(11): 1616-1623.
Ren Y, Guo S, Zhang J, et al. A tonoplast sugar transporter underlies a sugar accumulation QTL in watermelon[J]. Plant Physiology, 2018, 176(1): 836-850.
Ren Y, Sun H, Zong M, et al. Localization shift of a sugar transporter contributes to phloem unloading in sweet watermelons[J]. New Phytologist, 2020, 227(6): 1858-1871.
Ren Y, Li M, Guo S, et al. Evolutionary gain of oligosaccharide hydrolysis and sugar transport enhanced carbohydrate partitioning in sweet watermelon fruits[J]. The Plant Cell, 2021, 33(5): 1554-1573.