网格蛋白介导的内吞作用(CME)是所有真核生物摄取大分子和颗粒物质的基本过程。在动物和酵母中,BAR-SH3结构域蛋白、胞吞蛋白和两性蛋白在CME结束时发挥作用,为囊泡破裂和脱壳募集因子。拟南芥含有BAR-SH3结构域蛋白SH3P1–SH3P3,但对它们的作用知之甚少。
近日,著名国际期刊《Cell Reports》在线发表了名为“SH3Ps recruit auxilin-like vesicle uncoating factors for clathrin-mediated endocytosis”的研究文章。在这里,作者将SH3Ps鉴定为胞吞蛋白/两性蛋白的功能同源物。SH3P1–SH3P3与质膜(PM)上的离散位点结合,随后,SH3P2招募到网格蛋白包被小窝。SH3P2 在PM的募集模式与其相互作用因子(一种假定的脱壳因子,类辅助蛋白1)几乎相同。值得注意的是,SH3P1-SH3P3是大多数AUXILIN-LIKE1招募到PM所必需的。这表明CME的植物特异性修饰,其中BAR-SH3蛋白募集类辅助蛋白的脱壳因子,而不是脱壳磷酸酶,即突触伸蛋白。SH3P1-SH3P3在整个CME中与植物特异性内吞衔接子TPLATE复合物冗余地发挥作用,而不是由于其TASH3亚基中的SH3结构域。
内吞作用是在质膜(PM)上导致表面蛋白质和其他物质内化的过程。在植物中,和在其他真核生物中一样,最常见的内吞作用模式是涉及囊泡外壳蛋白网格蛋白的囊泡运输过程。网格蛋白介导的内吞作用(CME)已经在动物和酵母中进行了详细的研究,其中它被描述为一个高度复杂的过程,除了网格蛋白外,还涉及大量其他蛋白质因子。这些功能包括将网格蛋白与膜结合,膜弯曲的力产生,以及在早期阶段选择性装载物质。在CME的晚期,特化因子介导完整囊泡与PM的分离和剥离;即去除蛋白质外壳以释放囊泡以便与内体腔室融合。
在非植物中,网格蛋白包被囊泡(CCVs)的形成,尤其是导致断裂和脱壳的后期步骤,涉及BAR(Bin、两性蛋白和Rvs)结构域蛋白的作用。BAR结构域是形成新月形结构的二聚体,通常通过显示正电荷的凹面结合膜。因此,BAR结构域充当曲率传感器。例如与几乎形成的ccv的狭窄颈部结合,并充当曲率发生器,其中它们的结合和聚合导致膜进一步弯曲。CME涉及一套除BAR结构域外具有独特募集特征和组成的BAR结构域蛋白。值得注意的例子是两性蛋白和胞吞蛋白,它们具有SH3结构域,这是一种对蛋白质靶标上富含脯氨酸的序列具有亲和力的相互作用模块。两性蛋白和胞吞蛋白的SH3结构域与动力蛋白(在囊泡断裂中起作用的机械蛋白)和突触伸蛋白(通过改变囊泡膜脂质组成促进脱壳的磷脂磷酸酶)相互作用。因此,由于BAR结构域的曲率感应特性和SH3结构域的相互作用,BAR-SH3蛋白充当结合中间体,使CME最终步骤所需的因子的活性暂时得到调节。
拟南芥中CME的特征,包括导致切断和脱壳的步骤,还不太先进。拟南芥包含三种蛋白质,其BAR-SH3结构域组成类似于非植物胞吞蛋白/两性蛋白,SH3P1-SH3P3(SH3 DOMAIN-CONTAINING PROTEIN1–3)。为了支持保守功能,SH3P1-SH3P3的表达部分补充了酵母两性蛋白突变体rvs167。同时检测到SH3P1-SH3P3和植物动力蛋白之间的物理结合。SH3P2还与SAC9(SUPPRESSOR OF ACTIN9)相互作用,SAC9可能在拟南芥的内吞途径中具有类突触伸蛋白活性。有趣的是,SH3Ps也与辅助蛋白的一些推定的拟南芥同源物物理相互作用,辅助蛋白是一类通过募集Hsc70(heat shock cognate 70)起作用的脱壳因子,导致哺乳动物中网格蛋白笼的松弛。同源的AUXILIN-LIKE1和AUXILIN-LIKE2具有富含脯氨酸的结构域,通过酵母双杂交分析、免疫共沉淀、双分子荧光互补以及以网格蛋白轻链(CLC)为诱饵的串联亲和纯化中它们的共同分离,检测了与特定SH3P亚型的相互作用。这些相互作用可能代表CME的植物特异性修饰,其中BAR-SH3蛋白与类辅助蛋白脱壳因子结合,促进CCV脱壳,但这种模型的结果尚未在植物中研究。总的来说,缺乏对SH3P1–SH3P3在CME中的作用的全面评估,这也通过在纯化ccv的蛋白质组中鉴定SH3P1和SH3P2以及SH3P2与网格蛋白重链(CHC)的共免疫沉淀来表明。也就是说,SH3P2的功能包括运输泛素化的物质以及在自噬和细胞板形成中的作用。
在这里,作者利用功能丧失和先进的实时成像方法,表征了SH3P1-SH3P3在CME中的作用,并探讨了它们与假定的脱壳因子AUXILIN-LIKE1/2的联系。研究结果表明SH3P1-SH3P3作为胞吞蛋白/两性蛋白的同源物,参与植物特异性的与类辅助蛋白脱壳因子的关联。有趣的是,SH3P1-SH3P3与内吞衔接子TPLATE复合体(TPC)在功能上是冗余的,但这不是由于其亚基中存在SH3结构域。总之,这项研究有助于持续表征在植物谱系中进化的 CME 的独特特性。
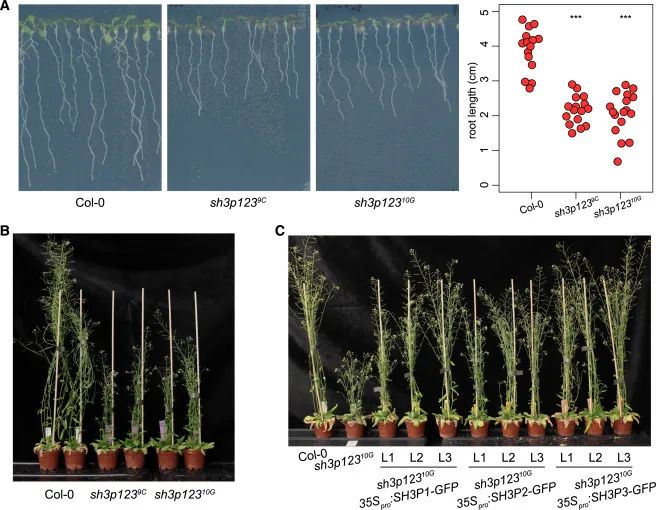
Figure 1 sh3p123 功能丧失突变体
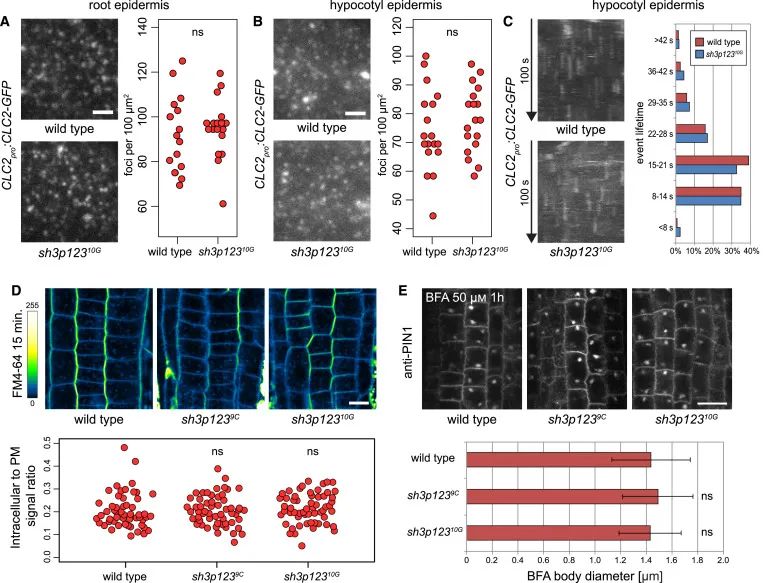
Figure 2 sh3p123中CME的评估
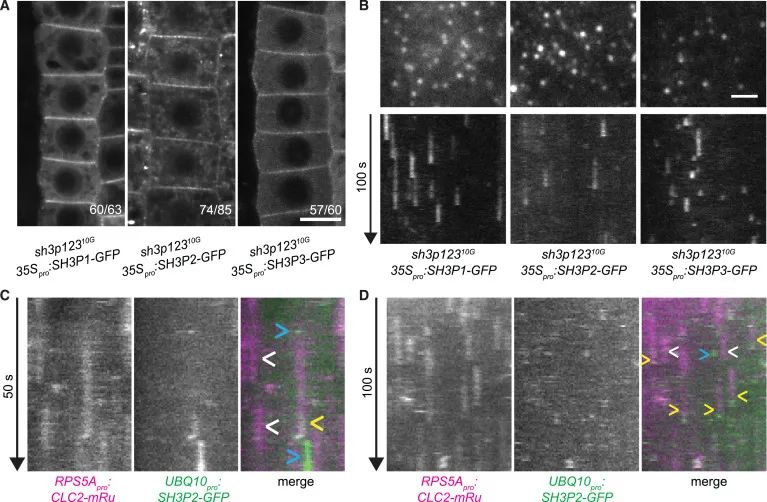
Figure 3 SH3P1–SH3P3 在PM的定位及招募到CCPs
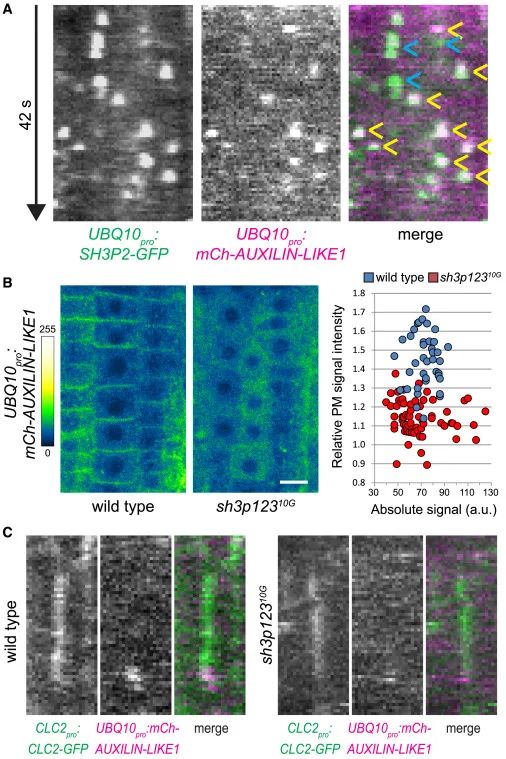
Figure4 SH3P1–SH3P3向PM招募类辅助蛋白1/2
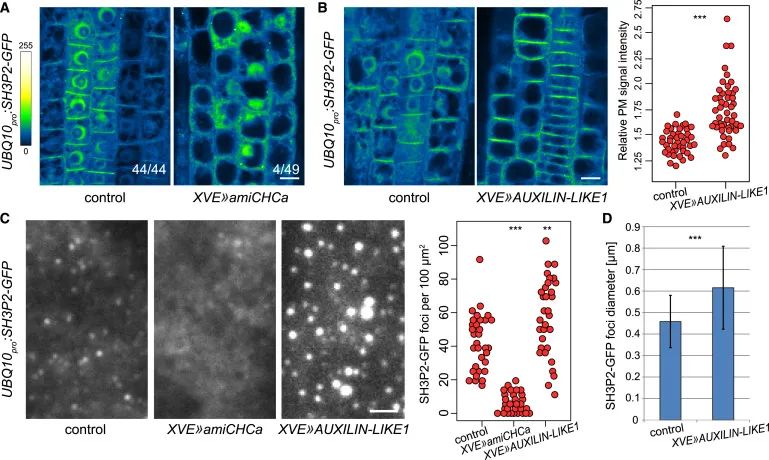
Figure 5与网格蛋白沉默相比,SH3P2-GFP对类辅助蛋白1过表达的明显反应
文章来源:植物生物技术Pbj