植物免疫防御系统是为抵抗多种病原菌的入侵而进化出的免疫系统,通过模式识别受体PRRs感知MAMPs会触发一种基础免疫防御反应,称为模式触发的免疫(PTI)。PRRs可以提供对大多数非适应性病原体的抵抗力,并在感染期间促进基础免疫力。PTI反应包括产生活性氧(ROS),激活丝裂原活化蛋白激酶级联,激活防御基因表达和胼胝质沉积。MAMPs最广泛研究的例子之一是鞭毛蛋白,这是细菌鞭毛的主要结构蛋白,flg22是一个与鞭毛蛋白N端附近最保守域相对应的22氨基酸表位肽,在各种植物物种中作为PTI的强效诱导剂。
在拟南芥中,富含亮氨酸的跨膜受体激酶FLAGELLIN SENSING 2 (FLS2)直接识别flg22,从而引发免疫信号的启动。在自然界中,鞭毛蛋白被聚合形成鞭毛,导致flg22表位被埋藏在鞭毛蛋白聚合结构中。已有研究对鞭毛蛋白中免疫原性肽配体flg22的蛋白酶解释放机制知之甚少。近日日本名古屋大学 Yoshikatsu Matsubayashi课题组在Nature Communications上发表了题为“Arabidopsis SBT5.2 and SBT1.7 subtilases mediate C-terminal cleavage of flg22 epitope from bacterial flagellin”的论文,设计了一个荧光猝灭底物来检测鞭毛蛋白中22氨基酸flg22表位C端的蛋白酶活性。作者鉴定了两个蛋白酶,SBT5.2和SBT1.7,作为参与flg22 C端切割的特异性蛋白酶。缺乏这两种蛋白酶的拟南芥突变植物的细胞质部分显示出从鞭毛蛋白中切割flg22的C端的减少,导致叶片在鞭毛蛋白处理后的细胞质ROS产生延迟。
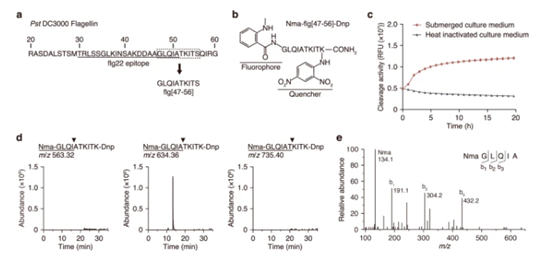
作者首先测量了用从丁香假单胞菌pv.纯化的鞭毛蛋白处理的野生型 (WT)拟南芥叶盘中 ROS 的产生。当WT叶盘暴露于100 nM的蛋白质或肽时,与flg22肽诱导的相比,鞭毛蛋白暴露后ROS的产生延迟约5分钟。为了鉴定裂解鞭毛蛋白内 flg22 结构域 C 端的蛋白酶,设计了一种荧光淬灭底物,专门检测 flg22 结构域 C 端的蛋白水解活性。添加底物后的 1-7 小时内,反应中的荧光强度随着时间的推移而增加,并且强度在长达 20 小时内保持最大水平;相反,将底物添加到热灭活的浸没培养基中时,没有观察到增加,其中蛋白酶可能已经变性。表明荧光猝灭底物 Nma-flg[47-56]-Dnp 可以检测拟南芥质外体内切蛋白酶,该酶可裂解鞭毛蛋白内 flg22 结构域的 C 末端。
图1 通过荧光淬灭底物检测鞭毛蛋白内 flg22 表位 C 末端的切割活性
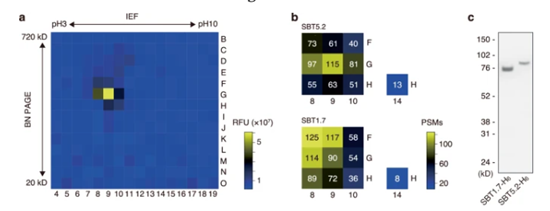
使用该系统对聚丙烯酰胺凝胶上的内切蛋白酶进行凝胶内检测。该程序鉴定了两种枯草杆菌酶,SBT5.2 (At1g20160) 和 SBT1.7 (At5g67360;也称为 ARA12),这两种枯草杆菌酶均在具有高 PSM 分数的活性凝胶组分中被特异性检测到。进一步研究表明SBT5.2 和 SBT1.7 可将 flg22 的 C 末端从鞭毛蛋白上切割下来,并且sbt5.2 sbt1.7双突变体中 flg22 从鞭毛蛋白 C 端裂解减少。
图2. SBT5.2 和 SBT1.7 鉴定为参与 flg22 结构域 C 端切割的内切蛋白酶.
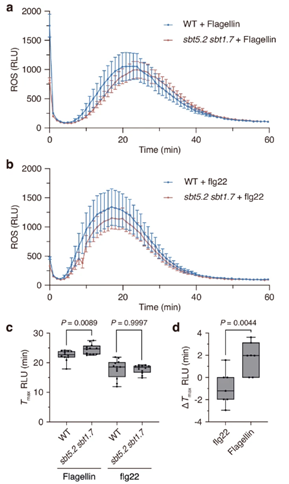
为了研究 PTI 期间 SBT5.2 和 SBT1.7 介导的鞭毛蛋白裂解的生物学作用,作者测量了用 100 nM 鞭毛蛋白处理的 WT 和sbt5.2 sbt1.7双突变体植物叶盘中 ROS 的产生。与 WT 叶盘相比,在鞭毛蛋白处理后, sbt5.2 sbt1.7叶盘中ROS 的产生延迟了约 2 分钟。sbt5.2 sbt1.7中 flg22 结构域 C 末端蛋白水解活性降低的结果。SBT5.2和SBT1.7的缺失会增加免疫原性肽蛋白水解释放所需的时间,导致 ROS 产生延迟。
图3.SBT5.2 和 SBT1.7 的缺失鞭毛蛋白暴露后叶盘中 ROS 的产生延迟.
通过纳米液相色谱-串联质谱(nano-LC-MS/MS)分析了拟南芥质外体中鞭毛蛋白的断裂模式,研究鞭毛蛋白中免疫原肽段的蛋白酶解释放。鞭毛蛋白的主要内切位点之一是flg22结构域的C端。通过蛋白质组学方法和荧光猝灭肽底物,确定了两种蛋白酶SBT5.2和SBT1.7参与了鞭毛蛋白在flg22结构域C端的切割。使用荧光淬灭底物结合天然二维电泳和蛋白质组学,有助于已经鉴定或推导了蛋白质裂解位点,但还没有找到相应的蛋白酶的鉴定和表征。
文章来源:植物生物技术Pbj