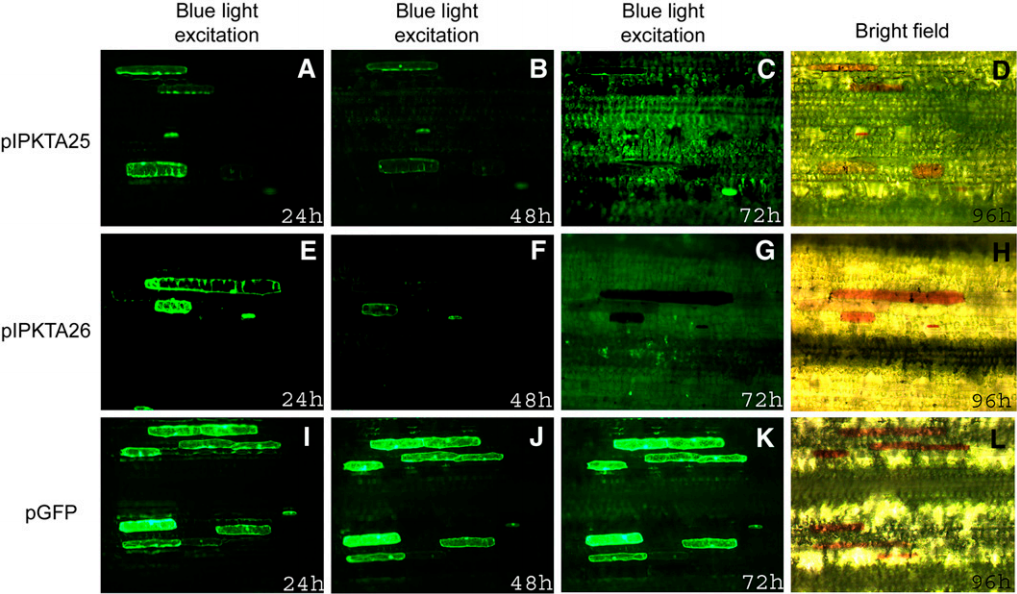
4.2无转化体系
>>>>4.2.1基因的时空表达模式
>>>>4.2.2建立瞬时转化体系
通过瞬时转化体系得到的实验结果,可以作为基因功能研究的一个辅助,还需要其他的数据支撑。下面伯小远就以不同的植物组织形态、部位、侵染方式来分享一下瞬时转化技术吧。
4.2.2.1 愈伤
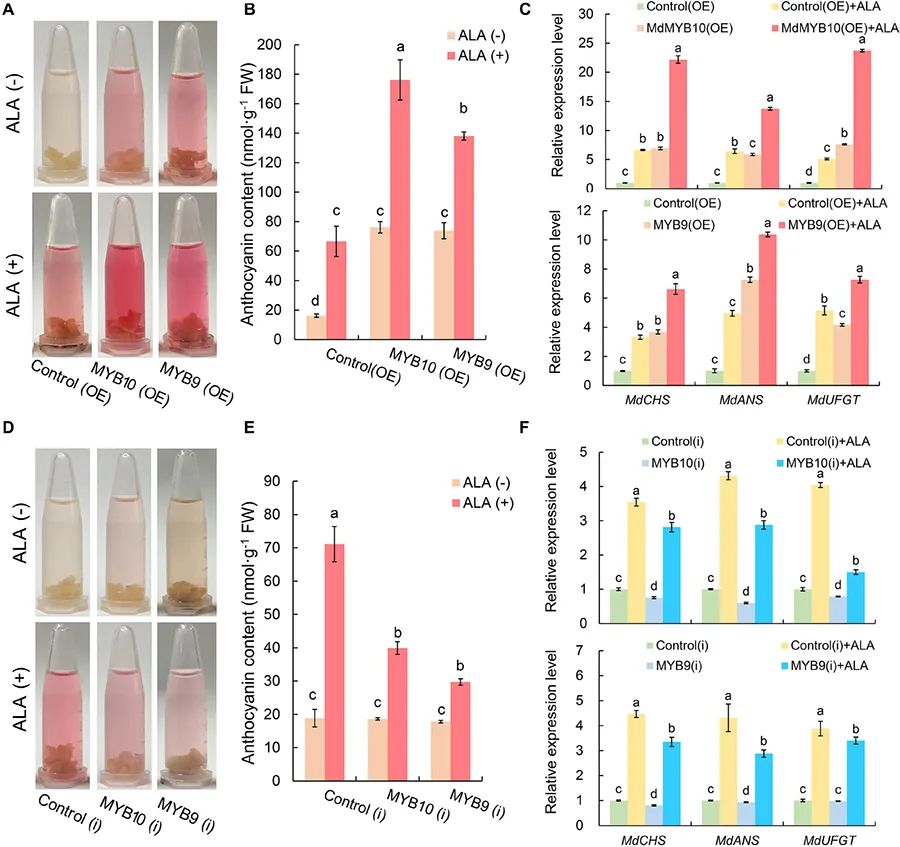 图1 ALA对过表达MdMYB10和MdMYB9的转基因苹果愈伤组织的着色水平、花青素含量、相应基因表达的影响 (Zheng et al. 2021)。bHLH转录因子是植物中最大的转录因子家族之一。Yuanwen Teng团队通过农杆菌侵染得到过表达PpbHLH64基因和干扰PpbHLH64基因的梨愈伤组织,经过连续光照处理,过表达PpbHLH64基因的梨愈伤组织相比干扰该基因的梨愈伤组织积累了更多的花青素(图2),这一结果证明了PpbHLH64与光诱导的花青素积累有关。
图1 ALA对过表达MdMYB10和MdMYB9的转基因苹果愈伤组织的着色水平、花青素含量、相应基因表达的影响 (Zheng et al. 2021)。bHLH转录因子是植物中最大的转录因子家族之一。Yuanwen Teng团队通过农杆菌侵染得到过表达PpbHLH64基因和干扰PpbHLH64基因的梨愈伤组织,经过连续光照处理,过表达PpbHLH64基因的梨愈伤组织相比干扰该基因的梨愈伤组织积累了更多的花青素(图2),这一结果证明了PpbHLH64与光诱导的花青素积累有关。
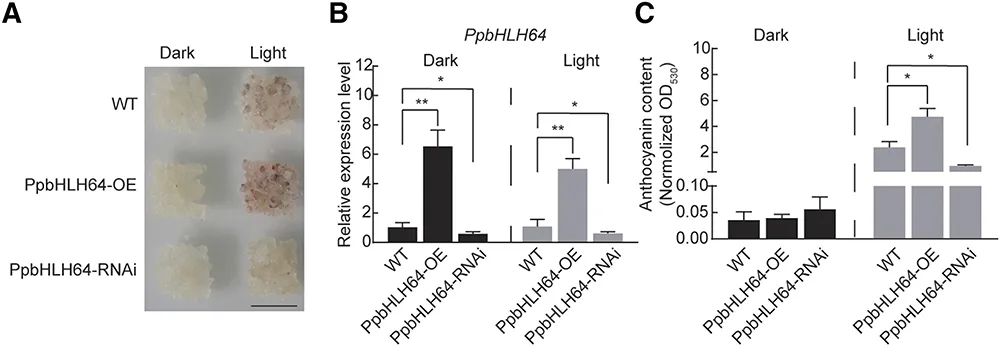 图2 PpbHLH64在梨愈伤组织中的功能分析 (Tao et al. 2020)。(A)梨愈伤组织中花青素的积累,OE为过表达实验组,RNAi为干扰实验组;(B)A中梨愈伤组织中PpbHLH64基因的相对表达量;(C)A中梨愈伤组织的花青素含量。
图2 PpbHLH64在梨愈伤组织中的功能分析 (Tao et al. 2020)。(A)梨愈伤组织中花青素的积累,OE为过表达实验组,RNAi为干扰实验组;(B)A中梨愈伤组织中PpbHLH64基因的相对表达量;(C)A中梨愈伤组织的花青素含量。
4.2.2.2 悬浮细胞
 图3 拟南芥、大豆、百脉根的悬浮细胞培养 (Moscatiello et al. 2013)。(a-c)在培养皿的固体培养基上培养愈伤;(d-f)在液体培养基中培养悬浮细胞;(g-i)光学显微镜下观察悬浮培养细胞。
图3 拟南芥、大豆、百脉根的悬浮细胞培养 (Moscatiello et al. 2013)。(a-c)在培养皿的固体培养基上培养愈伤;(d-f)在液体培养基中培养悬浮细胞;(g-i)光学显微镜下观察悬浮培养细胞。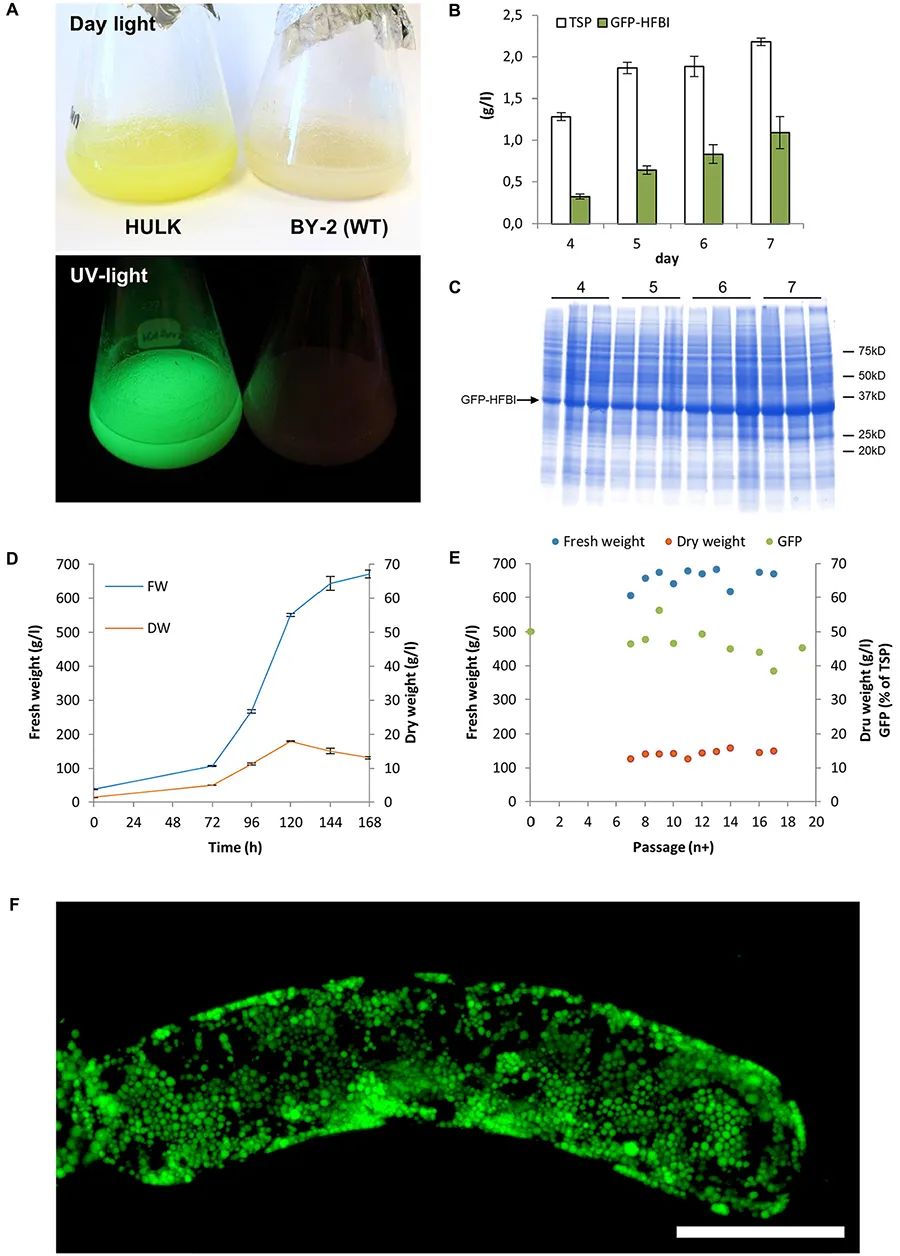 图4 烟草BY-2 Hulk细胞可表达高水平的GFP-HFBI蛋白 (Häkkinen et al. 2018)。(A)烟草BY-2 Hulk细胞中积累了GFP-HFBI蛋白;(B)对培养的蛋白进行含量测定;(C)SDS-PAGE检测蛋白;(D、E)鲜重、干重的测定;(F)共聚焦显微镜显示GFP-HFBI在蛋白质体中的积累。
图4 烟草BY-2 Hulk细胞可表达高水平的GFP-HFBI蛋白 (Häkkinen et al. 2018)。(A)烟草BY-2 Hulk细胞中积累了GFP-HFBI蛋白;(B)对培养的蛋白进行含量测定;(C)SDS-PAGE检测蛋白;(D、E)鲜重、干重的测定;(F)共聚焦显微镜显示GFP-HFBI在蛋白质体中的积累。
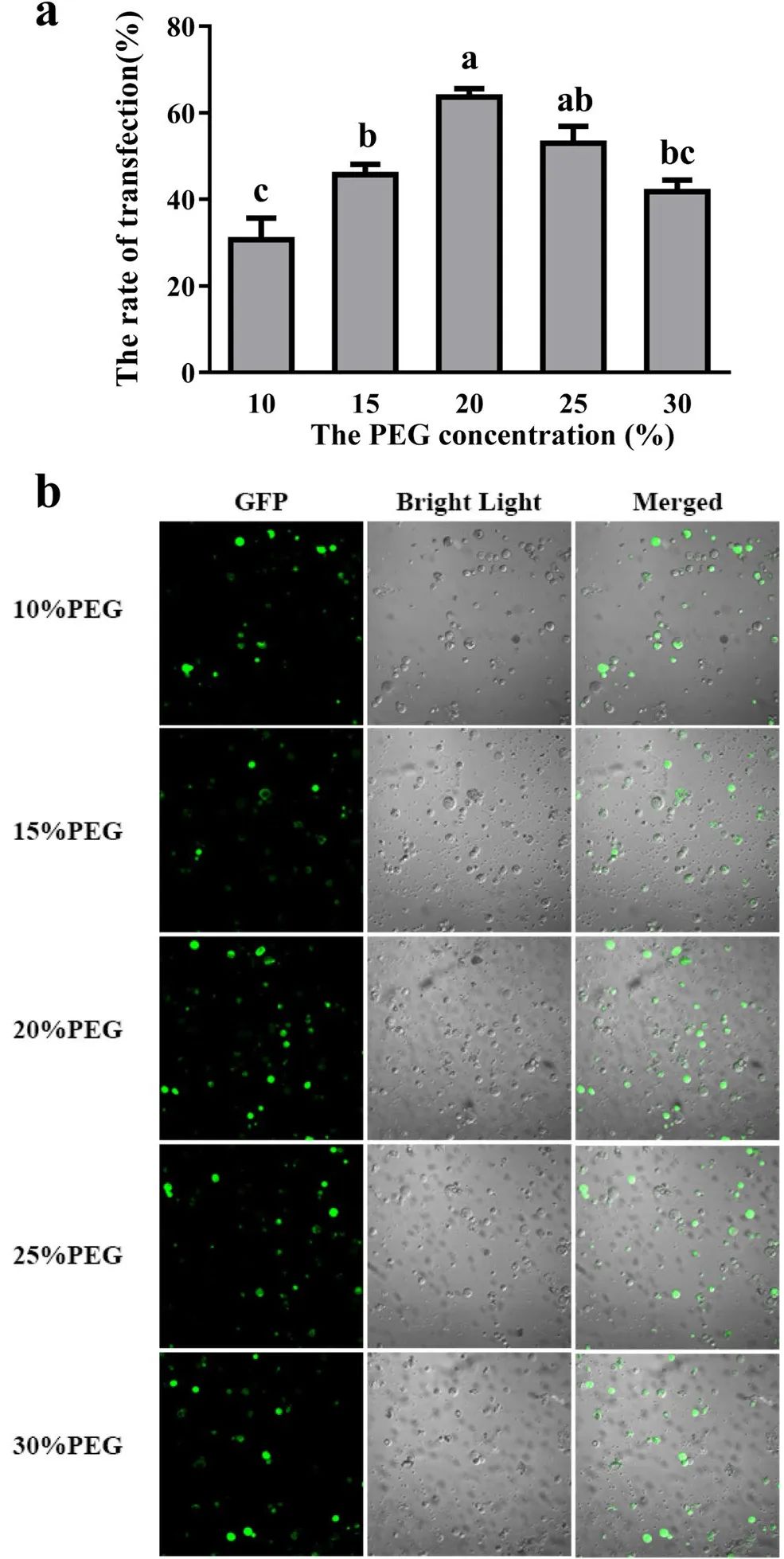 图5 PEG3350的浓度对小苍兰原生质体转化效率的影响 (Shan et al. 2019)。
图5 PEG3350的浓度对小苍兰原生质体转化效率的影响 (Shan et al. 2019)。
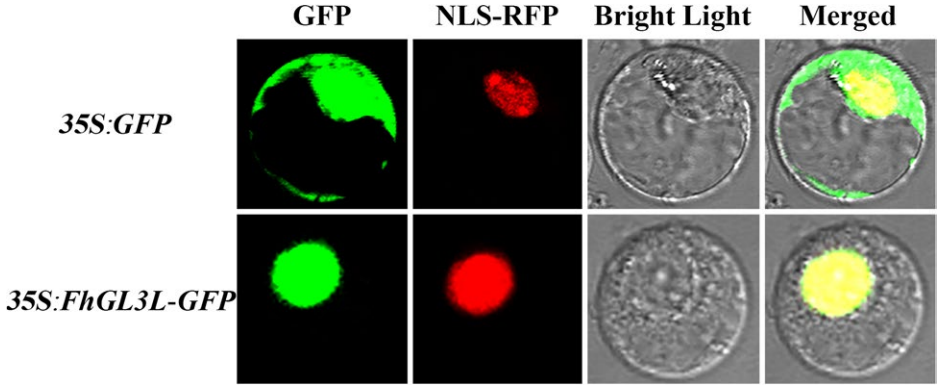 图6 在小苍兰原生质体中进行的亚细胞定位实验 (Shan et al. 2019)。
图6 在小苍兰原生质体中进行的亚细胞定位实验 (Shan et al. 2019)。
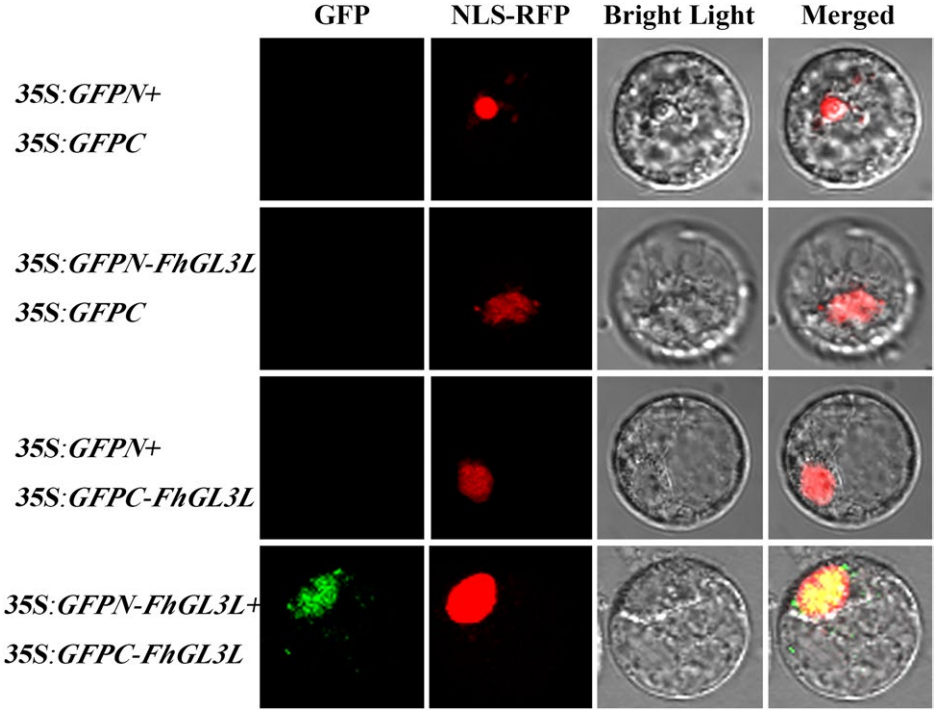 图7 在小苍兰原生质体中进行的BiFC实验 (Shan et al. 2019)。此实验目的是为了验证FhGL3L蛋白可以二聚化。
图7 在小苍兰原生质体中进行的BiFC实验 (Shan et al. 2019)。此实验目的是为了验证FhGL3L蛋白可以二聚化。
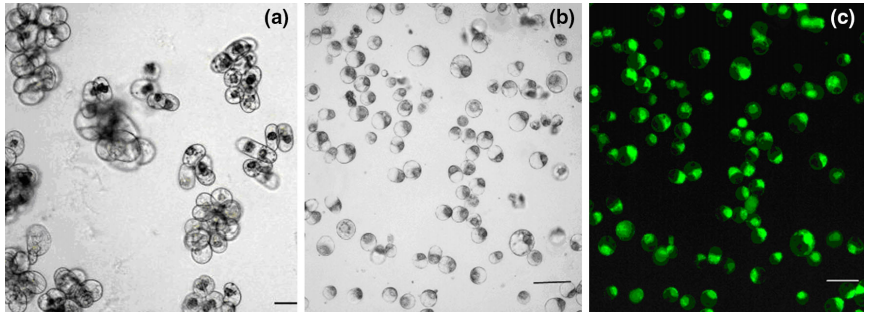 图8 从胡杨的悬浮细胞中分离原生质体 (Guo et al. 2015)。
图8 从胡杨的悬浮细胞中分离原生质体 (Guo et al. 2015)。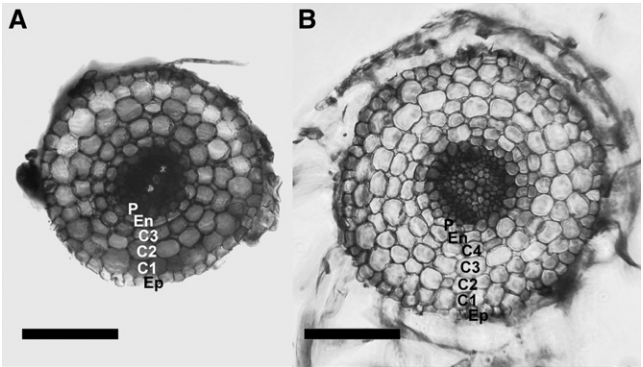 图9 番茄的不定根与毛状根在解剖学上结构相似 (Ron et al. 2014)。该团队通过切下番茄的子叶与发根农杆菌共培养来进行毛状根诱导,结果发现不定根与毛状根唯一的区别是毛状根通常还有一个额外的皮质层,而在整体细胞结构及其他方面几乎无区别。
图9 番茄的不定根与毛状根在解剖学上结构相似 (Ron et al. 2014)。该团队通过切下番茄的子叶与发根农杆菌共培养来进行毛状根诱导,结果发现不定根与毛状根唯一的区别是毛状根通常还有一个额外的皮质层,而在整体细胞结构及其他方面几乎无区别。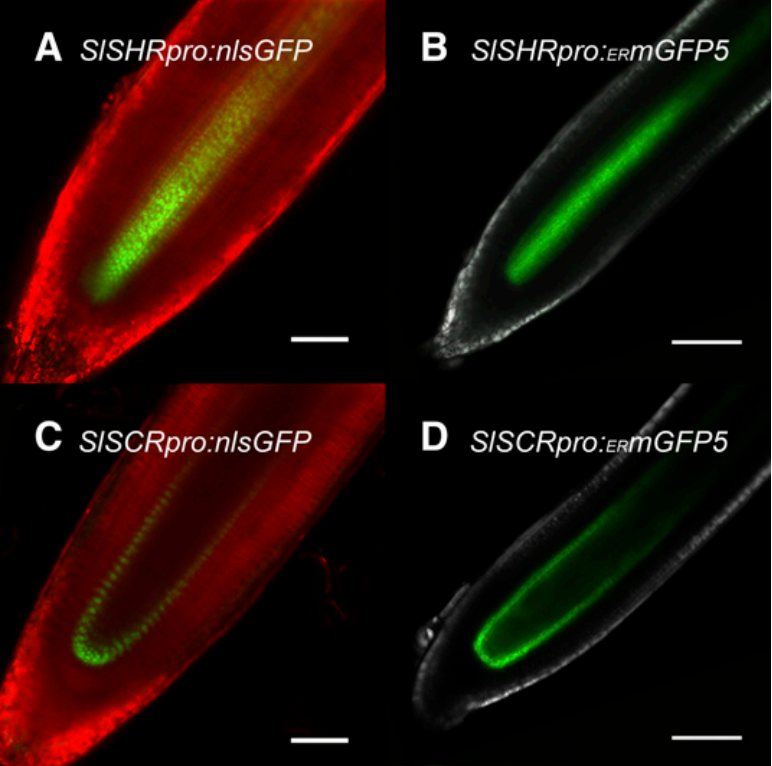 图10 由SHORT-ROOT和SCARECROW启动子驱动的表达模式在番茄的初生根与毛状根中是相同的 (Ron et al. 2014)。(A、C)诱导出的毛状根;(B、D)由根癌农杆菌介导的转基因番茄的初生根。
图10 由SHORT-ROOT和SCARECROW启动子驱动的表达模式在番茄的初生根与毛状根中是相同的 (Ron et al. 2014)。(A、C)诱导出的毛状根;(B、D)由根癌农杆菌介导的转基因番茄的初生根。 图11 无菌条件下大豆毛状根的转化及培养 (Jiang et al. 2019)。(a)在干燥器中使用氯气对大豆种子进行消毒;(b)在培养基中长到约6cm高;在感染发根农杆菌K599后的第4天(c)、第10天(d)、第12天(e)、第15天(f)、第19天(g);(h)毛状根被切掉并转移至White培养基中。
图11 无菌条件下大豆毛状根的转化及培养 (Jiang et al. 2019)。(a)在干燥器中使用氯气对大豆种子进行消毒;(b)在培养基中长到约6cm高;在感染发根农杆菌K599后的第4天(c)、第10天(d)、第12天(e)、第15天(f)、第19天(g);(h)毛状根被切掉并转移至White培养基中。
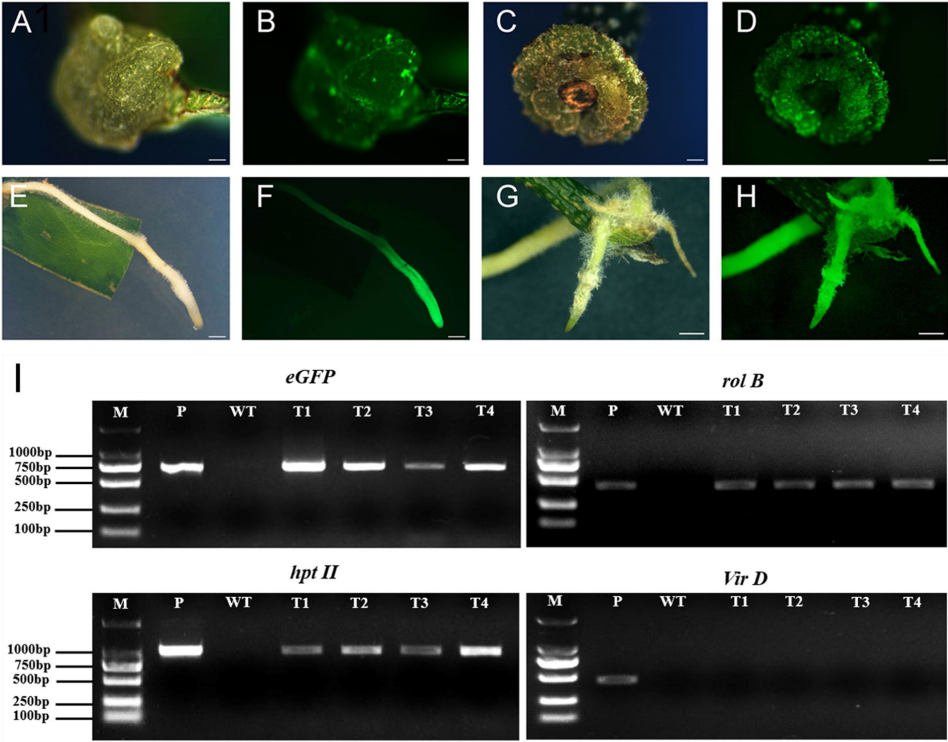 图12 由发根农杆菌介导的荔枝转化 (Qin et al. 2021)。由叶盘诱导出的愈伤(A)及其荧光图像(B),由茎段导出的愈伤(C)及其荧光图像(D),由叶片诱导出的毛状根(E)及其荧光图像(F),由茎段诱导出的毛状根(G)及其荧光图像(H),检测转基因毛状根中的基因(I),显示位于Ri质粒上但不在T-DNA上的VirD基因不存在于毛状根中,其他T-DNA上的eGFP、hptII基因均存在,负责毛根分化的rolB基因也存在。
图12 由发根农杆菌介导的荔枝转化 (Qin et al. 2021)。由叶盘诱导出的愈伤(A)及其荧光图像(B),由茎段导出的愈伤(C)及其荧光图像(D),由叶片诱导出的毛状根(E)及其荧光图像(F),由茎段诱导出的毛状根(G)及其荧光图像(H),检测转基因毛状根中的基因(I),显示位于Ri质粒上但不在T-DNA上的VirD基因不存在于毛状根中,其他T-DNA上的eGFP、hptII基因均存在,负责毛根分化的rolB基因也存在。
图13 对油松、青海云杉、丽江云杉的下胚轴进行农杆菌介导的瞬时转化后的检测 (Liu et al. 2020)。
图14 对两种大麻品种的下胚轴进行瞬时转化并检测 (Zaldívar-Cruz et al. 2003)。
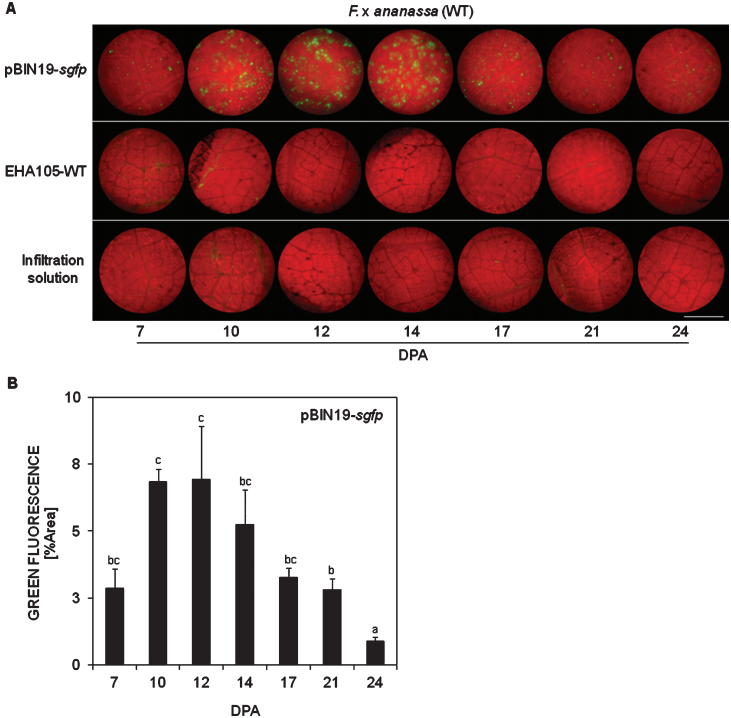 图15 草莓F. x ananassa叶片瞬时表达GFP (Hael-Conrad et al. 2019)。(A)叶片与农杆菌共培养后,在不同时间取样观察转入的GFP的表达情况;(B)对GFP荧光强度的量化比较。
图15 草莓F. x ananassa叶片瞬时表达GFP (Hael-Conrad et al. 2019)。(A)叶片与农杆菌共培养后,在不同时间取样观察转入的GFP的表达情况;(B)对GFP荧光强度的量化比较。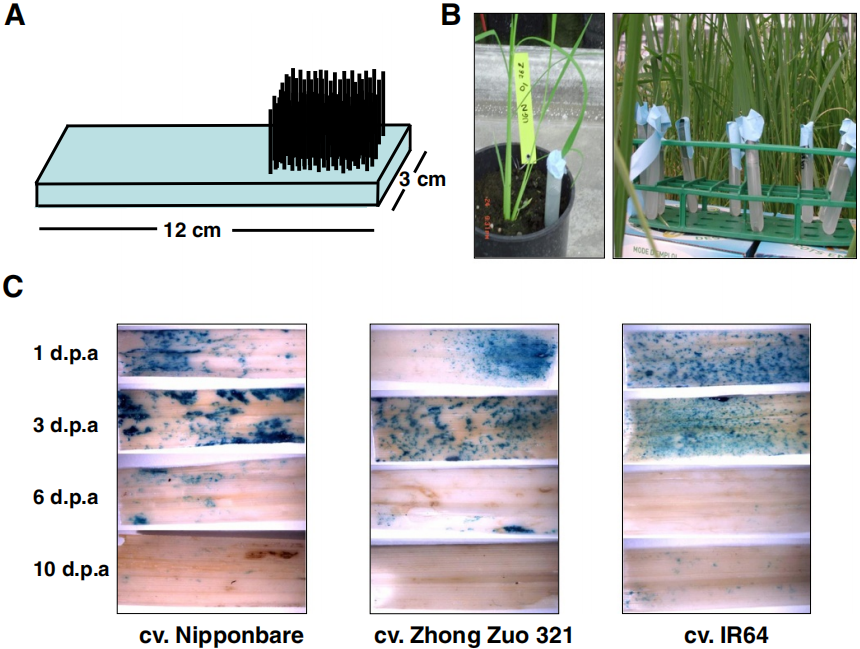
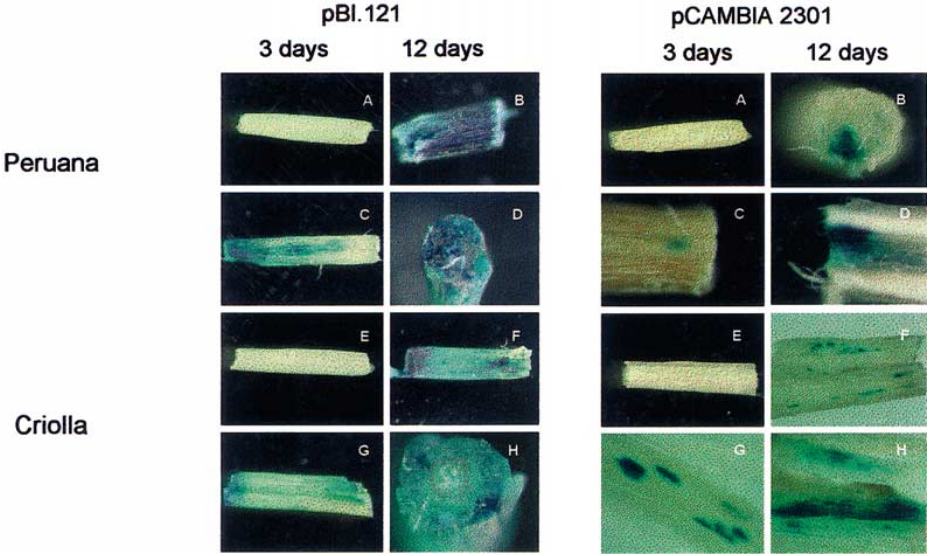
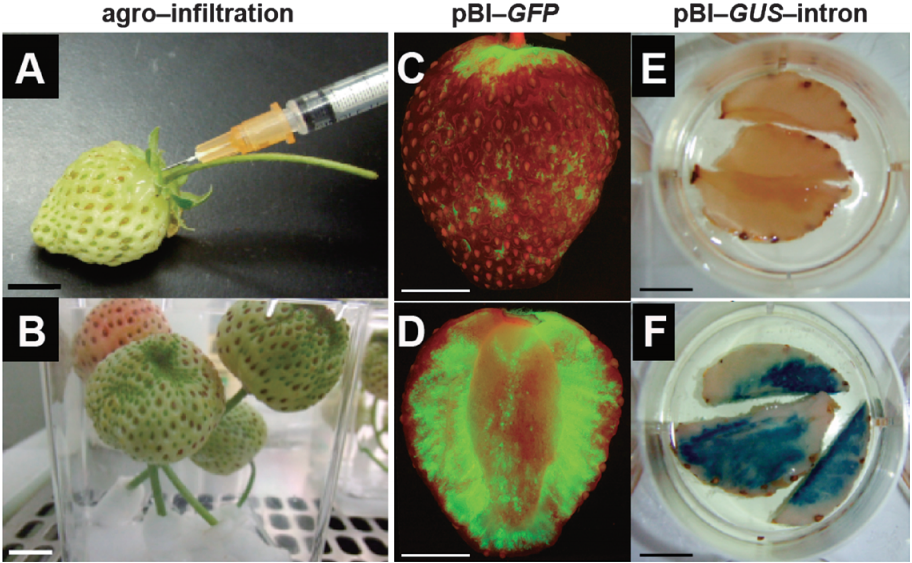 图17 在草莓中瞬时表达pBI-GFP和pBI-GUS (Miyawaki et al. 2012)。(A)将农杆菌侵染液注射到整个果实中;(B)注射后的果实置于盒中,放置于生长室;(C、D)侵染5天后检测果实正面、横截面的GFP荧光;(E)GUS染色的阴性对照;(F)侵染7天后检测果实的GUS染色情况。
图17 在草莓中瞬时表达pBI-GFP和pBI-GUS (Miyawaki et al. 2012)。(A)将农杆菌侵染液注射到整个果实中;(B)注射后的果实置于盒中,放置于生长室;(C、D)侵染5天后检测果实正面、横截面的GFP荧光;(E)GUS染色的阴性对照;(F)侵染7天后检测果实的GUS染色情况。
图18 干扰草莓果实的CHS基因及对照 (Hoffmann et al. 2006)。为了干扰草莓果实中的CHS基因(查耳酮合酶基因,与色素合成有关),构建了发夹干扰载体,通过瞬时转化体系注射入授粉14天后仍生长在植株上的果实,约10-14天后,果实上形成了白色区域(a、d),分别注射3次将收获几乎全白的果实(b、e),而注射空载则与正常果实一样(c、f)。
图19 在猕猴桃A. arguta RB-4瞬时过表达AaPG18基因 (Li et al. 2022)。(A)注射pBI121-AaPG18的果实一侧变红;(B)注射空载体的果实一侧没有变化;(C)qRT-PCR检测的结果显示注射后(A)果实中的AaPG18基因表达量升高。
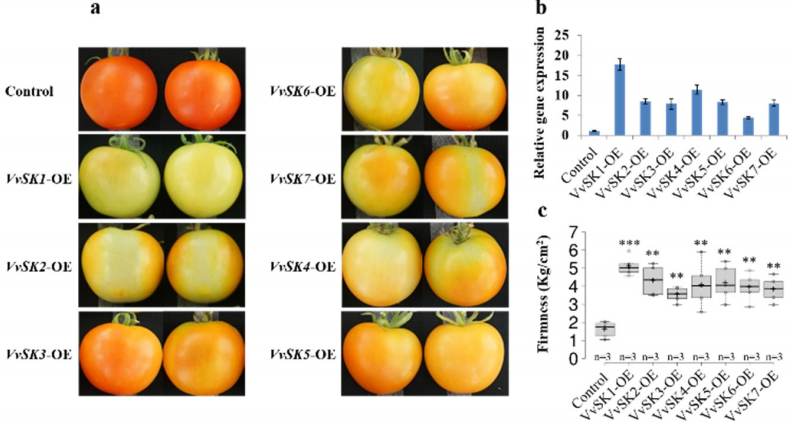
图20 在番茄中瞬时过表达VvSK基因以抑制果实成熟 (Zeng et al. 2020)。葡萄的VvSK基因在浆果转色后期强烈表达。(a)将35S:VvSK7-GFP注射到开花后12天的番茄果实中,4天后进行观察;(b)qRT-PCR检测VvSK基因的转录水平;(c)番茄果实硬度的测量。
图21 在不同的真空压力下,对瞬时转化的GUS基因表达情况进行检测 (Lv et al. 2019)。(a-d)为四种不同的苹果品种。

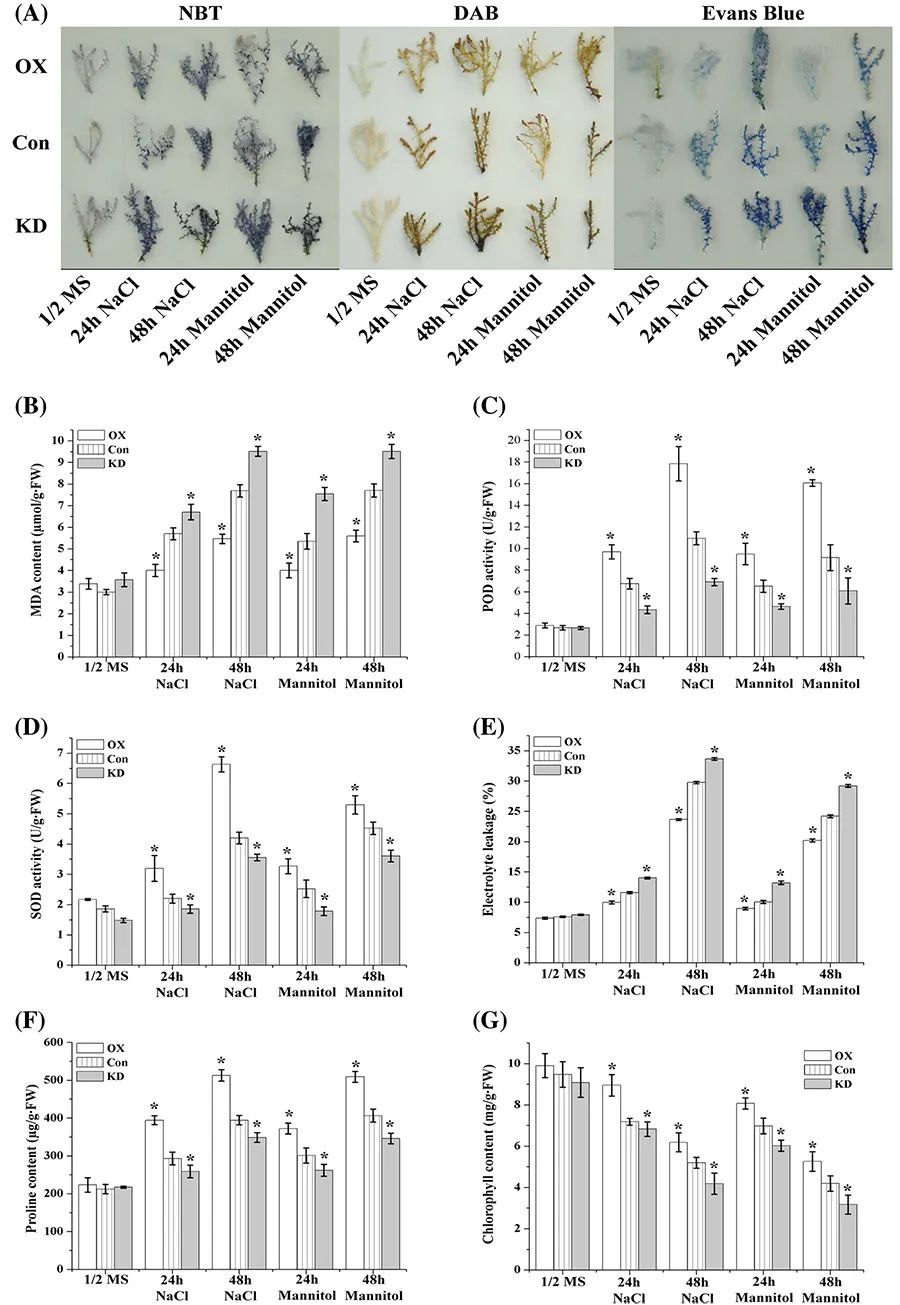
图23 ThDof1.4介导的生理生化分析 (Zang et al. 2017)。图中OX指瞬时过表达ThDof1.4,Con指瞬时转入空载作为对照组,KD指瞬时干扰ThDof1.4。(A)NBT、DAB、Evans blue染色;(B-G)检测不同瞬时转化材料胁迫处理后MDA含量、POD活性、SOD活性、电解质渗漏、脯氨酸含量、叶绿素含量。
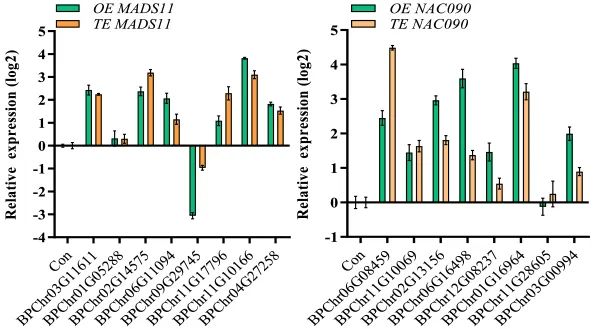
图24 检测过表达BpNAC090和BpMADS11基因的植株中,受这两个基因影响的相关基因的表达情况 (Jia et al. 2022)。图中OE指稳定转化BpNAC090和BpMADS11基因,TE指瞬时转化BpNAC090和BpMADS11基因。
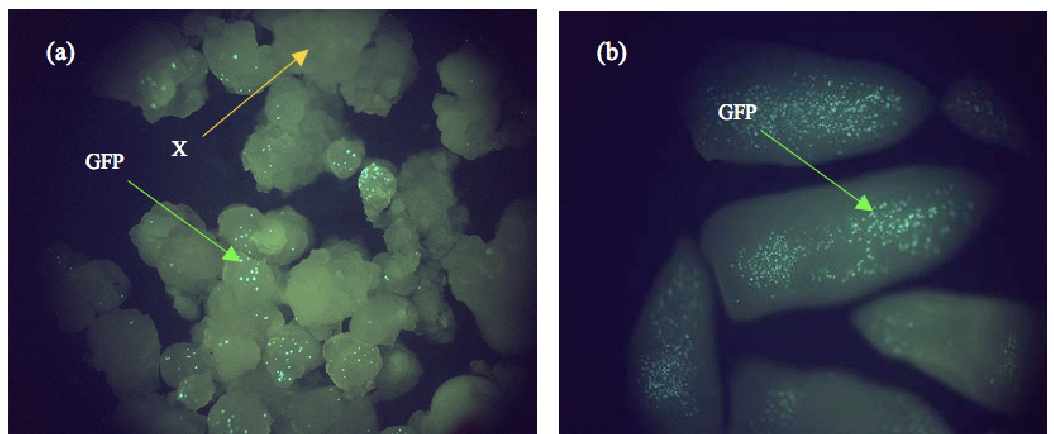
图25 在油棕中瞬时表达GFP (Kadir et al. 2007)。携带GFP的微粒轰击油棕的愈伤组织(a)和未成熟合子(b)。
图26 荧光蛋白在玉米中的瞬时和稳定表达模式 (Daniel et al. 2012)。共聚焦激光扫描显微镜图像显示近轴表皮细胞中ZmXYLT-mRFP(A)的瞬时表达、ZmROP7-mTFP的瞬时表达(B)和ZmPDI-YFP的稳定(C)和瞬时(D-F)表达。
图27 微粒轰击大麦叶片进行瞬时转化 (Dong et al. 2012)。
Dong, Wubei et al. “Protein polyubiquitination plays a role in basal host resistance of barley.” The Plant cell vol. 18,11 (2006): 3321-31. doi:10.1105/tpc.106.046326
Guo, Y., Song, X., Zhao, S. et al. A transient gene expression system in Populus euphratica Oliv. protoplasts prepared from suspension cultured cells. Acta Physiol Plant 37, 160 (2015). https://doi.org/10.1007/s11738-015-1906-8
Hael-Conrad, Verónica et al. GFP Transient Expression and Silencing in Fragaria x Ananassa. 1 Jan. 2020 : 209 – 222.
Häkkinen ST, Reuter L, Nuorti N, Joensuu JJ, Rischer H, Ritala A (2018) Tobacco BY-2 Media Component Optimization for a Cost-Efficient Recombinant Protein Production. 9. doi:10.3389/fpls.2018.00045
Hoffmann T, Kalinowski G, Schwab W (2006) RNAi-induced silencing of gene expression in strawberry fruit (Fragaria x ananassa) by agroinfiltration: a rapid assay for gene function analysis. Plant J 48 (5):818-826. doi:10.1111/j.1365-313X.2006.02913.x
Jia Y, Niu Y, Zhao H, Wang Z, Gao C, Wang C, Chen S, Wang Y (2022) Hierarchical transcription factor and regulatory network for drought response in Betula platyphylla. Hortic Res. doi:10.1093/hr/uhac040
Jiang, Hua et al. Agrobacterium rhizogenes-induced soybean hairy roots versus Soybean mosaic virus (ARISHR-SMV) is an efficient pathosystem for studying soybean-virus interactions. Plant methods vol. 15 56. 25 May. 2019, doi:10.1186/s13007-019-0442-8
Kadir, Ghulam and Ahmad Parveez (2007). Evaluation of Green Fluorescence Protein (GFP) as a Selectable Marker for Oil Palm Transformation via Transient Expression. Asia-Pacific Journal of Molecular Biology and Biotechnology 15.1:1-8.
Li Y, Huang H, Abid M, Gu H, Fang J, Cheng Z, Qi X (2022) Characterization and Identification of a Ripening-Related Gene AaPG18 in Actinidia arguta. Int J Mol Sci 23 (5). doi:10.3390/ijms23052597
Liu, S., Ma, J., Liu, H. et al. An efficient system for Agrobacterium-mediated transient transformation in Pinus tabuliformis. Plant Methods 16, 52 (2020). https://doi.org/10.1186/s13007-020-00594-5
Lv Y, Zhang M, Wu T, Wu T, Zhong Y (2019) The infiltration efficiency of Agrobacterium-mediated transient transformation in four apple cultivars. Scientia Horticulturae 256:108597. doi:https://doi.org/10.1016/j.scienta.2019.108597
Miyawaki K, Fukuoka S, Kadomura Y, Hamaoka H, Mito T, Ohuchi H, Schwab W, Noji S (2012) Establishment of a novel system to elucidate the mechanisms underlying light-induced ripening of strawberry fruit with an <i>Agrobacterium</i>-mediated RNAi technique. Plant Biotechnology advpub. doi:10.5511/plantbiotechnology.12.0406a
Moscatiello R, Baldan B, Navazio L (2013) Plant Cell Suspension Cultures. In: Maathuis FJM (ed) Plant Mineral Nutrients: Methods and Protocols. Humana Press, Totowa, NJ, pp 77-93. doi:10.1007/978-1-62703-152-3_5
Qin, Y., Wang, D., Fu, J. et al. Agrobacterium rhizogenes-mediated hairy root transformation as an efficient system for gene function analysis in Litchi chinensis. Plant Methods 17, 103 (2021). https://doi.org/10.1186/s13007-021-00802-w
Ron, Mily et al. “Hairy root transformation using Agrobacterium rhizogenes as a tool for exploring cell type-specific gene expression and function using tomato as a model.” Plant physiology vol. 166,2 (2014): 455-69. doi:10.1104/pp.114.239392
Santos RB, Abranches R, Fischer R, Sack M, Holland T (2016) Putting the Spotlight Back on Plant Suspension Cultures. 7. doi:10.3389/fpls.2016.00297
Shan, X., Li, Y., Zhou, L. et al. Efficient isolation of protoplasts from freesia callus and its application in transient expression assays. Plant Cell Tiss Organ Cult 138, 529–541 (2019). https://doi.org/10.1007/s11240-019-01649-9
Tao R, Yu W, Gao Y, Ni J, Yin L, Zhang X, Li H, Wang D, Bai S, Teng Y (2020) Light-Induced Basic/Helix-Loop-Helix64 Enhances Anthocyanin Biosynthesis and Undergoes CONSTITUTIVELY PHOTOMORPHOGENIC1-Mediated Degradation in Pear. Plant Physiol 184 (4):1684-1701. doi:10.1104/pp.20.01188
Zaldívar-Cruz, J., Ballina-Gómez, H., Guerrero-Rodríguez, C. et al. Agrobacterium-mediated transient transformation of annatto (Bixa orellana) hypocotyls with the GUS reporter gene. Plant Cell, Tissue and Organ Culture 73, 281–284 (2003). https://doi.org/10.1023/A:1023037108705
Zang D, Wang L, Zhang Y, Zhao H, Wang Y (2017) ThDof1.4 and ThZFP1 constitute a transcriptional regulatory cascade involved in salt or osmotic stress in Tamarix hispida. Plant Mol Biol 94 (4-5):495-507. doi:10.1007/s11103-017-0620-x
Zeng J, Haider MS, Huang J, Xu Y, Pervaiz T, Feng J, Zheng H, Tao J (2020) Functional Characterization of VvSK Gene Family in Grapevine (Vitis vinifera L.) Revealing their Role in Berry Ripening. Int J Mol Sci 21 (12). doi:10.3390/ijms21124336
Zheng J, Liu L, Tao H, An Y, Wang L (2021) Transcriptomic Profiling of Apple Calli With a Focus on the Key Genes for ALA-Induced Anthocyanin Accumulation. Front Plant Sci 12:640606. doi:10.3389/fpls.2021.640606
Zheng L, Liu G, Meng X, Li Y, Wang Y (2012) A versatile Agrobacterium-mediated transient gene expression system for herbaceous plants and trees. Biochem Genet 50 (9-10):761-769. doi:10.1007/s10528-012-9518-0
官网链接:plant.biorun.com