泛素化是蛋白质翻译后修饰的类型之一,泛素-蛋白酶体系统(UPS)与底物间的相互作用构成了复杂的泛素化信号网络,参与调控细胞周期、免疫应激反应、信号传导等生物体内几乎所有的生命活动。深入研究蛋白质的泛素化,对于揭示其在植物免疫、生长发育及应对非生物胁迫中发挥作用的分子机制具有重要意义。关于蛋白质泛素化的基本概念及背景知识伯小远已经在往期文章“蛋白翻译后修饰——泛素化”详细介绍了,感兴趣的话大家可以点击链接阅读~
1)GPS-SUMO: Prediction of SUMOylation Sites & SUMO-interacting Motifs (biocuckoo.cn)
2)ProP 1.0-DTU Health Tech-Bioinformatic Services
3)GPS-Uber-Ubiquitin-protein ligase enzymes-substrate relationship prediction (biocuckoo.cn)
4)UbiNet 2.0 (cuhk.edu.cn)
5)The CUCKOO Workgroup (biocuckoo.org)
需要注意的是,网站仅能提供预测,想要得到真实可靠的结果大家还是需要通过相关实验进行证明哦!
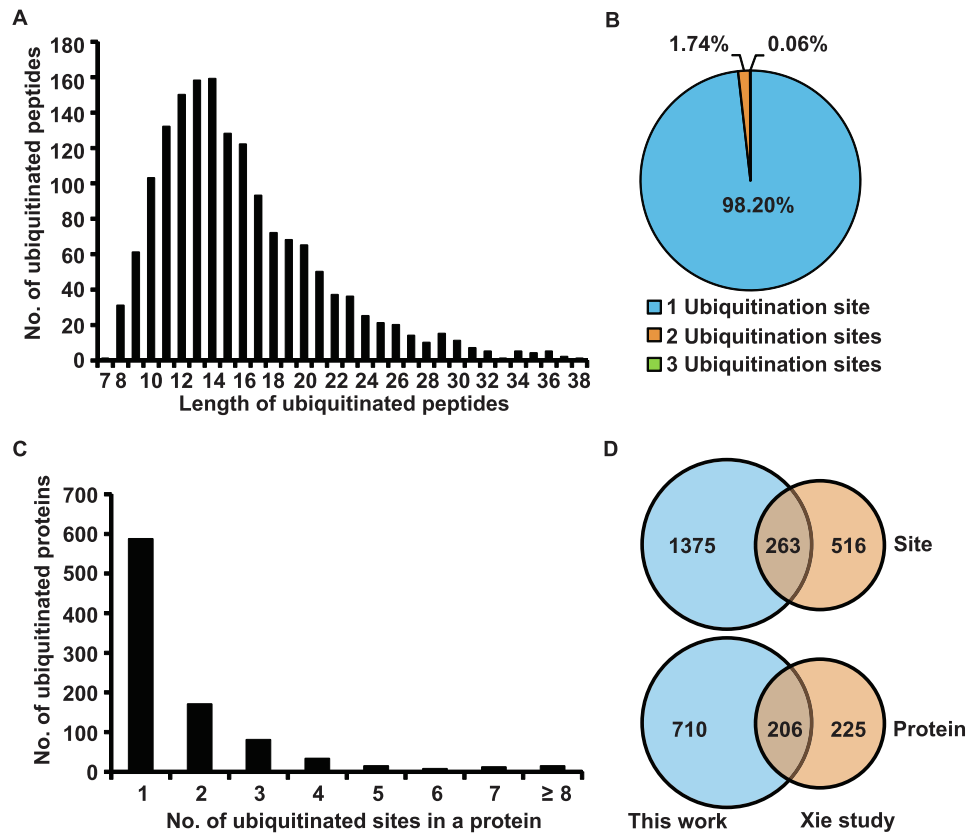
2020年,华南农业大学周海课题组在Genomics Proteomics Bioinformatics杂志上发表了一篇题为“Ubiquitinome Profiling Reveals the Landscape of Ubiquitination Regulation in Rice Young Panicles”的研究论文,在该研究论文中作者利用液相色谱-质谱联用技术(LC-MS/MS)技术,分析了水稻幼穗中蛋白质的泛素化情况,共鉴定到916个泛素化蛋白、1638个泛素化修饰位点。其中710个泛素化蛋白及1375个泛素化位点是前人未鉴定到的(图1)。
图1 水稻幼穗中已鉴定赖氨酸泛素化肽的特征(Zhu et al., 2020)。(A)泛素化肽在不同长度肽中的分布;(B)基于泛素化位点数量的泛素化肽的分布;(C)基于泛素化位点数量的泛素化蛋白的分布;(D)幼穗和幼叶之间泛素化位点和泛素化蛋白数量的比较(Xin et al., 2015)。
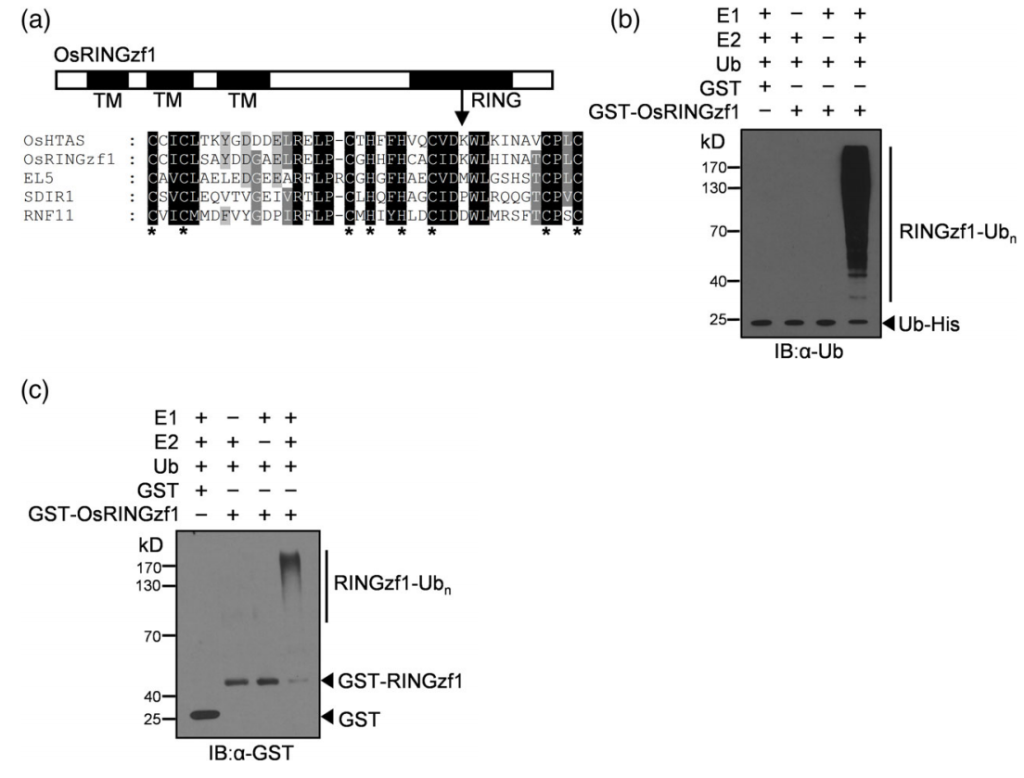
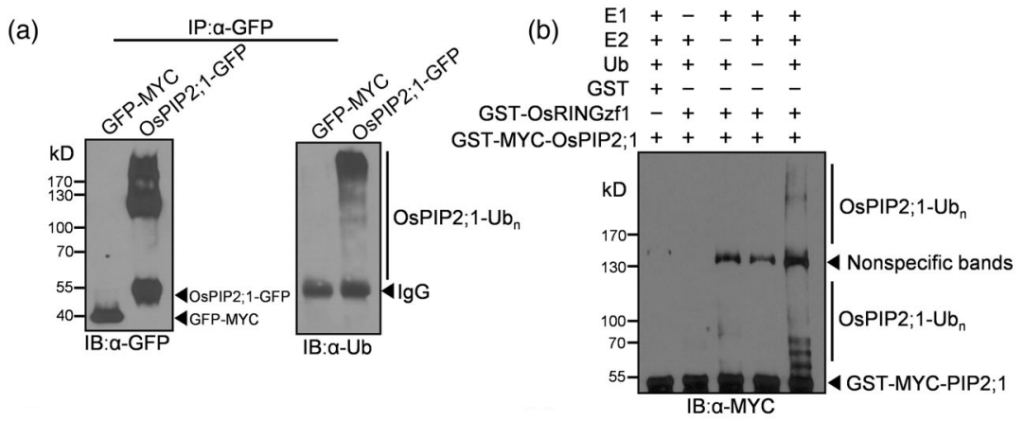
2022年,上海市农业生物基因中心罗利军课题组在Plant Biotechnology Journal杂志上发表了一篇题为“Ubiquitin ligase OsRINGzf1 regulates drought resistance by controlling the turnover of OsPIP2;1”的研究论文。在该研究论文中,作者在干旱条件下从水稻中鉴定出了编码E3泛素连接酶的基因OsRINGzf1,通过蛋白结构域分析和体外表达纯化OsRINGzf1蛋白,并结合蛋白质免疫印记实验证实该蛋白具有E3泛素连接酶活性(图2)。此外作者通过Co-IP、Spilt-LUC实验验证了OsRINGzf1和OsPIP2;1蛋白存在互作。为了验证OsPIP2;1是否是OsRINGzf1的泛素化靶点,作者构建了GFP-OsPIP2;1的融合表达蛋白,用抗GFP抗体和抗泛素化抗体进行免疫印迹检测,结果表明OsPIP2;1在体内发生泛素化,结合体外泛素化实验验证了OsPIP2;1是OsRINGzf1的泛素化靶点(图3)。
图2 OsRINGzf1具有泛素连接酶活性(Chen et al., 2022)。(a)OsRINGzf1是一个RING-H2型E3连接酶;(b-c)在E1、E2和泛素蛋白存在的情况下,泛素化抗体和GST抗体检测OsRINGzf1-GST自泛素化。
图3 OsRINGzf1介导OsPIP2;1的泛素化 (Chen et al., 2022)。(a)OsPIP2;1蛋白的体内泛素化,以GFP-MYC为阴性对照;(b)OsPIP2;1蛋白体外泛素化,GST作为阴性对照。
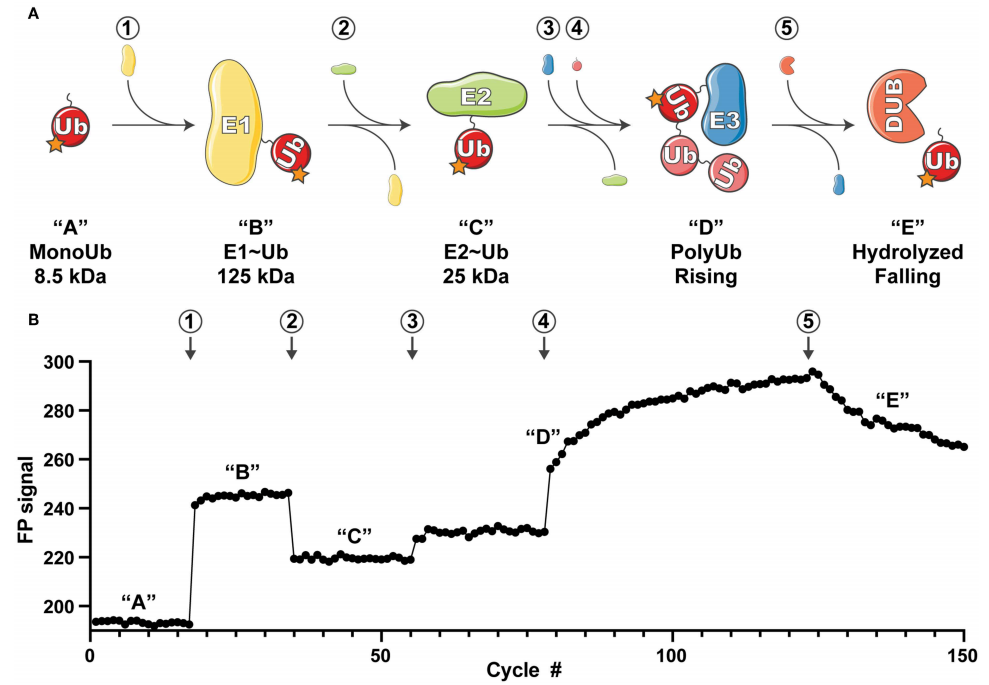
图4 UbiReal实验原理概览(Franklin and Pruneda, 2019)。(A)UbiReal监测的泛素偶联序列状态示意图,圈出的数字表示添加对应的蛋白质,与(B)中的数字对应,引号中的字母表示泛素复合物的状态,也对应到(B)中观察到的荧光偏振(Fluorescence polarization,FP)信号的变化。提供了复合物的近似分子量,并反映了预期FP信号的幅度。“D”中的“Rising”对应于E3酶产生上升的FP信号,“E”中的“Falling”对应于DUB酶活性产生下降的FP信号;(B)反映UbiReal全面监测泛素化过程能力的数据。数字和字母分别表示添加对应的蛋白质和泛素复合物的状态。
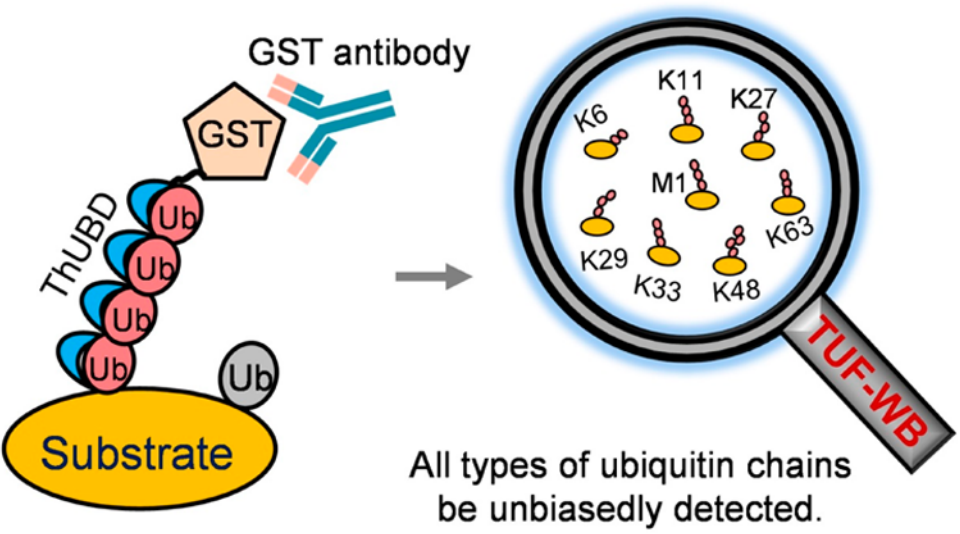
2019年,国家蛋白质科学中心徐平课题组在Analytical chemistry杂志上发表了一篇题为“Specific and Unbiased Detection of Polyubiquitination via a Sensitive Non-Antibody Approach”的研究论文。在该研究论文中,作者基于前期的研究构建了串联杂交UBD(ThUBD),ThUBD的检测效率及其与泛素链的亲和力均高于天然存在的UBD。它可以与Far-Western blot实验结合从而检测蛋白质的泛素化修饰(图5),并将这种可视化研究蛋白质泛素化的技术命名为TUF-WB。其基本流程首先是利用SDS-PAGE分离蛋白质,转膜、封闭结束后用ThUBD或谷胱甘肽转移酶(GST)孵育膜。洗涤后的膜用抗GST抗体孵育,最后进行显影检测。
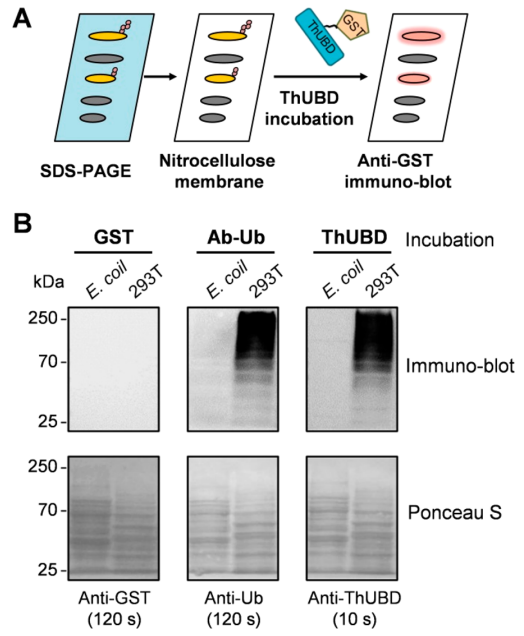
为了验证TUF-WB的可行性,作者以人胚胎肾293T细胞、大肠杆菌的细胞裂解物为实验材料,进行了基于ThUBD的免疫印记分析实验,实验结果表明TUF-WB在检测泛素化信号方面具有很高的特异性(图6)。
图5 ThUBD结合Far-Western blot形成的检测蛋白泛素化的新技术(TUF-WB)(Xiao et al., 2019)。
图6 TUF-WB特异性识别泛素化蛋白(Xiao et al., 2019)。(A)TUF-WB的工作流程;(B)固定在硝化纤维素膜上的大肠杆菌和293T细胞的裂解物分别用GST抗体、泛素化抗体和ThUBD孵育,抗泛素化抗体检测作为阳性对照;对样品进行GST标记蛋白印迹,GST抗体检测作为阴性对照,检测胭脂红染色作为上样对照。
小远给大家列举了4种蛋白泛素化的检测方法,前两种小远已经在很多泛素化研究的相关文献中看到过,后两种小远目前没有找到检测植物蛋白泛素化的案例,如果大家有合适的文献也欢迎发送给小远,大家一起学习进步噢!
了解完泛素化位点预测及其检测方法后,想必大家也想了解泛素化在植物体内的功能。对于我们研究的植物来说,任何一个蛋白发生泛素化都可能影响植物体内的生化过程,UPS在这些过程中发挥着重要作用。下面一起来看看吧!
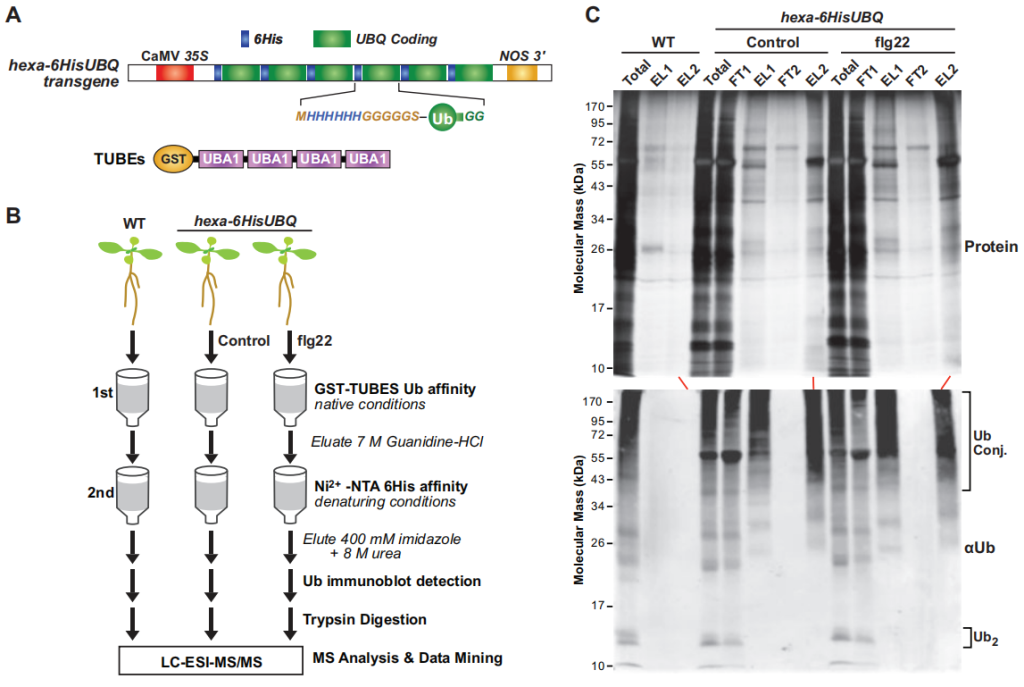
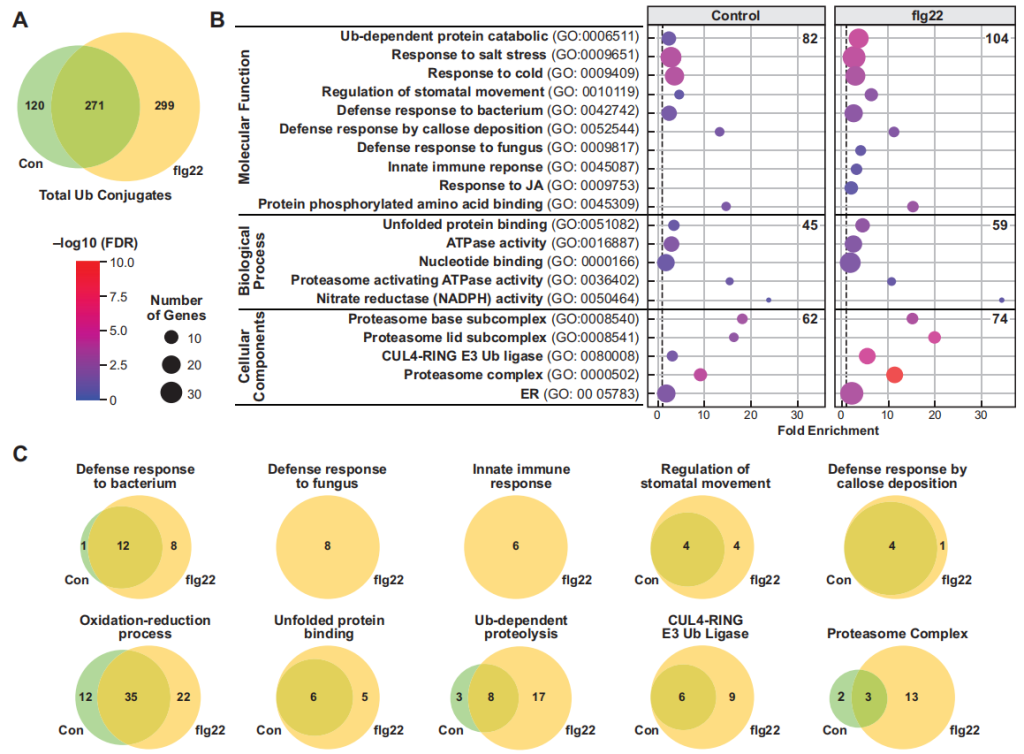
作者首先外源添加flg22(细菌鞭毛蛋白中一段保守区域,能够诱导植物天然的免疫反应)处理含hexa-6HisUBQ的拟南芥转基因幼苗,通过两步亲和纯化法从对照组(WT)、未处理(Control)和flg22处理的幼苗中提取泛素化蛋白质(图7),结合质谱分析一共鉴定了690个高可信度的泛素化蛋白,其中271个蛋白为对照组和flg22处理组共有的,299个蛋白是flg22处理组特有的,120个蛋白是对照组特有的,这说明由flg22触发的植物免疫反应增加了拟南芥蛋白的泛素化水平(图8A)。GO分析发现,flg22处理组中特有的泛素化蛋白参与抗病、抗逆等多个生物学过程(图8B),且泛素化的蛋白质中明显存在UPS相关蛋白(图8C)。
图7 两步亲和纯化法表达6HIS-UBQ的转基因拟南芥泛素化蛋白(Ma et al., 2021)。(A)hexa-6HIS-UBQ转基因示意图,一个合成的UBQ基因编码6个重复的Ub单体,N端以6His序列标记,随后是一个富含甘氨酸(G)的连接子(MHHHHHHGGGGGSA),在组成型CaMV 35S启动子的驱动下,首尾融合形成一个单帧内的六联体-6His-UBQ转基因载体(Saracco et al., 2009);(B)分析拟南芥p35S:hexa-6HIS-UBQ幼苗泛素化的蛋白质组学方法流程图;(C)两步亲和纯化从拟南芥植物中分离得到表达6His-Ub的泛素化蛋白。
图8 flg22处理和未处理的泛素化蛋白的GO分析(Ma et al., 2021)。(A)对照组、flg22处理和未处理的泛素化蛋白的韦恩图;(B)基于GO注释对蛋白质参与的生物过程、分子功能和细胞成分进行分析;(C)基于GO注释对蛋白质进行功能基团分类。
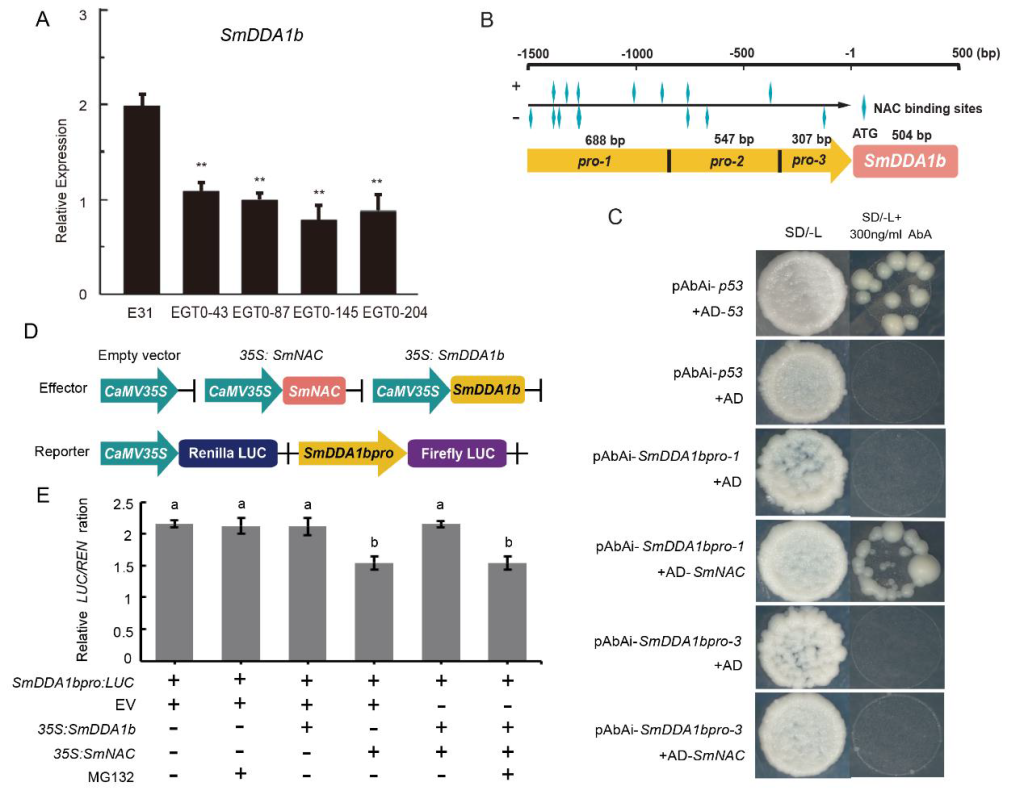
通过上一篇文献,我们了解到UPS系统中的相关蛋白参与植物免疫反应。而E3泛素连接酶是UPS系统中广泛存在的蛋白质。研究表明,E3泛素连接酶是一种植物免疫调节蛋白,参与植物免疫反应(Zhang Yi and Zeng Lirong, 2020)。2023年,华南农业大学曹必好课题组在Horticulture Research杂志上发表了一篇题为“A putative E3 ubiquitin ligase substrate receptor degrades transcription factor SmNAC to enhance bacterial wilt resistance in Eggplant”的研究论文。在该研究论文中,作者分析了E3泛素连接酶的底物受体蛋白SmDDA1b通过降解SmNAC从而提高茄子抗青枯病的分子机制,为茄科植物遗传育种提供了理论基础。
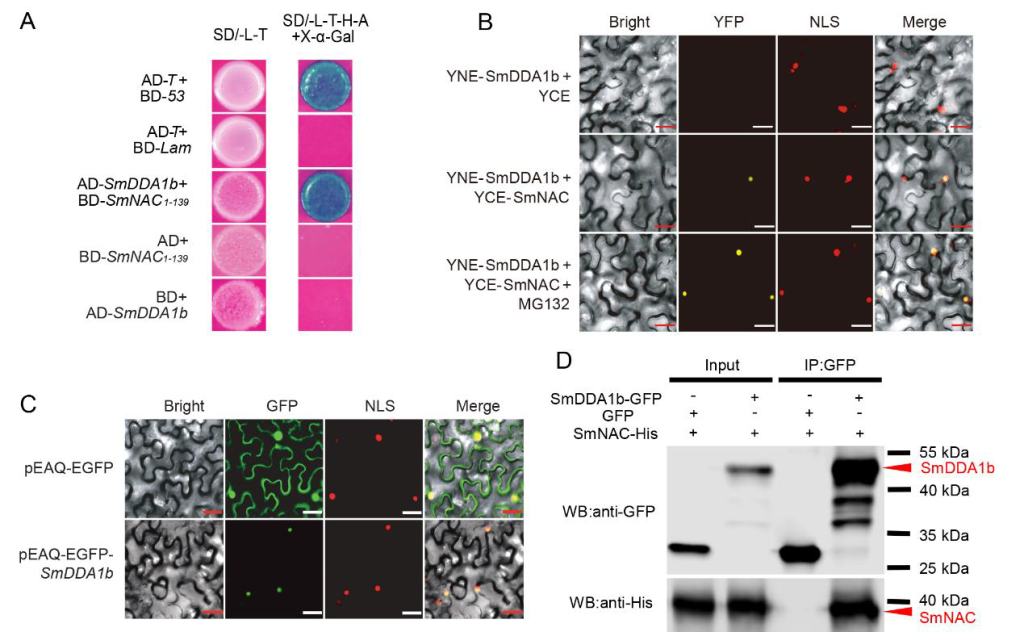
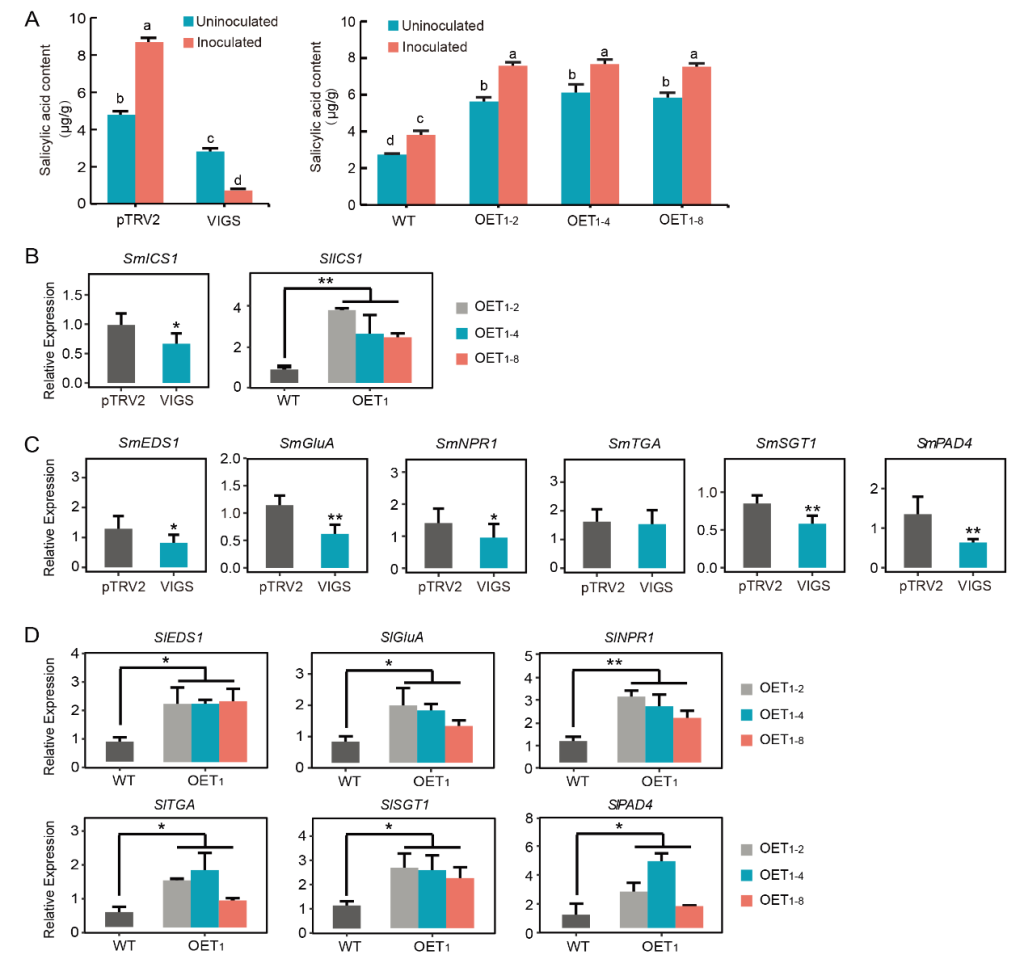
作者首先通过酵母双杂筛库实验筛选出了SmNAC潜在的互作蛋白SmDDA1b,随后通过Y2H实验、BiFC实验、Co-IP实验验证了SmNAC与SmDDA1b互作,同时通过亚细胞定位发现SmDDA1b定位于细胞核(图9)。前期的研究表明SmNAC通过抑制水杨酸(SA)的生物合成来负向调节茄子对青枯病的抗性(Na et al., 2016),因此作者构建了SmDDA1b过表达植株和VIGS沉默植株,并检测了过表达植株和沉默植株中SA的含量,同时还检测了SA合成相关基因ICS1及SA信号通路中相关基因的表达量,发现过表达植株中这些基因的表达量均有所增加,并且SA的含量也相应增加,而在沉默植株中均表现为下降,说明SmDDA1b正向调控SA的生物合成并参与其信号通路(图10)。
图9 SmDDA1b与SmNAC的相互作用及SmDDA1b的亚细胞定位分析(Yan et al., 2023)。(A)Y2H实验;(B)BiFC实验;(C)SmDDA1b的亚细胞定位;(D)Co-IP实验。
图10 SmDDA1b正向调控SA的生物合成,参与SA相关的信号通路(Yan et al., 2023)。(A)水杨酸含量测定,pTRV2—对照组,VIGS—沉默植株,WT—野生型,OE—过表达植株;(B)ICS1在沉默植株和过表达植株中的表达量;(C、D)SA信号通路相关基因在沉默植株和过表达植株中的表达量。
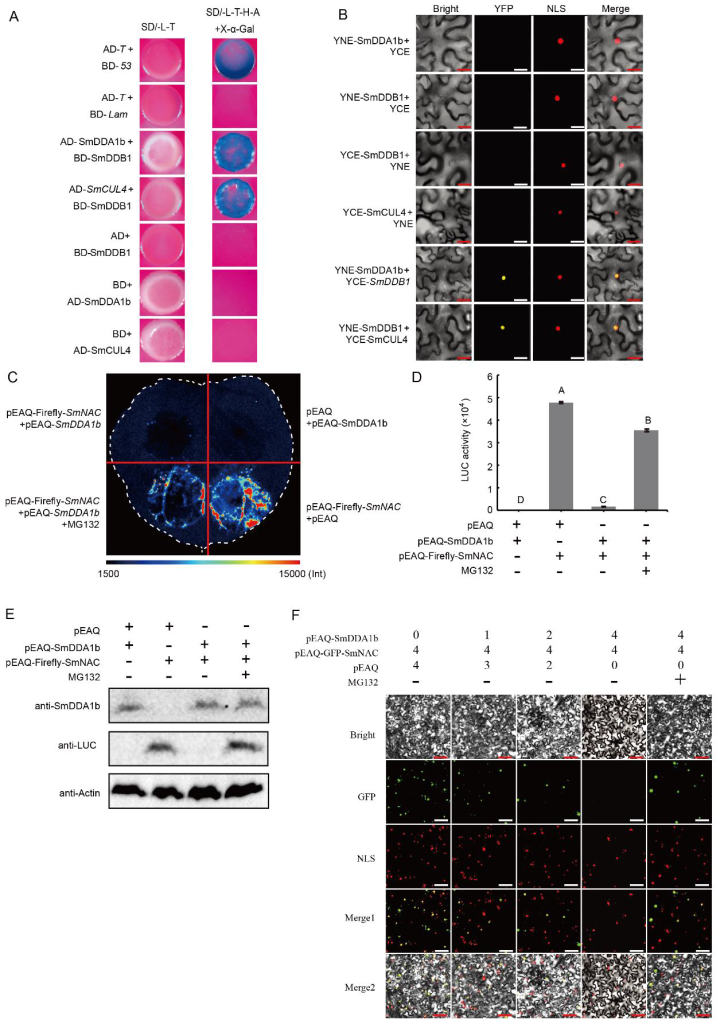
研究发现,SmDDA1b是AtDDA1的同源蛋白,而AtDDA1蛋白是E3泛素连接酶(CRL4)的底物受体蛋白(Irigoyen et al., 2014)。底物受体蛋白(DDA1)和UPS系统中的支架蛋白CUL4(The cullin-RING ubiquitin-protein ligases)通过DNA损伤修复接合蛋白DDB1(Pang et al., 2019)结合到CRL4上。因此作者又通过Y2H实验、BiFC实验验证了SmDDB1与SmCUL4、SmDDA1b存在相互作用,表明SmDDA1b在茄子中可能具有E3泛素连接酶活性(图11A-D)。紧接着作者又通过Western Blot实验、荧光素酶报告基因实验、亚细胞定位实验证明SmDDA1b介导SmNAC的泛素化降解(图11E-F)。
图11 SmDDB1与SmCUL4和SmDDA1b相互作用,SmDDA1b介导SmNAC的降解(Yan et al., 2023)。(A)Y2H实验;(B)BiFC实验;(C)SmDDA1b介导SmNAC的降解,pEAQ-萤火虫-SmNAC+pEAQ和pEAQ+pEAQ-SmDDA1b处理分别作为阳性对照和阴性对照,MG132为26S蛋白酶体抑制剂;(D)萤火虫荧光素酶活性鉴定;(E)Western Blot实验;(F)亚细胞定位实验。
为了更具体地揭示抗病机制,作者又反过来研究SmNAC是否可以调控SmDDA1b。作者检测了过表达SmNAC植株中SmDDA1b的表达量,发现SmDDA1b的表达量低于野生型植株中的表达量。通过Y1H实验和Dual-LUC实验发现SmNAC可以与SmDDA1b的启动子结合并且抑制其表达(图12)。
图12 SmNAC与SmDDA1b启动子结合并抑制SmDDA1b的表达(Yan et al., 2023)。(A)SmDDA1b在SmNAC过表达植株中的表达量,E31代表野生型,EGT0-43、EGT0-87、EGT0-145、EGT0-204代表T0代的过表达植株;(B)启动子截短示意图;(C)Y1H实验;(D、E)Dual-LUC实验载体构建示意图及酶活性测定。
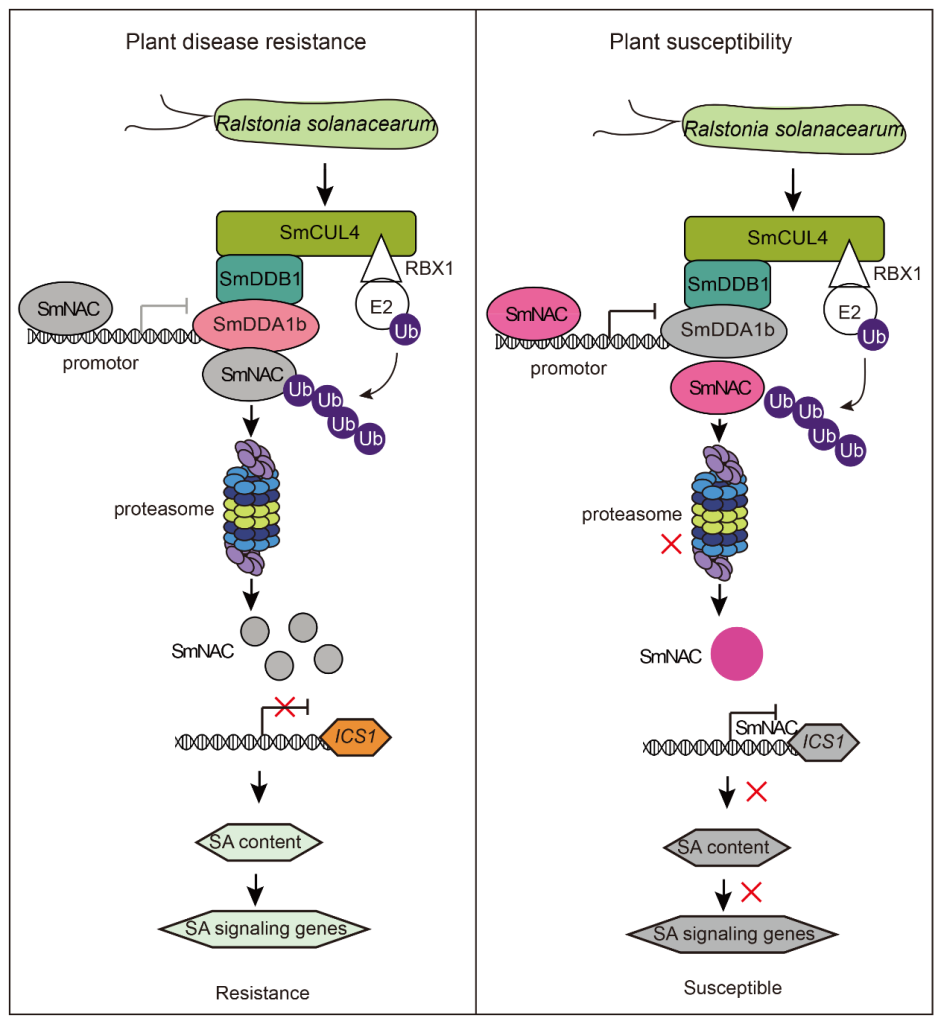
基于以上实验结果,作者构建了SmDDA1b调控茄子对青枯病的抗性模型图(图13)。对于抗病茄子,在青枯病菌胁迫期间,SmDDA1b 蛋白被诱导表达。SmNAC 被 SmDDA1b 识别,然后被 SmDDA1b 介导的泛素/26S 蛋白酶体系统 (UPS)降解,从而减轻对SA生物合成相关基因ICS1表达的抑制,因此,SA信号通路被激活从而触发茄子免疫反应,最终提高茄子对青枯病的抗性。对于易感茄子,在青枯病菌胁迫期间,SmDDA1b的表达受到抑制,因此SmNAC不能被泛素/26S蛋白酶体系统(UPS)识别和降解,并且SmNAC 蛋白反过来抑制 SmDDA1b 的表达,SmNAC对SmICS1的抑制作用增强,SA和SA信号通路受到抑制,从而降低茄子对青枯病的抗性。
图13 SmDDA1b调控植物对青枯病的抗性模型图(Yan et al., 2023)。
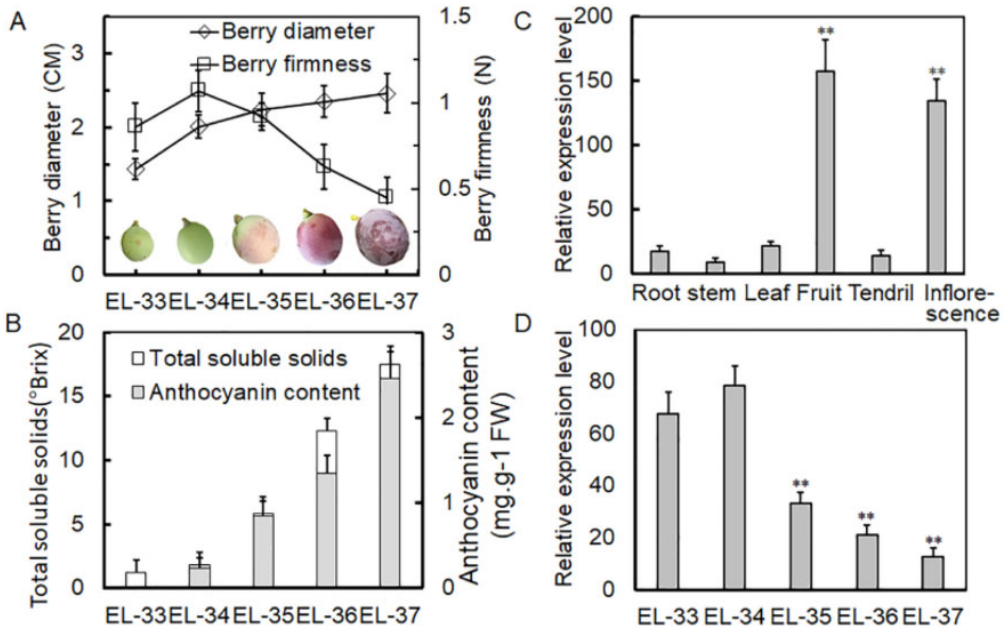
作者首先分析了葡萄果实发育过程五个阶段的形态和相关的生理参数,发现果实直径持续增加,而果实硬度在EL-34阶段达到峰值,然后从EL-34阶段开始下降。总可溶性固形物和花青素含量在五个阶段都有所增加。通过qRT-PCR实验发现VlPUB38在果实和花序中的表达量明显高于其他组织部位,且其在EL-35阶段(果实开始成熟的阶段)的表达量下降(图14)。以上结果说明VlPUB38参与葡萄果实的发育过程。
图14 VlPUB38在葡萄果实发育中的表达(Yu et al., 2020)。(A)浆果直径和硬度的测定;(B)浆果总可溶性固形物和花青素含量的测定;(C)VlPUB38在葡萄植株不同器官中的qRT-PCR表达分析;(D)VlPUB38在浆果不同发育阶段的qRT-PCR表达分析。
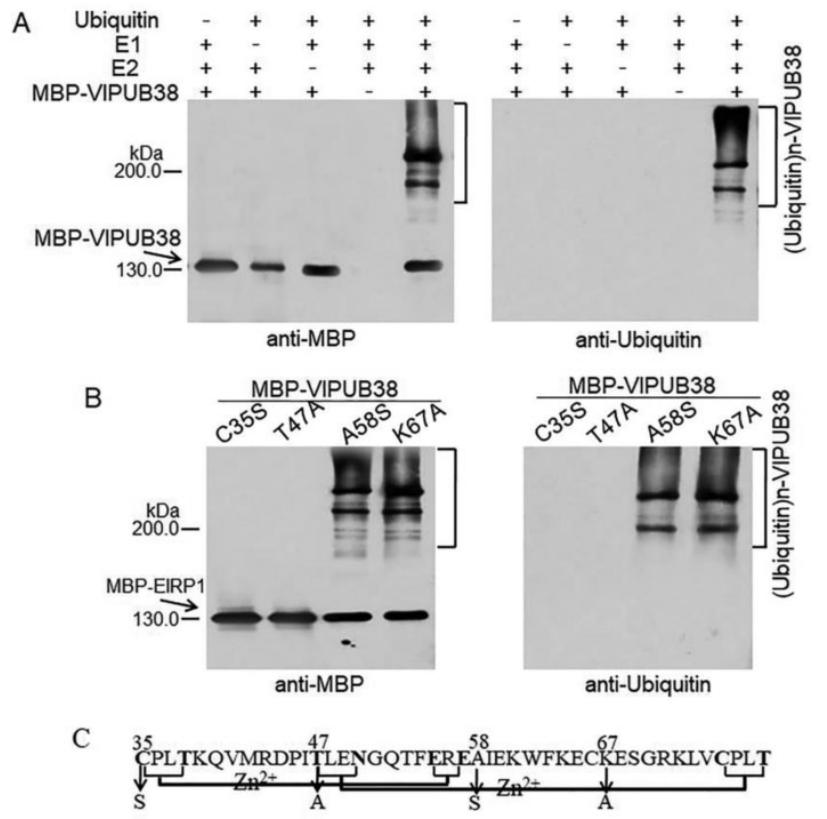
植物U-box蛋白具E3连接酶活性,通过结构域分析发现VlPUB38存在U-box结构域,因此作者猜测VlPUB38是E3连接酶,通过体外泛素酶活性实验验证了VlPUB38确实具有泛素连接酶活性(图15)。
图15 VlPUB38具有E3泛素连接酶活性(Yu et al., 2020)。(A)VlPUB38的E3泛素连接酶活性测定;(B)4个VlPUB38突变体的E3泛素连接酶活性测定;(C)VlPUB38基序的结构和突变位点示意图。
作者构建VlPUB38瞬时过表达载体,发现VlPUB38过表达抑制了草莓果实的成熟。同时通过ABA处理过表达VlPUB38的草莓果实,发现其可溶性物质和花青素的含量均增加,同时ABA合成过程关键基因NCED1表达上调,ABA信号转导途径的关键基因ABI1表达下调(图16)。以上结果表明,VlPUB38抑制草莓果实的成熟,并且参与调控ABA合成和信号转导过程。
图16 过表达VlPUB38抑制草莓果实成熟(Yu et al., 2020)。(A)过表达VlPUB38的草莓和野生型草莓的生长表型;(B、C)过表达VlPUB38的草莓果实中花青素和总可溶性固形物含量测定;(D)qRT-PCR分析过表达VlPUB38的草莓果实中与成熟相关的基因的表达量。
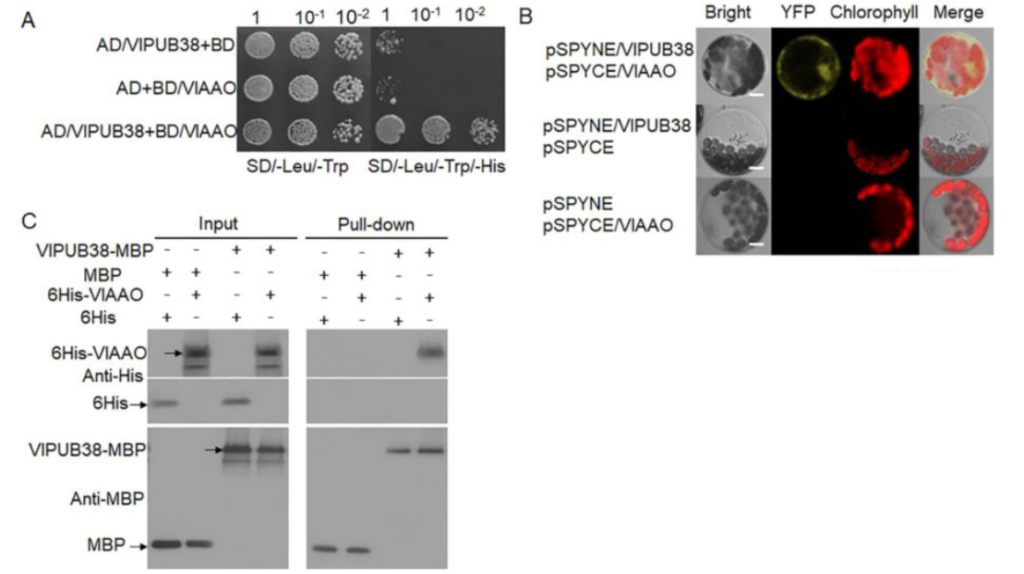
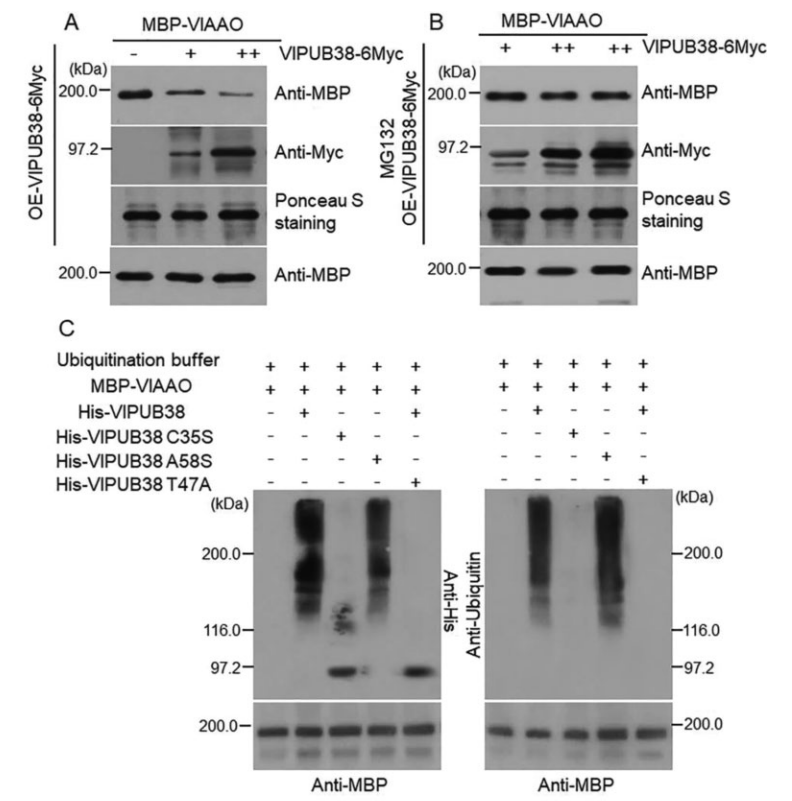
为了进一步验证VlPUB38的功能,作者通过酵母双杂筛库实验筛选、结合BiFC实验、GST Pull-down实验证实了与VlPUB38互作的蛋白VIAAO(图17),对VIAAO进行基本的生物信息学分析发现其是拟南芥ABA-醛氧化酶的同源蛋白。随后作者通过无细胞降解检测实验和体外泛素化实验证明VlPUB38通过26S蛋白酶体介导VIAAO泛素化降解(图18)。
图17 VlPUB38与VlAAO存在相互作用(Yu et al., 2020)。(A)Y2H实验;(B)BiFC实验;(C)GST Pull-down实验。
图18 VlPUB38通过26S蛋白酶体介导VlAAO的泛素化降解(Yu et al., 2020)。(A、B)无细胞降解实验,过表达VlPUB38导致VlAAO的表达量降低,MG132为26S蛋白酶体抑制剂;(C)VlPUB38介导VlAAO发生泛素化。
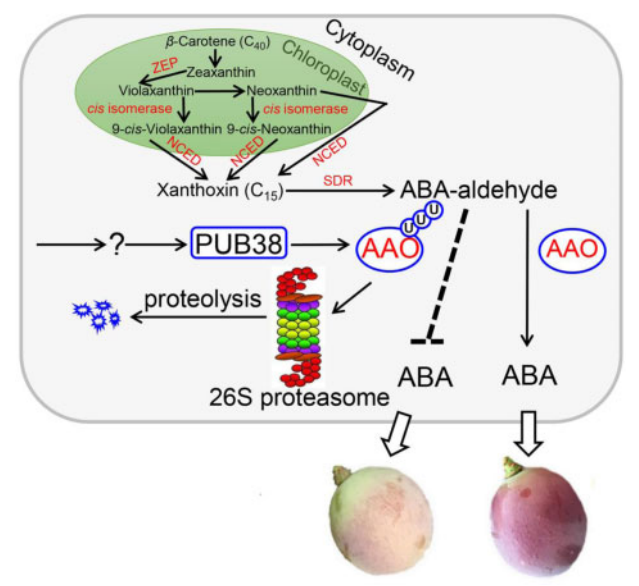
基于以上实验结果,作者绘制了VlPUB38调控葡萄果实发育的模型图(图19)。VlPUB38是葡萄果实成熟的负调控基因,其编码的蛋白质可以识别并泛素化VlAAO,并通过26S蛋白酶体系统水解VlAAO,从而调控ABA,最终调控果实的发育过程。
图19 VlPUB38调控葡萄果实发育的模型图(Yu et al., 2020)。
由于篇幅有限,这次并未给大家介绍蛋白质泛素化修饰在植物应对非生物胁迫中的作用,也并没有给大家分享多种修饰类型如何共同调控植物生长,下次有机会再给大家详细介绍!当然如果大家感兴趣的话,可以自行阅读相关文献。顺便打个广告,伯远生物已经引进赛默飞Orbitrap Astral高分辨率质谱仪并已经稳定运行,可以承接蛋白质组学相关业务,大家感兴趣的话也欢迎联系我们的销售经理噢~
Zhu L, Cheng H, Peng G, et al. Ubiquitinome Profiling Reveals the Landscape of Ubiquitination Regulation in Rice Young Panicles[J]. Genomics Proteomics & Bioinformatics, 2020.
Xin, Xie, Hou xiang, et al. Comprehensive Profiling of the Rice Ubiquitome Reveals the Significance of Lysine Ubiquitination in Young Leaves[J]. Journal of Proteome Research, 2015, 14(5):2017-2025.
Chen S, Xu K, Kong D, et al. Ubiquitin ligase OsRINGzf1 regulates drought resistance by controlling the turnover of OsPIP2; 1[J]. Plant Biotechnology Journal, 2022, 20(9): 1743-1755.
Franklin T G, Pruneda J N. A high-throughput assay for monitoring ubiquitination in real time[J]. Frontiers in Chemistry, 2019, 7: 816.
Xiao W, Liu Z, Luo W, et al. Specific and Unbiased Detection of Polyubiquitination via a Sensitive Non-Antibody Approach[J]. Analytical Chemistry, 2019, 92(1).
Ma X, Zhang C, Kim D Y, et al. Ubiquitylome analysis reveals a central role for the ubiquitin-proteasome system in plant innate immunity[J]. Plant physiology, 2021, 185(4): 1943-1965.
Zhang Y, Zeng L. Crosstalk between ubiquitination and other post-translational protein modifications in plant immunity[J]. Plant communications, 2020, 1(4).
Yan S, Wang Y, Yu B, et al. A putative E3 ubiquitin ligase substrate receptor degrades transcription factor SmNAC to enhance bacterial wilt resistance in Eggplant[J]. Horticulture Research, 2023: uhad246.
Na C, Shuanghua W, Jinglong F, et al. Overexpression of the Eggplant (Solanum melongena) NAC Family Transcription Factor SmNAC Suppresses Resistance to Bacterial Wilt[J]. Scientific Reports, 2016, 6:31568.
Irigoyen M L, Iniesto E, Rodriguez L, et al. Targeted degradation of abscisic acid receptors is mediated by the ubiquitin ligase substrate adaptor DDA1 in Arabidopsis[J]. The Plant Cell, 2014, 26(2): 712-728.
Pang P X, Shi L, Wang X J, et al. Cloning and expression analysis of the StCUL1 gene in potato[J]. Journal of Plant Biochemistry and Biotechnology, 2019, 28: 460-469.
Yu Y, Meng X, Guo D, et al. Grapevine U-box E3 ubiquitin ligase VlPUB38 negatively regulates fruit ripening by facilitating abscisic-aldehyde oxidase degradation[J]. Plant and Cell Physiology, 2020, 61(12): 2043-2054.
Saracco S A, Hansson M, Scalf M, et al. Tandem affinity purification and mass spectrometric analysis of ubiquitylated proteins in Arabidopsis[J]. The Plant Journal, 2009, 59(2): 344-358.