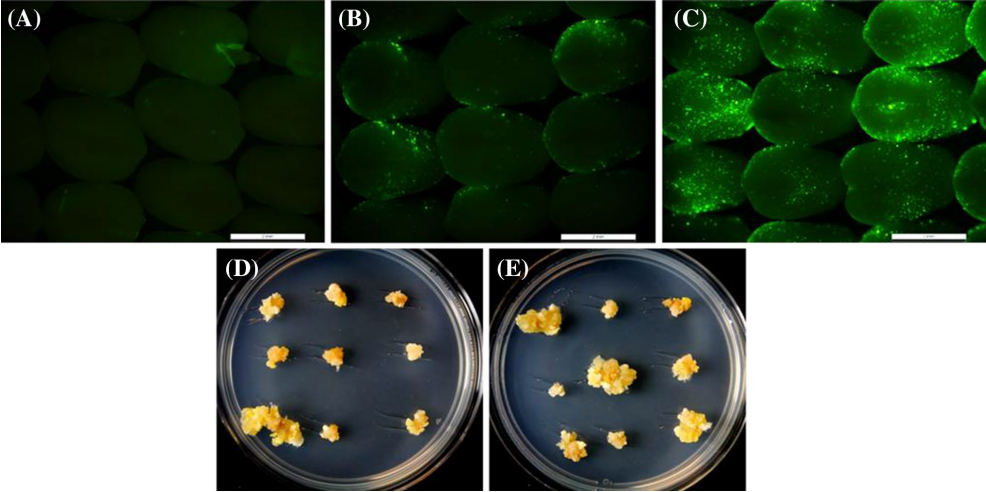
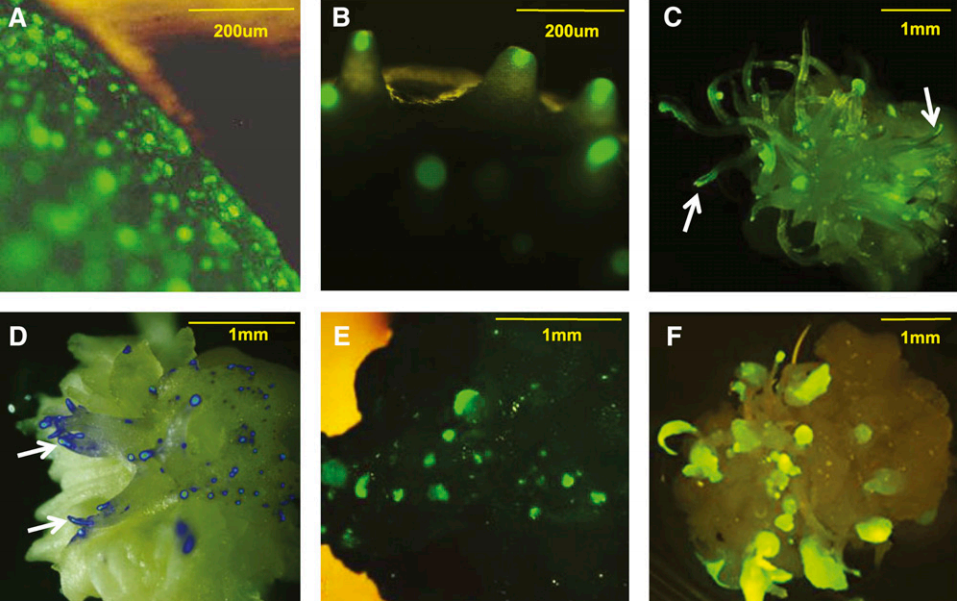
 图1 Bbm和Wus2瞬时表达产生的早期生长表型(Lowe et al., 2016)。(A)单独引入Ubipro:moGFP:pinII(对照),在盾片表面观察单个绿色荧光细胞。(B-D)用含有nospro:Wus2:pinII和moGFP的载体转化,荧光细胞范围似乎略有扩大。(D)来自青色滤光片组的荧光显微照片和落射荧光显微照片相互叠加。(E)用含有Ubipro:Bbm:pinII和moGFP的载体转化。观察到绿色荧光多细胞簇。(F)用含有Wus2、Bbm和moGFP的载体的转化表型。
图1 Bbm和Wus2瞬时表达产生的早期生长表型(Lowe et al., 2016)。(A)单独引入Ubipro:moGFP:pinII(对照),在盾片表面观察单个绿色荧光细胞。(B-D)用含有nospro:Wus2:pinII和moGFP的载体转化,荧光细胞范围似乎略有扩大。(D)来自青色滤光片组的荧光显微照片和落射荧光显微照片相互叠加。(E)用含有Ubipro:Bbm:pinII和moGFP的载体转化。观察到绿色荧光多细胞簇。(F)用含有Wus2、Bbm和moGFP的载体的转化表型。
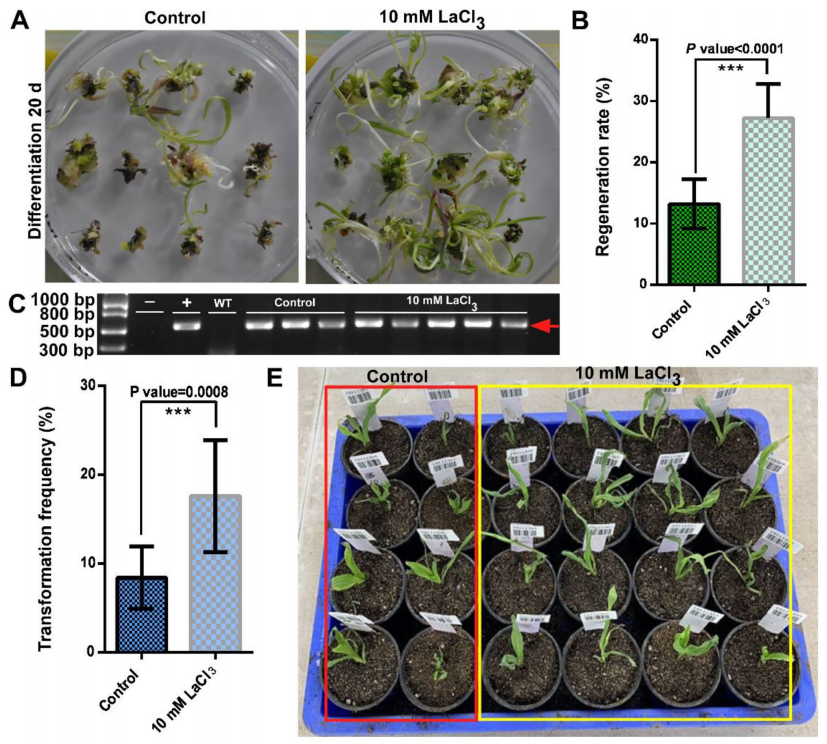
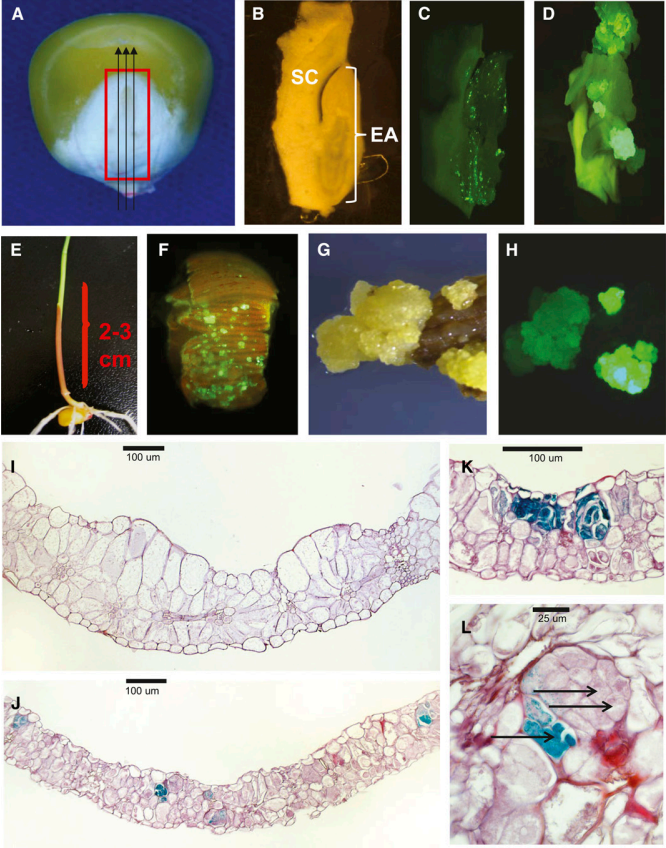 图2 玉米成熟种子或幼苗的转化(Lowe et al., 2016)。(A-D)准备用于转化的成熟胚切片,将成熟胚从籽粒中切下来(A),然后进行平行切割以获得300-400µm厚的切片,其中可以辨别出盾片(SC)和胚轴(EA)(B),在胚轴中观察到瞬时表达(C),并且在2至3周后,可以观察到愈伤组织从该区域生长出来(D)。(E-H)准备用于转化的叶组织,从单个PHH5G幼苗(E)中取出一段叶片并切成约1mm的段,经农杆菌侵染并培养7-14天后,清楚地观察到叶表面细胞簇的分散模式(F),并且随着进一步培养,可观察到转基因愈伤在光学显微镜(G)或落射荧光显微镜(H)下的表型。(I-L)通过比较来自未转化幼苗叶片(I)和转化的(BSVpro:GUS:pinII+nospro:Wus2:pinII+Ubipro:Bbm:pinII)叶片(J)的横截面,对叶片中的异位细胞分裂模式进行早期观察。
图2 玉米成熟种子或幼苗的转化(Lowe et al., 2016)。(A-D)准备用于转化的成熟胚切片,将成熟胚从籽粒中切下来(A),然后进行平行切割以获得300-400µm厚的切片,其中可以辨别出盾片(SC)和胚轴(EA)(B),在胚轴中观察到瞬时表达(C),并且在2至3周后,可以观察到愈伤组织从该区域生长出来(D)。(E-H)准备用于转化的叶组织,从单个PHH5G幼苗(E)中取出一段叶片并切成约1mm的段,经农杆菌侵染并培养7-14天后,清楚地观察到叶表面细胞簇的分散模式(F),并且随着进一步培养,可观察到转基因愈伤在光学显微镜(G)或落射荧光显微镜(H)下的表型。(I-L)通过比较来自未转化幼苗叶片(I)和转化的(BSVpro:GUS:pinII+nospro:Wus2:pinII+Ubipro:Bbm:pinII)叶片(J)的横截面,对叶片中的异位细胞分裂模式进行早期观察。
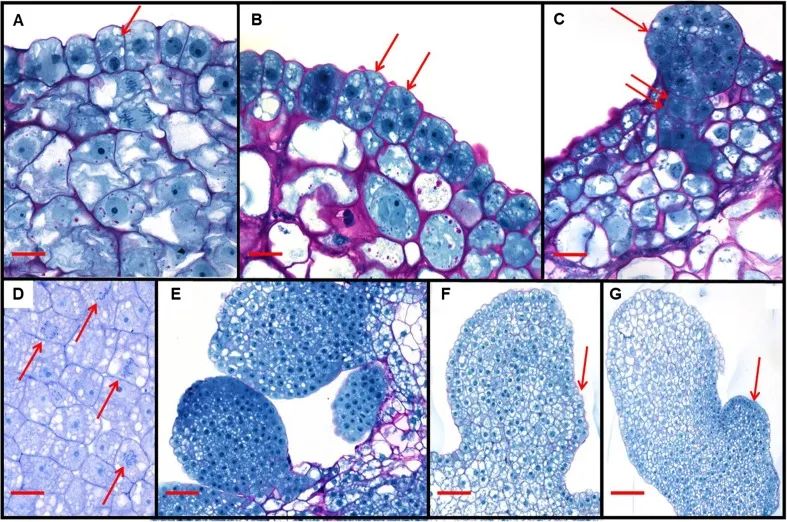
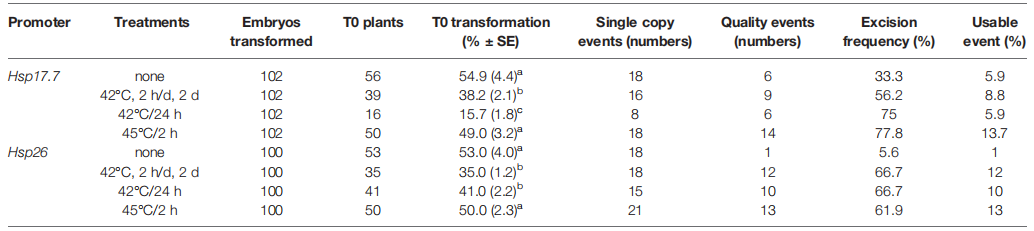 表2 使用Hsp17.7热休克启动子调控Cre切除三个玉米自交系(HC69、PH85E和PH84Z)中的形态发生基因和标记基因的结果(Wang et al., 2020)。
表2 使用Hsp17.7热休克启动子调控Cre切除三个玉米自交系(HC69、PH85E和PH84Z)中的形态发生基因和标记基因的结果(Wang et al., 2020)。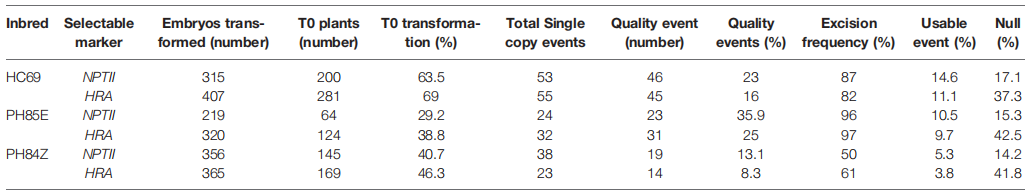
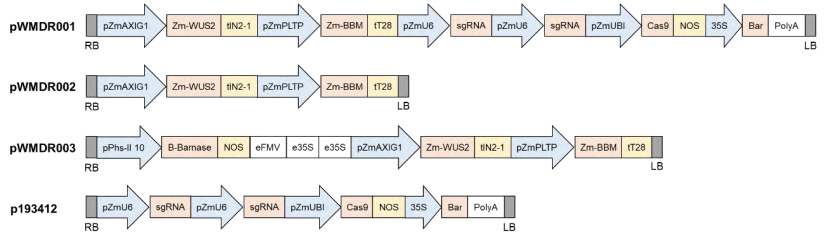
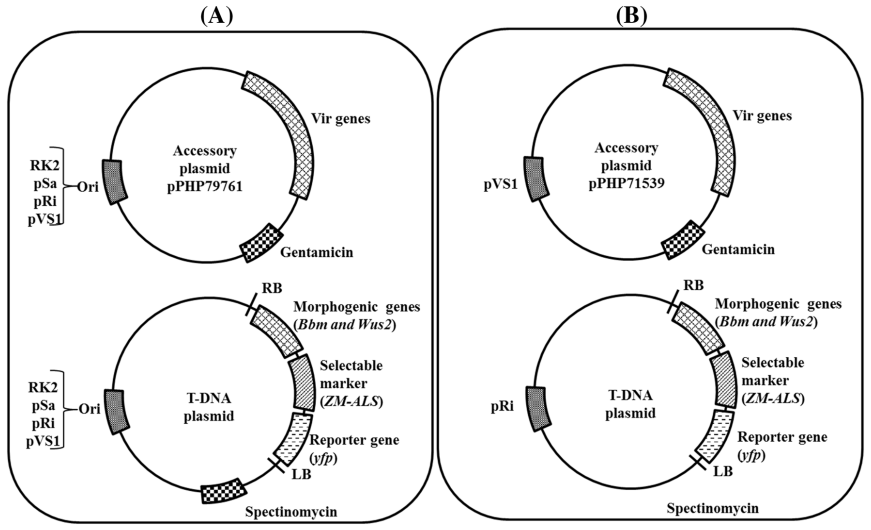
图4 辅助载体和基因敲除载体示意图(许洁婷等, 2022)。
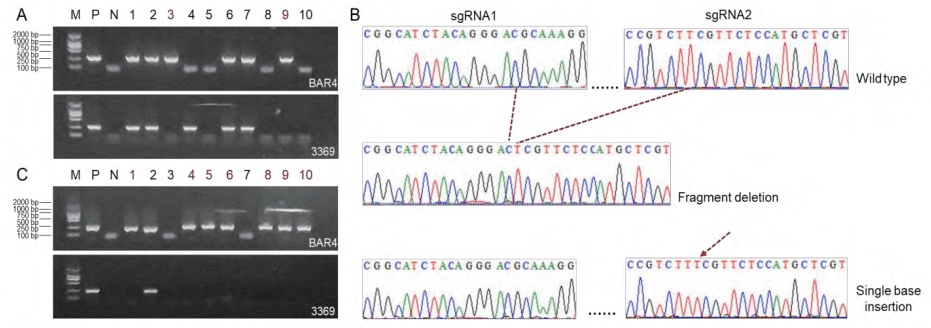
图5 混合转化后的基因型分离检测(A,C)和Waxy基因编辑情况(B)(许洁婷等, 2022)。
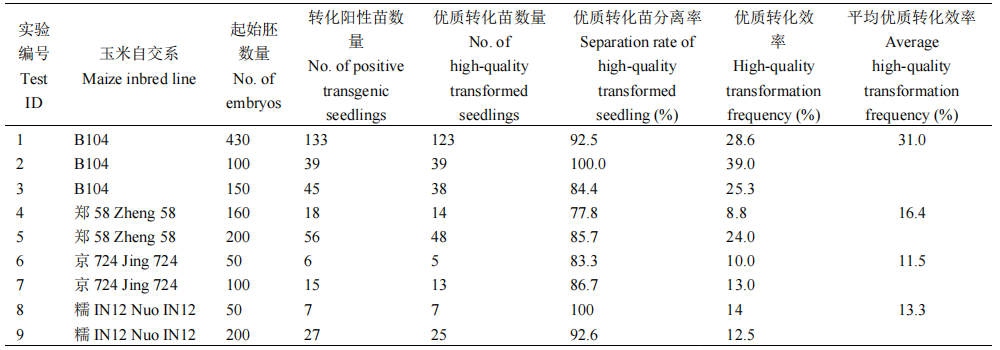
表3 四个玉米自交系中pWMDR003和基因编辑载体混合转化的转化效率(许洁婷等, 2022)。
 图6 农杆菌载体系统的发展,来源:GOLDBIO。图中简要展示了野生型Ti质粒、双元载体、超双元载体、三元载体的质粒结构和适用场景。对质粒中毒力基因的改造可提高农杆菌侵染效率。
图6 农杆菌载体系统的发展,来源:GOLDBIO。图中简要展示了野生型Ti质粒、双元载体、超双元载体、三元载体的质粒结构和适用场景。对质粒中毒力基因的改造可提高农杆菌侵染效率。
2018年4月23日,Ajith Anand团队在Plant Molecular Biology上发表了题为“An improved ternary vector system for Agrobacterium-mediated rapid maize transformation”的研究论文,该研究开发了一种带有辅助质粒“pVIR”的三元载体系统,此系统弥补了pSB1载体原有的毒力基因缺陷,并增加了毒性基因,简化了载体构建步骤。将辅助质粒与T-DNA双元载体结合起来形成的三元载体,对之前转化效率较低的玉米自交系进行遗传转化,可使转化效率显著增加(图7、表4)。此外,研究人员对辅助质粒和T-DNA载体上的复制起点进行筛选(图8),鉴定出了四种ORI-by-ORI组合,分别是pSa/pVS1、RK2/pSa、pRi/RK2和pRi/pVS1,它们会使优异玉米自交系的转化效率高达86%-103%。最后,作者在三元载体系统的辅助质粒中引入形态调节基因Bbm和Wus2后,发现可以有效提高植物遗传转化的效率并缩短转化周期。
图7 pPHP70298改善了玉米中的瞬时和稳定T-DNA转化(Anand et al., 2018)。用双元载体pPHP45981(A)、三元载体pSB1/pPHP45981(B)和pPHP70298/pPHP45981(C)转化PH2RT未成熟胚5天后,荧光蛋白的表达情况。三元载体pSB1/pPHP45981(D)和pPHP70298/pPHP45981(E)产生的愈伤组织生长情况。
表4 两种不同玉米自交系HC69和PH2RT中的转化数据(Anand et al., 2018)。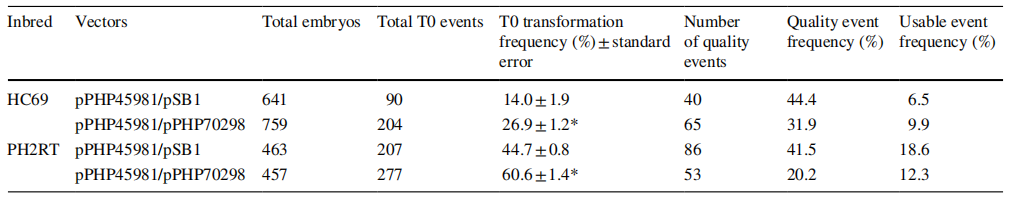
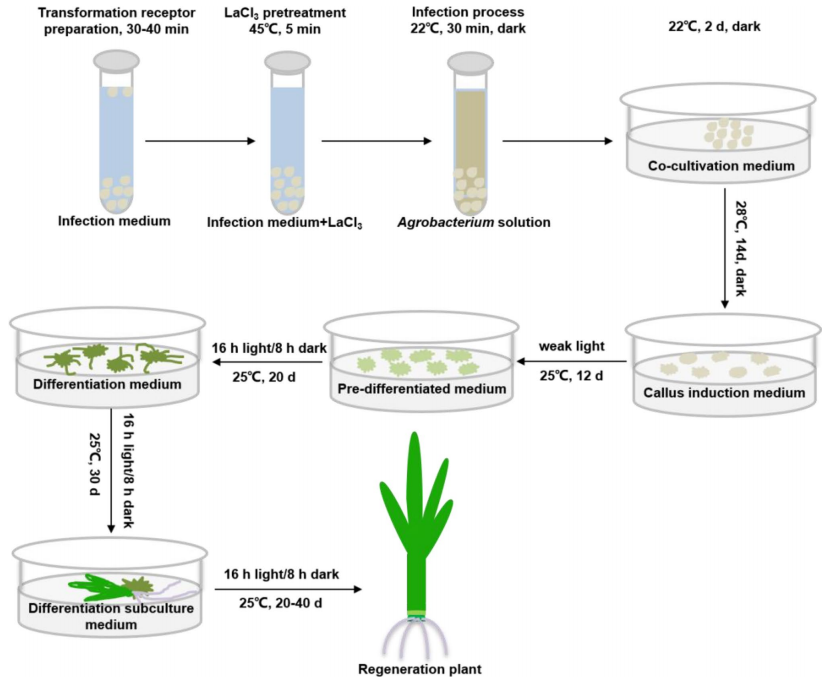
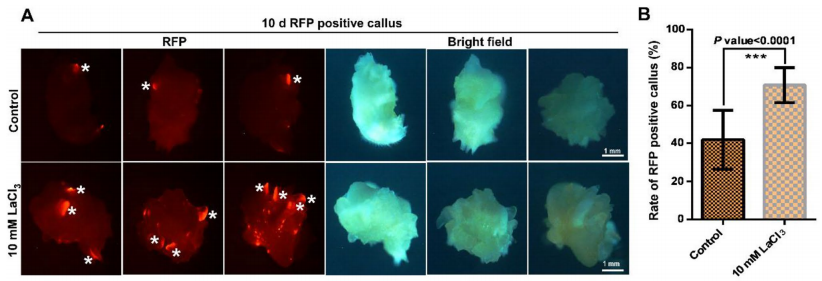
图9 经LaCl3预处理的玉米遗传转化示意图(Liu et al., 2022)。
图10 用10mM LaCl3预处理玉米未成熟胚可提高愈伤组织的阳性率(Liu et al., 2022)。(A)RFP阳性的愈伤组织在选择性培养基中培养10天,在RFP(左)和明场(右)下用荧光显微镜观察,白色星号表示不定芽。(B)RFP阳性愈伤组织的统计学分析。
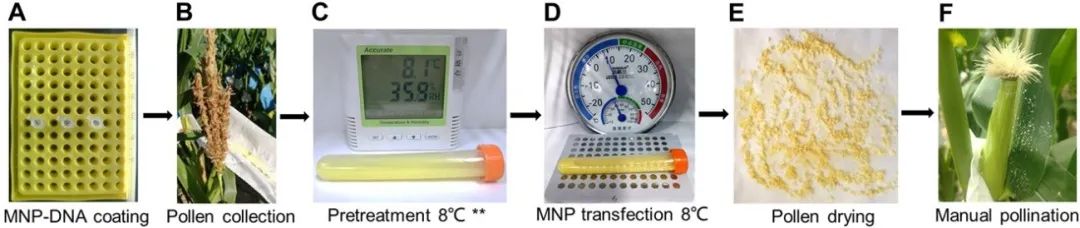
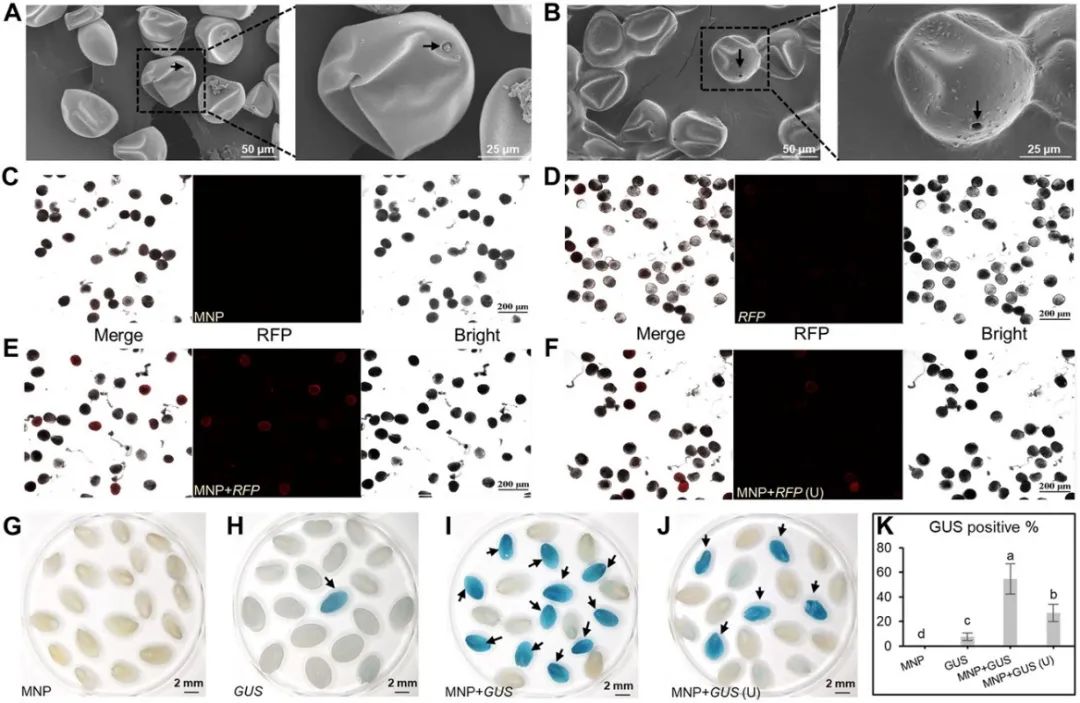
图12 纳米磁珠介导的不依赖基因型的玉米遗传转化流程(Wang et al., 2022)。(A)用质粒DNA涂覆磁性纳米颗粒(MNPS)。(B)收集田间玉米花粉。(C)用转化缓冲液在8°C下预处理花粉10分钟。(D)花粉在8°C下转化20分钟。(E)过滤并吸干花粉,将花粉与玉米淀粉混合。(F)人工授粉。
图13 花粉萌发孔的打开是纳米磁珠介导的外源基因成功导入花粉和幼胚的关键(Wang et al., 2022)。(A)从田间种植的玉米中收集的新鲜花粉的扫描电镜图像。(B)用转染缓冲液在8°C下预处理10分钟的玉米花粉的扫描电镜图像,图中展示的是打开状态的花粉萌发孔。(C-F)使用RFP作为报告基因,检测不同条件下花粉的转化率。(G-J)使用GUS作为报告基因,检测不同条件下玉米幼胚的转化率;(K)玉米幼胚GUS阳性百分比。
Lamb C, Dixon RA. The oxidative burst in plant disease resistance. Annu Rev Plant Physiol Plant Mol Biol. 1997, 48: 251-275.
Lowe K, Wu E, Wang N, et al. Morphogenic Regulators Baby boom and Wuschel Improve Monocot Transformation. Plant Cell. 2016, 28(9): 1998-2015.
Lowe K, La Rota M, Hoerster G, et al. Rapid genotype “independent” Zea mays L. (maize) transformation via direct somatic embryogenesis. In Vitro Cell Dev Biol Plant. 2018, 54(3): 240-252.
Liu S, Shi Y, Liu F, et al. LaCl3 Treatment Improves Agrobacterium-mediated Immature Embryo Genetic Transformation Frequency of Maize. Plant Cell Reports. 2022.
Toyota M, Spencer D, Sawai-Toyota S, et al. Glutamate triggers long-distance, calcium-based plant defense signaling. Science. 2018, 361: 1112-1115.
Wang N, Arling M, Hoerster G, et al. An Efficient Gene Excision System in Maize. Front Plant Sci. 2020, 11: 1298.
Wang ZP, Zhang ZB, Zheng DY, et al. Efficient and genotype independent maize transformation using pollen transfected by DNA-coated magnetic nanoparticles. J Integr Plant Biol. 2022.
Zuo J, Niu Q W, Frugis G, et al. The WUSCHEL gene promotes vegetative-to-embryonic transition in Arabidopsis. Plant J, 2002, 30: 349-359.
许洁婷, 刘相国, 金敏亮, 等.不依赖基因型的高效玉米遗传转化体系的建立.作物学报, 2022, 1-8.
官网链接:plant.biorun.com