发育和细胞分化是由细胞之间的串扰指导的复杂过程,这些串扰会影响细胞命运决定和细胞特异性基因表达程序的建立。早期的研究用光学显微镜来跟踪细胞的分裂,近来,DNA条形码, cre-lox系统和其他遗传系统已被用于在发育或分化的后期阶段出现的前体或祖细胞。单细胞RNA测序技术(scRNA-seq)的进步提供了丰富的表达数据,用于计算并预测发育的轨迹,并且可以与遗传谱系追踪技术相关联,来重建系谱图。尽管很多研究表明谱系追踪和 scRNA-seq 等技术在创建细胞轨迹之间关系方面的应用非常成功,但这些分析受到时间分辨率和检测到的基因数量的限制,因此有时无法检测到从一个细胞状态到下一个细胞状态的基因表达变化,并且更难以研究发育轨迹。

近日,荷兰鹿特丹伊拉斯姆斯大学医学中心Joost Gribnau团队在Nature Biotechnology杂志发表了题为“Retrospective analysis of enhancer activity and transcriptome history” 的研究论文。为了促进全基因组细胞状态追踪,该团队开发了一个系统来标记带有 DCM 甲基化标签的转录基因, 为肠道干细胞(ISC)分化的吸收与分泌谱系决定提供了新的见解,并且表明ISC保留了维持ISC特征和描述与分化相关基因未来表达所需的独特的染色质图谱。DCM-TM技术(DCM-time machine)标记了有活性的基因和增强子,并证实了DCM甲基化遗传到子细胞中,且对子细胞基因表达的影响有限。
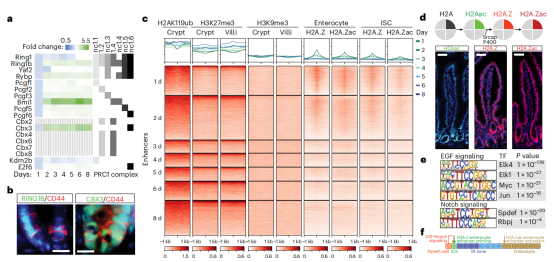
DCM–POLR2B标记活性基因标记系统的开发。作者将细菌甲基转移酶DCM融合到小鼠RNA聚合酶2亚基b(Polr2b)上,并将该DCM-Polr2b融合基因引入胚胎干细胞(ESC)系中的Col1a1位点。为了检测DCM甲基化,作者开发了甲基化DNA测序(MeD-seq),这是一种基于限制性内切酶LpnPI介导的CpG和DCM甲基化靶标位点消化的技术。LpnPI 可识别 50% 的所有甲基化 CpG 二核苷酸以及所有DCM甲基化CmeC(A/T)GG 五核苷酸。提取DNA进行了MeD-seq分析证实了该技术在胚胎干细胞中的可行性。(图1)DCM-POLR2B融合蛋白有效地整合到RNApol2复合物中,用DCM甲基化标记活性基因,对基因表达的影响最小,同时也可以用于追踪活性增强子和基因。DCM-Polr2b: m2rtTAESCs中添加dox,可诱导全基因组出现范围内5倍的DCM甲基化水平。在诱导后,DCM甲基化图谱在转录本的起始位点(TSS),基因体和转录末端位点(TES)处显示DCM甲基化增加,基因表达与DCM甲基化水平之间存在直接关系。
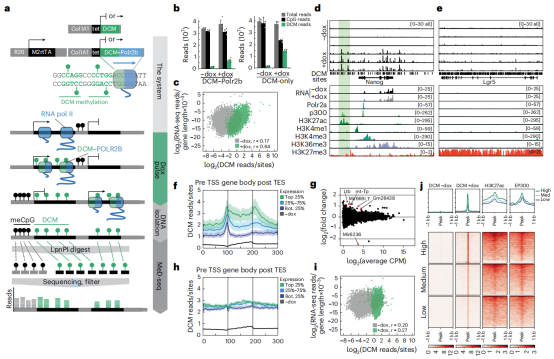 图1 DCM-TM技术应用在胚胎干细胞中。
DCM甲基化在体内随复制而繁殖。监测DCM甲基化在体内小肠中的积累,维持和繁殖情况,MeD-seq分析表明,TSS,基因体和TES的DCM甲基化与基因表达水平,POLR2A结合,H3K36me3沉积和H3K27Ac富集区域相关。通过确定与肠上皮细胞中H2B-GFP信号丢失相关的DCM标记的相对损失,可以确定肠上皮细胞的DCM繁殖率。结果显示,每次细胞分裂的平均DCM甲基化繁殖率为56%,并且在不同基因组区域繁殖率没有差异。(图2)
图1 DCM-TM技术应用在胚胎干细胞中。
DCM甲基化在体内随复制而繁殖。监测DCM甲基化在体内小肠中的积累,维持和繁殖情况,MeD-seq分析表明,TSS,基因体和TES的DCM甲基化与基因表达水平,POLR2A结合,H3K36me3沉积和H3K27Ac富集区域相关。通过确定与肠上皮细胞中H2B-GFP信号丢失相关的DCM标记的相对损失,可以确定肠上皮细胞的DCM繁殖率。结果显示,每次细胞分裂的平均DCM甲基化繁殖率为56%,并且在不同基因组区域繁殖率没有差异。(图2)
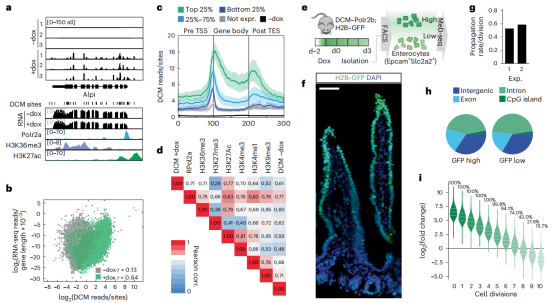 图2 DCM在小肠中的标记和繁殖。
肠道干细胞(ISC)分化至肠上皮细胞时基因活性的动力学研究。作者在将ISC分化为肠细胞后测试了DCM-TM技术,与小肠细胞中分离的DNA的全基因组甲基化测序技术(WGBS)进行比较,二者之间有非常高的相关性,而MeD-seq能够检测到高于WGBS至少120倍以上的DCM甲基化标记。对DCM信号明显高于背景水平的基因进行聚类,可以追溯到肠道发育在第6天(簇6)达到峰值并在第8天(簇8)更突出的基因在ISC中富集。相比之下,DCM-TM可以检测到的基因多于scRNA-seq检测到的基因。(图3)DCM-TM也可用于检测增强子活性,并将其与潜在的TF动力学相关联。与肠上皮细胞分化相关的转录因子(TFs)在其中发挥重要作用,在早期时间点达到高峰(未展示)。
图2 DCM在小肠中的标记和繁殖。
肠道干细胞(ISC)分化至肠上皮细胞时基因活性的动力学研究。作者在将ISC分化为肠细胞后测试了DCM-TM技术,与小肠细胞中分离的DNA的全基因组甲基化测序技术(WGBS)进行比较,二者之间有非常高的相关性,而MeD-seq能够检测到高于WGBS至少120倍以上的DCM甲基化标记。对DCM信号明显高于背景水平的基因进行聚类,可以追溯到肠道发育在第6天(簇6)达到峰值并在第8天(簇8)更突出的基因在ISC中富集。相比之下,DCM-TM可以检测到的基因多于scRNA-seq检测到的基因。(图3)DCM-TM也可用于检测增强子活性,并将其与潜在的TF动力学相关联。与肠上皮细胞分化相关的转录因子(TFs)在其中发挥重要作用,在早期时间点达到高峰(未展示)。
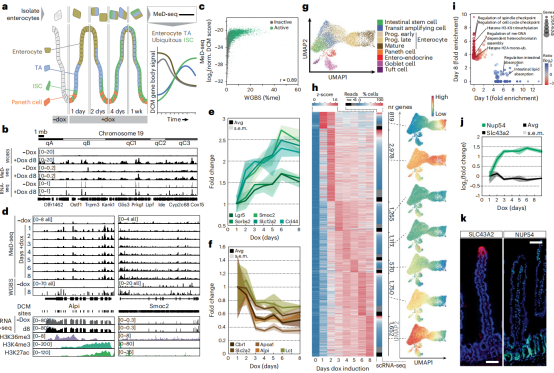 图3 DCM-Polr2b标记揭示了从肠道干细胞到小肠细胞的基因活性图谱。
异染色质介导的肠道增强子和启动子调节作用有限,这表明激活信号和TF网络可能在ISC分化过程中发挥更主导的作用。此前发现组蛋白变异体 H2A.Z的乙酰化(H2A.Zac)与增强子激活有关。H2A.Z优先积累在肠上皮细胞特异性增强子上,H2A.Zac在肠细胞中的更明显富集。H2A.Z预先标记了ISCs中的肠细胞特异性增强子,这些增强子在ISC分化过程中通过乙酰化而被激活。(图4)
图4 H2A.Z被招募到ISCs中的肠细胞特异性增强子
图3 DCM-Polr2b标记揭示了从肠道干细胞到小肠细胞的基因活性图谱。
异染色质介导的肠道增强子和启动子调节作用有限,这表明激活信号和TF网络可能在ISC分化过程中发挥更主导的作用。此前发现组蛋白变异体 H2A.Z的乙酰化(H2A.Zac)与增强子激活有关。H2A.Z优先积累在肠上皮细胞特异性增强子上,H2A.Zac在肠细胞中的更明显富集。H2A.Z预先标记了ISCs中的肠细胞特异性增强子,这些增强子在ISC分化过程中通过乙酰化而被激活。(图4)
图4 H2A.Z被招募到ISCs中的肠细胞特异性增强子
为了探究ISC分化中的吸收到分泌的命运决定的“开关”,作者对DCM标记的基因进行了KEGG通路分析发现了Notch信号传导等途径。Notch信号控制吸收与分泌细胞命运的决定,通过Hes1,Hes3和Hes5的作用决定了ISC和肠上皮细胞的祖细胞中Atoh1的抑制作用。Notch信号介导的Atoh1及其关键靶基因Spdef和Gfi1的抑制可能涉及从双电位祖细胞逐渐过渡到另一个细胞状态,或者可能涉及向吸收或分泌谱系的二元转换。在ISC分化期间,至少部分转录吸收和分泌程序被激活,但完整转录程序的建立是由Notch1和Atoh1指导的吸收到分泌谱系命运决定的。(图5)
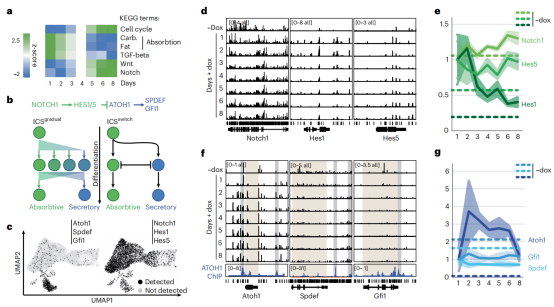
图5 Notch信号在吸收细胞和分泌细胞的命运决定。
本文报道了一套新的系统,用DCM甲基化标记转录基因,以便在体内发育或分化的后期阶段进行检查。应用DCM-TM技术对特定细胞类型进行全转录组和增强子活性谱系追踪,并证明了通过分离分化细胞类型建立TF和信号转导路线图的可能性,而无需分离细胞,也无需推断计算中的连续性。DCM-TM转基因可以与传统的谱系追踪技术相结合,以精细绘制细胞命运决策,或与scMeD-seq或scWGBS结合使用,以区分谱系路径并跟踪网络变化。同时作者鉴定了不同细胞状态的新标记基因,并为小鼠肠道细胞分化过程中的转录动力学提供了新的见解。