类胡萝卜素( carotenoids)是一类重要的天然色素的总称, 普遍存在于动物、高等植物、真菌、藻类的黄色、橙红色或红色的色素之中。它是含40个碳的类异戊烯聚合物, 即四萜化合物。典型的类胡萝卜素是由8个异戊二烯单位首尾相连形成。类胡萝卜素的颜色因共轭双键的数目不同而变化。共轭双键的数目越多, 颜色越移向红色。类胡萝卜素的结构和构象决定了其电子态的能量格局,从而决定了它们的生物学功能。类胡萝卜素激发态在光合光捕获中充当能量供体以及光信号传导中的光感受器。橙色类胡萝卜素蛋白(OCP)是唯一已知的类胡萝卜素激活光感受器,仅存在于蓝藻中发挥控制光合机制的光捕获功能。近日英国伦敦帝国学院生命科学系 Jasper J. van Thor课题组在Nature Communication杂志上在线发表了题为“Light activation of Orange Carotenoid Protein reveals bicycle-pedal single-bond isomerization”的研究论文。通过捕获并解析不同时间点光照下早期光产物和后续反应中间体的结构,结果表明第一个稳定的光产物表现出C9′-C8’和C7′-C6’单键以bicycle-pedal (s-BP)结构的协同异构化,以及N端结构域(NTD)随分钟时间尺度动力学的变化。随后s-BP异构体恢复到暗态类胡萝卜素构型,结构变化传播到C端结构域(CTD),导致类胡萝卜素酮基与蛋白质残基的H键断裂。

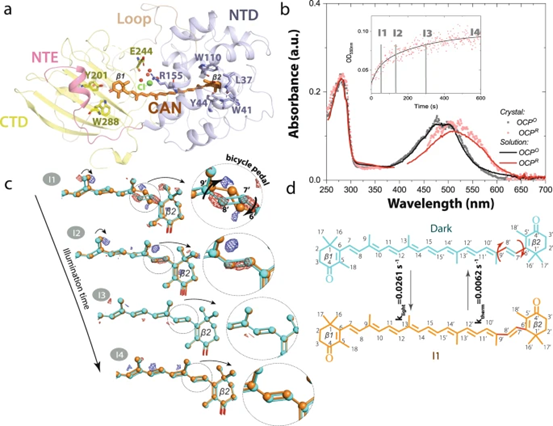
图1. 角黄质单键异构化以bicycle-pedal方式进行,触发OCP光激活。
作者首先在OCP的晶体和溶液中测量的光诱导吸收变化。与以前对OCP光活化的晶体学研究相反,OCPO在溶液和晶体中的吸收光谱几乎是相同的,表明类胡萝卜素在晶体和溶液中的电子结构可能相同。OCP在晶体中具有光活性,其光响应特性与溶液中的光响应特性非常相似。
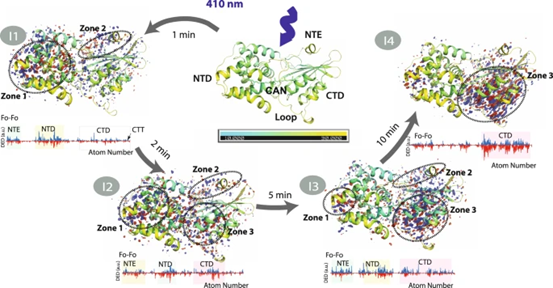
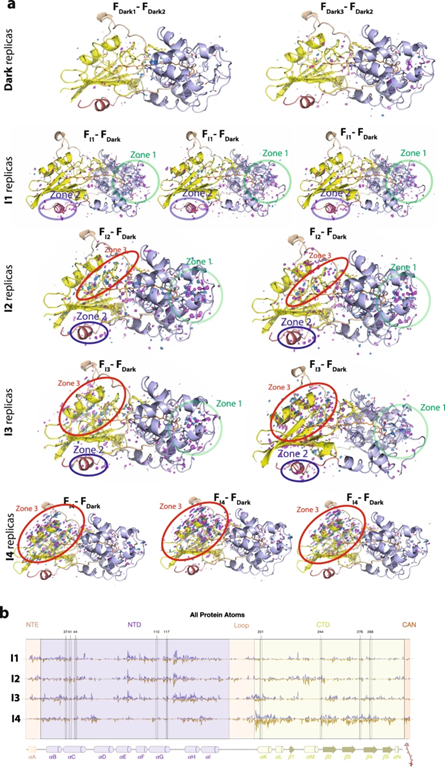 图2. 不同状态下的Q 加权 F光–F黑暗差电子密度(DED)信号。
作者在1、2、5和10分钟分别收集了不同的X射线晶体学数据,在1分钟光照的I1数据集显示,沿C9′-C8’单键的s-反式到s-顺式CAN异构化与沿C7′-C6’单键的s-顺式到s-反式异构化(s-BP异构化)是激活的早期步骤。在I2中也检测到与异构化相关的DED信号,尽管与I1相比不太明显。与I1相反,I2的解析外推坐标仅支持协调C9′-C8’顺式/ C7′-C6’反式状态的一小部分群体,而暗(C9′-C8’反式/ C7′-C6’顺式)构象再次成为主导状态。根据DED图、2mFo-DFc图和使用外推结构因子的精炼坐标判断,I3和I4中的异构化在5分钟后完全衰减。X射线数据直接证明,在C端结构域(CTD)中的重排之前,会发生瞬时的bicycle-pedal(s-BP)单键异构化。I1结构是类胡萝卜素碳链的s-BP异构化调节蛋白质的活性或生物功能的第一个状态。
图2. 不同状态下的Q 加权 F光–F黑暗差电子密度(DED)信号。
作者在1、2、5和10分钟分别收集了不同的X射线晶体学数据,在1分钟光照的I1数据集显示,沿C9′-C8’单键的s-反式到s-顺式CAN异构化与沿C7′-C6’单键的s-顺式到s-反式异构化(s-BP异构化)是激活的早期步骤。在I2中也检测到与异构化相关的DED信号,尽管与I1相比不太明显。与I1相反,I2的解析外推坐标仅支持协调C9′-C8’顺式/ C7′-C6’反式状态的一小部分群体,而暗(C9′-C8’反式/ C7′-C6’顺式)构象再次成为主导状态。根据DED图、2mFo-DFc图和使用外推结构因子的精炼坐标判断,I3和I4中的异构化在5分钟后完全衰减。X射线数据直接证明,在C端结构域(CTD)中的重排之前,会发生瞬时的bicycle-pedal(s-BP)单键异构化。I1结构是类胡萝卜素碳链的s-BP异构化调节蛋白质的活性或生物功能的第一个状态。
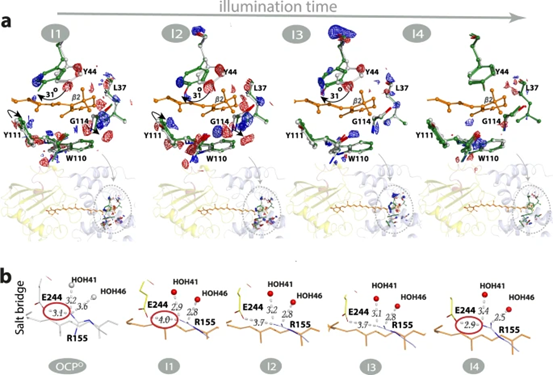
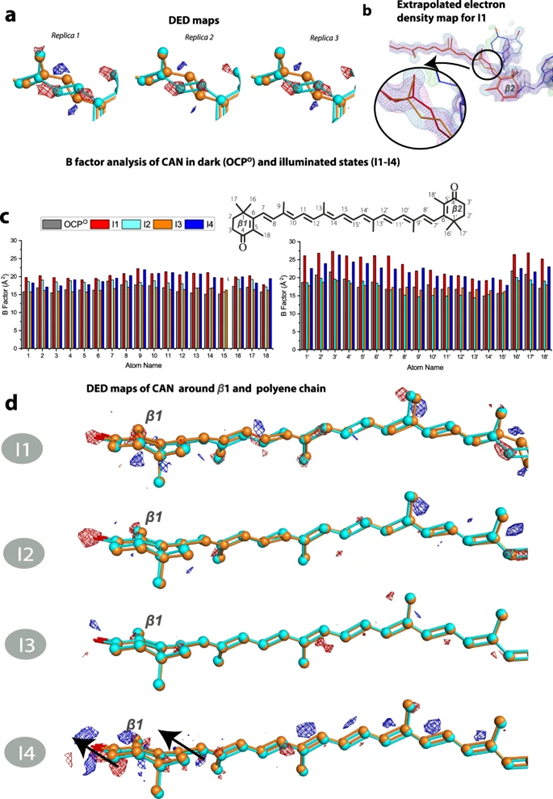 图3. 光照下类胡萝卜素角黄质(CAN)构象。
光诱导的结构变化发生在整个OCP蛋白中,并以时间依赖性方式变化。随着CTD中DED信号的发展,区域1和2中的DED信号在I3和I4中衰减,表明NTD是OCP光激活的主要作用位点。
在使用外推结构因子进行坐标细化后,详细分析了中间产物I1、I2、I3和I4的结构重排情况。与W41一起,残基Y44和W110通过π-π堆积与类胡萝卜素β2环相互作用。在最终的照明产物(I4,图5b)中,残基E244和R155之间的距离恢复到黑暗状态下的原始3Å距离,OCP构象变化的信号传播是由内部氢键网络的重新排列所介导的。
图6. 溶液中OCP中bicycle-pedal异构化的光谱数据。
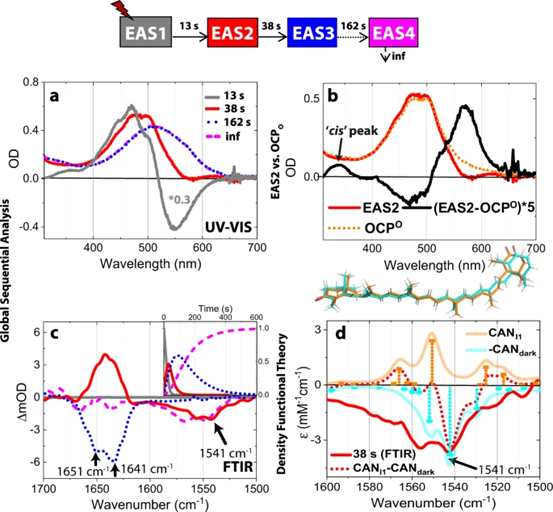
作者使用与晶体相同的照明条件在溶液中进行FTIR和UV/Vis光谱分析进一步确认CAN的异构化是光诱导的,并确认在晶体中观察到的光活化反应是否也发生在溶液中。OCP溶液和OCP晶体中的整体光循环动力学非常相似。除了由于晶体堆积限制而在晶体中无法实现CTD/NTD最后一步的分离外,酰胺-I FTIR动力学数据和分配与晶体学观察结果非常吻合,表明在OCP溶液和晶体中都发生了相同的光诱导结构重排。X射线数据表明,最初的光产品涉及CAN类胡萝卜素的C9′-C8’和C7′-C6’单键沿BP方式的s-异构化。
作者通过紫外/可见光和红外光谱研究与谐波频率计算相结合,证实了晶体和溶液中的反应机制。为了应对光诱导的s-BP异构化,OCP结构变化从NTD传播到CTD。类胡萝卜素和CTD蛋白分子之间的H键断裂并不是光激活的开始,而是继异构化后NTD重排的继发事件。该研究对于理解类胡萝卜素的光物理学和一般共轭系统的光敏演变非常重要。此外,OCP整体激活机制的发现首次为获得控制和操纵OCP的光调节功能提供了基础,在光遗传学、生物成像和农业方面具有潜在的应用。
图3. 光照下类胡萝卜素角黄质(CAN)构象。
光诱导的结构变化发生在整个OCP蛋白中,并以时间依赖性方式变化。随着CTD中DED信号的发展,区域1和2中的DED信号在I3和I4中衰减,表明NTD是OCP光激活的主要作用位点。
在使用外推结构因子进行坐标细化后,详细分析了中间产物I1、I2、I3和I4的结构重排情况。与W41一起,残基Y44和W110通过π-π堆积与类胡萝卜素β2环相互作用。在最终的照明产物(I4,图5b)中,残基E244和R155之间的距离恢复到黑暗状态下的原始3Å距离,OCP构象变化的信号传播是由内部氢键网络的重新排列所介导的。
图6. 溶液中OCP中bicycle-pedal异构化的光谱数据。
作者使用与晶体相同的照明条件在溶液中进行FTIR和UV/Vis光谱分析进一步确认CAN的异构化是光诱导的,并确认在晶体中观察到的光活化反应是否也发生在溶液中。OCP溶液和OCP晶体中的整体光循环动力学非常相似。除了由于晶体堆积限制而在晶体中无法实现CTD/NTD最后一步的分离外,酰胺-I FTIR动力学数据和分配与晶体学观察结果非常吻合,表明在OCP溶液和晶体中都发生了相同的光诱导结构重排。X射线数据表明,最初的光产品涉及CAN类胡萝卜素的C9′-C8’和C7′-C6’单键沿BP方式的s-异构化。
作者通过紫外/可见光和红外光谱研究与谐波频率计算相结合,证实了晶体和溶液中的反应机制。为了应对光诱导的s-BP异构化,OCP结构变化从NTD传播到CTD。类胡萝卜素和CTD蛋白分子之间的H键断裂并不是光激活的开始,而是继异构化后NTD重排的继发事件。该研究对于理解类胡萝卜素的光物理学和一般共轭系统的光敏演变非常重要。此外,OCP整体激活机制的发现首次为获得控制和操纵OCP的光调节功能提供了基础,在光遗传学、生物成像和农业方面具有潜在的应用。