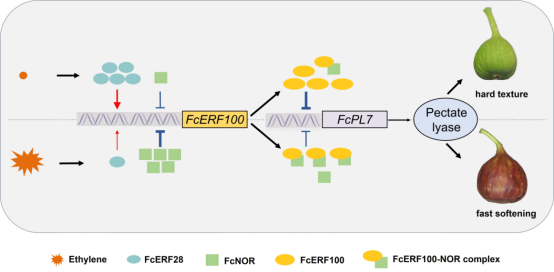
近日,Plant Biotechnology Journal杂志在线发表了由中国农业大学马会勤课题组撰写的“ERF100 regulated by ERF28 and NOR controls pectate lyase 7, modulating fig (Ficus carica L.) fruit softening”论文。该研究证实了ERF转录因子FcERF100可以通过调节细胞壁修饰基因FcPL7的表达影响无花果果实软化进程。进一步研究发现FcERF100受到上游转录因子FcERF28和FcNOR的双重调控,其形成的蛋白网络可以在果实发育早期驱动必要的细胞壁修饰,并在果实成熟阶段通过调节组分比例引发快速软化。该成果解析了ERF-NAC复合体动态调控果实软化的分子机制,为果实品质改良的分子育种研究提供了重要理论依据。
图1 FcERF100在无花果果实中的瞬时表达
图2 FcERF100在番茄果实中的稳定过表达
图3 FcERF100负调控FcPL7转录
图4 FcERF28可以促进FcERF100的转录
图5 FcNOR与FcERF100相互作用并转录抑制FcERF100
l Cui, Y., Zhai, Y., He, J., Song, M., Flaishman, M.A., and Ma, H.Q. (2022) AP2/ERF genes associated with superfast fig (Ficus carica L.) fruit ripening. Front. Plant Sci. 13, 1040796.
l Freiman, Z.E., Rodov, V., Yablovitz, Z., Horev, B., and Flaishman, M.A. (2012) Preharvest application of 1-methylcyclopropene inhibits ripening and improves keeping quality of ‘Brown Turkey’ figs (Ficus carica L.). Sci. Hortic-Amsterdam. 138, 266-272.
l Qiao, H., Zhang, H., Wang, Z. and Shen, Y. (2021) Fig fruit ripening is regulated by the interaction between ethylene and abscisic acid. J. Integr. Plant Biol. 63, 553-569.
l Solomon, A., Golubowicz, S., Yablowicz, Z., Grossman, S., Bergman, M., Gottlieb, H.E., Altman, A., Kerem, Z., and Flaishman, M.A. (2006) Antioxidant activities and anthocyanin content of fresh fruits of common fig (Ficus carica L.). J. Agric. Food Chem. 54, 7717-7723.
l Zhai, Y., Fan, Z., Cui, Y., Gu, X., Chen, S. and Ma, H. (2022) APETALA2/ethylene responsive factor in fruit ripening: roles, interactions and expression regulation. Front. Plant Sci. 13, 979348.
图文来源:植物生物技术Pbj






