细胞核一般是最容易观察到的细胞器,被双层核被膜包被,通过贯穿核膜的核孔与细胞质交流,外层核膜与内质网膜相连,如有需要,蛋白质会直接从细胞质运输至细胞核。内质网是一种由相互连接的膜囊与膜管构成的连续系统,贯穿于细胞的大部分区域,其本身是蛋白质合成的主要场所,蛋白质直接从细胞质进入内质网,一部分会留在内质网,但大多数蛋白质通过囊泡运送到高尔基体并随后进入其他细胞器。高尔基体常位于细胞核附近,接收来自内质网的蛋白质并对其进行修饰,再将它们运送至其他细胞器或质膜。叶绿体和线粒体均由双层膜包被,同细胞核一样,如有需要,蛋白质会直接从细胞质运输至叶绿体或线粒体。
图1 细胞内的膜被细胞器、细胞质膜(Liu and Li, 2019)。备注:原文作者用此图表示内质网与其他细胞器之间的通讯,图中星星处表示内质网与其他亚细胞区室物理接触的位置,伯小远借用此图是想让大家建立膜被细胞器之间紧密交流的印象。
不同的细胞器之间不断地进行着交流,迎来送往,好不热闹,这其中涉及到的机制非常复杂,伯小远在本文中仅关注在细胞器膜与细胞核双定位的蛋白,看看到底有哪些原因引发了蛋白由膜入核,这种变化又对植物产生了怎样的影响。另外,根据定义,细胞器是由膜包被的、分布在细胞质中的功能性结构,因而细胞质膜并不属于细胞器的范畴,但由于细胞质膜与细胞核的交流也很密切,所以伯小远在这里也会介绍细胞质膜与细胞核双定位的蛋白。
2020年,复旦大学/浙江大学刘建祥课题组联合复旦大学陆孙杰课题组在Plant Biotechnology Journal杂志上发表了一篇题为“A membrane-associated NAC transcription factor OsNTL3 is involved in thermotolerance in rice”的研究论文,该研究表明热胁迫和内质网胁迫会引起NAC转录因子基因OsNTL3上调表达、会使OsNTL3从质膜迁移至细胞核,ntl3突变体对高温胁迫敏感,过表达去除C端跨膜结构域的OsNTL3ΔC可提高水稻幼苗的耐热性。
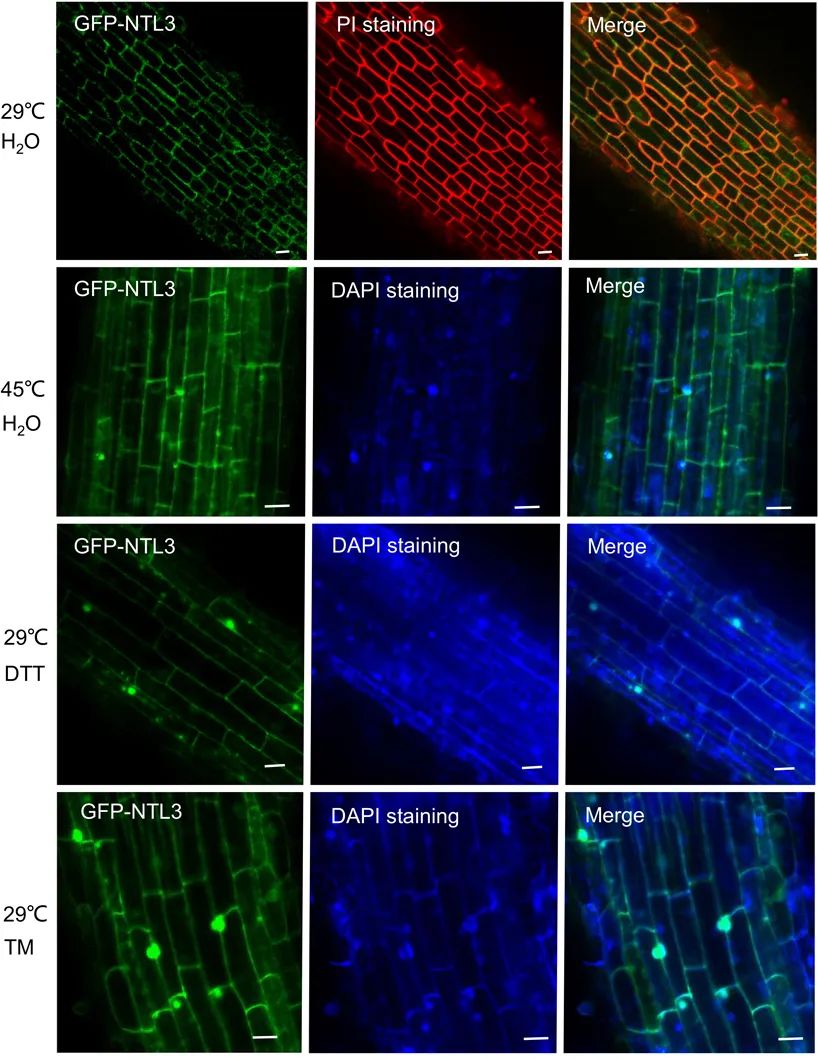
图2 水稻中OsNTL3对热胁迫和内质网胁迫响应后迁移至核(Liu et al., 2020)。作者构建了稳定表达GFP-NTL3的转基因植株,在常温生长条件下,大部分GFP-NTL3信号出现在根尖细胞的边界,植株经过热胁迫(45℃)或内质网胁迫处理(DTT或TM)后,在核中出现了更多的信号。备注:在实验条件下,内质网胁迫可以被一些化学物质诱导或模拟,比如二硫苏糖醇(DTT),DTT能影响氧化还原状态,破坏蛋白的二硫键,衣霉素(TM)可以影响N-糖基化修饰,进而抑制蛋白的正常折叠与成熟。
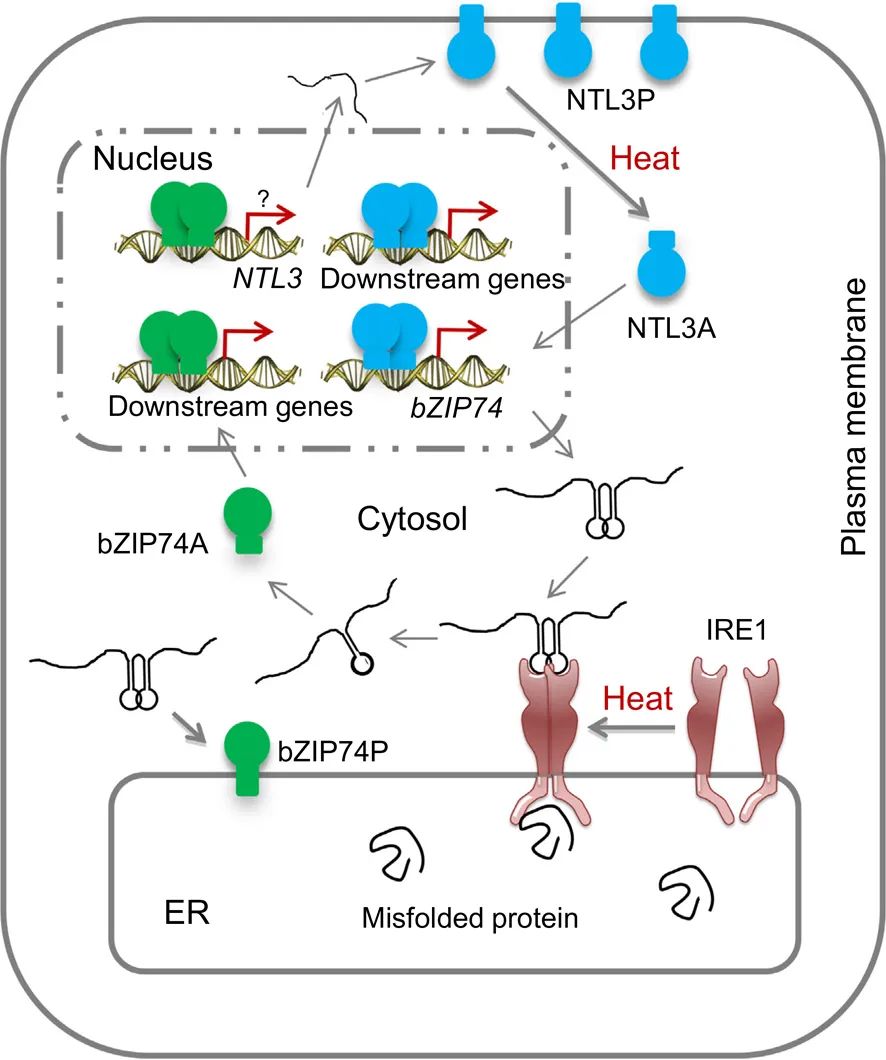
图3 OsNTL3在热胁迫引起的内质网胁迫反应中的假设工作模型(Liu et al., 2020)。作者发现OsNTL3直接与OsbZIP74启动子结合,并结合其他结果作出推测:发生热胁迫后,内质网中错误折叠蛋白的积累导致OsIRE1的激活,OsIRE1具有蛋白激酶和内切核酸酶结构域,其剪切掉OsbZIP74 mRNA双茎结构中的20个核苷酸,使本身定位于内质网上处于休眠状态的bZIP74P变成了激活状态的bZIP74A,bZIP74A进入细胞核,再直接或间接地上调OsNTL3和其他下游基因,使热胁迫信号从质膜、内质网膜传递到细胞核,并形成了一个调节回路。
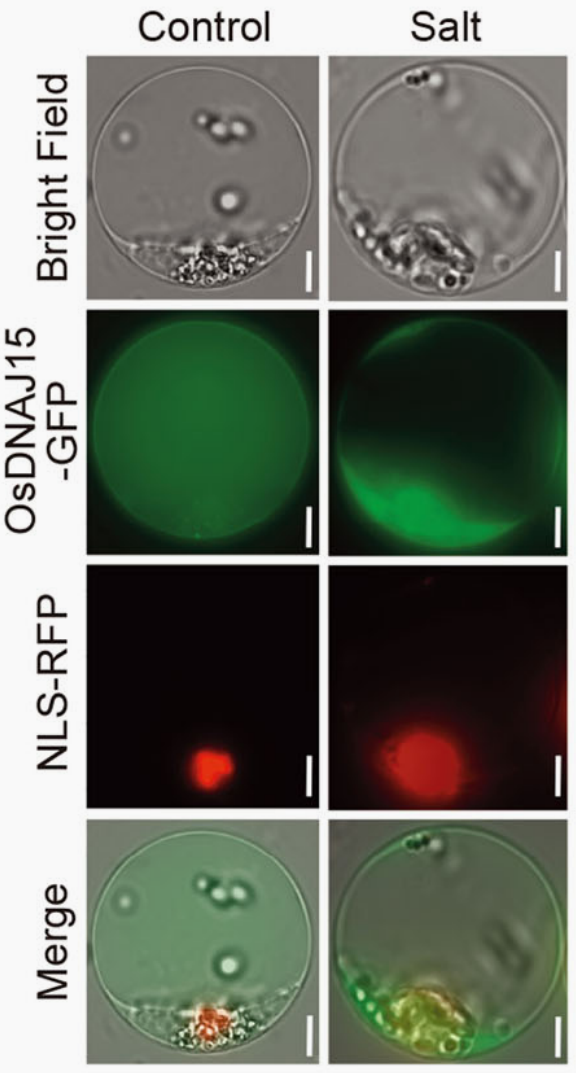
图4 盐胁迫下OsDNAJ15的亚细胞定位(Liu et al., 2023)。
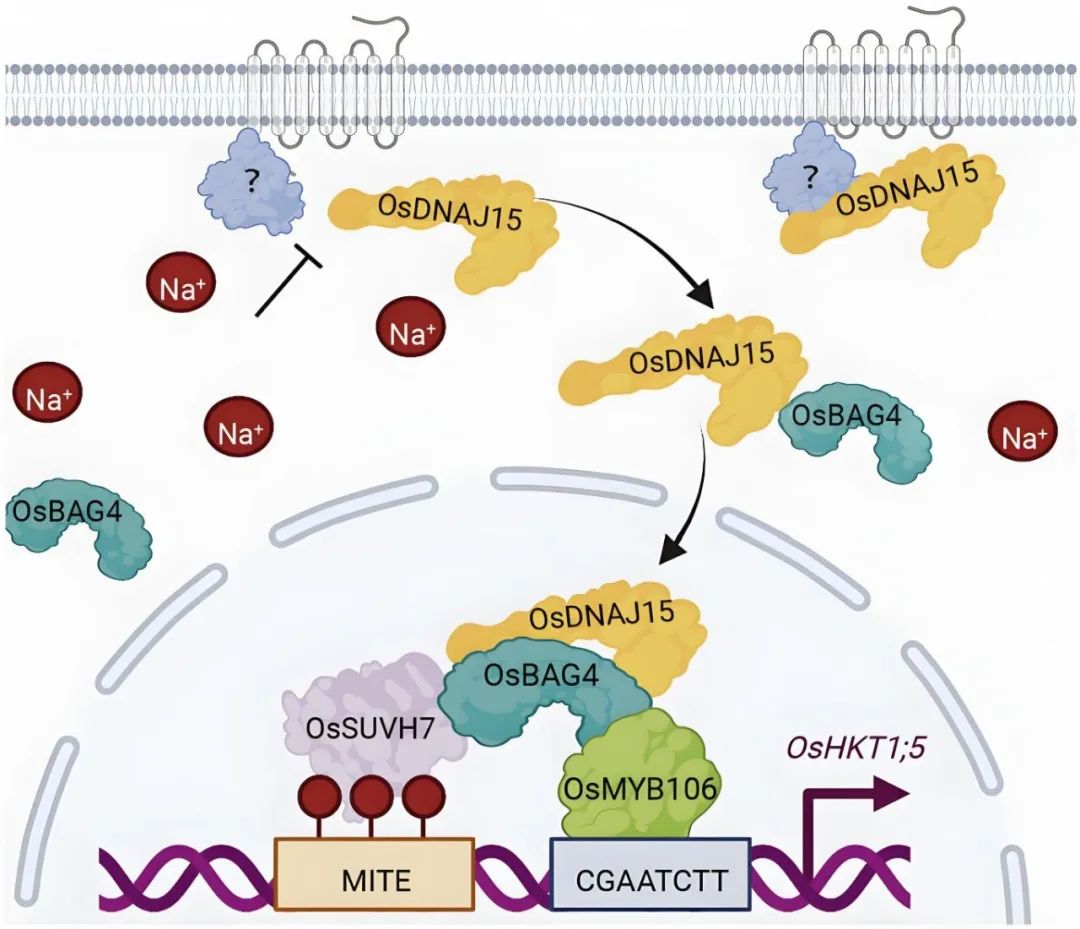
图5 OsDNAJ15促进OsBAG4的活性以激活OsHKT1;5的表达(Liu et al., 2023)。
图6 引发内质网胁迫的环境因素(Ko and Brandizzi, 2024)。
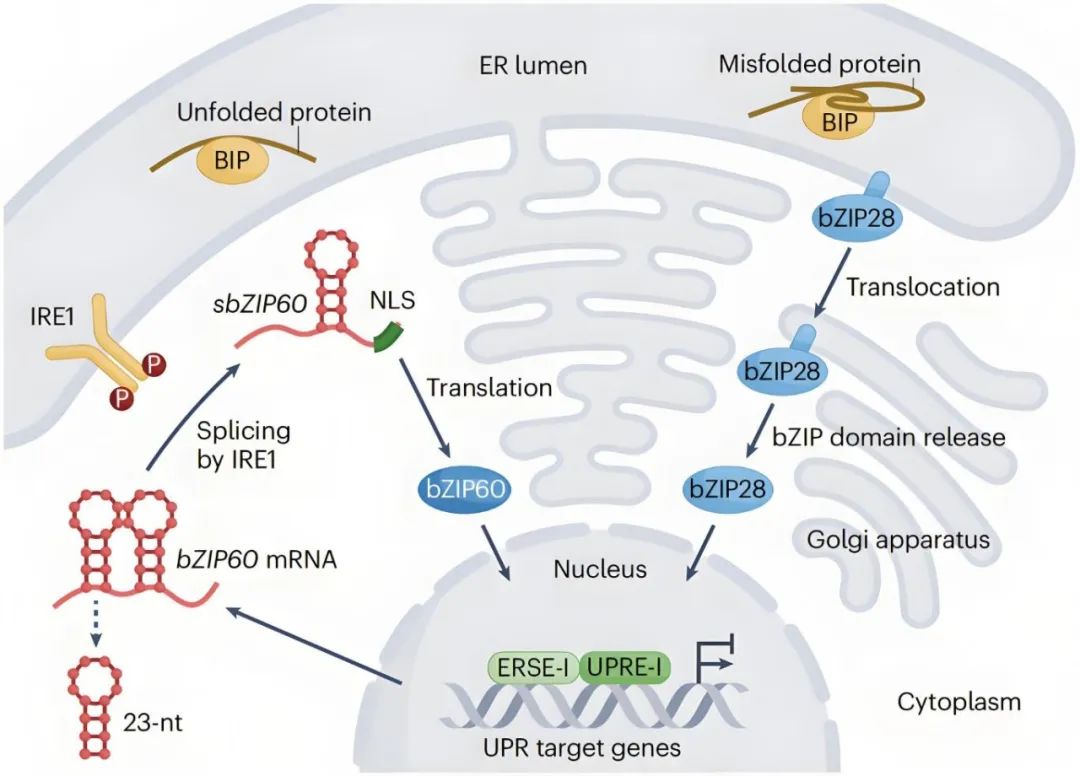
目前UPR主要有两种途径,IRE1-bZIP60途径和bZIP28途径,均涉及到内质网膜结合转录因子的内质网膜-核迁移过程。
在IRE1-bZIP60途径,发生内质网胁迫后,跨膜蛋白IRE1会聚合并自磷酸化以激活其核糖核酸酶活性,对编码bZIP60的mRNA进行剪接,切掉一个23nt的内含子,生成带有核定位信号的活性转录因子bZIP60。
在bZIP28途径,跨膜蛋白bZIP28通过与伴侣蛋白BiP结合稳定驻留于内质网中,感受到内质网胁迫后,BiP优先结合未折叠蛋白并释放bZIP28,bZIP28被运输到高尔基体中被蛋白酶切割,释放出的N端片段包含一个bZIP结构域,随后重新定位至细胞核。
关于内质网胁迫的研究论文和综述都比较多,伯小远在此就不列举具体的文献案例啦。
图7 植物中的内质网胁迫感知和UPR反应(Ko and Brandizzi, 2024)。
严重内质网胁迫/病原菌感染
-NAC089–内质网膜→细胞核
除了上述bZIP家族的内质网膜转录因子,NAC家族的NAC089内质网膜转录因子也被发现在发生胁迫后被蛋白酶水解进入细胞核中,调节细胞程序性死亡。
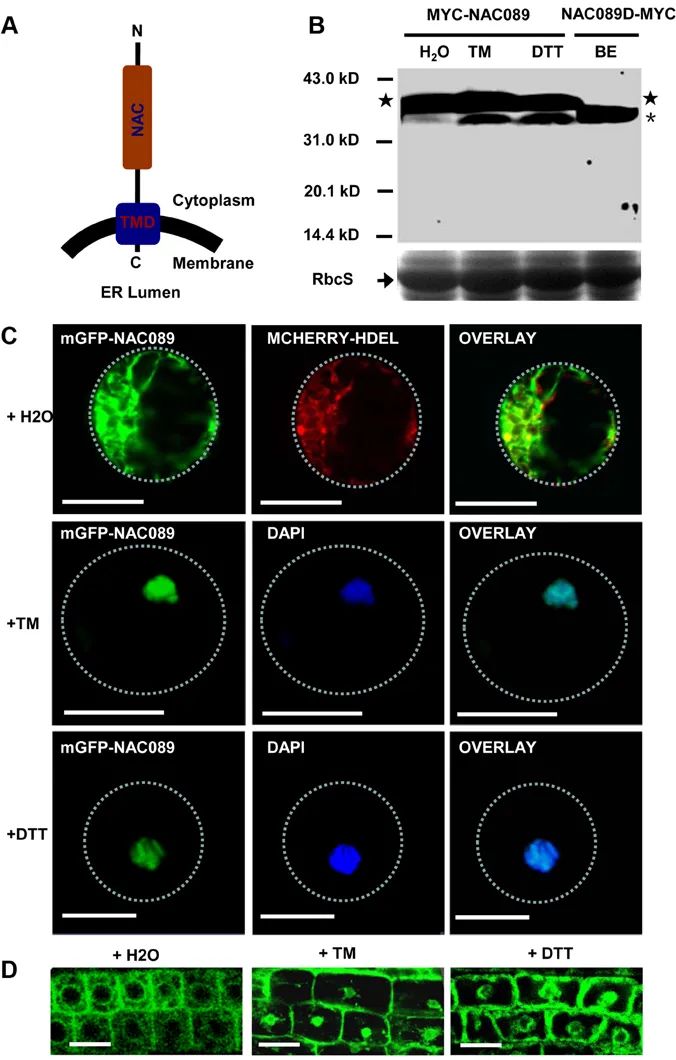
2014年,复旦大学刘建祥课题组在Plos Genetics杂志上发表了题为“The membrane-associated transcription factor NAC089 controls ER-Stress-Induced programmed cell death in plants”的研究论文,作者发现当发生严重内质网胁迫时,内质网膜定位的NAC089的膜结合区被切割掉,生成活性形式的NAC089,随后重新定位至细胞核,诱导细胞程序性死亡相关调节因子的表达。而bZIP60和bZIP28能诱导NAC089的表达,也可能调控NAC089负调控因子的表达,说明促进细胞存活和促进细胞死亡的信号均由bZIP60和bZIP28控制,它们之间的平衡决定了内质网胁迫条件下细胞的存活或死亡。
图8 在内质网胁迫反应过程中,NAC089从内质网膜重新定位至细胞核(Yang et al., 2014)。(A)NAC089的拓扑结构;(B)发生内质网胁迫后生成活性形式的NAC089;(C)在拟南芥叶片原生质体和(D)根细胞中,发生内质网胁迫后mGFP-NAC089会重新定位。
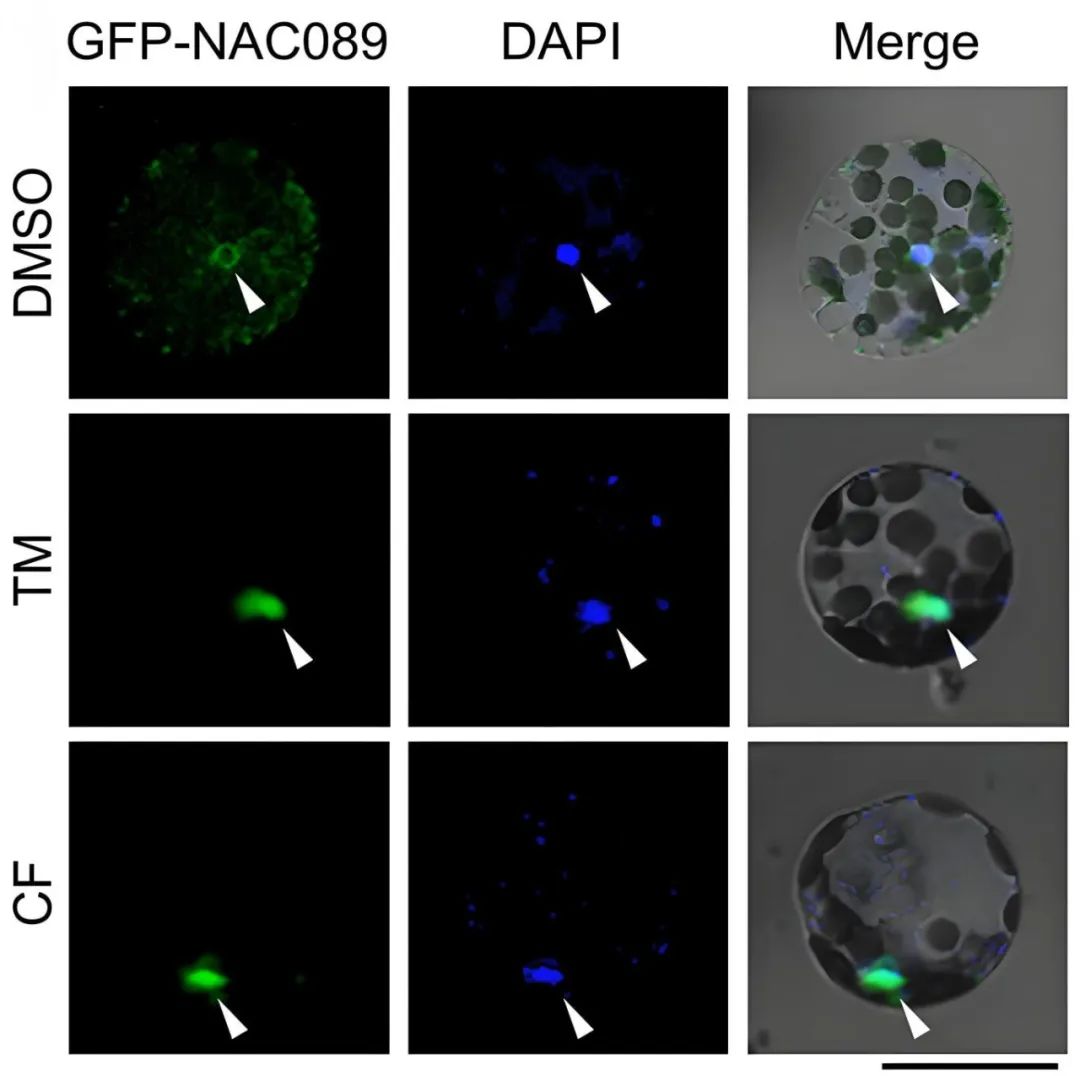
2021年,中国农业大学窦道龙课题组在The Plant Journal杂志上发表了题为“Phytophthora infection signals-induced translocation of NAC089 is required for endoplasmic reticulum-stress response-mediated plant immunity”的研究论文,作者发现NAC089能够响应疫霉菌侵染以及疫霉菌的培养滤液,从内质网经高尔基体转运进入细胞核中,并且这种迁移依赖于BAK1蛋白(BRI1相关受体激酶1),之后NAC089在细胞核中正调控细胞死亡相关基因的表达。
图9 辣椒疫霉菌的培养滤液能激活NAC089从内质网膜重新定位至细胞核的信号通路(Ai et al., 2021)。TM:衣霉素;CF:辣椒疫霉菌培养滤液。
-内质网膜→细胞核
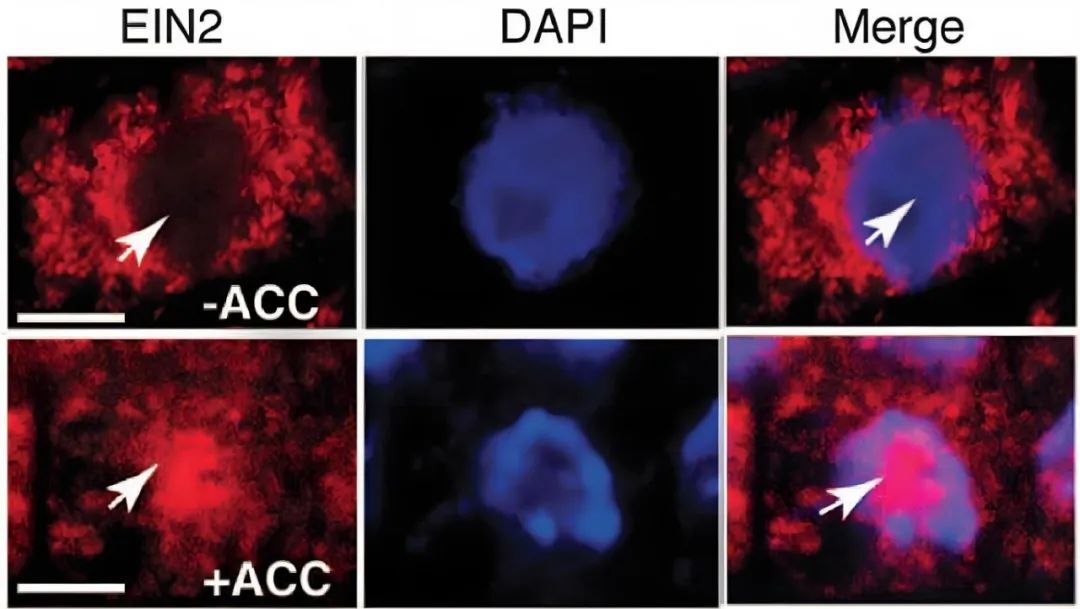
2012年,Joseph R. Ecker课题组在Science杂志上发表了题为“Processing and subcellular trafficking of ER-tethered EIN2 control response to ethylene gas”的文章,作者通过保守结构域预测,发现在EIN2的C端有一个核定位信号(NLS),亚细胞定位结果显示使用乙烯前体1-氨基环丙烷羧酸(ACC)处理样品会使EIN2由内质网转移至细胞核。除了全长EIN2片段,作者也检测到约75kD的较小EIN2片段,因此推测EIN2被蛋白水解酶剪切,并通过实验确定了EIN2的剪切位点位于C端的S645位置,最终发现乙烯能抑制CTR1蛋白激酶对EIN2 S645位点的磷酸化修饰(后续其他研究证明CTR1除了磷酸化EIN2的S645位点,还可以磷酸化其S924位点)才导致EIN2的C端被剪切掉后入核。
图10 乙烯处理后,EIN2从内质网迁移至细胞核(Qiao et al., 2012)。
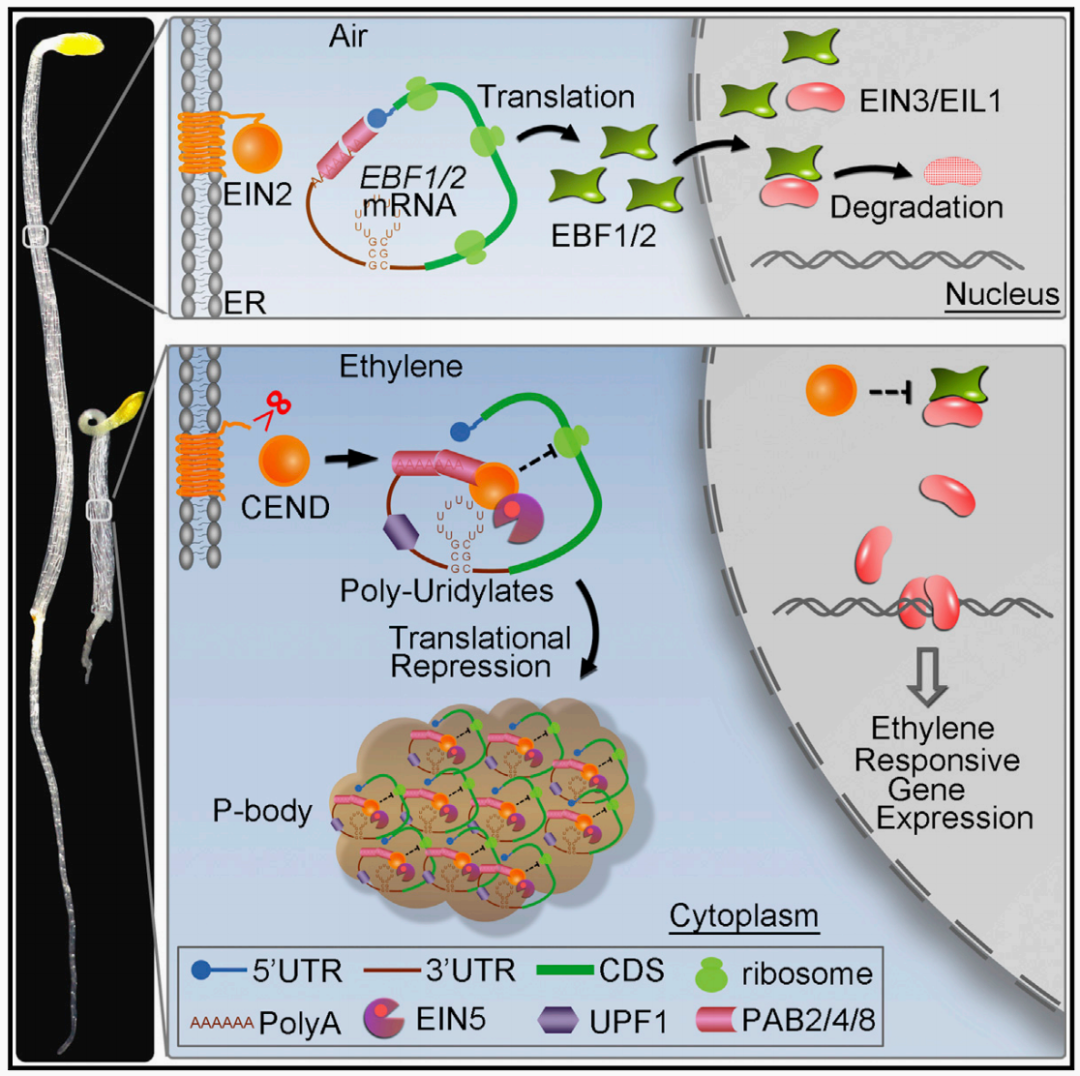
2015年,北京大学郭红卫课题组在Cell杂志上发表了题为“EIN2-directed translational regulation of ethylene signaling in Arabidopsis”的文章,作者系统揭示了EIN2从内质网膜迁移至核的分子机制。当乙烯存在时,EIN2 CEND被蛋白水解酶从内质网上切割下来,细胞质中的EIN2 CEND可以和EBF1/2 mRNA的3′ UTR互作,并且通过和定位于细胞质的P-body中的组分互作,将EBF1/2 mRNA带入P-body,从而抑制EBF1/2 mRNA的翻译,EIN2 CEND进入细胞核,稳定EIN3/EIL1并使其积累,激活一系列乙烯响应基因,介导植物的乙烯反应。
图11 乙烯信号传导途径(Li et al., 2015)。
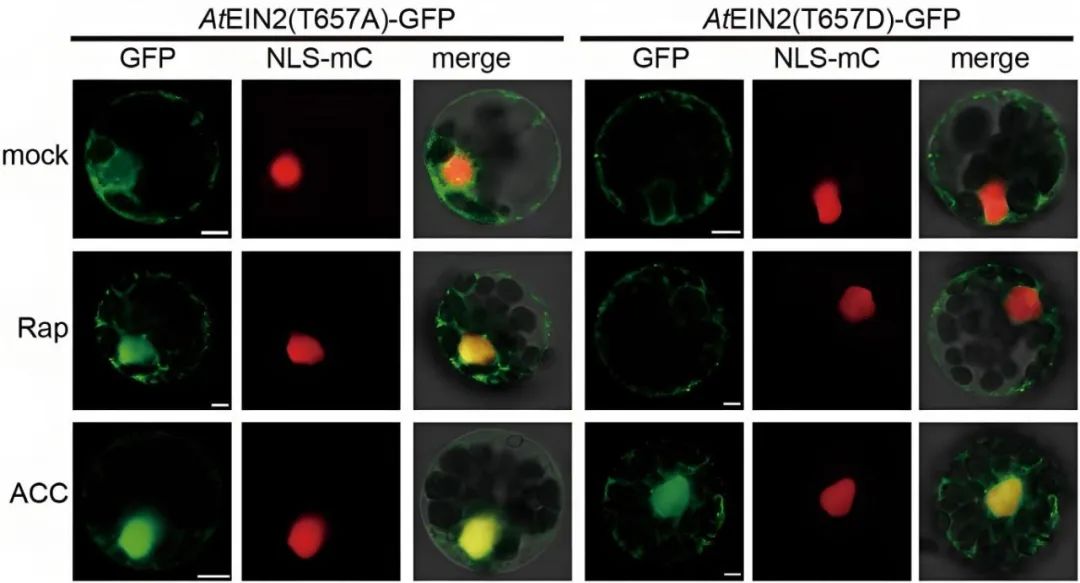
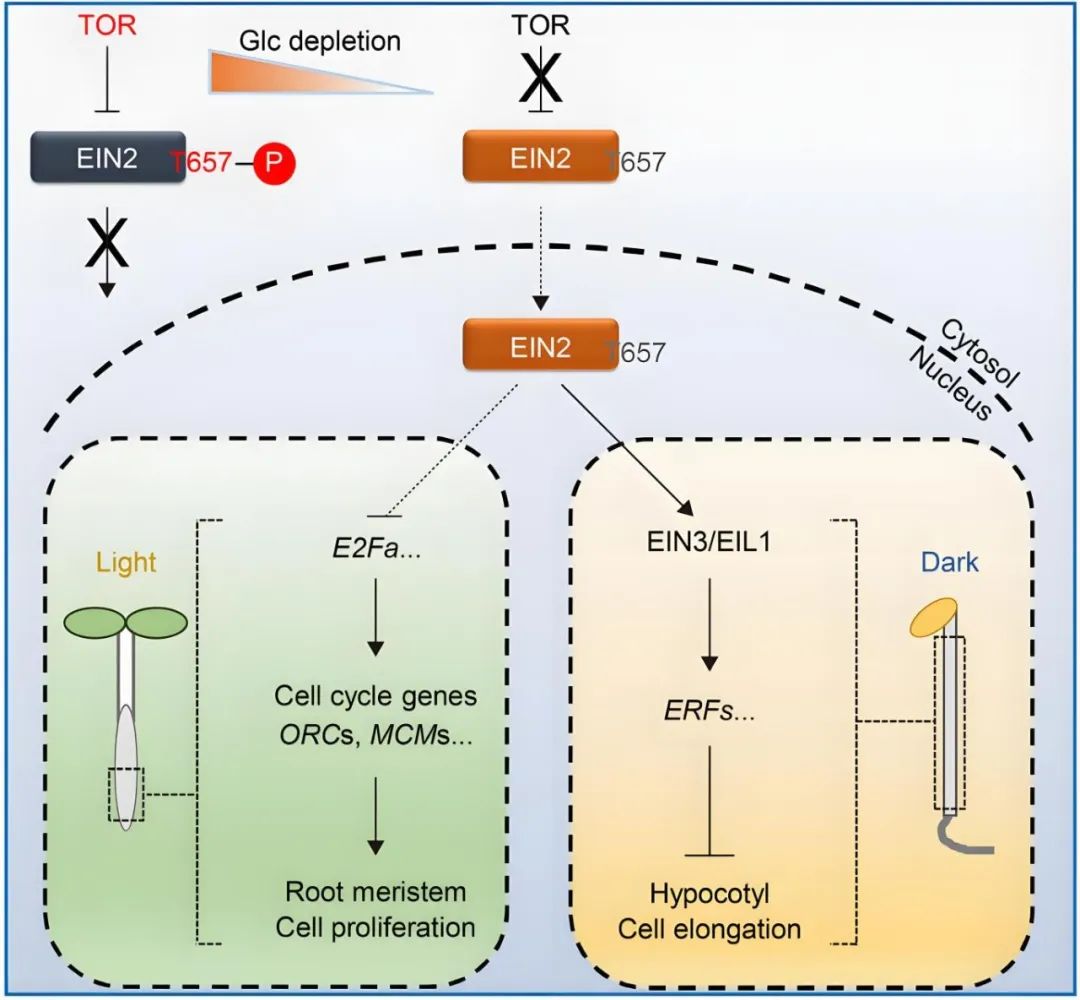
2021年,福建农林大学熊延课题组在Nature杂志上发表了题为“The TOR-EIN2 axis mediates nuclear signalling to modulate plant growth”的文章,作者发现TOR激酶磷酸化EIN2蛋白的Thr657位点,抑制EIN2全长蛋白的入核,当发生糖饥饿或TOR激酶受到抑制时,EIN2 Thr657位点的磷酸化被解除,EIN2以全长蛋白的形式进入细胞核,调控糖-TOR信号下游相关基因的转录,从而抑制下胚轴的伸长。该信号通路独立于前述的乙烯-CTR1-EIN2 S645/S924信号通路,EIN2入核后调控的下游基因也是不同的,显示出植物能通过不同的蛋白激酶精细调控EIN2不同的磷酸化位点,即植物构建出差异的蛋白磷酸化密码并赋予EIN2不同的功能。
图12 EIN2 T657位点去磷酸化和持续磷酸化状态对EIN2入核的影响(Fu et al., 2021)。Rap:雷帕霉素,可抑制TOR激酶。
图13 葡萄糖-TOR-EIN2信号通路(Fu et al., 2021)。葡萄糖激活的TOR直接磷酸化EIN2以抑制其核穿梭。在葡萄糖缺乏的条件下,去磷酸化的EIN2进入细胞核,并通过不同的下游效应因子控制根尖分生组织的激活和下胚轴细胞的伸长。
叶绿体膜与核
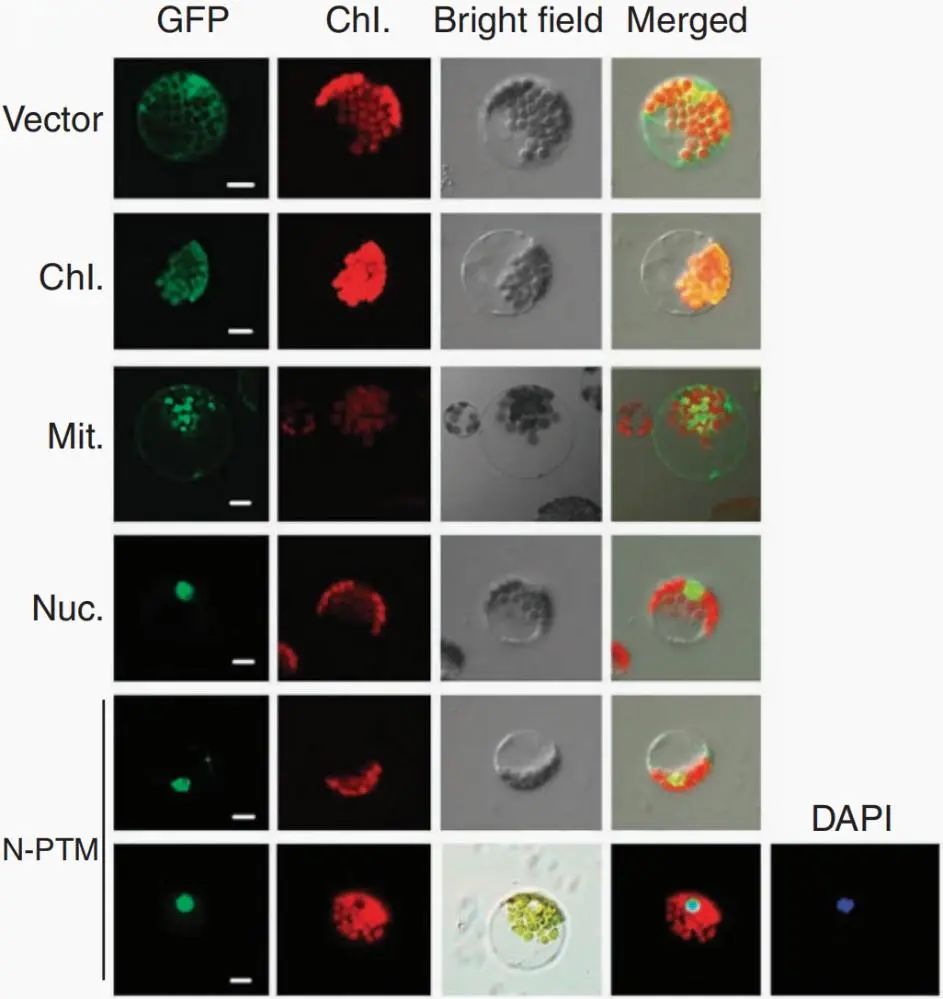
图14 全长PTM与N-PTM的亚细胞定位比较(Sun et al., 2011)。
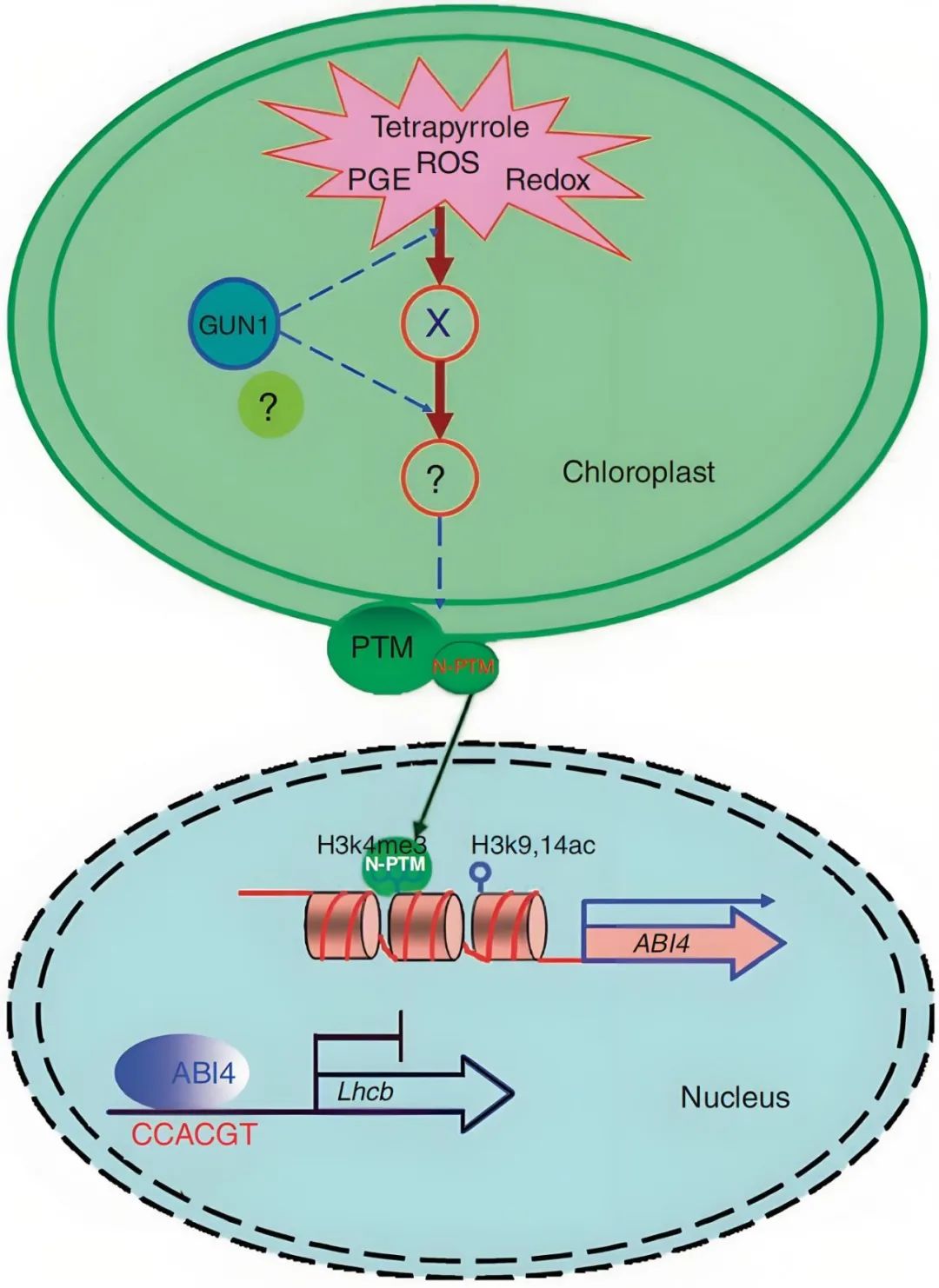
图15 PTM在叶绿体逆向信号通路中充当传感器(Sun et al., 2011)。当叶绿体发育受损或受到胁迫时会产生叶绿体逆行信号,这些信号汇聚到GUN1,GUN1生成或传输第二个信号,之后PTM被未知蛋白酶水解成成熟形式,并重新定位到细胞核,并与ABI4的启动子结合,ABI4表达的激活与组蛋白修饰相关。