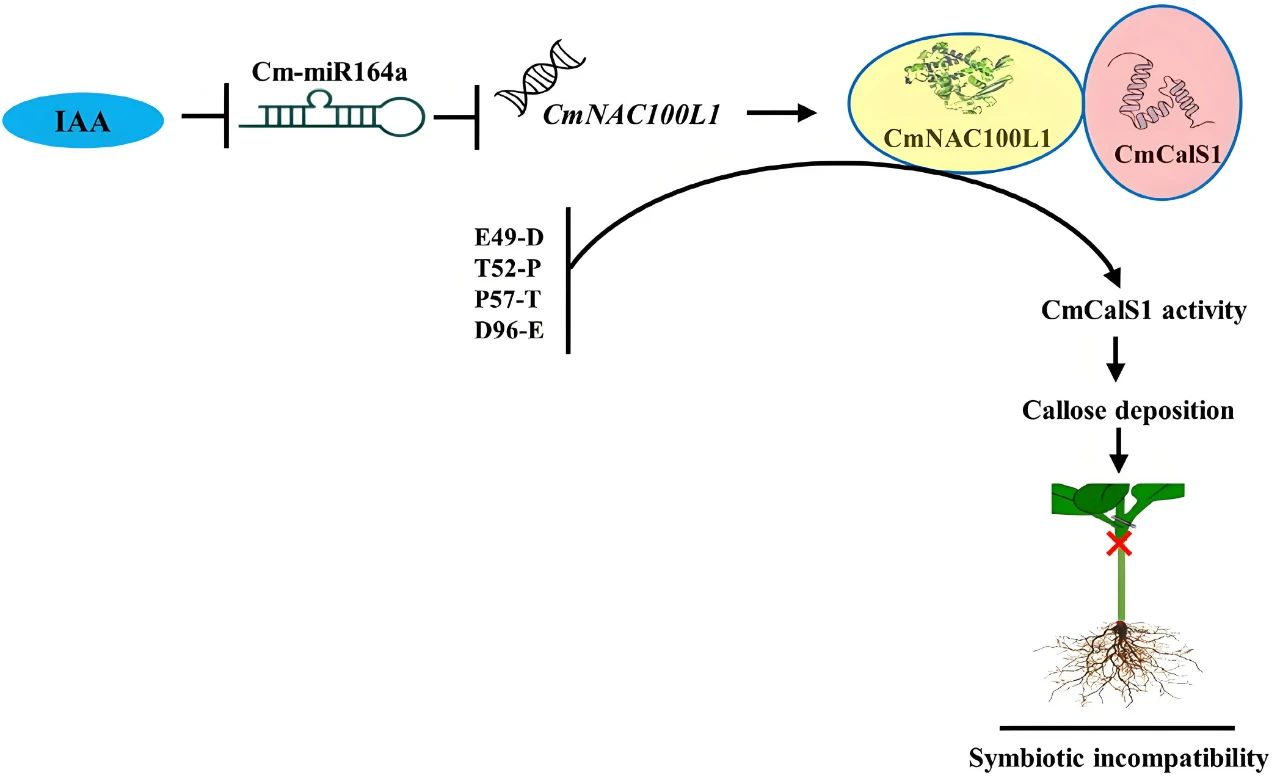
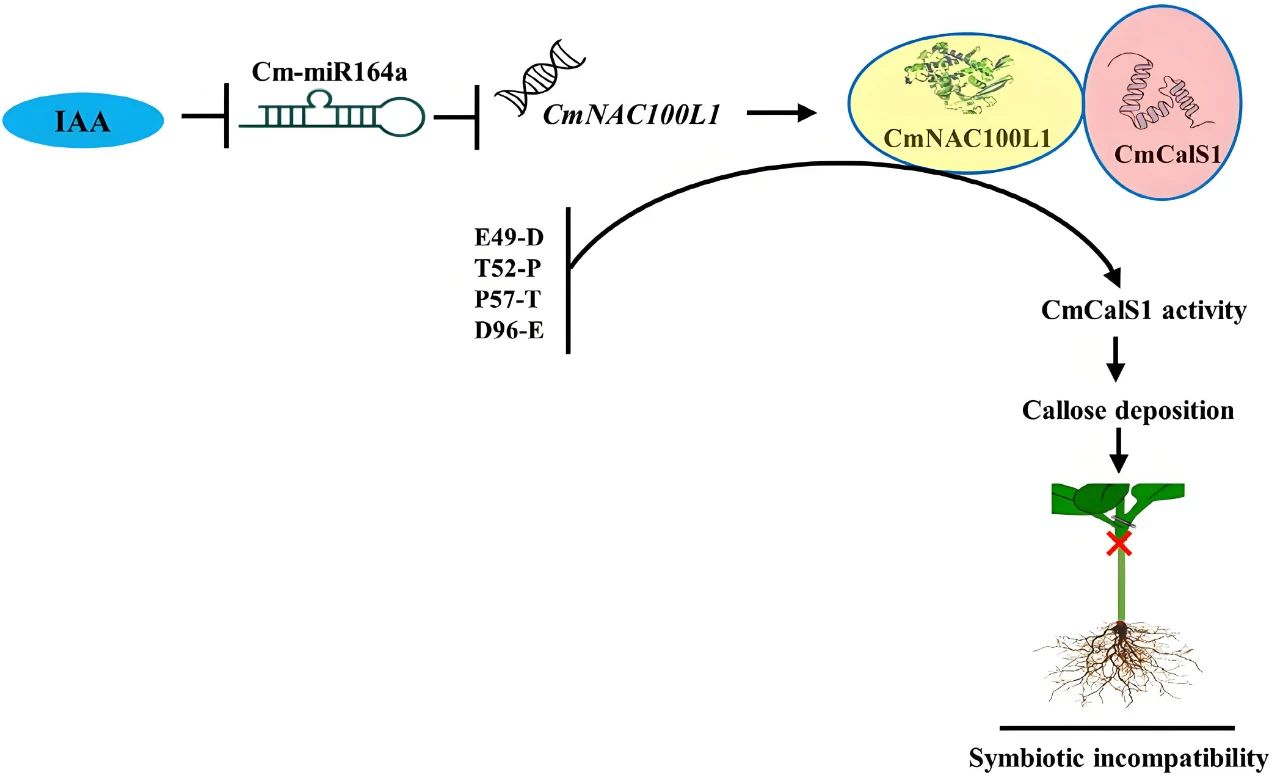
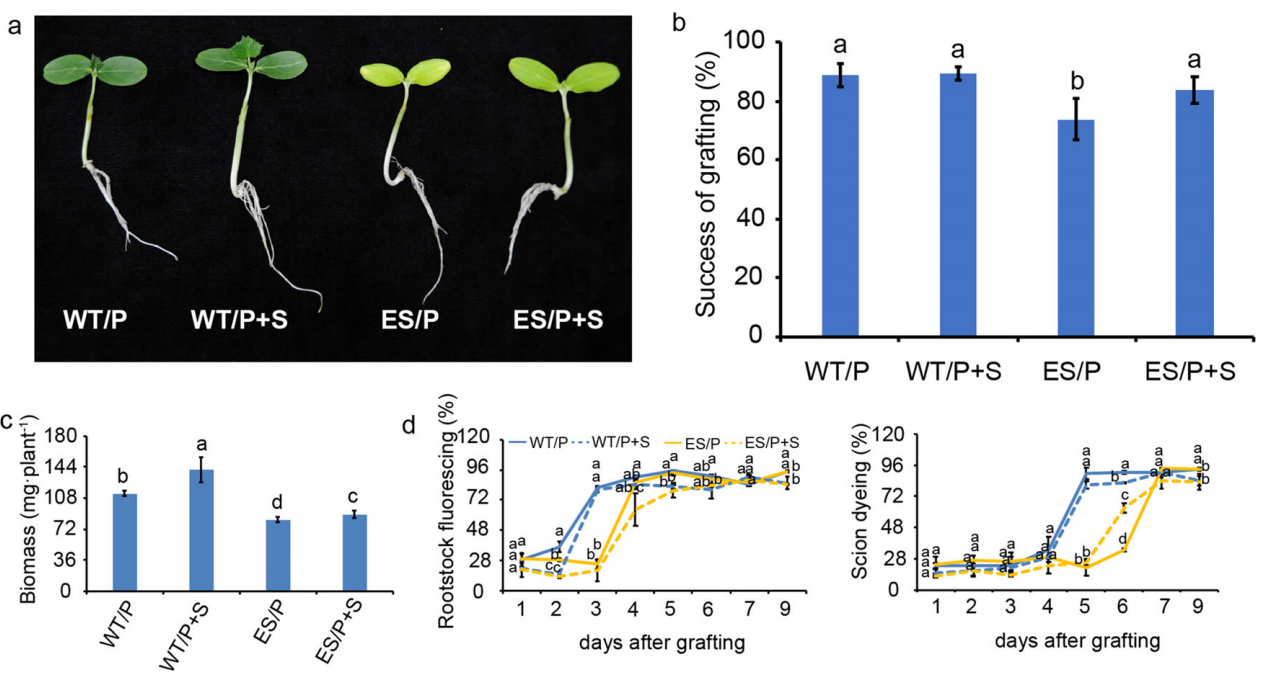
本文内容速览:
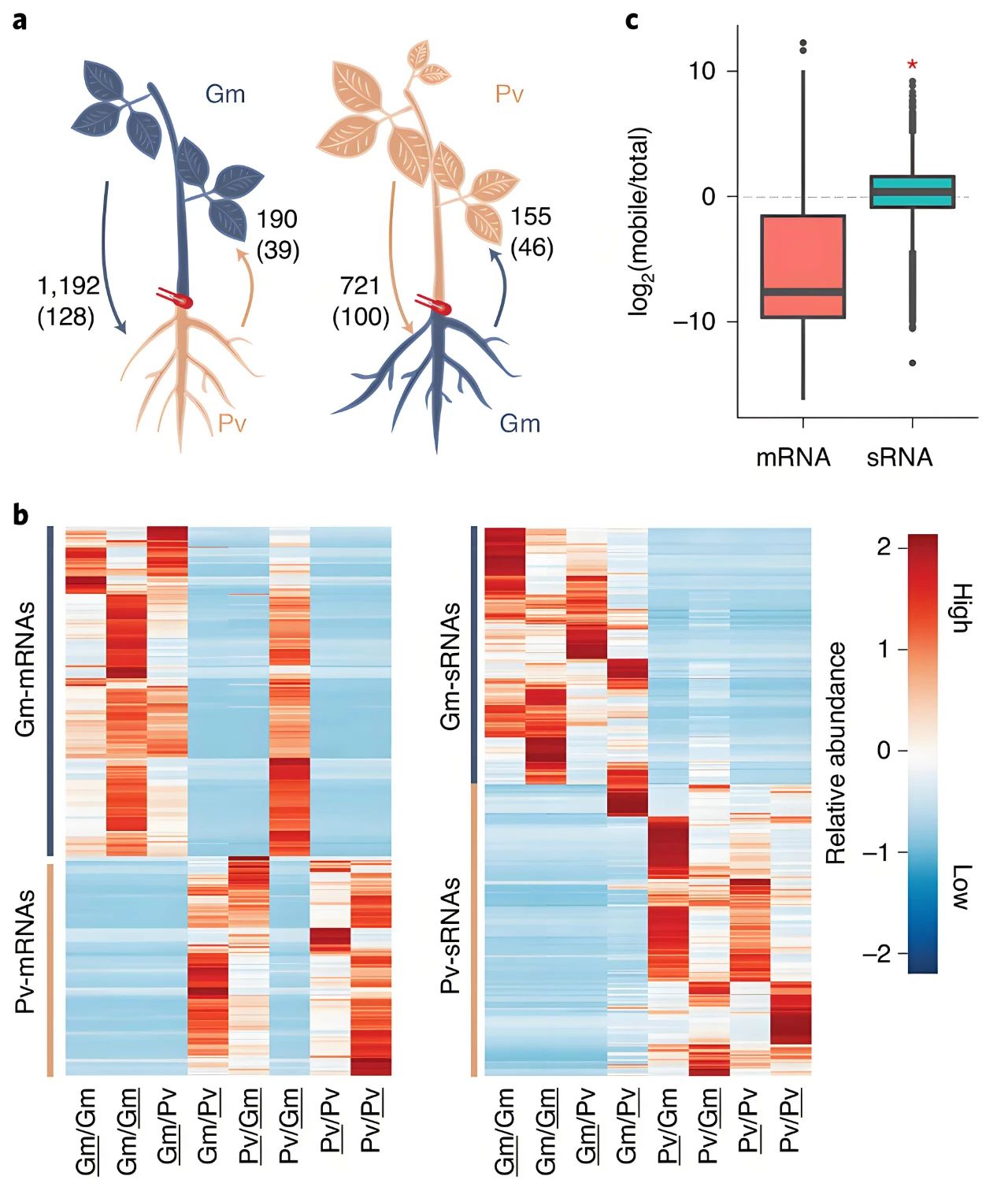
2021年1月,青岛农业大学马渐新课题组在Nature Plants杂志上发表了一篇题为“Unidirectional movement of small RNAs from shoots to roots in interspecific heterografts”的研究论文,作者利用大豆(Glycine max)-菜豆(Phaseolus vulgaris)嫁接系统,鉴定出了100种可移动microRNAs和32种可移动阶段性小干扰RNA(phased small interfering RNAs, phasiRNAs),它们主要在接穗中产生并运输到砧木,且在大多数情况下,在砧木中积累的水平与在接穗中观察到的水平相近。此外,作者发现sRNAs迁移的丰度和效率高于mRNA,这可能是因为sRNAs与mRNA移动调控机制的差异,并且sRNAs受到更严格的调控,因此sRNAs在功能上可能比mRNA更重要。
嫁接中涉及的可移动分子根据其自身性质、植物的需求以及所处的具体部位等因素,既会参与长距离运输以协调植物整体的生长发育,也会进行短距离运输来实现局部细胞间的沟通和协调(图2)。关于长距离运输和短距离运输的相关知识小远已经在“追光植物背后的故事(一)”为大家讲解过啦,大家快去看看吧。
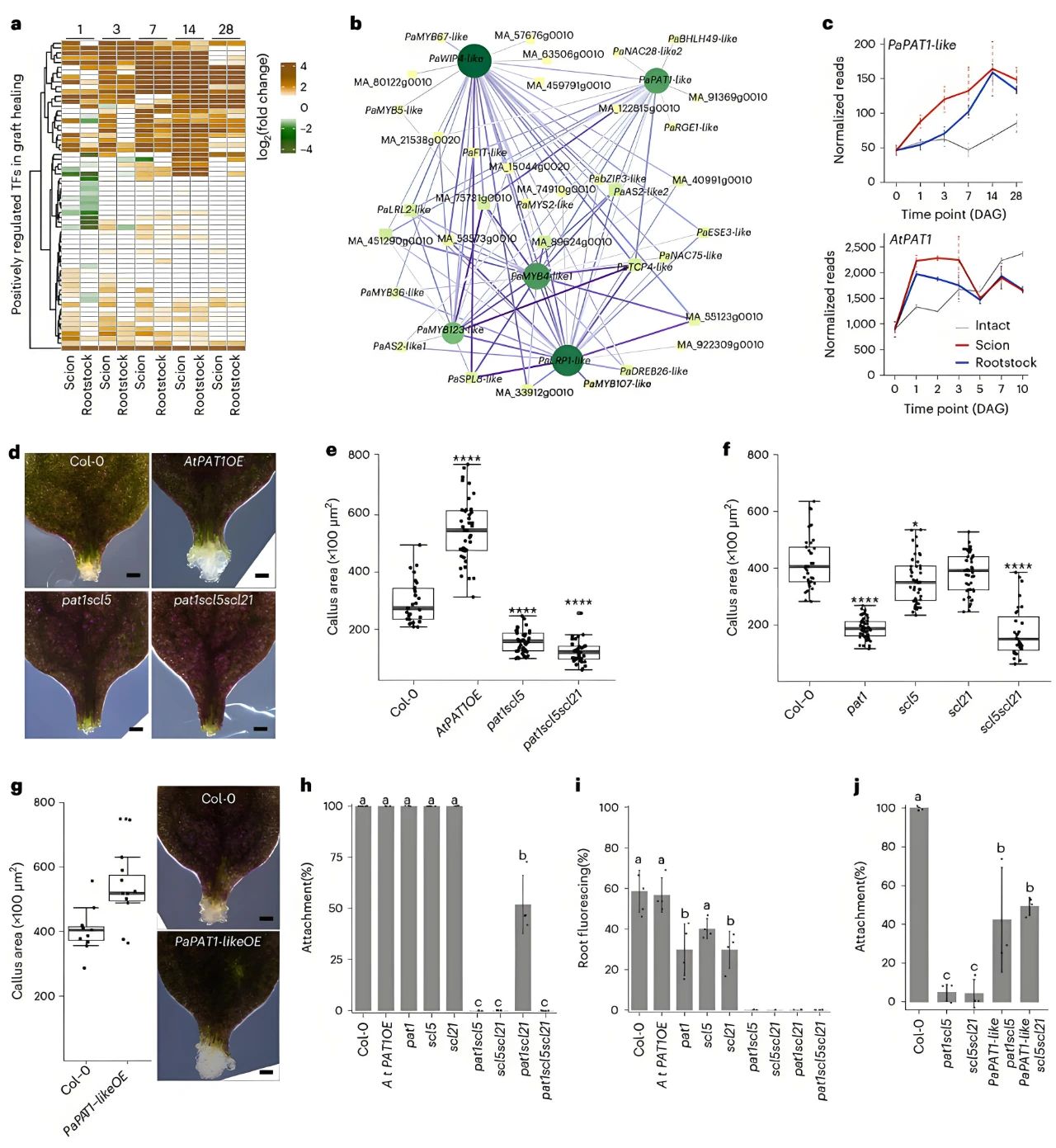
为了探索云杉嫁接形成的转录调控,作者通过WGCNA加权相关网络分析,挑选了在接穗和砧木中特异性表达差异,而在完整植株中表达无差异的模块生成基因调控网络,其中PaPAT1-like、PaWIP4-like、PaMYB4-like、PaLRP1-like和PaMYB123-like这5个转录因子显著上调,充当了调控网络的枢纽(图4a-b)。然后,作者发现拟南芥同源基因LRP1、MYB4和PAT1也在拟南芥嫁接过程中被诱导表达,这表明拟南芥和云杉之间存在广泛保守的调控反应(图4c)。由于PAT1基因家族能促进根尖再生,因此作者构建了拟南芥愈伤组织PAT1过表达株系和pat1突变体。发现,AtPAT1OE在叶柄损伤部位愈伤组织形成增加,而pat1、pat1scl5和pat1scl5scl21系愈伤组织形成明显受损。与野生型相比,scl5在愈伤组织形成方面表现出轻微缺陷,而scl21没有表现出显著差异(图4d-f)。随后为了研究云杉PaPAT1-like是否具有与拟南芥PAT1相似的功能,作者克隆了PaPAT1-like基因,在拟南芥中建立了PaPAT1-like过表达株系,发现与野生型相比,PaPAT1-likeOE增加了叶柄切端的愈伤组织面积(图4g),并且pat1scl5、scl5scl21、pat1scl21和pat1scl5scl21的嫁接贴合率都降低了(图4h)。在CFDA介导的韧皮部重连实验中,PAT1突变体表现出中度到强烈的韧皮部重连抑制(图4i)。此外作者还发现PaPAT1-likeOE可以部分修复pat1scl5和scl5scl21双突变体的嫁接贴合率缺陷(图4j)。
图4 PAT1相关基因促进植物愈合(Feng et al., 2024)。(a)嫁接愈合过程中正调控转录因子的热图;(b)基于嫁接激活的转录因子基因调控网络得出的前五个核心转录因子的调控关联图;(c)欧洲云杉(Picea abies)和拟南芥(Arabidopsis)在嫁接形成过程中PaPAT1-like和AtPAT1的表达情况;(d)野生型、AtPAT1OE、pat1scl5突变体、pat1scl5scl21突变体叶柄切端形成愈伤组织的情况;(e)野生型、AtPAT1OE、pat1scl5突变体、pat1scl5scl21突变体叶柄外植体的愈伤组织面积;(f)野生型、pat1、scl5、scl21和scl5scl21叶柄外植体的愈伤组织面积;(g)野生型、PaPAT1-likeOE的叶柄切端形成愈伤组织的图像及定量分析;(h、i)同株嫁接的野生型、AtPAT1OE、pat1、scl5、scl21、pat1scl5、scl5scl21、pat1scl21和pat1scl5scl21的嫁接贴合率(h)和韧皮部重连率(i);(j)在pat1scl5和scl5scl21中转化了PaPAT1-like的嫁接贴合率。
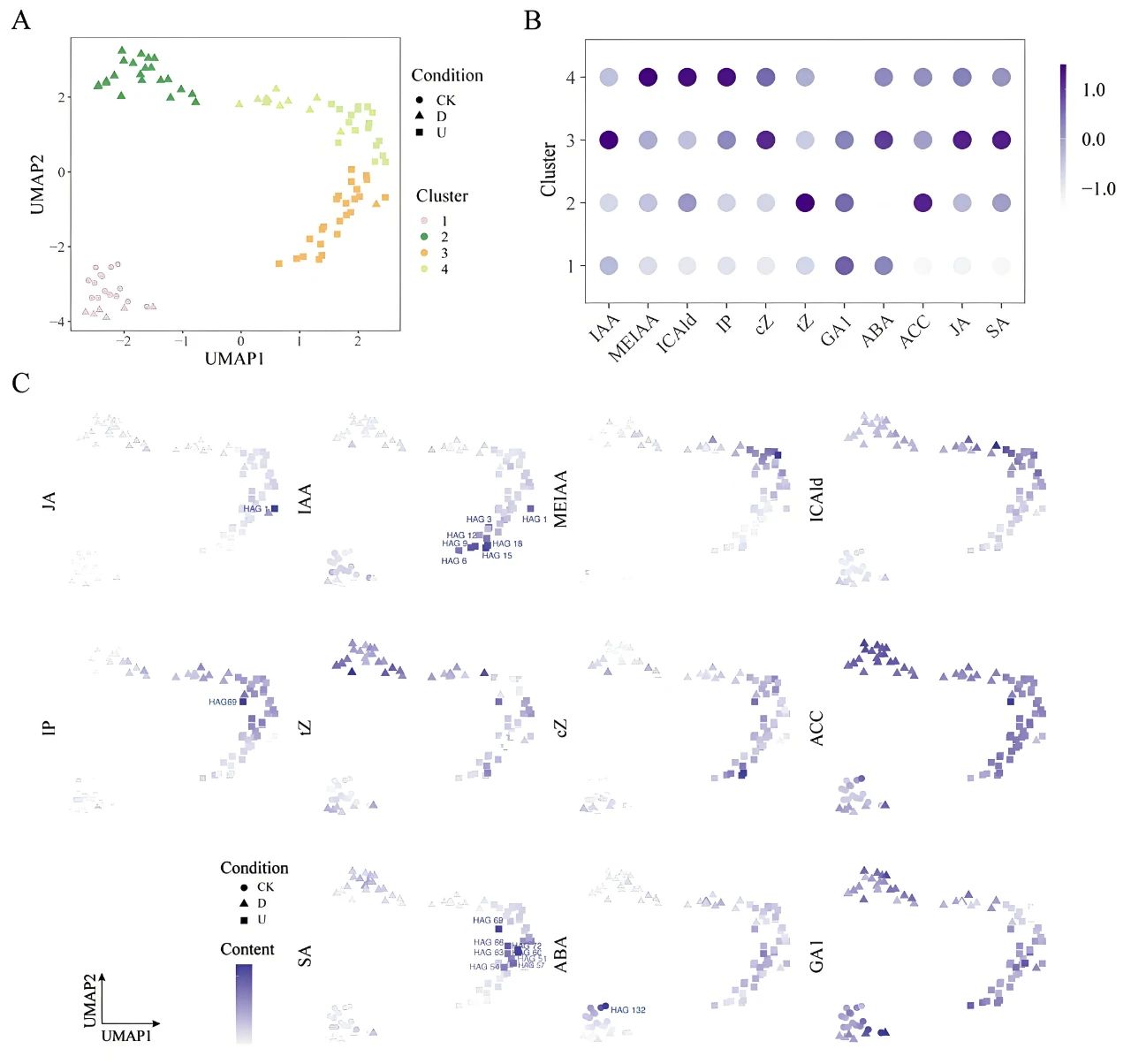
图6 番茄嫁接愈合过程中的激素动力学(Duan et al., 2024)。(A)通过K均值聚类法对样本进行聚类。CK:完整节间切片;D:嫁接口下方的节间切片;U:嫁接口上方的节间切片;(B)四个聚类中的平均激素水平。颜色越深,表示含量越高;(C)每种激素的动态轨迹。圆形、三角形和方形的颜色代表激素含量(颜色越深,含量越高)。
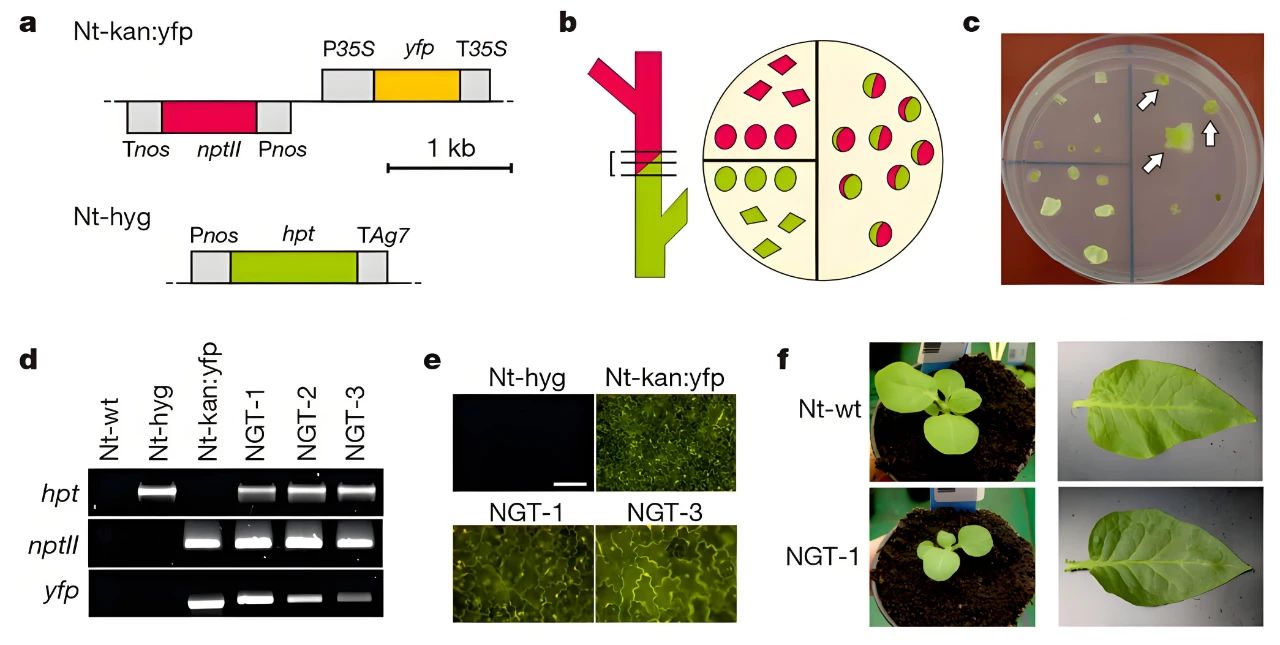
为了探究嫁接是否能够实现核DNA的转移,作者培育了两种携带不同选择标记基因的转基因烟草,Nicotiana tabacum携带卡那霉素抗性基因,Nicotiana glauca携带潮霉素抗性基因(图9a)。将两种烟草嫁接,在细胞融合发生之后,切下嫁接部位,并对其进行卡那霉素和潮霉素抗性的双重筛选(图9b)。发现培养基中长出了许多具有双重抗性的小苗(NGT)(图9c)。通过PCR检测,在三个双重抗性的独立株系中,分别检测到了两种抗性基因的表达,初步表明在嫁接部位发生了核基因的转移(图9d)。对双重抗性烟草的表型进行了比较,发现与野生型幼苗相比,NGT幼苗的细胞比嫁接前的烟草细胞更大(图9e),并且发现NGT幼苗的生长迟缓,叶片绿色色素沉着增强(图9f)。