本文内容速览:
在农业生产上,病原体是导致作物减产的主要原因之一,加强作物对病原体的防御能力是育种学家一直以来的研究重点,然而抗病能力的提高往往会导致作物其他性状的改变,这就是我们前期文章“植物的生长-防御平衡”中所讲到的。普遍意义上的植物抗病主要取决于植物先天免疫系统和病原体的毒力系统,但越来越多的研究表明,植物在生长发育的各个阶段会被不同的病原体侵染定植,存在于植物根际、叶际及内部组织中的微生物组对植物的抗病性有着至关重要的作用。
在进入正题之前,我们先来了解一下植物微生物组的概念。植物微生物组通常指生活在植物表面和内部的微生物群落,包括细菌、真菌和古细菌等。它们与植物之间建立复杂的相互作用,包括但不限于从微生物组内相互作用到与寄主植物、外源微生物和昆虫的相互作用,影响植物的生长、健康和抗逆性。
2022年8月,安徽农业大学谢珊珊课题组在hytopathology杂志上发表了一篇题为“Maize Root Exudates Recruit Bacillus amyloliquefaciens OR2-30 to Inhibit Fusarium graminearum Infection”的研究论文。该研究论文中,作者中从156株根际微生物中筛选出1株对玉米根系分泌物趋化能力更强的芽孢杆菌亚种(Bacillus amyloliquefaciens)OR2-30。OR2-30可以分泌脂肽从而抑制禾谷镰刀菌(Fusarium graminearum)分生孢子的形成和萌发、诱导活性氧爆发以及导致菌丝体细胞死亡,最终提高了玉米对F. graminearum的抗性。
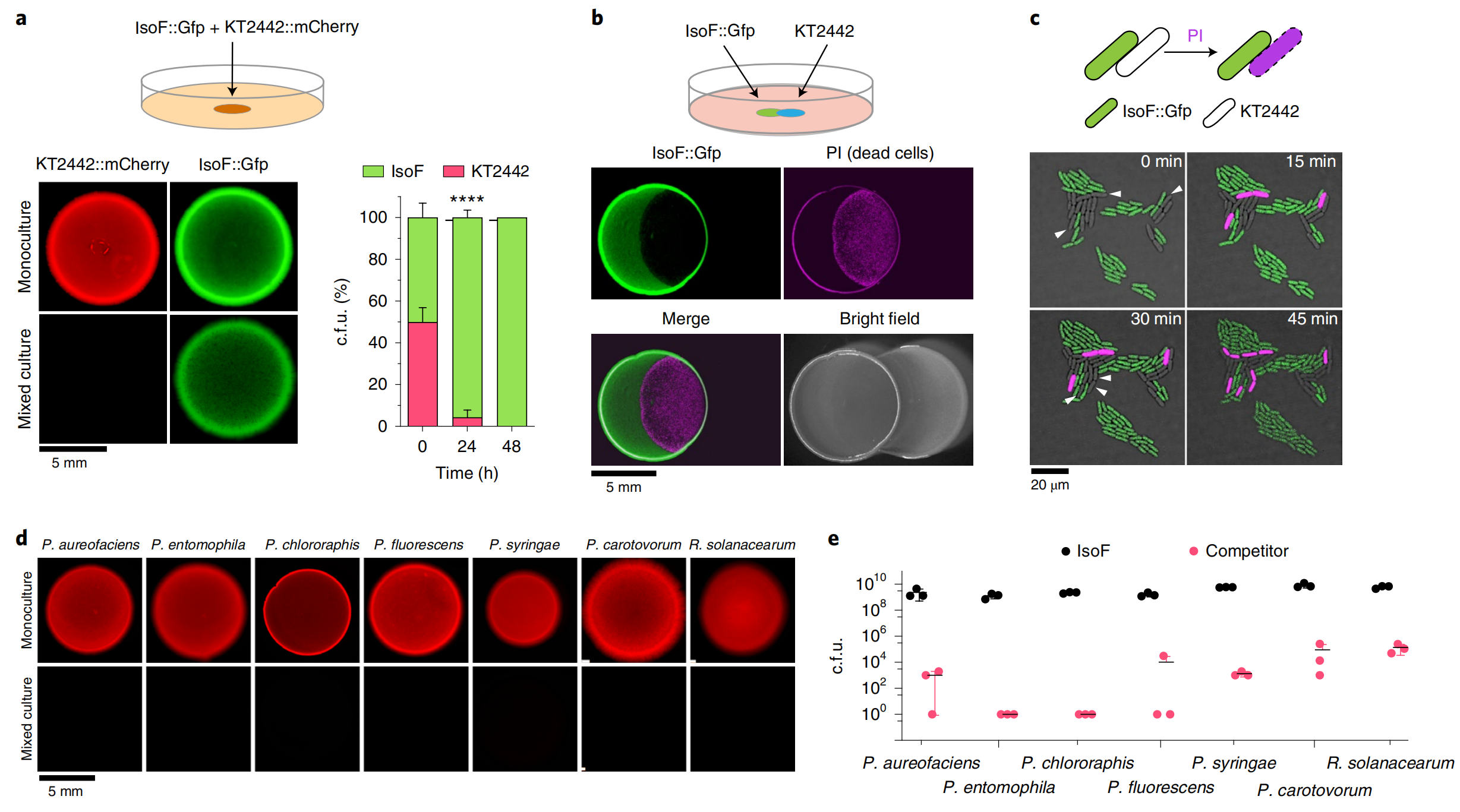
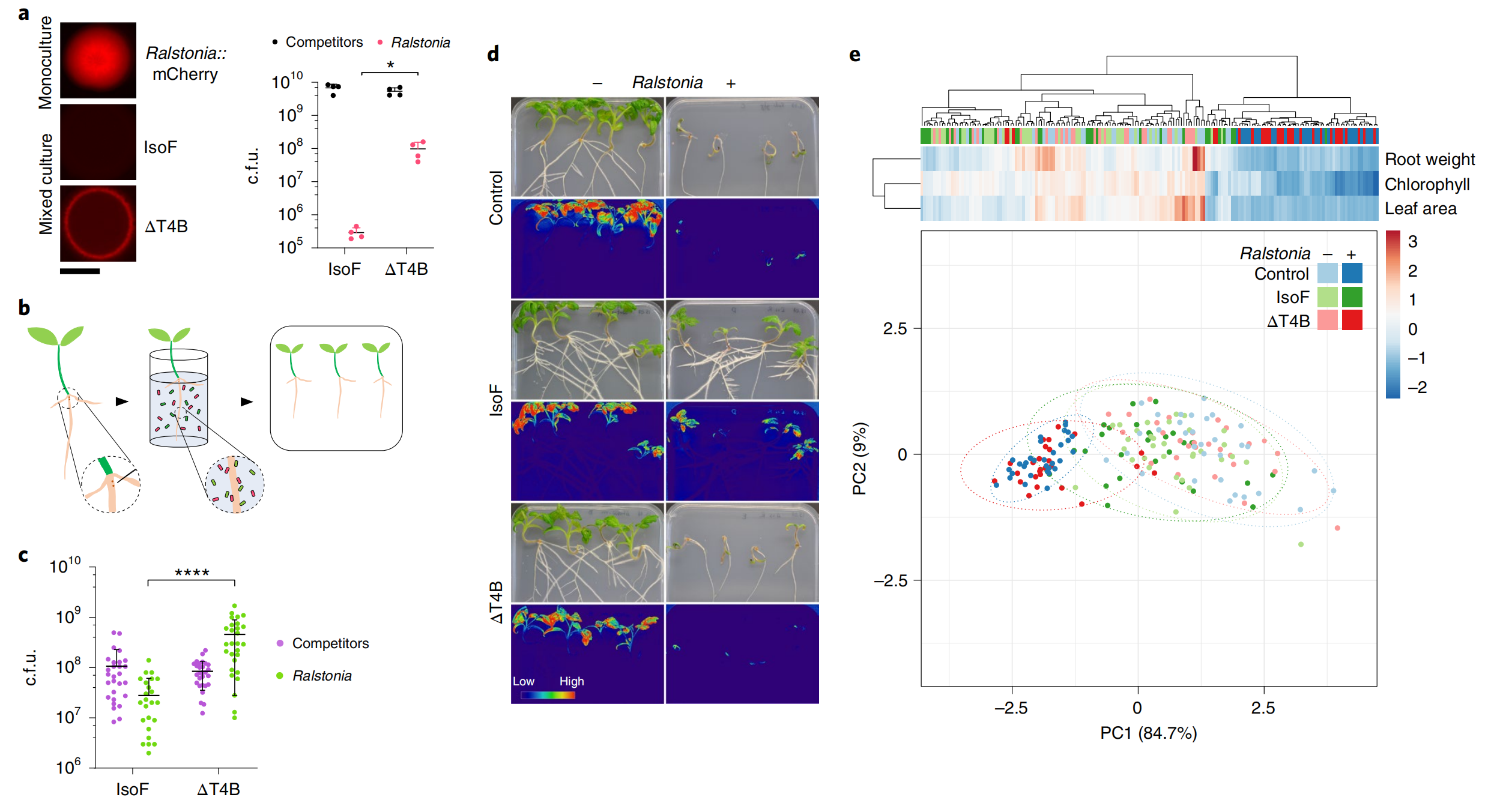
2022年9月,瑞士苏黎世大学Leo Eberl课题组在Nature Microbiology杂志上发表了一篇题为“Pseudomonas putida mediates bacterial killing, biofilm invasion and biocontrol with a type IVB secretion system”的研究论文。该研究论文中,作者发现了一种可以将毒性效应蛋白递送到细菌病原体中的分泌系统T4BSS,并证明植物有益细菌——恶臭假单胞杆菌(Pseudomonas putida)IsoF可借助该系统分泌毒性效应蛋白杀死土壤和植物中的大部分革兰氏阴性菌(图2),且其kib基因簇是发挥作用所必需的。青枯病菌是一种导致多种作物细菌枯萎病的主要病原体,因此作者又以番茄为植物材料检测了其对青枯病菌的抗性,发现IsoF确实可以提高番茄对青枯病的抗性(图3)。该研究为提高作物产量促进农业可持续发展提供了新的思路。
以上两篇文献主要是通过扩散或者分泌系统抑制病原体且均是针对抑制单个病原体,然而植物面对的环境日益复杂,针对单一病原菌的有益微生物在促进植物抗病性方面会稍显不足,那么是否存在对不同病原菌均存在抑制作用的微生物呢?答案当然是肯定!2022年6月,浙江大学陈云/俞云龙课题组联合中国科学遗传与发育生物学研究所杨白课题组在Nature Microbiology杂志上发表了一篇题为“Fusarium fruiting body microbiome member Pantoea agglomerans inhibits fungal pathogenesis by targeting lipid rafts”的研究论文。在该研究论文中作者发现由成团泛菌(Pantoea agglomerans)ZJU23分泌的herbicolin A(HA)负责抑制植物病原体,并且具有广泛的抗真菌谱,包括人类机会性真菌病原体(图4),这表明它在控制农业和临床环境中的真菌疾病方面具有潜力。
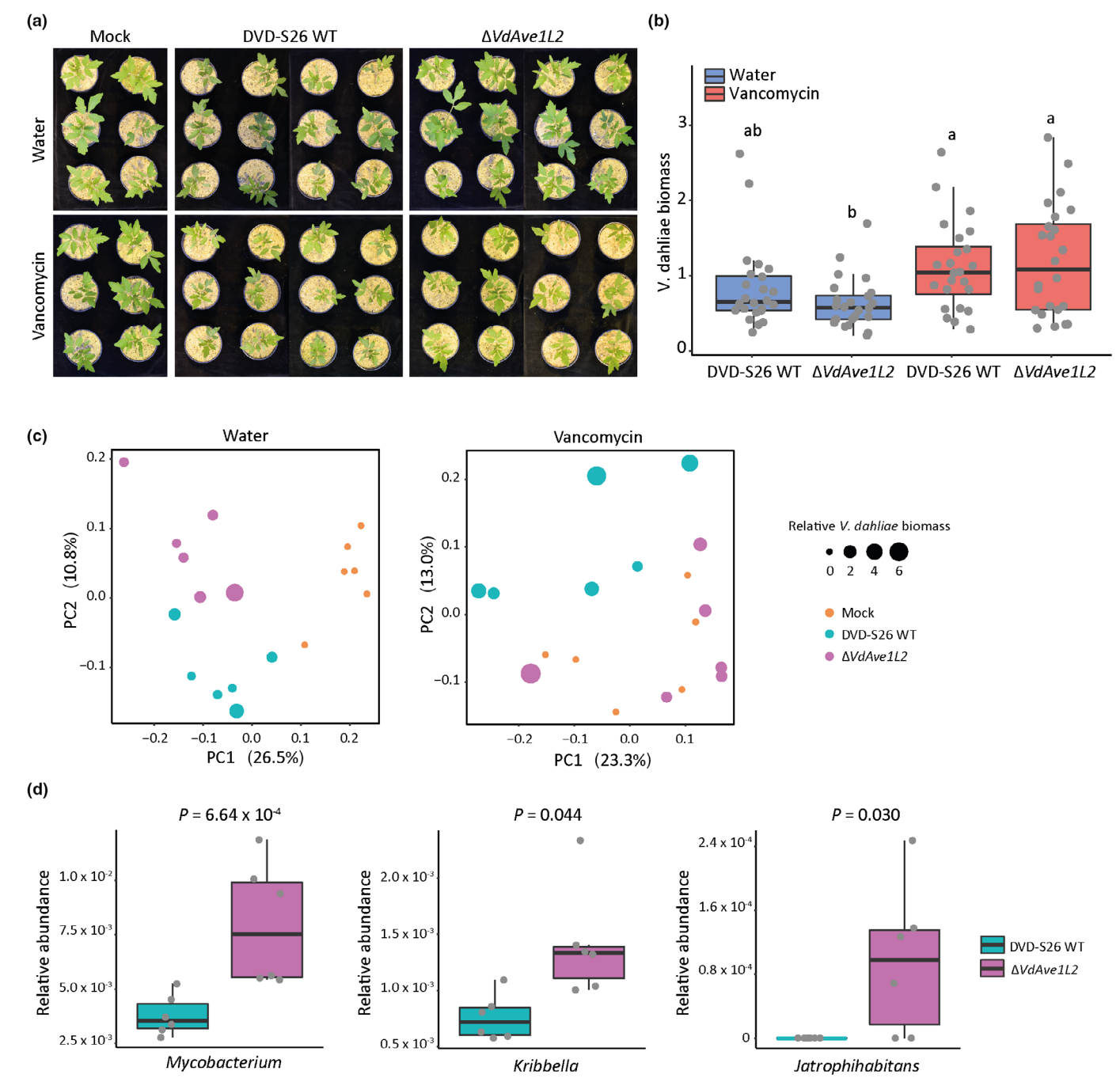
2023年2月,德国科隆大学植物科学研究所Bart P H J Thomma课题组在New Phytologist杂志上发表了一篇题为“A highly polymorphic effector protein promotes fungal virulence through suppression of plant-associated Actinobacteria”的研究论文。在该研究论文中,作者首先从大丽轮枝菌中鉴定出毒力效应蛋白VdAve1L2,随后为了确定大丽轮枝菌分泌的VdAve1L2是否影响宿主微生物群,作者基于大丽轮枝菌DVD-S26和VdAve1L2缺失突变体定植的番茄根的16S核糖体DNA分析的结果进行了细菌群落分析,结合体外抗菌活性检测实验发现放线菌是唯一受到VdAve1L2显著抑制的门,说明VdAve1L2可以直接靶向放线菌(图5)。紧接着作者从番茄植株中提取根际微生物群,并且用万古霉素(革兰氏阳性菌特异性抗生素)处理的微生物群落和水处理的微生物群落分别处理番茄。经16S核糖体测序发现,与水处理微生物群的植物相比,万古霉素处理的微生物群落的番茄植株没有显著改变的细菌门群落。并且当接种VdAve1L2缺失突变体时,与含有水处理群落的植物相比,万古霉素处理微生物群的番茄植株的发育迟缓,且VdAve1L2缺失突变体的定植显着增加(图6)。以上结果表明,番茄根部微生物群中的放线菌可以拮抗大丽轮枝菌在寄主植物中的侵染定植,而大丽轮枝菌利用VdAve1L2反过来抑制放线菌并促进植物感病。
图5 VdAve1L2对番茄根系微生物群放线菌的影响(Snelders et al., 2023)。(a)VdAve1L2是一种抗菌效应蛋白。枯草芽孢杆菌的体外生长被VdAve1L2抑制。抗菌效应物VdAve1作为阳性对照,超纯水(MQ)作为阴性对照;(b)通过16S核糖体DNA测定接种大丽轮枝菌野生型菌株DVD-S26、相应的DVD-S26 VdAve1L2缺失突变体、大丽花黄萎病菌株JR2 VdAve1缺失突变体和相应的VdAve1L2过表达菌株10天后,番茄根系微生物群细菌门的相对丰度;(c)大丽轮枝菌的定植不产生影响番茄根系微生物群的多样性;(d)基于Bray-Curtis差异的主坐标分析揭示了基于VdAve1L2存在的根微生物组组成的分离;(e)放线菌是唯一在分泌VdAve1L2的V. dahliae菌株定殖的微生物群中被显著抑制的门。
图6 用万古霉素处理番茄根系微生物群可降低VdAve1L2的毒力贡献(Snelders et al., 2023)。(a)接种后19天,万古霉素处理或水处理的番茄植株的表型,这些微生物群落感染了DVD-S26和VdAve1L2缺失突变体;(b)实时荧光定量PCR测定番茄茎组织中大丽轮枝菌的相对生物量;(c)基于Bray-Curtis差异的主坐标分析揭示了水处理过的番茄植株根系微生物群组成的分离,而万古霉素处理过的大丽轮枝菌菌株和模拟处理后的微生物群落则没有分离;(d)与VdAve1L2缺失突变体定殖相比,含有水处理微生物群落的番茄植株中消耗的三种放线菌属的相对丰度。
植物微生物组导致植物感病
在常驻微生物群落中,某些成员也可能是潜在植物病原菌,随着它们在宿主植物中相对丰度的增加或改变,可能会引发或加剧病害的严重程度。造成上述现象的原因主要分为:1)宿主植物失去调节微生物群的能力,导致菌群失调,最终潜在的病原微生物就会引起植物病害(Lv et al., 2023);2)条件性共生的微生物在某些情况下会转变称为成潜在的病原菌,导致植物病害的发生。这种转变通常与环境压力、植物免疫系统的抑制或根部损伤等因素有关。当植物处于逆境时,有益微生物的平衡被打破,它们可能过度繁殖或失去原有的抑制作用,从而表现出病原特性。
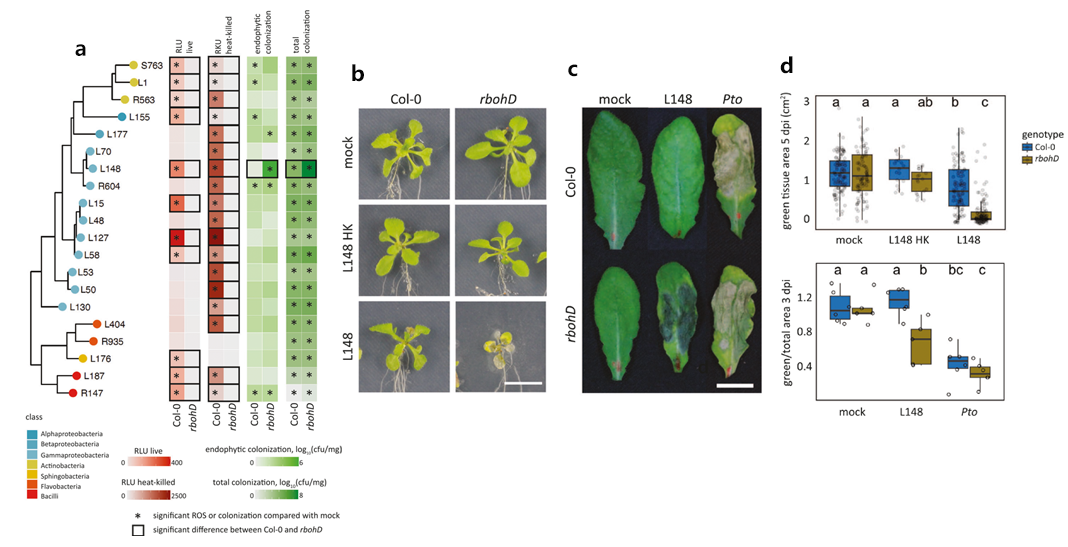
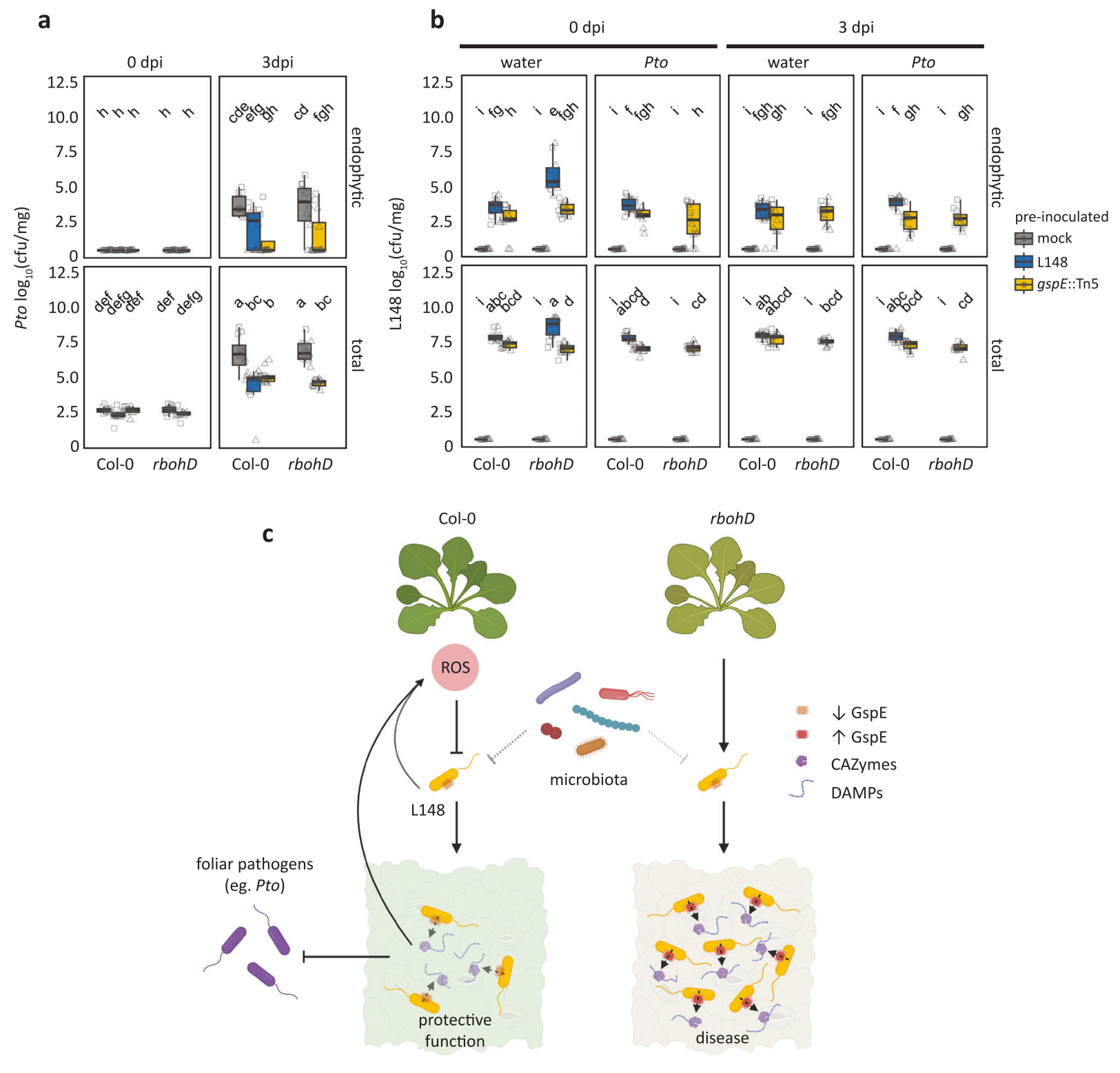
植物通过RBOHD(一种NADPH氧化酶)产生的活性氧(ROS)可以影响共生菌的定植,ROS不仅调节对病原体的抵抗力,还调节植物微生物群的组成和功能(Bolwell et al., 2009)。2024年1月,华中农业大学Kenichi Tsuda课题组在Nature Communications杂志上发表了一篇题为“Commensal lifestyle regulated by a negative feedback loop between Arabidopsis ROS and the bacterial T2SS”的研究论文。在该研究论文中,作者从健康的拟南芥植物中分离的共生菌可以触发依赖RBOHD介导的ROS的产生,拟南芥rbohD缺失突变体植株中黄单胞菌L148的总定殖量和内生定植量均显著增加,且黄单胞菌L148仅引起rbohD缺失突变体植株病害,这表明RBOHD介导的ROS抑制了黄单胞菌L148的定殖与其潜在的致病能力(图7)。
图7 rbohD介导的ROS抑制了黄单胞菌L148的定殖与其潜在的致病能力(Entila et al., 2024)。(a)选择的微生物群成员的系统发育关系及其对应的ROS爆发谱的热图表示,以及它们各自在Col-0和rbohD缺失突变体植株叶片中的定殖能力;*表示模拟物与该菌株的性状在基因型内存在显著差异;□表示Col-0和rbohD缺失突变体植株的性状在种内差异显著;(b-d)黄单胞菌L148、pto的致病性(b、c)和绿色组织面积定量(d)。
为了解释黄单胞菌L148潜在致病能力的遗传基础,作者开发了一种基于全基因组突变体的高通量筛选方案,创制并验证了黄单胞菌L148::Tn5突变文库,进一步筛选分发现编码II型分泌系统(T2SS)的gspE是黄单胞菌L148引起rbohD缺失突变植株病害必需的。随后作者分析了拟南芥野生型(Col-0)和rbohD缺失突变体植株处于水淹条件下的叶片植物细菌转录组,分析数据表明表明RBOHD抑制T2SS基因的表达,包括gspE(图8)。以上结果表明条件性共生黄单胞菌L148的潜在致病性受到RBOHD介导的ROS的调控,只要黄单胞菌的T2SS受到ROS或者其他微生物成员的控制,它就是一种有益的细菌,可以促进拟南芥对病原体的抵抗力,反之就会导致拟南芥发生病害(图9)。
图8 植物RBOHD抑制T2SS基因的表达,包括黄单胞菌L148的gspE(Entila et al., 2024)。(a)Col-0和rbohD缺失突变体植株中黄单胞菌L148的植物细菌转录组的热图;(b)Col-0和rbohD缺失突变体植株中黄单胞菌L148转录组的主成分分析;(c)CAZymes和T2SS组成基因的DEGs的火山图;(d)T2SS基因的基因组结构;(e)T2SS组件的图形表示;(f)a中基因簇(以数字表示)的 KEGG 通路富集分析;(g)RNA-Seq标准化了gspE、alaA和rpfF的计数;(h)qRT-PCR实验检测gspE、alaA和rpfF的表达量;(i)黄单胞菌L148野生型菌株在TSB±10 μM PQ中培养24 h后gspE、alaA和rpfF的qRT-PCR表达谱分析。