本文内容速览:
植物遗传转化是指通过物理、化学或生物方法将目的基因转移到植物体内整合、表达并稳定遗传,使受体植物表现出目的基因所调控的性状。在植物基因功能研究中,该技术常被用于研究目的基因在植物体内的功能。然而,目前大多数的植物遗传转化方法存在操作复杂、基因型限制、再生困难以及转化效率低等问题。因此,对许多物种来说,快速高效且不依赖于植物基因型的转化和再生仍然是一个挑战。近些年,科研工作者也在不断地开发和优化新的遗传转化方法,接下来就跟着小远一起看看近几年发表的一些高效遗传转化方法吧。
GiFT
大豆是重要的粮油作物之一,也是人类植物性蛋白和油脂的重要来源。随着世界人口的不断增加,大豆的消费需求逐年上升。通过遗传转化技术对大豆的性状进行改良,可以提高大豆优良新品种的育种效率,为大豆生产提供更多的选择。近些年,虽然科研工作者不断优化大豆的遗传转化体系,但是在大豆中实现快速、高效且不依赖于基因型的转化仍存在挑战。
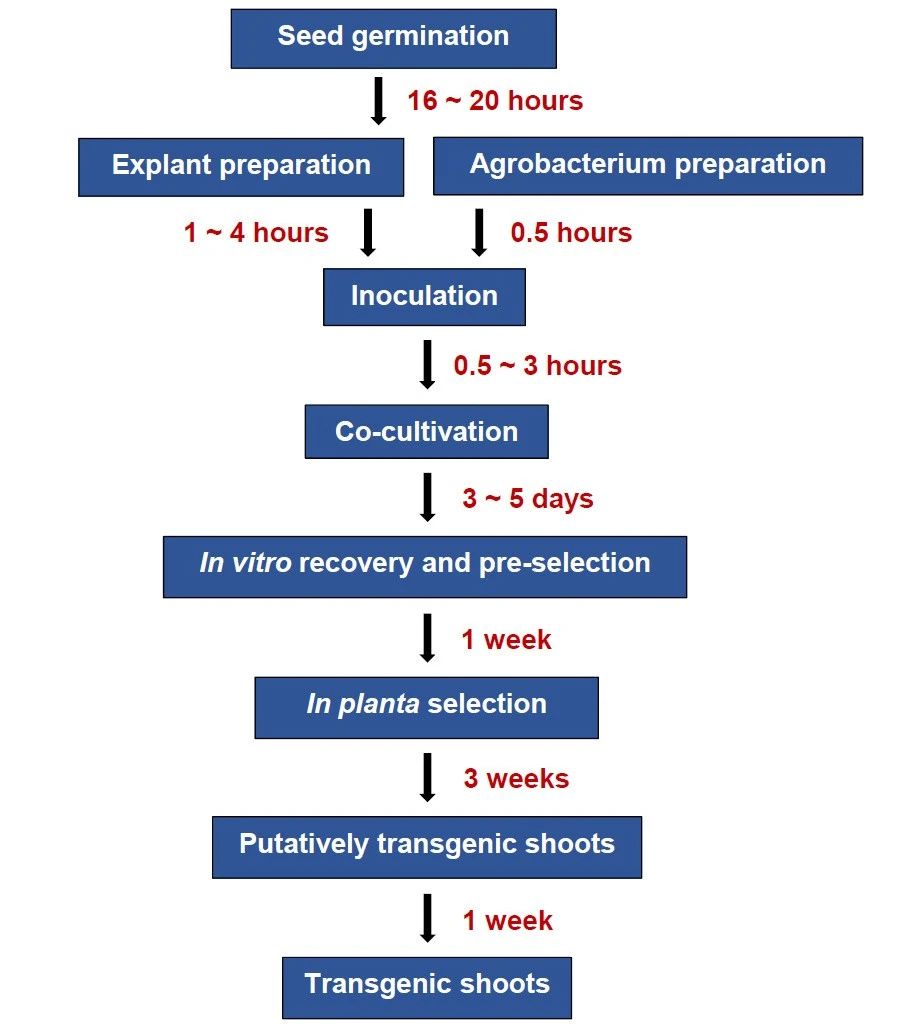
2024年8月,先正达集团的钟衡、李常宝团队在Plant Communications杂志上发表了一篇题为“A fast and genotype-independent in planta Agrobacterium-mediated transformation method for soybean”的研究论文,该研究开发了一种快速、高通量且不依赖基因型的大豆转化方法GiFT(Genotype-independent Fast Transformation)。该方法是以萌发的种子作为外植体,利用45KHz的超声进行损伤处理后,将损伤的外植体与农杆菌悬浮液孵育约30分钟,然后将外植体正面朝上置于培养皿中,在23℃的密闭容器中暗培养3-5天。随后,将外植体放在液体培养基中进行约1周的恢复培养和预筛后,移栽到土壤中种植,在种植期间用除草剂对大豆幼苗进行3周的筛选,并结合检测结果从而获得转基因阳性苗(图1D-P、图2)。

RAPID
针对具有强再生能力及无性繁殖的植物来说,开发不依赖组织培养的遗传转化方法有助于实现更多难以进行组织培养的经济作物和特色植物的性状改良。2024年4月,中国科学院华南植物园侯兴亮课题组在Plant Communications杂志上发表了一篇题为“A simple and efficient in planta transformation method based on the active regeneration capacity of plants”的研究论文。该研究报道了一种以植物主动再生能力为基础的快速、高效的遗传转化方法RAPID(Regenerative Activity-dependent in Planta Injection Delivery),并成功地在甘薯、马铃薯和厚藤中得到应用。
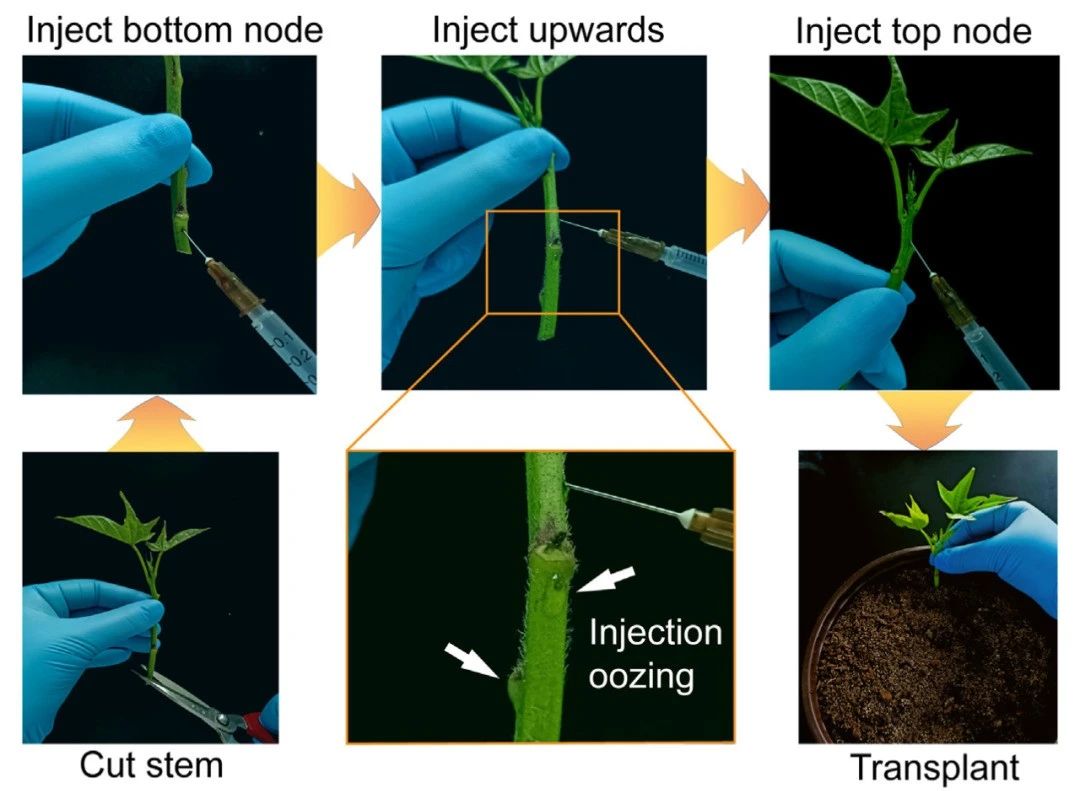
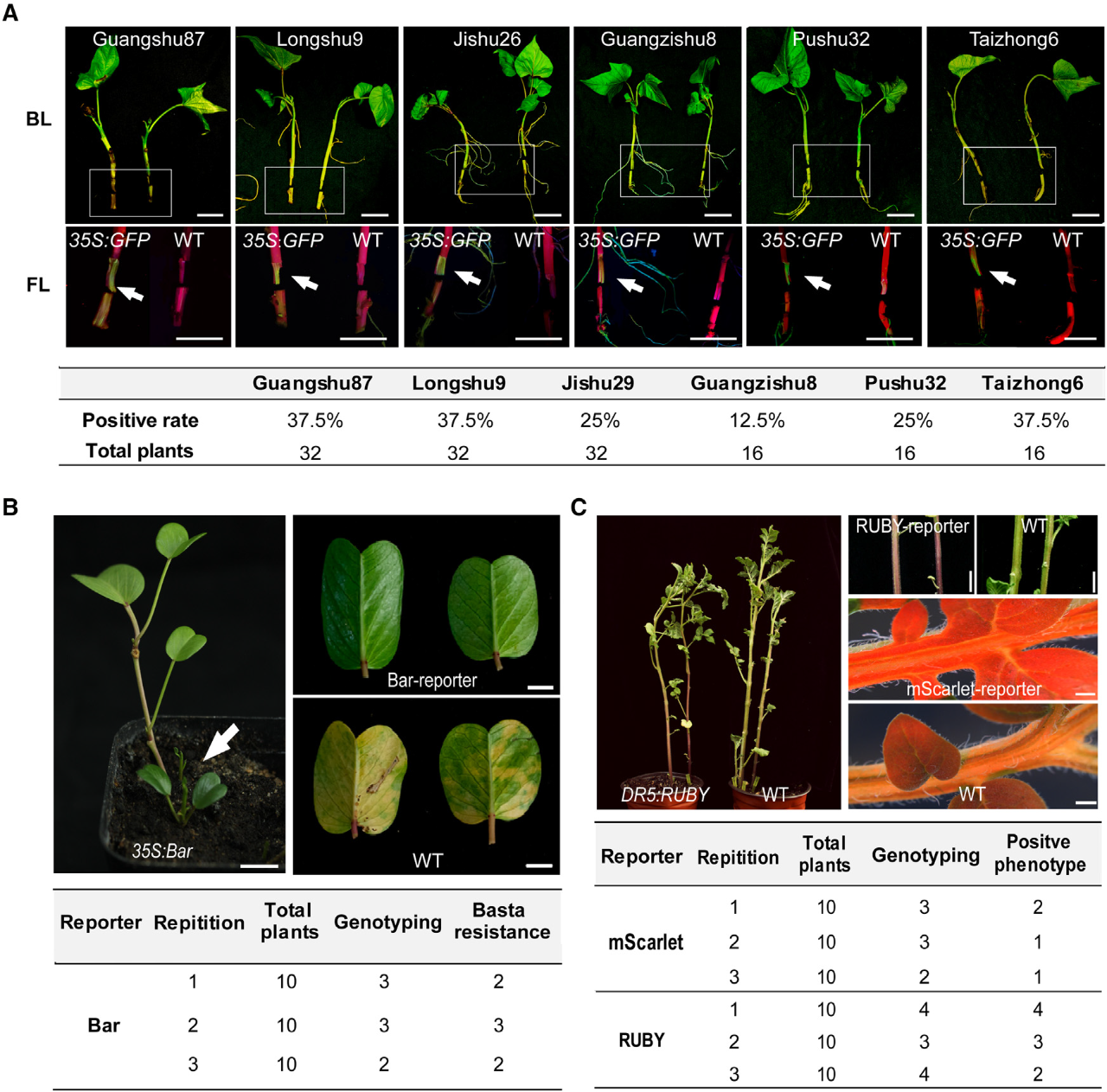
在该论文中,作者首先以甘薯为测试对象进行遗传转化体系的开发。将带有节点的甘薯茎切下,用注射器将含有GUS报告基因载体的农杆菌注射到节点处,注射完毕后直接将甘薯茎种植在土壤中(图3)。待甘薯茎长出不定根后,利用GUS报告基因可以快速检测出阳性根。通过对阳性侧芽和阳性块茎上发的芽进行培养则可以获得独立的转基因植株(图4C)。此外,作者还检测了转基因植株的T-DNA插入位点,确定获得的植株是独立的转化株系。这些结果表明利用甘薯的主动再生能力建立高效的遗传转化体系是可行的。
图3 甘薯高效遗传转化流程(Mei et al., 2024)。
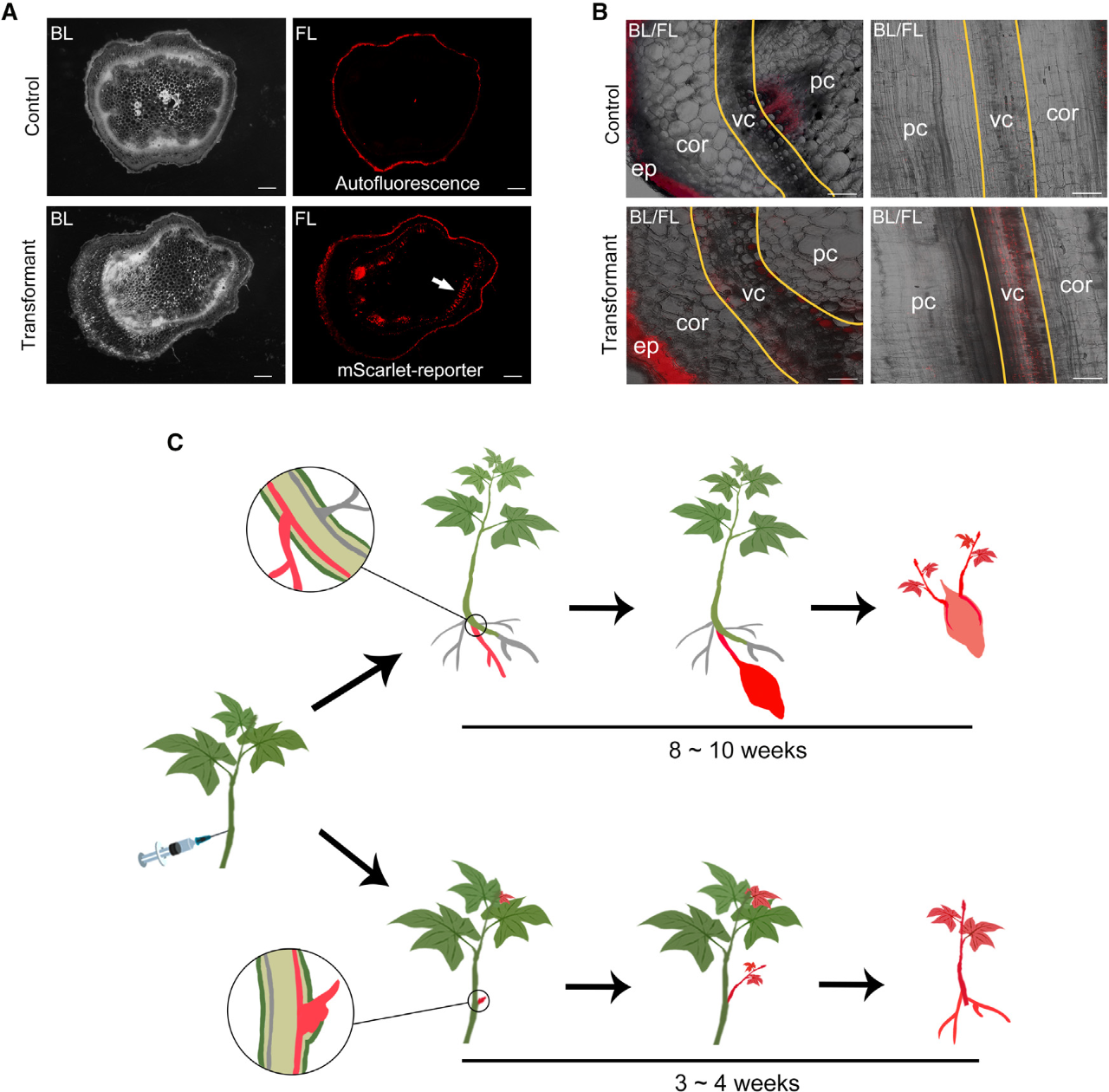
接下来,作者对转化体系进行了优化,首先是筛选合适的农杆菌,通过比较不同农杆菌的转化效率,发现根癌农杆菌AGL1最适用于甘薯转化,且OD值为0.5时转化效率最高。其次是比较了不同浓度组合的乙酰丁香酮和Silwet-L77对转化的影响,结果显示当添加100µM的乙酰丁香酮和0.02%的Silwet-L77时,甘薯的转化效率最高。此外,作者通过测试发现mScarlet荧光报告基因和RUBY报告系统都可以用于RAPID转化体系,并且基因编辑载体也可以利用该转化体系进行递送。随后,作者使用mScarlet报告基因分析了转化后的甘薯茎段,结果表明RAPID是通过诱导分生组织细胞转化来产生阳性再生植株(图4)。为了进一步证明RAPID方法的适用性,作者在不同品种的甘薯以及马铃薯、厚藤中做了测试,结果显示均可以获得转基因植株(图5)。
RBS
相比于大多数模式植物和作物来说,因为缺乏高效的遗传转化体系,果树领域的研究受到了很大的限制。2024年2月,山东农业大学张世忠课题组在Plant Biotechnology Journal杂志上发表了一篇题为“An efficient genetic transformation system mediated by Rhizobium rhizogenes in fruit trees based on the transgenic hairy root to shoot conversion”的研究论文。该研究以木本果树为对象,开发了一种由发根农杆菌介导的高效遗传转化方法RBS(Root-borne Shoot),为果树的分子育种提供了技术支持。
在该研究中,作者首先以苹果的叶片和茎作为外植体,利用发根农杆菌进行侵染获得了转基因毛根,并进一步发现,靠近枝条顶端的新叶具有更高的遗传转化效率。接着,为了诱导转基因毛根再生出转基因芽,作者以转基因毛根作为外植体,开发了转基因毛根到芽的转化体系(图6)。并测试了植物激素对愈伤诱导和芽诱导的最佳浓度,最终确定在愈伤组织诱导培养基(CIM)中添加的最适激素为0.8mg/L的IAA和0.1mg/L的6-BA,在芽诱导培养基(SIM)中添加的最适激素为0.08mg/L的IAA和0.1mg/L的TDZ。
为了提高转基因毛根的芽再生效率,作者利用雌二醇诱导型启动子测试了多个干细胞活性调控基因对毛根的芽再生效率的影响。结果显示,利用雌二醇诱导MdWOX5的表达能够非常显著地提高转基因毛根的芽再生效率(图7)。另外,作者在毛根中过表达RUBY和根生长调节因子MdRGF5后均获得了相应表型的转基因植株,这进一步证实了RBS方法具有一定的应用价值。最后,为了检验该方法是否适用于其它果树,作者在猕猴桃中做了测试,结果表明可以成功地获得GFP过表达的转基因植株(图8)。
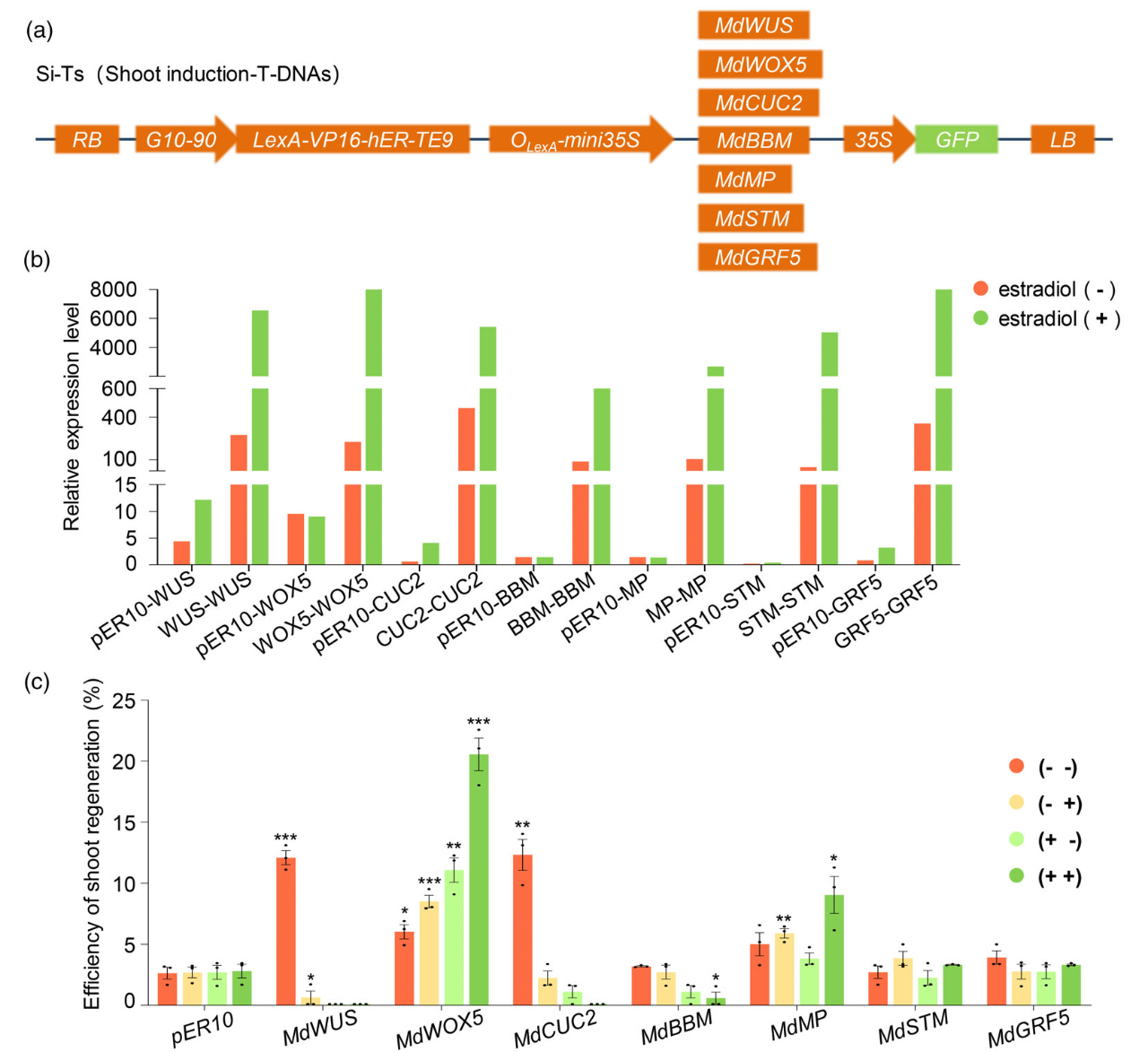
图7 干细胞活性调控基因可以提高转基因毛根的芽再生效率(Liu et al., 2024)。(a)pER10载体构建示意图;(b)用50mM的雌二醇处理48h后毛状根中各个干细胞活性调控基因的表达水平,pER10-WUS表示空载转基因毛根中MdWUS基因的表达水平,WUS-WUS表示转基因阳性毛根中MdWUS基因的表达水平;(c)在雌二醇诱导型启动子驱动下表达的各个干细胞活性调控基因对毛根的芽再生效率的影响,括号中第一个符号表示CIM中是否添加雌二醇,第二个符号表示SIM中是否添加雌二醇,加号表示培养基中添加了雌二醇,减号表示未添加雌二醇。
在先前的推文“听说遗传转化不需要愈伤组织?”中,小远给大家介绍过南方科技大学朱健康课题组开发的CDB递送系统,该系统针对具有根蘖能力的植物,利用发根农杆菌侵染切割后的根茎交界部位,诱导该部位产生转化根,继而再由转化根产生转基因植株(Cao et al., 2022)。CDB递送系统自开发以来已经陆续在橡胶草、甘薯、丹参、远志、长寿花、玉树和虎尾兰等植物中进行测试并获得了转基因植株。在该系统中,毛根的诱导和培养是主要的限速步骤,如果能够简化毛根的培养过程,将极大的简化CDB的技术流程。
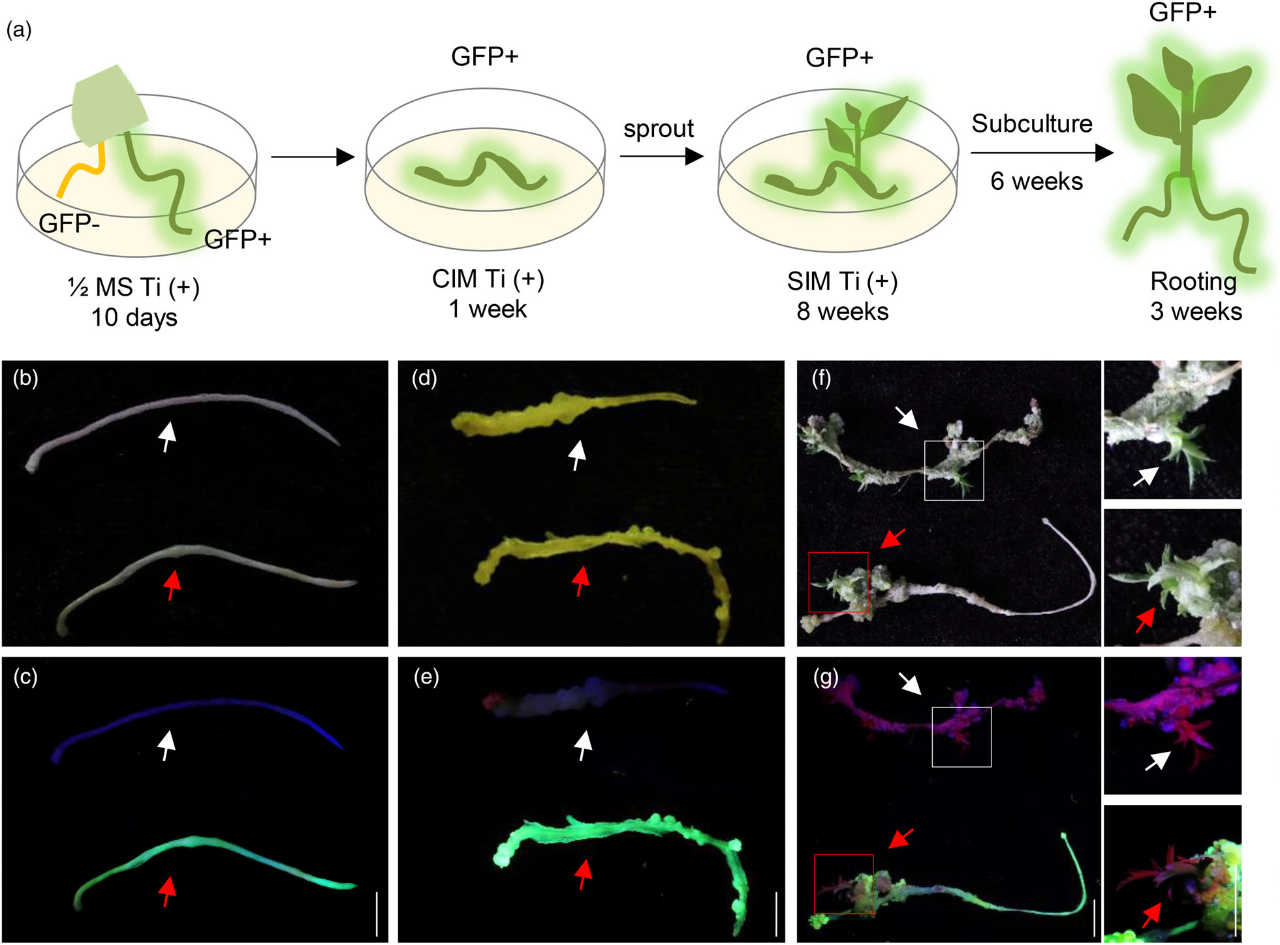
2023年11月,南方科技大学朱健康课题组在The Innovation Life杂志上发表了一篇题为“Extremely simplified cut-dip-budding method for genetic transformation and gene editing in Taraxacum kok-saghyz”的研究论文。该研究通过优化CDB系统,开发出了无需毛根诱导和培养的橡胶草基因编辑递送方法ES-CDB(Extremely simplified Cut-dip-budding)。在该论文中,作者基于橡胶草根部具有芽再生能力这一特点,先将橡胶草的根切成2-3厘米的根段,并在两侧的伤口上涂抹农杆菌,然后将农杆菌包被的根段置于潮湿的蛭石表面,经过大约两周的培养,橡胶草根段上会再生出新芽,并逐渐长成完整的植株(图9A)。接着,作者使用不同的根癌农杆菌(AGL1、GV3101、EHA105、LBA4404)和不同的发根农杆菌(MSU440、Ar 1193、C58C1、Ar Qual、K599)对ES-CDB递送方法进行了测试,结果显示,发根农杆菌K599的转化效率最高(图9C)。
为了进一步验证该方法在基因编辑方面的应用,作者设计并构建了一个靶向TKPDS基因的编辑载体,之后将携带此载体的K599菌株涂抹在橡胶草根段两端的切口处,经过培养,从再生的芽中可以观察到白化芽,作者结合测序结果进一步明确了白化芽的编辑情况及编辑效率。利用该方法在其它三种橡胶草品种中同样也获得了基因编辑材料(图9E-J)。最后,作者进一步简化了ES-CDB方法的操作流程,将切割后的根段直接浸泡在农杆菌菌液中30分钟,然后放置在潮湿的蛭石上培养,同样可以获得基因编辑植株(图9K)。
由于棉花转化的基因型依赖性,使得许多优良品种的遗传改良受到了限制。因此,开发无基因型限制的棉花高效遗传转化体系,有助于加速棉花研究领域的发展。
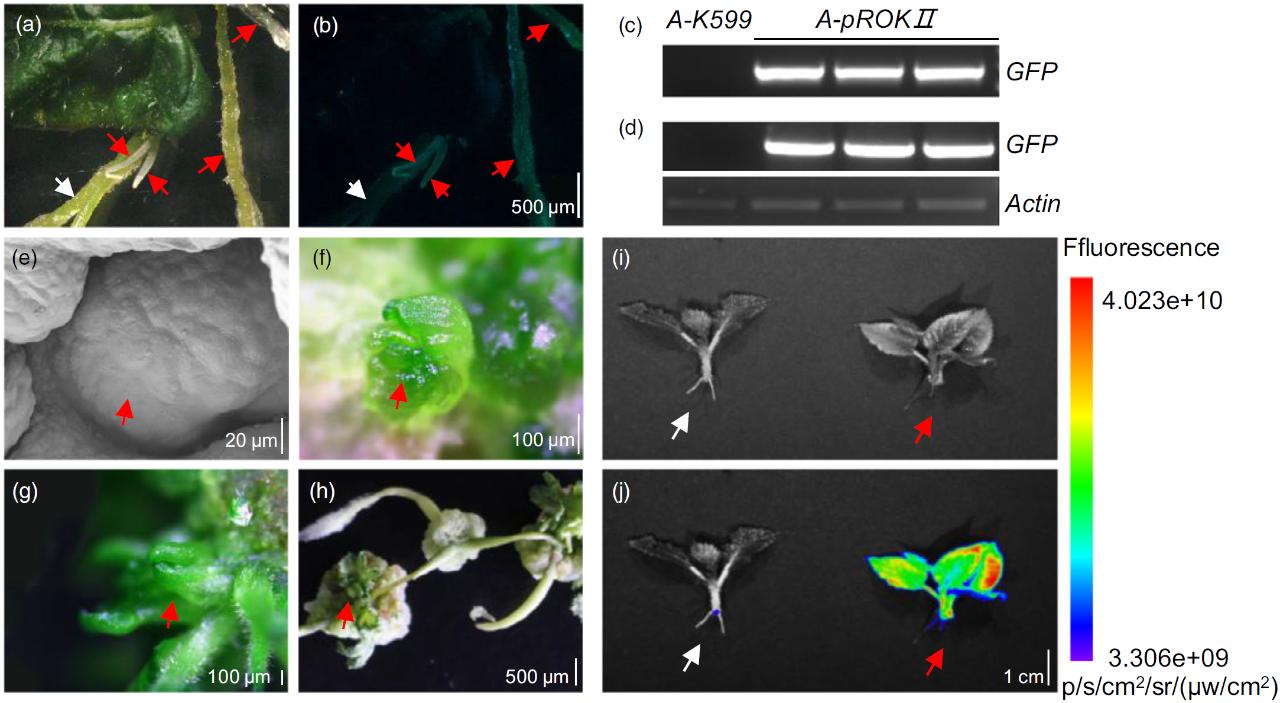
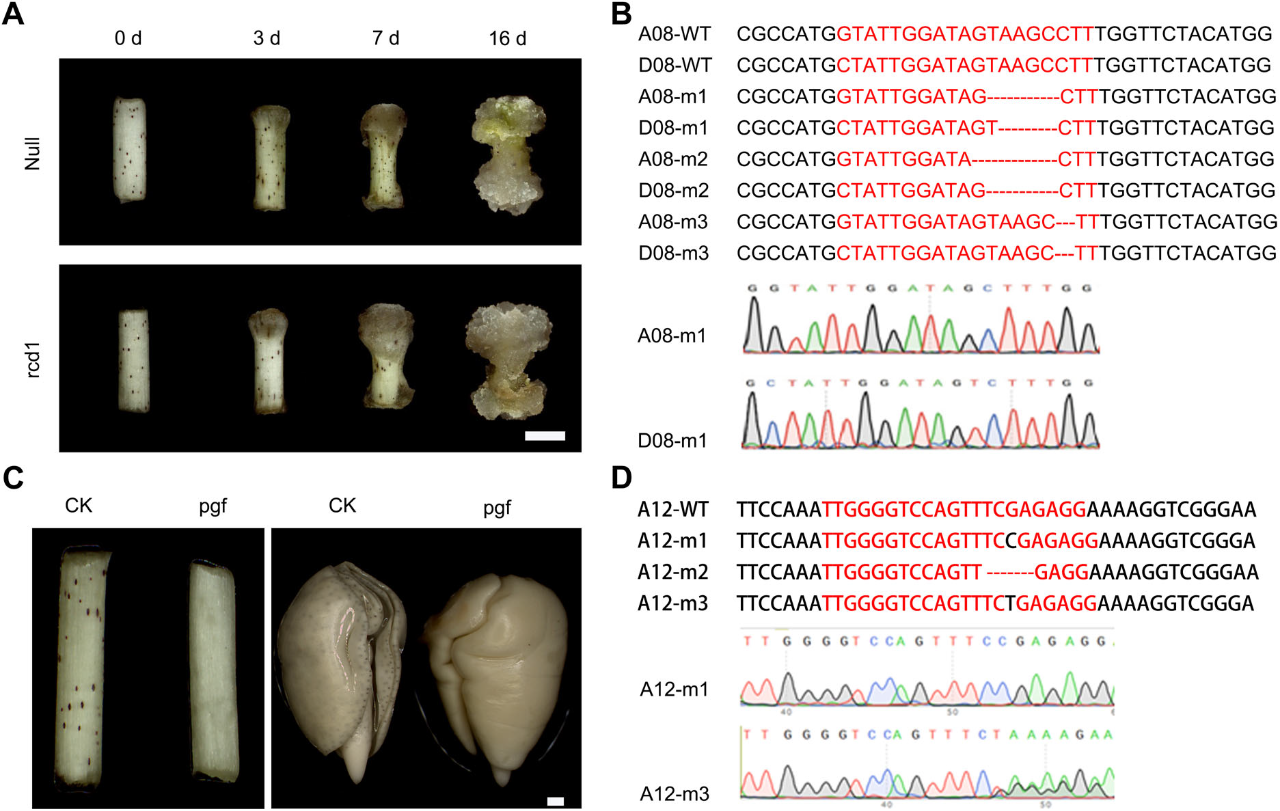
2022年12月,中国农业科学院李付广课题组在Journal of Integrative Plant Biology杂志上发表了一篇题为“Efficient genotype-independent cotton genetic transformation and genome editing”的研究论文。该研究开发了一种茎尖分生组织细胞介导的转化方法SAMT(Shoot apical meristem cell-mediated transformation),可以快速有效地转化各种抗逆性棉花,为加速棉花育种进程提供了技术支持。在该论文中,作者以难转化品种CCRI 49的茎尖分生组织作为外植体,利用农杆菌将外源基因转入分生区细胞中,进而诱导细胞产生不定芽并生长为完整植株(图10A)。与传统的棉花遗传转化方法相比,SAMT方法的转化周期可缩短至2-3个月(图10D)。
随后,作者在几种抗逆性棉花品种中测试了该方法的可行性,结果显示所有测试的棉花品种均可通过SAMT方法获得转基因植株,这表明该方法可以克服棉花转化中的基因型依赖性。为了探究SAMT方法在棉花基因编辑中的应用效果,作者将参与棉花愈伤组织增殖的基因GhRCD1和调控腺体发育的基因GhPGF分别作为靶基因,通过转化茎尖分生组织,成功的获得了对应的编辑植株(图11)。此外,作者还检测了过表达和基因编辑植株的遗传能力,结果显示所检测的植株中只有少量过表达株系是嵌合体。综上,SAMT作为一种可靠的遗传转化方法,为棉花基因功能研究提供了有效的技术支持。
图10 棉花SAMT方法的开发(Ge et al., 2022)。(A)SAMT转化流程示意图;(B)利用SAMT方法获得转基因植株的案例图;(C)转基因植株叶片、胚珠、花药和根中的GFP信号;(D)棉花SAMT和体细胞胚胎发生(SE)两种遗传转化方法的周期比较。
文章至此就告一段落了!在本次的推文中,小远主要和大家分享了几种快速、高效的遗传转化方法,这些方法不仅缩短了植物遗传转化的周期还克服了基因型依赖性,使更多的品种能够通过遗传转化来进行基因功能研究。最后,再浅浅插播一条广告,我司目前可以为大家提供大豆、马铃薯、棉花等二十九大物种的遗传转化服务,有需要的小伙伴可以查询我司官网biorun.com或致电400-027-0273详询哦!
References:
Cao X, Xie H, Song M, et al. Cut-dip-budding delivery system enables genetic modifications in plants without tissue culture. The Innovation, 2022, 4(1):100345.
Cao X, Xie H, Song M, et al. Extremely simplified cut-dip-budding method for genetic transformation and gene editing in Taraxacum kok-saghyz. The Innovation Life, 2023, 1(3): 100040.
Ge X, Xu J, Yang Z, et al. Efficient genotype-independent cotton genetic transformation and genome editing. Journal of Integrative Plant Biology, 2022.
Liu L, Qu J, Wang C, et al. An efficient genetic transformation system mediated by Rhizobium rhizogenes in fruit trees based on the transgenic hairy root to shoot conversion. Plant Biotechnology Journal, 2024, 22(8):2093-2103.
Mei G, Chen A, Wang Y, et al. A simple and efficient in planta transformation method based on the active regeneration capacity of plants. Plant Communications, 2024, 5(4).
Zhong H, Li C, Yu W, et al. A fast and genotype-independent in planta Agrobacterium-mediated transformation method for soybean. Plant Communications, 2024.
图文来源:伯远生物公众号