本文内容速览:
伯小远在“辣”这篇文章中曾提到过,辣椒素能与哺乳动物体内的TRPV1的热感受体结合,产生类似疼痛和灼烧的感觉。实际上,TRPV1隶属于瞬时受体电位(Transient Receptor Potential,TRP)离子通道蛋白家族,该家族是动物的温度感知受体。1997年,加州大学的David Julius教授在研究辣椒素对痛觉神经元的影响时发现了TRPV1受体。随后,TRP其他家族成员也逐步被发现。David Julius教授因首次发现动物温度受体的贡献而获得了2021年诺贝尔生理学或医学奖。
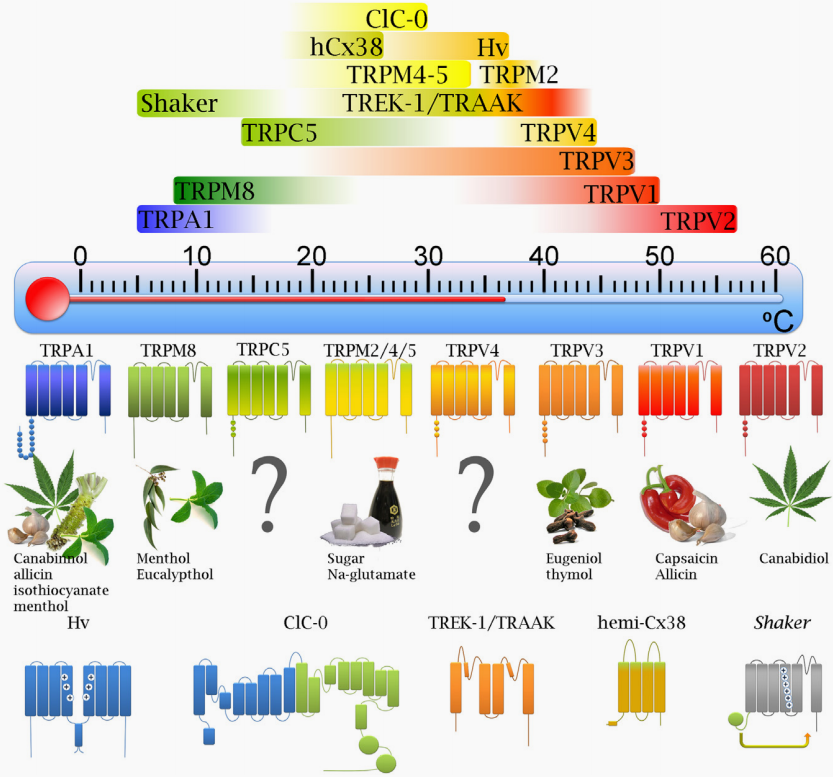
图1 感知不同温度的TRPs和其他离子通道(Baez et al., 2014)。
植物是固着生物,不断地受到温度等环境因子的影响,目前在植物中并未发现TRP的同源物,那植物是如何感知温度信号的呢?先说说目前的结果:近十几年科学家们发现了一些潜在的植物热感应器,但尚未确定能够将温度信息传递给多种途径的主感应器。
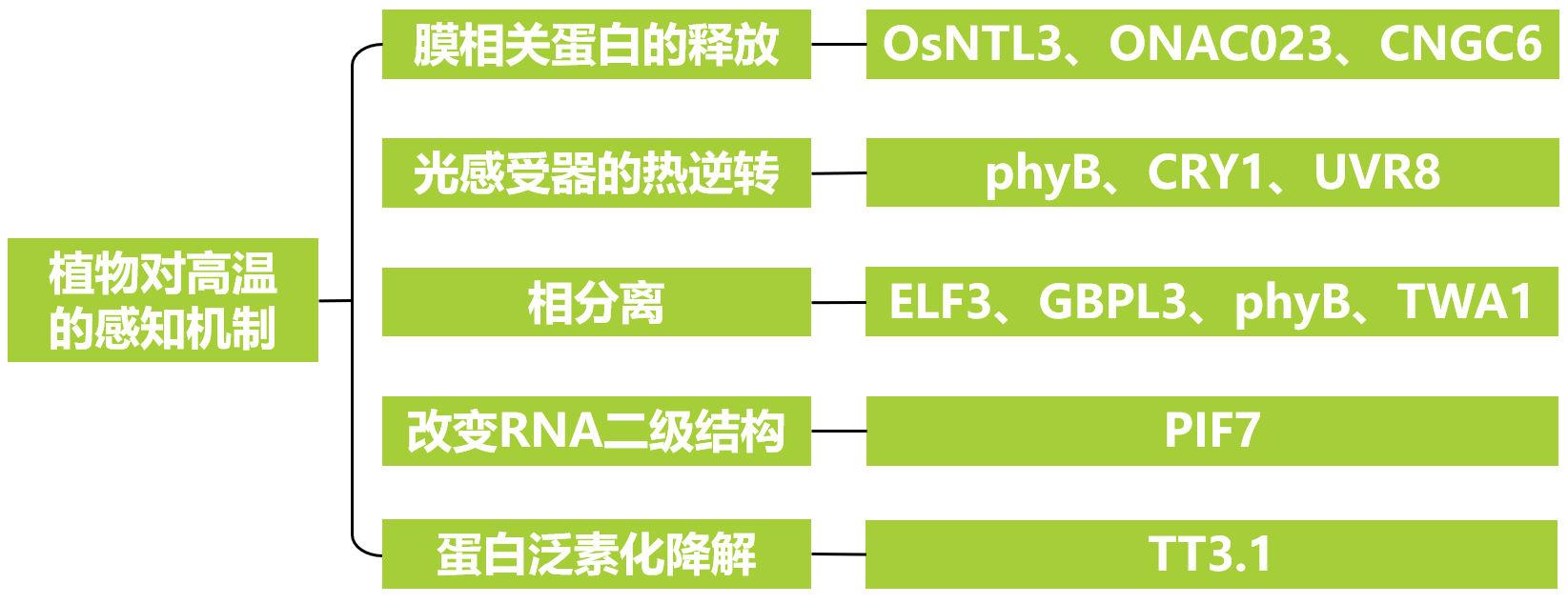
表1 潜在的植物热感应器(改编自Jung et al., 2023)。
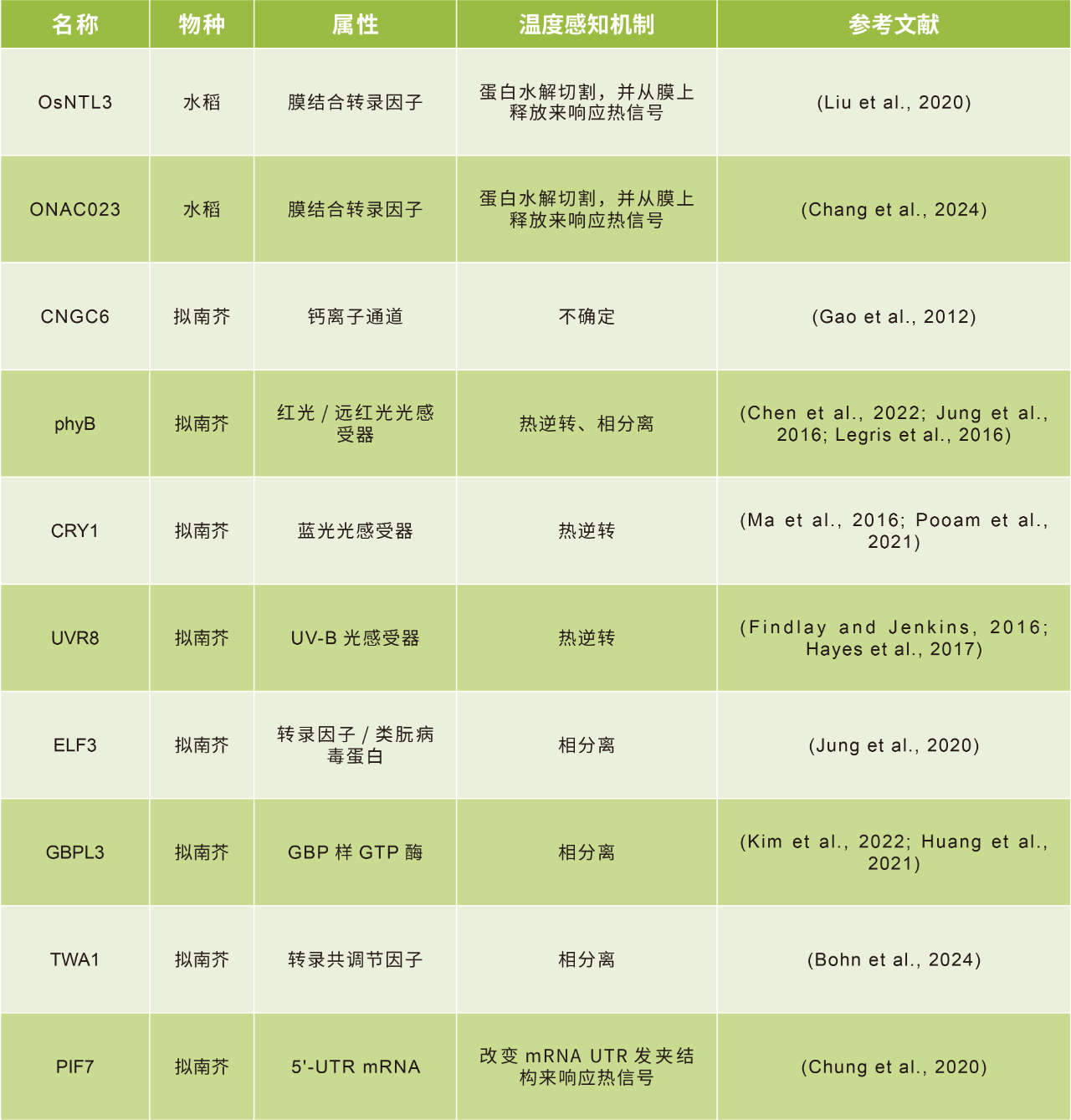
备注:高温条件下蛋白从其活性状态自发转化回非活性状态的过程称为热逆转(thermal reversion)。
从表1可以看出,植物对高温的感知机制涉及膜相关蛋白的释放、光感受器的热逆转、相分离、改变RNA二级结构、蛋白泛素化降解等方面,下面和伯小远具体了解一下吧。
膜相关蛋白的释放
2020年,复旦大学/浙江大学刘建祥联合复旦大学陆孙杰团队在Plant Biotechnology Journal杂志上发表了一篇题为“A membrane-associated NAC transcription factor OsNTL3 is involved in thermotolerance in rice”的研究论文,该研究表明热胁迫会引起NAC转录因子基因OsNTL3的表达上调、会使OsNTL3从质膜迁移至细胞核,并且ntl3突变体对高温胁迫敏感,而无跨膜结构域的OsNTL3截短蛋白(OsNTL3ΔC)的表达可提高水稻幼苗的耐热性。总之,该研究揭示了OsNTL3在水稻耐热性中的重要作用。
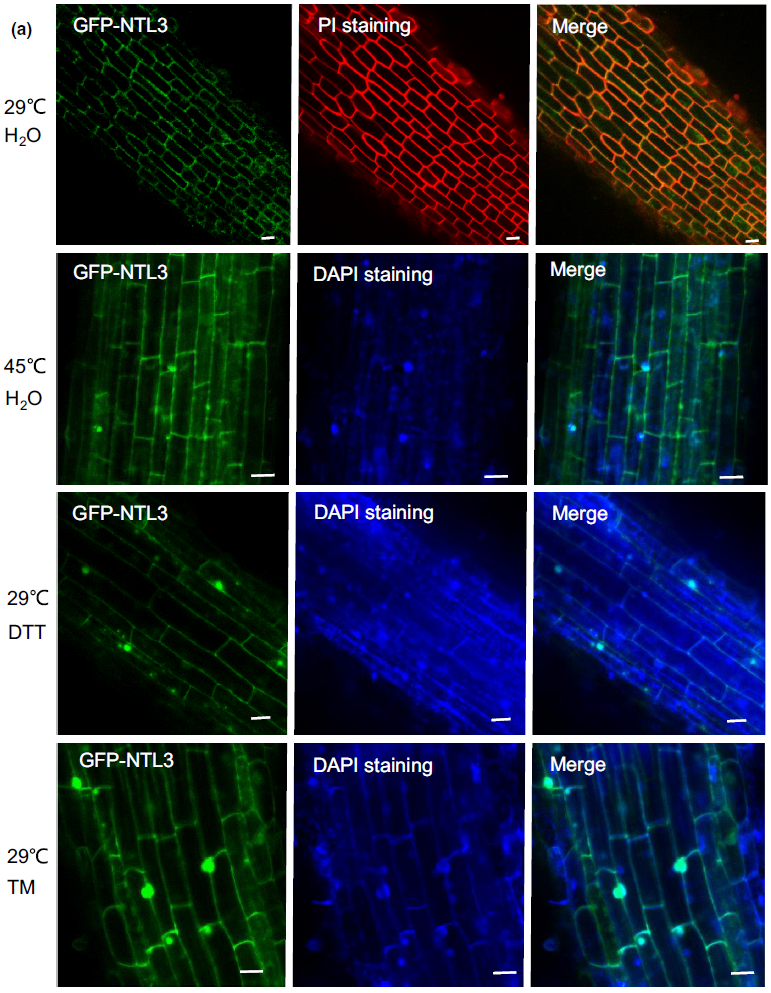
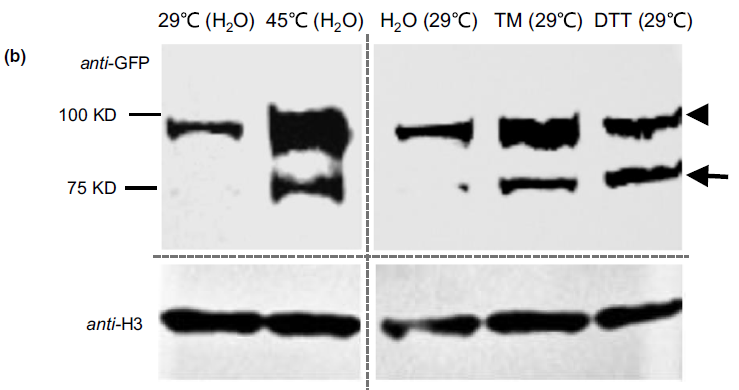
图2 OsNTL3的亚细胞定位(Liu et al., 2020)。在正常温度下,大部分的GFP-NTL3信号出现在根尖的细胞边界上;发生热胁迫或内质网胁迫(指由于各种原因导致内质网功能障碍,图中使用DTT或TM试剂处理可模仿该状态)后,GFP-NTL3信号会出现在细胞核中,WB检测显示当受到热胁迫或内质网胁迫后,部分OsNTL3蛋白会被重加工,并重新定位至细胞核。

图3 过表达OsNTL3ΔC可提高水稻幼苗的耐热性(Liu et al., 2020)。
2024年,华中农业大学熊立仲团队联合扬州大学方玉洁团队在Nature Communicaitons杂志上发表了一篇题为“Stress-induced nuclear translocation of ONAC023 improves drought and heat tolerance through multiple processes in rice”的研究论文,该研究表明ONAC023正调控水稻苗期和生殖期的耐旱性和耐热性。在干旱/热胁迫下,ONAC023从细胞质膜迁移到细胞核中,但引起这种重定位的原因先前并未解析,而该研究发现干旱/热胁迫可以诱导Remorin家族蛋白OSREM1.5发生去磷酸化,去磷酸化的OSREM1.5与核转运受体Importin-α相互作用进而促进了ONAC023的质膜-核迁移,当ONAC023入核后,可以靶向参与水分运输、活性氧(ROS)稳态和选择性剪接有关的多种基因,进而调控水稻对干旱和高温的多层胁迫反应。
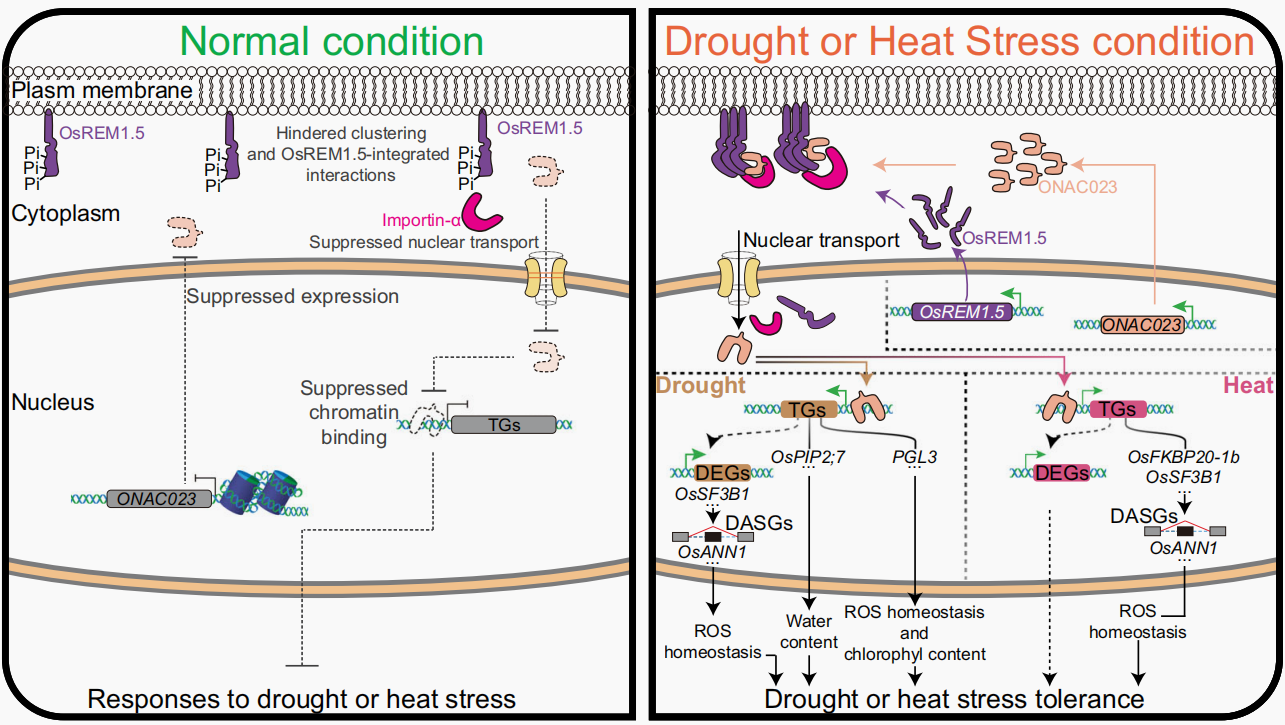
图4 ONAC023赋予水稻耐旱性和耐热性的工作模型(Chang et al., 2024)。
定位于细胞质膜的各种离子通道蛋白在动物体内起温度感应器的作用(图1),在植物中是否也存在类似的现象呢?研究发现,发生轻度热胁迫时,环磷酸腺苷(cAMP)水平升高,环核苷酸门控钙离子通道6(CNGC6)被cAMP激活,介导钙离子内流,增加热休克蛋白(HSP)相关基因的表达,从而提高了植物的耐热性(Gao et al., 2012)。同时,CNGC家族的某些其他成员也被发现存在类似现象,因此CNGC家族被认为是一种潜在的植物热感应器。但也有人据此提出,温度感应器是否是具有腺苷酸环化酶(简称AC,可将ATP转变为cAMP)活性的蛋白,而不是钙离子通道本身呢?目前,也确实有报道表明腺苷酸环化酶ZmRPP13-LK3是热胁迫诱导cAMP合成和HSP表达所必需的(Yang et al., 2021)。
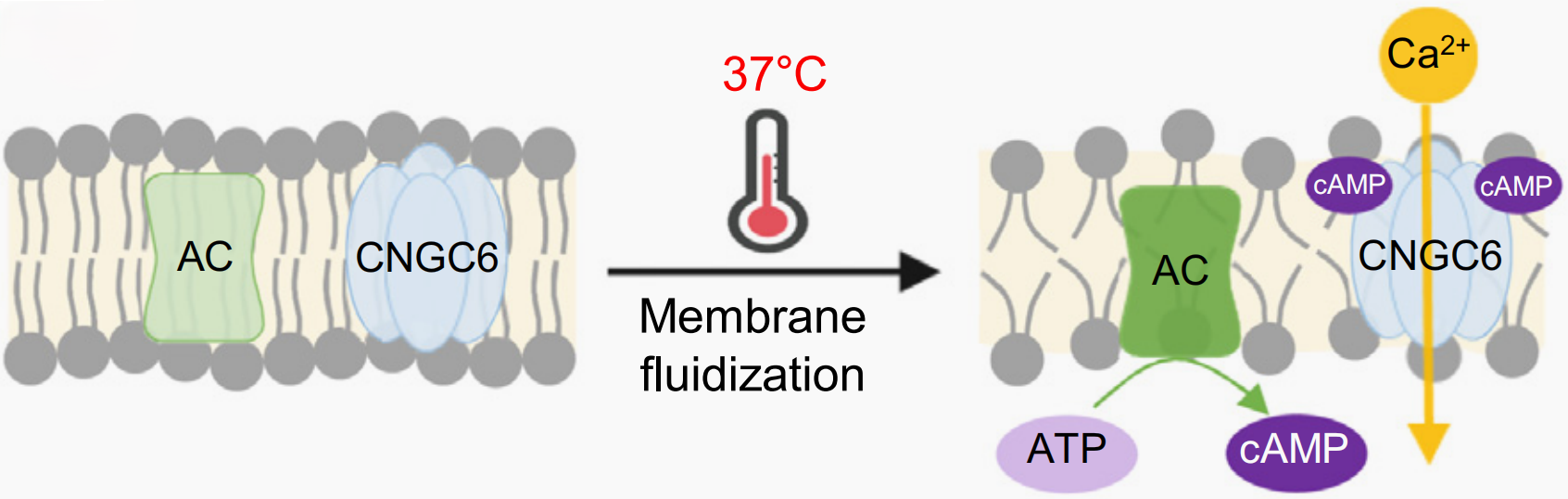
图5 高温下CNGC6通道蛋白的激活模型(Jung et al., 2023)。
光感受器的热逆转
除了上述的膜相关蛋白,光感受器也参与了植物对高温的感知。植物中的光感受器包括:主要负责感知红光、远红光的光敏色素(phy),主要负责感知蓝光的隐花素(CRYs)、向光素(PHOTs),主要负责感知紫外线B(UV-B)的抗紫外线位点8(UVRB)。其中,与感知高温有关的光感受器主要是phyB、CRYs和UVRB。
在5种光敏色素phyA~phyE中,phyB是植物在光照下生长时最丰富的光敏色素。phyB可在两个光可逆构象Pr(红光吸收态)和Pfr(远红光吸收态)之间切换:没有红光照射时,phyB主要处于无生物活性的Pr状态,此时积聚在细胞质;当Pr状态的phyB吸收红光(660nm)后可以转变为具有生物活性的Pfr状态,并且由细胞质迁移至细胞核;Pfr状态的phyB吸收远红光(730nm)或处于黑暗条件时,又可以转变回Pr状态。
2016年,剑桥大学Philip Wigge团队和布宜诺斯艾利斯生化研究所Jorge Casal团队背靠背在Science杂志上分别发表了题为“Phytochromes function as thermosensors in Arabidopsis”和“Phytochrome B integrates light and temperature signals in Arabidopsis”的研究论文,两篇论文均发现phyB不仅感知光,还能感知高温,温度越高,phyB的Pfr状态(记为phyB Pfr)向Pr状态转化的速度越快。由于phyB Pfr能抑制转录因子PIF4(植物热形态建成正调节因子),因此,高温导致phyB Pfr减少,其抑制的PIF4被释放,从而导致植物热形态建成的发生。
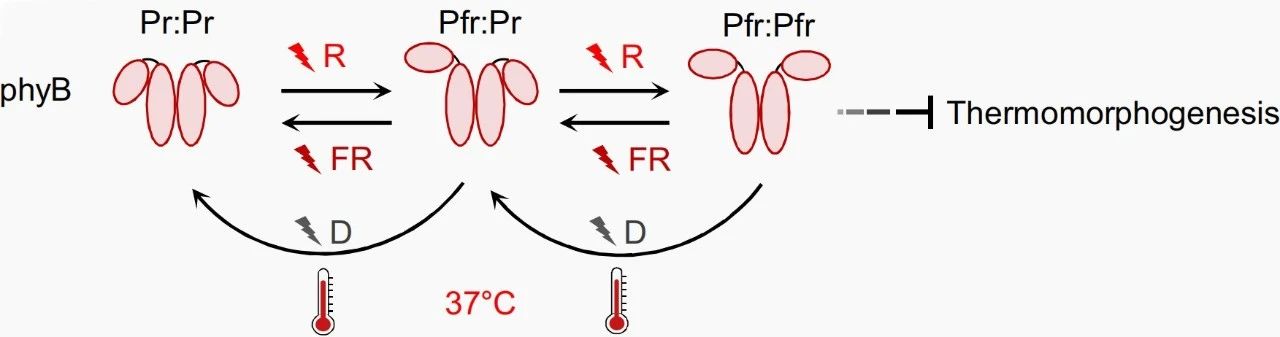
图6 高温导致phy B发生热逆转(Jung et al., 2023)。
备注:在高温下,植物下胚轴和叶柄伸长,叶片生长方向与地面的角度增大,出现早花等表型,统称为植物的热形态建成(thermomorphogenesis),PIF4和HY5是涉及热形态建成的两个重要转录因子。
植物中可以响应高温的其他光感受器CRYs、UVRB,在植物响应高温时的分子机制如下:在高温下,CRY1可能通过热逆转影响其自身活性,即从具有生物活性的FADH状态转化为无生物活性的FADox静止状态,再通过其下游转录因子PIF4来调节植物对高温的响应(Ma et al., 2016; Pooam et al., 2021),UVRB对高温的响应与CRYs类似(Findlay and Jenkins, 2016; Hayes et al., 2017),这里不再赘述。

图7 CRY1与PIF4相互作用以调控植物对高温的响应(Xu and Zhu, 2021)。CRY1通过与PIF4以蓝光依赖的形式结合,CRY1-PIF4在温度升高时通过调控生长素合成基因YUC8的表达,调控生长素合成及下胚轴伸长(B)。
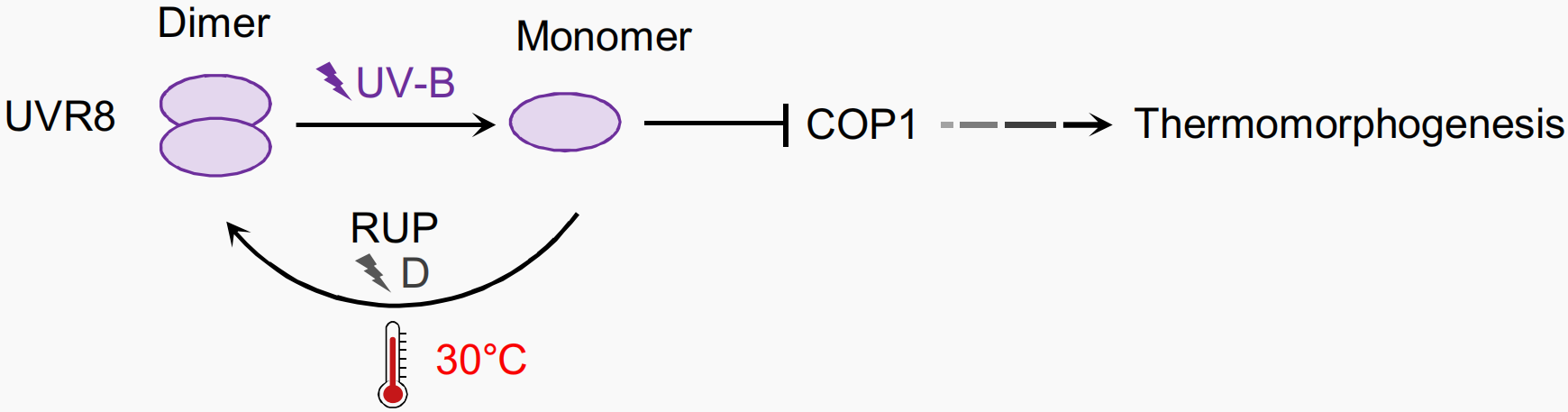
图8 UVR8在黑暗中以非活性二聚体的形式存在,但在UV-B照射下可以转变为活性单体,因此UV-B可以通过UVR8抑制PIF4介导的热形态建成。高温促进RUP(为UV-B光形态建成抑制因子)介导的UVR8二聚化,UVR8与COP1作用抑制PIF4转录,最终抑制高温下的生长素信号和茎伸长(Jung et al., 2023)。
相分离
就像水中形成油滴一样,相分离(phase separation)是将单相均质溶液分成两个不同相即富含溶质的致密相和缺乏溶质的稀相的过程。相分离的发生通常与分子间相互作用、分子浓度、环境条件变化等有关,当解混的能量增益大于熵损失时,就会发生相分离。更多关于相分离的资料可参考文章“相变无奇,聚合分离——相分离”。
如果分离出的凝聚体是液态,则脱混过程被称为液-液相分离(LLPS),发生LLPS能使细胞积极应对包括温度在内的非生物压力,因为凝聚体的液体状特征能够快速改变其中的分子组成以应对环境变化。一般情况下,相分离的蛋白质通常包含内部无序区域(IDRs)、类朊病毒样结构域(PrDs)等结构。目前已发现ELF3、GBPL3、phyB和TWA1等在感知高温时会发生相分离。
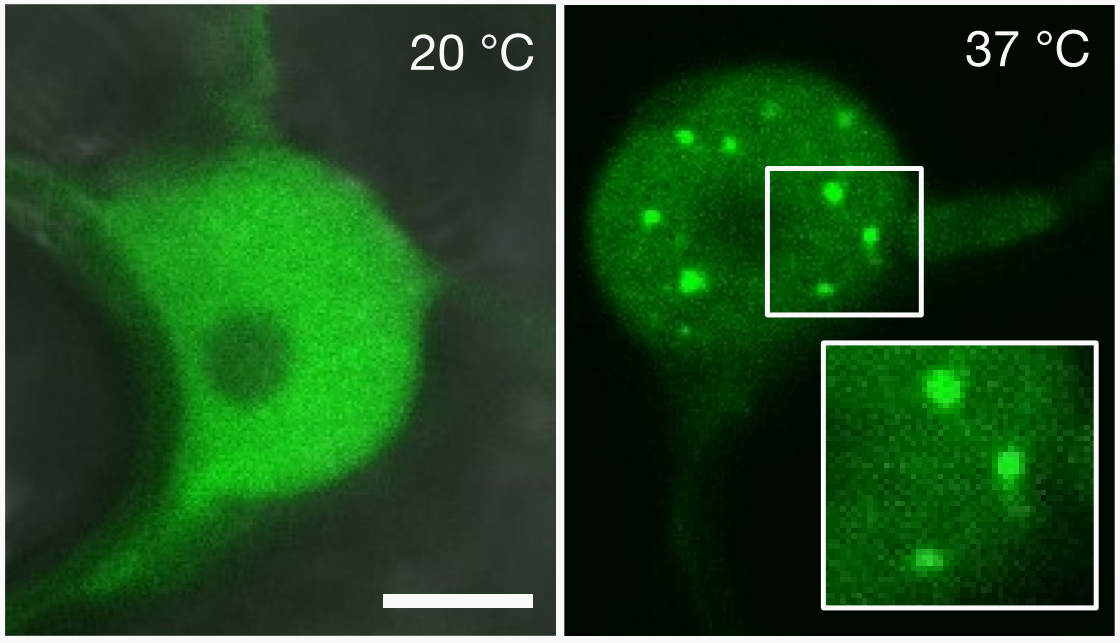
2020年,剑桥大学Philip Wigge团队在Nature杂志上发表了一篇题为“A prion-like domain in ELF3 functions as a thermosensor in Arabidopsis”的研究论文,该研究显示ELF3(EARLY FLOWERING 3)含有PrD结构域,该结构域内的聚谷氨酰胺重复序列(polyQ)长度与ELF3蛋白的热响应性有关,polyQ长度越长,ELF3的热响应性越好。在拟南芥和酵母中进行的实验均表明,在低温环境下,ELF3-GFP信号是弥散性的,但在高温环境会形成明显的点状信号,而不含PrD的ELF3在相同条件下没有发生相分离(图9a、e)。总之,PrD介导的ELF3相分离能够感知环境温度变化,这是首次发现的相分离-温度感知机制。
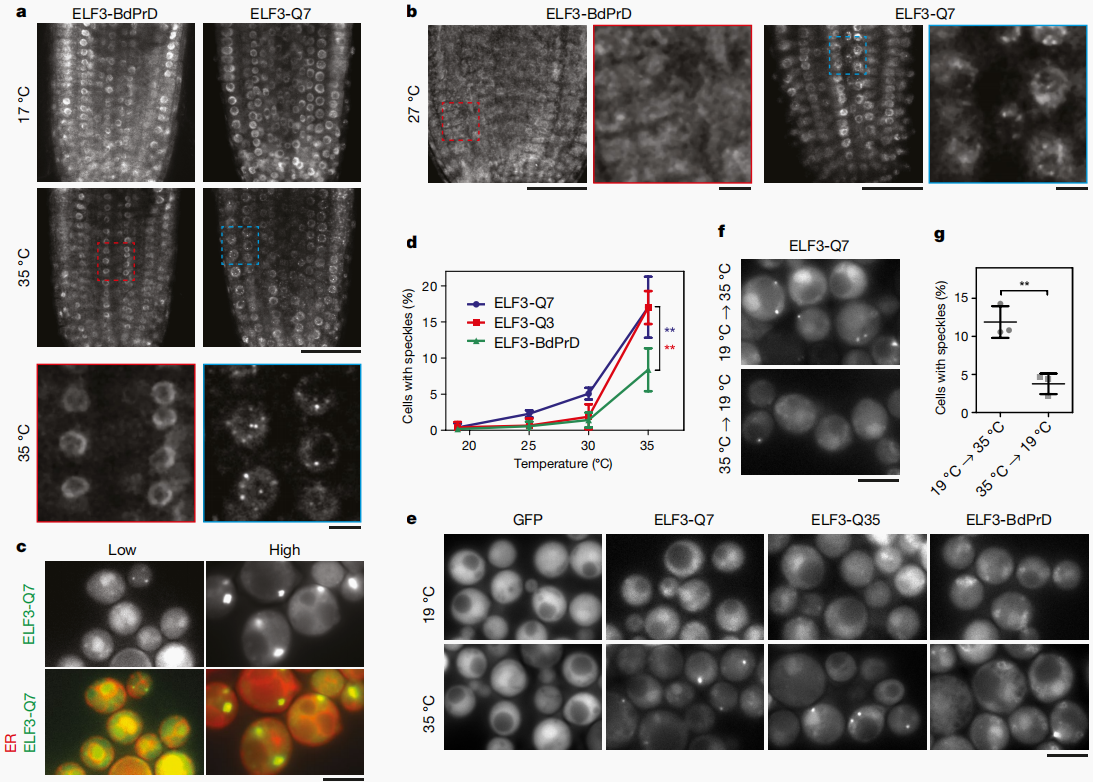 图9 高温诱导体内ELF3发生相分离(Jung et al., 2020)。(a、b)在拟南芥幼苗中表达不同形式的ELF3,在不同温度下观察荧光;ELF3-Q7指GFP标记的ELF3,具有7个polyQ;ELF3-BdPrD指GFP标记的二穗短柄草的ELF3(该ELF3不含PrD结构域);(c)在30℃酵母细胞中表达少量或大量的ELF3-Q7;(d、e)在不同温度下,对酵母细胞中ELF3点状细胞占比的测定;ELF3-Q35指GFP标记的更长polyQ序列的ELF3;(f、g)酵母细胞在19℃过夜培养,转移至35℃孵育30min后进行测定,再转移至19℃孵育60min后进行测定。
图9 高温诱导体内ELF3发生相分离(Jung et al., 2020)。(a、b)在拟南芥幼苗中表达不同形式的ELF3,在不同温度下观察荧光;ELF3-Q7指GFP标记的ELF3,具有7个polyQ;ELF3-BdPrD指GFP标记的二穗短柄草的ELF3(该ELF3不含PrD结构域);(c)在30℃酵母细胞中表达少量或大量的ELF3-Q7;(d、e)在不同温度下,对酵母细胞中ELF3点状细胞占比的测定;ELF3-Q35指GFP标记的更长polyQ序列的ELF3;(f、g)酵母细胞在19℃过夜培养,转移至35℃孵育30min后进行测定,再转移至19℃孵育60min后进行测定。
高温会导致植物表现早花,这个现象与ELF3能够发生相分离是否有关呢?研究发现,在拟南芥中,夜间复合物(Evening Complex,EC)是昼夜节律系统中的一个关键调控模块,该模块由ELF3、ELF4和LUX三个蛋白组成。其中,ELF3是复合物的核心组分;ELF4为小α螺旋蛋白;LUX是一种MYB类转录因子,负责直接结合目标基因的启动子区域。在低温环境下,ELF3与ELF4、LUX形成EC转录抑制复合体,抑制开花基因的转录,使植物表现出晚花表型。但在高温环境下,ELF3以依赖于PrD的方式发生LLPS,导致EC解离,进而促进开花基因的转录,使植物表现出早花表型(Jung et al., 2020; Ezer et al., 2017; Silva et al., 2020)(图10)。 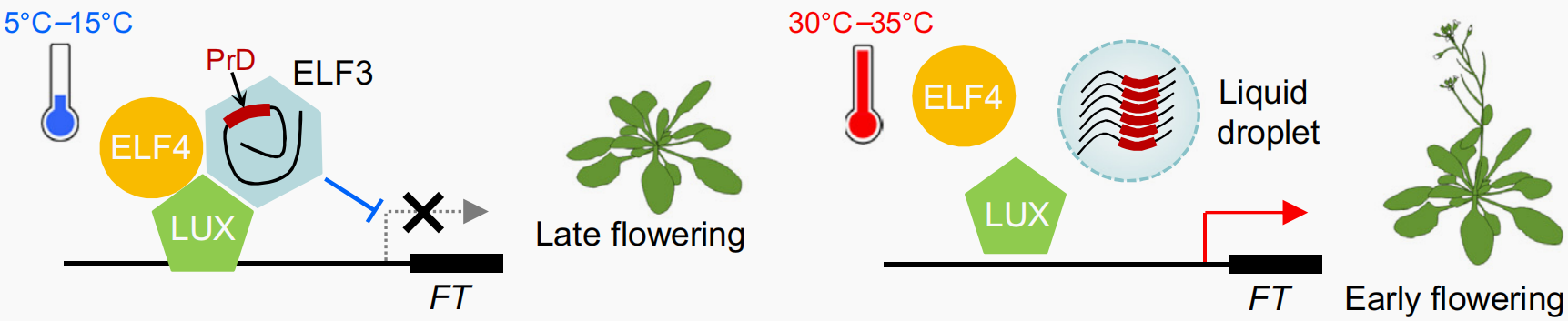
图10 ELF3通过相分离响应温度(Jung et al., 2023)。
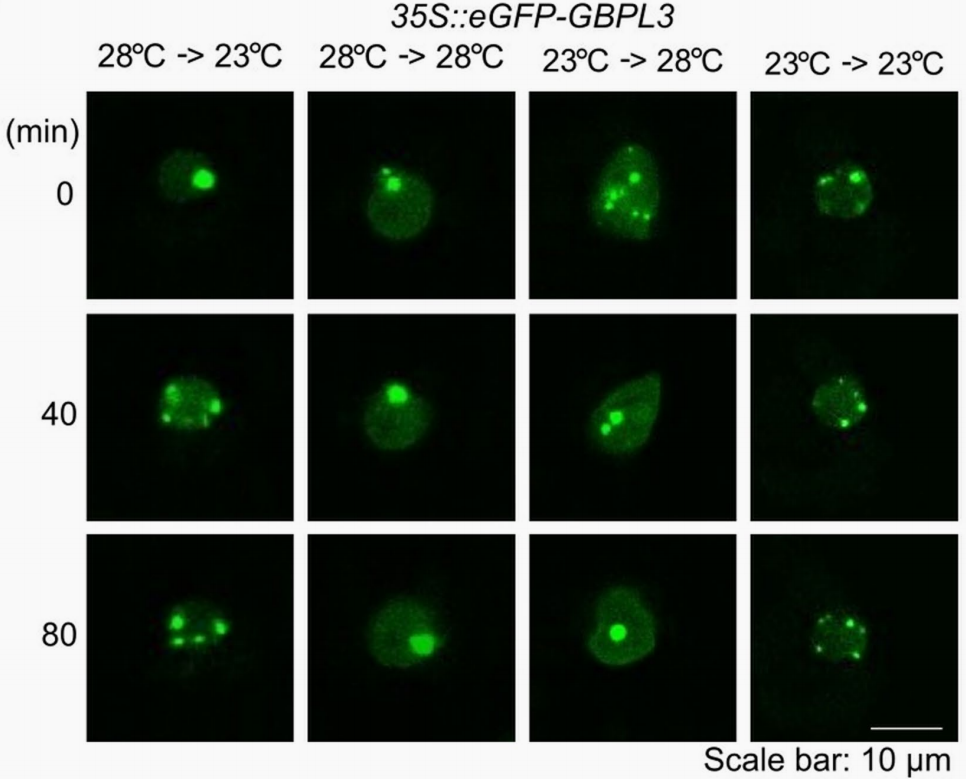
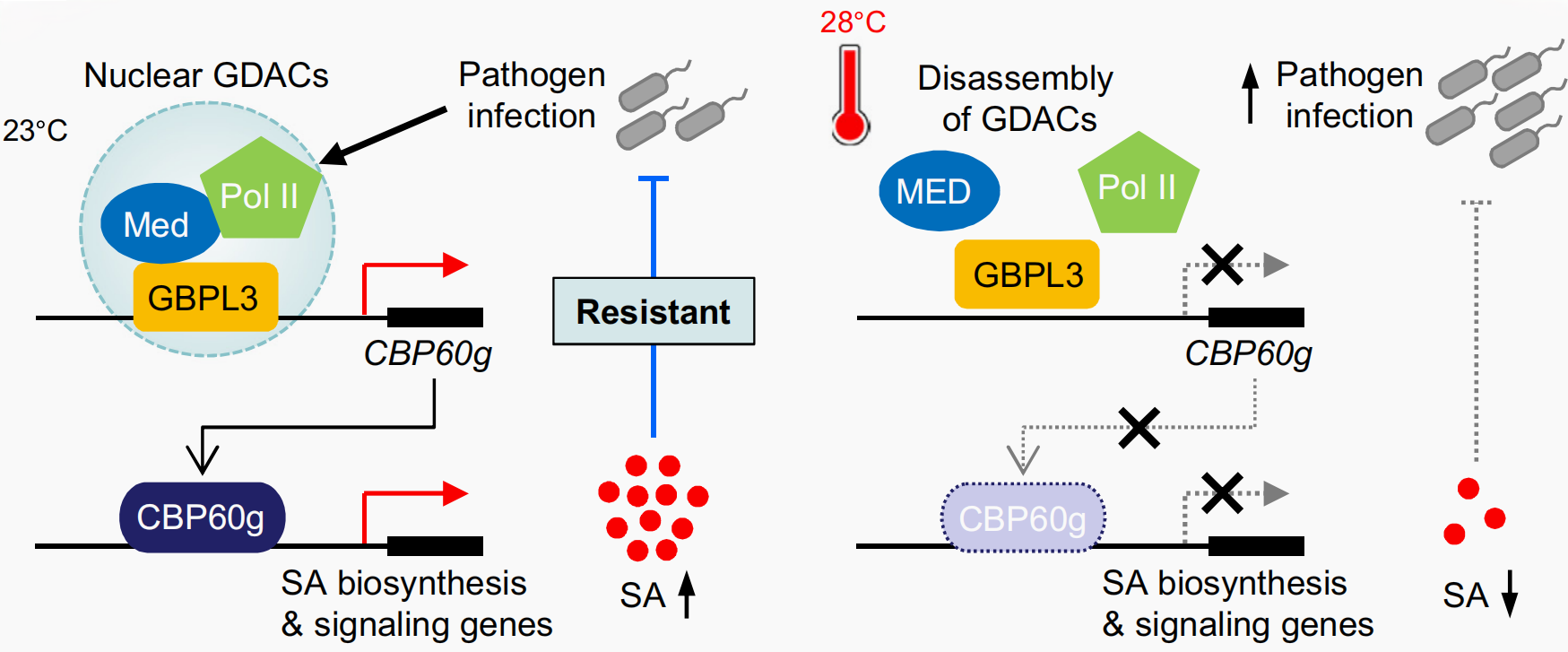
2022年,美国霍华德-休斯医学研究所/耶鲁大学John MacMicking联合杜克大学何胜洋团队在Nature杂志上发表了一篇题为“Increasing the resilience of plant immunity to a warming climate”的研究论文,作者发现水杨酸(SA)途径具有高温敏感性,并且研究显示GTP酶GBPL3的C端具有一个IDR区,且GBPL3在高温下发生相分离,使包含GBPL3、MED和RNA聚合酶II(Pol II)的GBPL防御激活缩合物(GDACs)凝聚体数量显著降低(图11),从而使结合到CBP60g和SARD1启动子上的GBPL3数量减少,引起CBP60g和SARD1数量减少,而CBP60g和SARD1本可以结合SA合成关键基因ICS1的启动子,其数量的减少最终导致SA的合成减少。
图11 将表达eEFP-GBPL3的拟南芥叶肉细胞从28℃移至23℃或者从23℃移至28℃(Kim et al., 2022)。
图12 GDACs对植物免疫的热调控作用(Jung et al., 2023)。
2022年,北京大学钟上威团队在Molecular Cell杂志上发表了一篇题为“Integration of light and temperature sensing by liquid-liquid phase separation of phytochrome B”的研究论文,作者发现phyB的N端延伸片段(NTE)具有IDR区,NTE序列能特异性地、直接地感知温度,phyB的C端具有极强的寡聚化能力使自我聚集,光照能促进phyB发生LLPS形成光体(PBs),而高温可以使光体解离。PBs表现出液滴状凝聚体的生物物理特性,包括PIFs在内的多种信号成分被选择性地结合,形成浓缩的微环境。该研究提出了不同但高度相关的两种物理信号是如何被同一个受体传导至下游的。
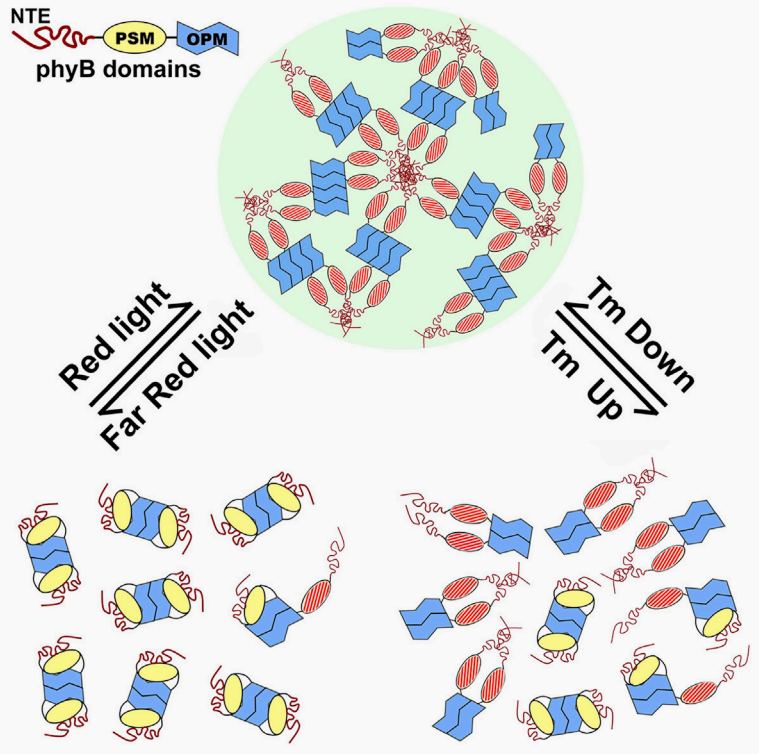 图13 phyB分别通过可逆构象转变、LLPS实现对光照、温度的感知(Chen et al., 2022)。
图13 phyB分别通过可逆构象转变、LLPS实现对光照、温度的感知(Chen et al., 2022)。
备注:推荐大家精读该文献,该研究把前文所述2016年两篇Science文章中对phyB的研究作了更严谨且富有逻辑的分析。
2024年,慕尼黑工业大学Alexander Christmann和Erwin Grill团队在Nature杂志上发表了一篇题为“The temperature sensor TWA1 is required for thermotolerance in Arabidopsis”的研究论文,作者发现了感知温度的转录共调节因子THERMO-WITH ABA-RESPONSE 1(TWA1),它是一种预测的内部无序蛋白(IDP),TWA1对温度的感知来自于其N末端高度可变的HVR结构域。TWA1在高温下通过相分离在细胞核亚结构中积累,与转录因子JAM2、TPL相互作用形成阻遏复合物,抑制相关基因的表达。在不同物种中,TWA1的直系同源物提供了不同的温度感知阈值。
图14 GFP-TWA1在烟草表皮细胞核亚结构与JAM2、TPL结合,图中显示了TWA1在核中的成像(Bohn et al., 2024)。
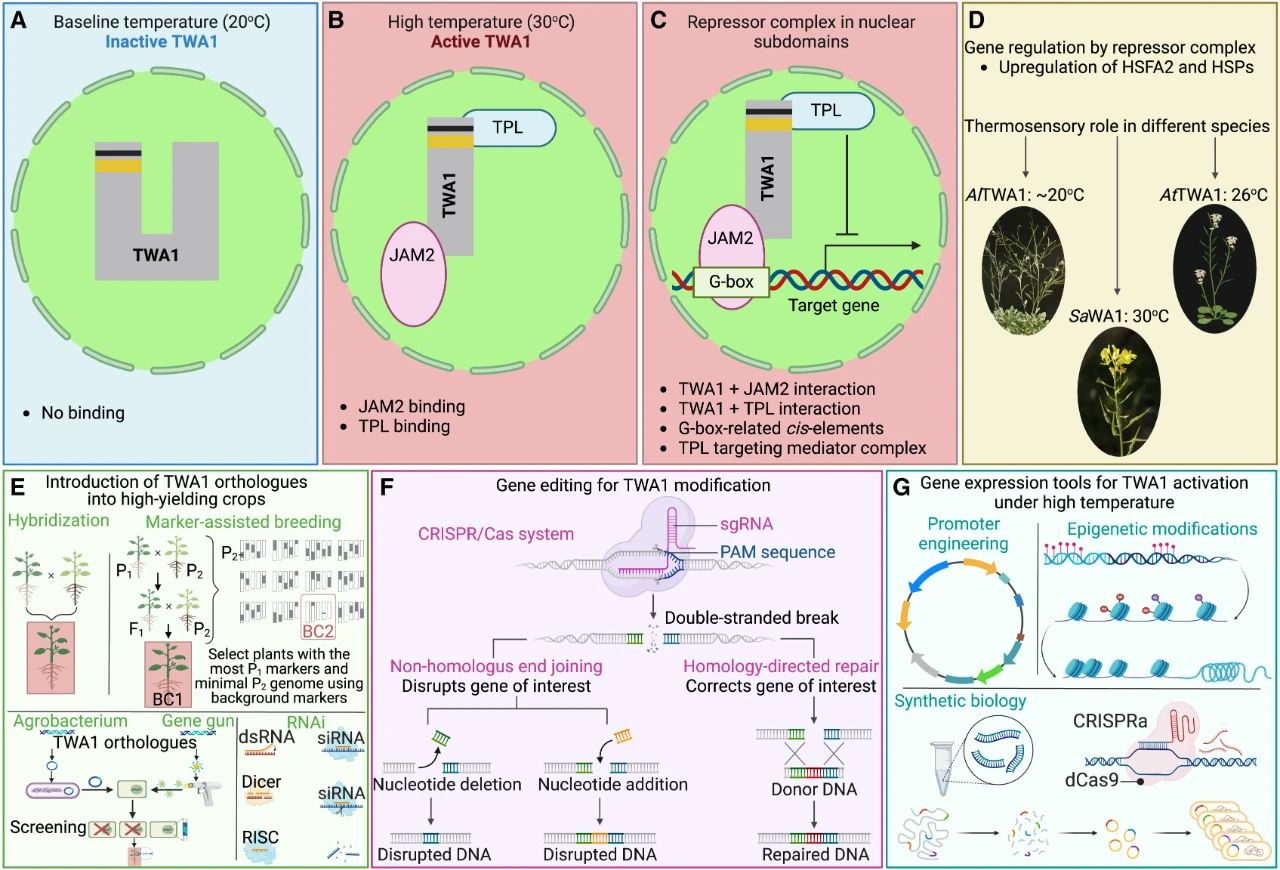 图15 TWA1热感应器随温度变化的动态调控机制(Raza et al., 2024)。
图15 TWA1热感应器随温度变化的动态调控机制(Raza et al., 2024)。
在植物中,PrD序列和IDR序列广泛存在,因此,利用LLPS来研究含有PrD或IDR的蛋白质如何参与温度传感的方法将是识别植物中热传感器的有效方法。
改变RNA二级结构
2023年11月,英国邓迪大学詹姆斯-哈顿研究所Emma C. Hardy联合Martin Balcerowicz团队在Journal of Experimental Botany杂志上发表了一篇题为“Untranslated yet indispensable—UTRs act as key regulators in the environmental control of gene expression”的研究论文,作者发现PIF7 mRNA 5′ UTR中包含一个发夹结构,当植物处于22℃~27℃时,该RNA发夹结构发生变化,能提高PIF7的翻译水平,积累更多的PIF7蛋白(Chung et al., 2020)。PIF7进而调控下游与光合作用、细胞伸长、热胁迫响应相关的基因,来帮助植物在高温环境中维持生长和生存。
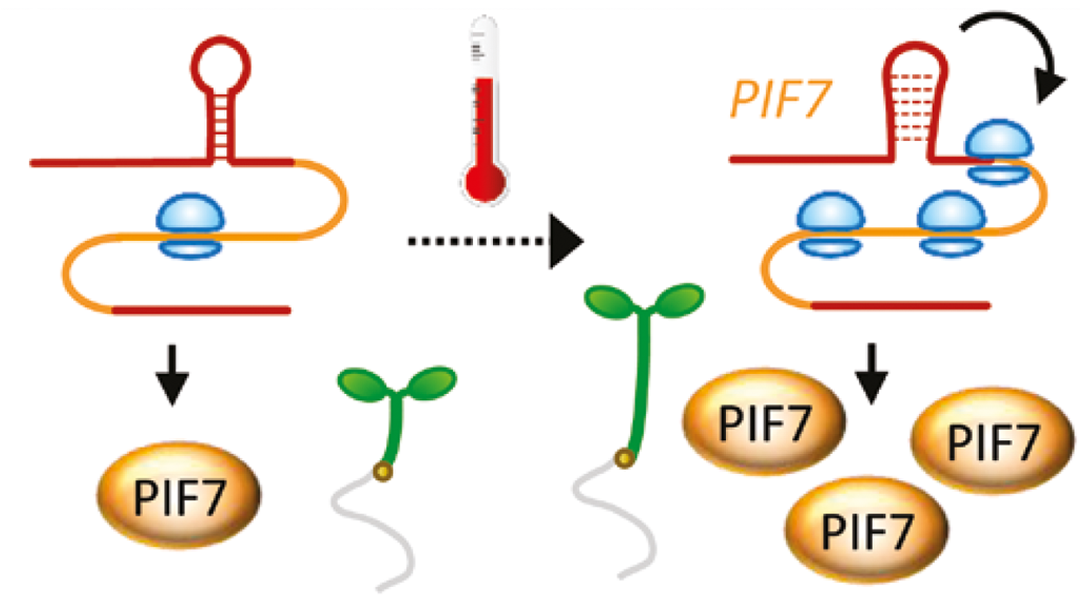
图16 PIF7 mRNA 5′ UTR中的热敏发夹结构在高温下会变成更宽松的构象,能增强蛋白的翻译(Hardy and Balcerowicz, 2024)。
备注:PIF7 mRNA 5′ UTR因此被认为是一种RNA温度计。
蛋白泛素化降解
2022年,中科院分子植物科学卓越创新中心林鸿宣研究团队联合上海交通大学林尤舜研究团队在Science 期刊上发表题为“A genetic module at one locus in rice protects chloroplasts to enhance thermotolerance”的研究论文,该研究发现了植物中一种新的耐高温机制,揭示了由水稻耐热复杂数量性状基因位点TT3中存在的基因TT3.1和TT3.2 组成的遗传模块在调控水稻抵抗高温的作用。非洲栽培稻中的TT3.1具有更强的E3泛素连接酶活性,能更多地招募并泛素化叶绿体前体蛋白TT3.2,在高温下实现对叶绿体的保护,提高水稻的高温抗性和产量。更多详细信息可参考文章“热热热——Science顶刊揭秘热浪下的植物”。
Temperature Sensing in Plants
植物对温度的感知涉及极其复杂的细胞过程, 包括脂质代谢、光信号、相分离等,而且温度与光、干旱等又有着相关但独立的复杂关系,本文介绍了近十几年来科学家们发现的一些潜在的植物热感应器,涉及的机制包括膜相关蛋白的释放、光感受器的热逆转、相分离、改变RNA二级结构、蛋白泛素化降解等,篇幅所限,很多内容没有具体展开,主要是帮助大家了解植物感知温度涉及的相关机制包括哪些方面,打开大家的研究思路,文中不足之处还希望大家继续补充喔!
References:
Baez D, Raddatz N, Ferreira G, Gonzalez C, Latorre R (2014) Gating of thermally activated channels. CURR TOP MEMBR 74: 51-87
Chang Y, Fang Y, Liu J, Ye T, Li X, Tu H, Ye Y, Wang Y, Xiong L (2024) Stress-induced nuclear translocation of ONAC023 improves drought and heat tolerance through multiple processes in rice. NAT COMMUN 15: 5877
Chen D, Lyu M, Kou X, Li J, Yang Z, Gao L, Li Y, Fan LM, Shi H, Zhong S (2022) Integration of light and temperature sensing by liquid-liquid phase separation of phytochrome B. MOL CELL 82: 3015-3029
Chung B, Balcerowicz M, Di Antonio M, Jaeger KE, Geng F, Franaszek K, Marriott P, Brierley I, Firth AE, Wigge PA (2020) An RNA thermoswitch regulates daytime growth in Arabidopsis. NAT PLANTS 6: 522-532
Ezer D, Jung JH, Lan H, Biswas S, Gregoire L, Box MS, Charoensawan V, Cortijo S, Lai X, Stockle D, Zubieta C, Jaeger KE, Wigge PA (2017) The evening complex coordinates environmental and endogenous signals in Arabidopsis. NAT PLANTS 3: 17087
Findlay KM, Jenkins GI (2016) Regulation of UVR8 photoreceptor dimer/monomer photo-equilibrium in Arabidopsis plants grown under photoperiodic conditions. PLANT CELL ENVIRON 39: 1706-1714
Gao F, Han X, Wu J, Zheng S, Shang Z, Sun D, Zhou R, Li B (2012) A heat-activated calcium-permeable channel–Arabidopsis cyclic nucleotide-gated ion channel 6–is involved in heat shock responses. PLANT J 70: 1056-1069
Hardy EC, Balcerowicz M (2024) Untranslated yet indispensable-UTRs act as key regulators in the environmental control of gene expression. J EXP BOT 75: 4314-4331
Hayes S, Sharma A, Fraser DP, Trevisan M, Cragg-Barber CK, Tavridou E, Fankhauser C, Jenkins GI, Franklin KA (2017) UV-B Perceived by the UVR8 Photoreceptor Inhibits Plant Thermomorphogenesis. CURR BIOL 27: 120-127
Huang S, Zhu S, Kumar P, MacMicking JD (2021) A phase-separated nuclear GBPL circuit controls immunity in plants. NATURE 594: 424-429
Jung JH, Barbosa AD, Hutin S, Kumita JR, Gao M, Derwort D, Silva CS, Lai X, Pierre E, Geng F, Kim SB, Baek S, Zubieta C, Jaeger KE, Wigge PA (2020) A prion-like domain in ELF3 functions as a thermosensor in Arabidopsis. NATURE 585: 256-260
Jung JH, Domijan M, Klose C, Biswas S, Ezer D, Gao M, Khattak AK, Box MS, Charoensawan V, Cortijo S, Kumar M, Grant A, Locke JC, Schafer E, Jaeger KE, Wigge PA (2016) Phytochromes function as thermosensors in Arabidopsis. SCIENCE 354: 886-889
Jung JH, Seo PJ, Oh E, Kim J (2023) Temperature perception by plants. TRENDS PLANT SCI 28: 924-940
Kim JH, Castroverde C, Huang S, Li C, Hilleary R, Seroka A, Sohrabi R, Medina-Yerena D, Huot B, Wang J, Nomura K, Marr SK, Wildermuth MC, Chen T, MacMicking JD, He SY (2022) Increasing the resilience of plant immunity to a warming climate. NATURE 607: 339-344
Legris M, Klose C, Burgie ES, Rojas CC, Neme M, Hiltbrunner A, Wigge PA, Schafer E, Vierstra RD, Casal JJ (2016) Phytochrome B integrates light and temperature signals in Arabidopsis. SCIENCE 354: 897-900
Liu XH, Lyu YS, Yang W, Yang ZT, Lu SJ, Liu JX (2020a) A membrane-associated NAC transcription factor OsNTL3 is involved in thermotolerance in rice. PLANT BIOTECHNOL J 18: 1317-1329
Liu XH, Lyu YS, Yang W, Yang ZT, Lu SJ, Liu JX (2020b) A membrane-associated NAC transcription factor OsNTL3 is involved in thermotolerance in rice. PLANT BIOTECHNOL J 18: 1317-1329
Ma D, Li X, Guo Y, Chu J, Fang S, Yan C, Noel JP, Liu H (2016) Cryptochrome 1 interacts with PIF4 to regulate high temperature-mediated hypocotyl elongation in response to blue light. P NATL ACAD SCI USA 113: 224-229
Pooam M, Dixon N, Hilvert M, Misko P, Waters K, Jourdan N, Drahy S, Mills S, Engle D, Link J, Ahmad M (2021) Effect of temperature on the Arabidopsis cryptochrome photocycle. PHYSIOL PLANTARUM 172: 1653-1661
Raza A, Zaman QU, Hu Z (2024) Leveraging a new thermosensor for heat-smart future agriculture. PLANT COMMUN: 101007
Silva CS, Nayak A, Lai X, Hutin S, Hugouvieux V, Jung JH, Lopez-Vidriero I, Franco-Zorrilla JM, Panigrahi K, Nanao MH, Wigge PA, Zubieta C (2020) Molecular mechanisms of Evening Complex activity in Arabidopsis. P NATL ACAD SCI USA 117: 6901-6909
Xu Y, Zhu Z (2021) PIF4 and PIF4-Interacting Proteins: At the Nexus of Plant Light, Temperature and Hormone Signal Integrations. INT J MOL SCI 22
Yang H, Zhao Y, Chen N, Liu Y, Yang S, Du H, Wang W, Wu J, Tai F, Chen F, Hu X (2021) A new adenylyl cyclase, putative disease-resistance RPP13-like protein 3, participates in abscisic acid-mediated resistance to heat stress in maize. J EXP BOT 72: 283-301
Zhang H, Zhou JF, Kan Y, Shan JX, Ye WW, Dong NQ, Guo T, Xiang YH, Yang YB, Li YC, Zhao HY, Yu HX, Lu ZQ, Guo SQ, Lei JJ, Liao B, Mu XR, Cao YJ, Yu JJ, Lin Y, Lin HX (2022) A genetic module at one locus in rice protects chloroplasts to enhance thermotolerance. SCIENCE 376: 1293-1300