本文内容速览:
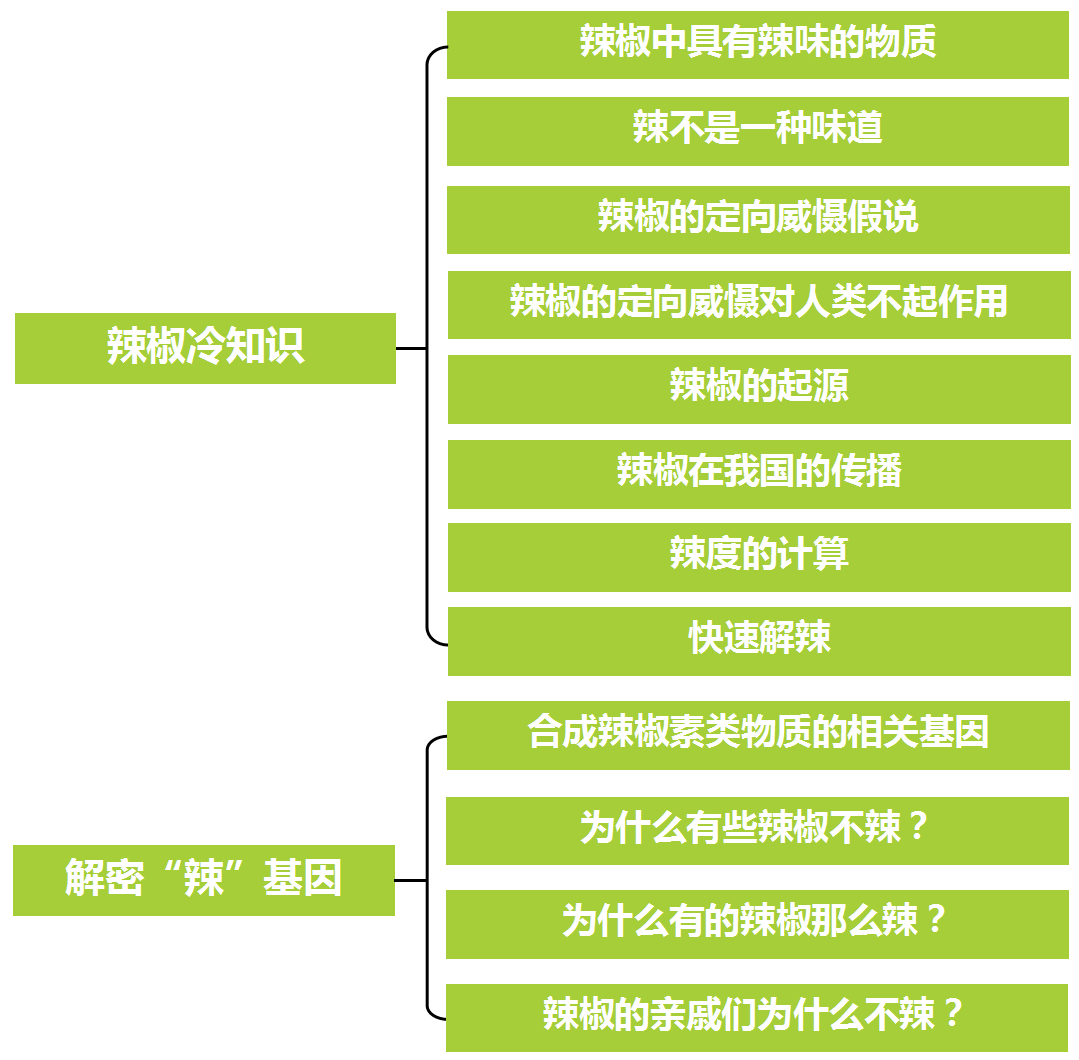
辣椒冷知识
辣椒中具有辣味的物质:辣椒(Capsicum annuum)的辣味来自一系列在结构和性质上非常相似的物质,称为辣椒素类物质。
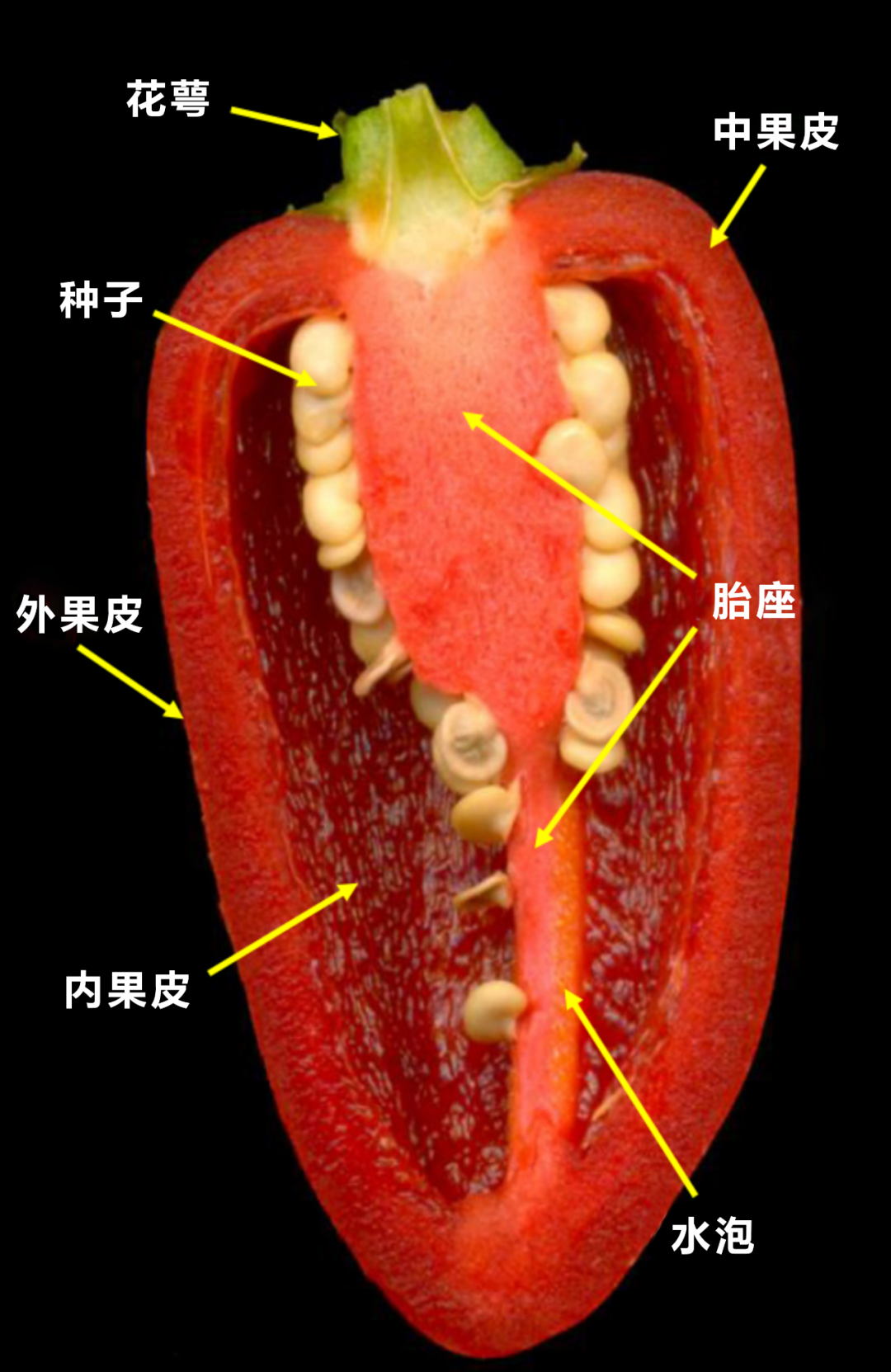
图1 辣椒解剖图(改编自Naves et al., 2019)。辣椒素类物质是在辣椒的胎座表皮细胞中合成的,以“水泡”的形式积累,再通过子房隔膜运输至果肉。大家可以想想辣椒的哪个地方最辣呢?

图2 辣椒中辣椒素类物质合成后,积聚在“水泡”中(雷建军,2018)。
辣不是一种味道:辣椒素类物质能与哺乳动物体内的香草素受体亚型1(TRPV1)的热感受体结合,产生类似疼痛和灼烧的感觉(Caterina et al., 1997),但这其实是一种感官错觉,实际上并不会造成任何物理、化学伤害。
辣椒的定向威慑假说:辣椒的结构简单,扒开皮就是种子,种子又小又嫩且无坚硬的果壳保护,经过哺乳动物如啮齿动物消化后种子会被破坏,辣椒也就无法繁殖了。辣椒因此进化出了辣椒素,哺乳动物在尝试过辣椒之后就不敢再接近这种食物了。鸟类没有牙齿,消化系统简单因而不会破坏种子,其活动范围广且鸟类的热感受体与哺乳动物有结构差异,因此鸟类感知不到“辣”味,总之,鸟类是辣椒种子传播的理想媒介(Tewksbury and Nabhan, 2001)。当然,也有研究者认为辣椒进化出辣椒素是为了抵抗真菌,越辣的辣椒对某些有害真菌的抵抗力越强(Tewksbury et al., 2008)。

图3 取食辣椒的鸟类。图片来源:Wikimedia Commons。
辣椒的定向威慑对人类不起作用:当人类食用辣椒时,辣椒素与TRPV1受体结合后,神经系统会向大脑传递信息,告知身体正暴露于危险的温度,大脑以为组织正被灼伤,为了自救,会分泌内啡肽来帮忙减轻痛苦,人类因此爱上了吃辣椒产生的“痛并快乐着”的感觉,类似看恐怖电影、坐过山车、蹦极等带来的感觉。
辣椒的起源:辣椒是起源于南美洲西部至西北部安第斯山脉沿线地区的一种小型浆果。辣椒能够传播到欧洲,要得益于航海家哥伦布,他1492年登上了美洲大陆,并将辣椒带回欧洲,宣称辣椒是一种类似胡椒的香辛调料,这也是为什么“pepper”既表示胡椒也表示辣椒的原因。此后,辣椒由葡萄牙人的贸易路线迅速传播至全世界。辣椒属约35个种,其中有5个是栽培种,除了我们常说的辣椒(Capsicum annuum)外,其他分别为浆果状辣椒(Capsicum baccatum)、黄灯笼辣椒(Capsicum chinense)、灌木状辣椒(Capsicum frutescens)和绒毛辣椒(Capsicum pubescens)。
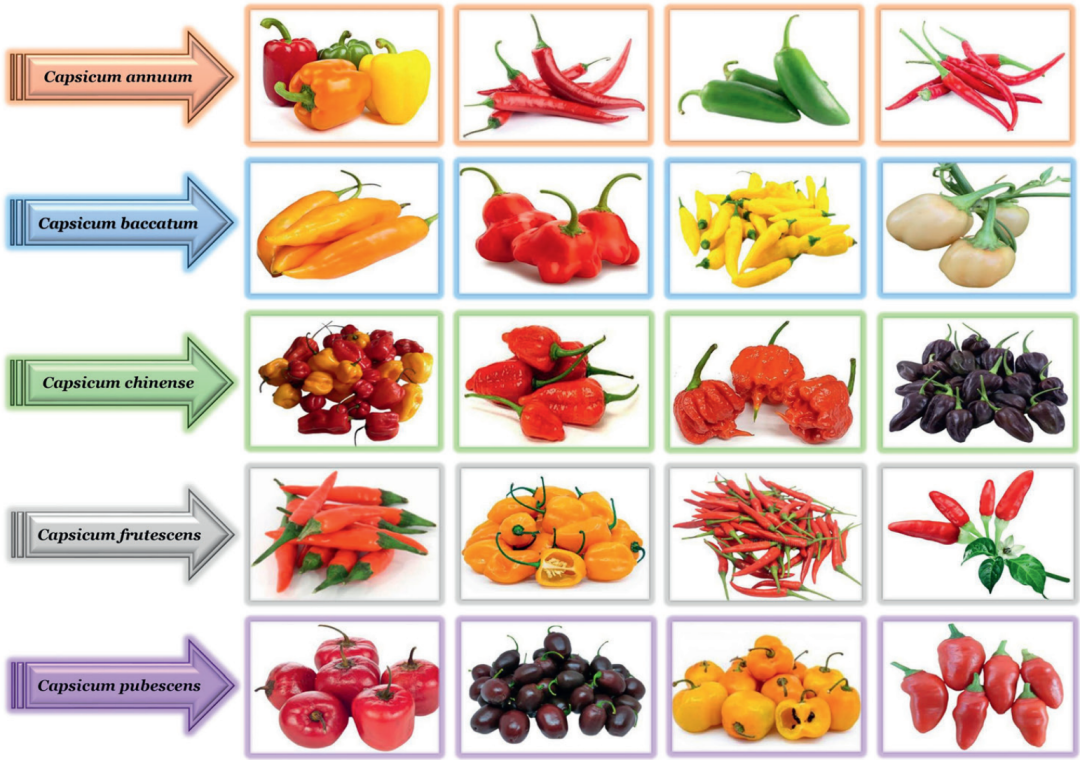
图4 五种辣椒栽培种(Dhamodharan et al., 2023)。
辣椒在我国的传播:葡萄牙的贸易船队把辣椒作为全球香料和调料贸易的主力,于明朝末年(16世纪末到17世纪初)通过海上丝绸之路和陆上丝绸之路传入中国。最先接受辣椒的是贵州人,在食盐极其短缺的年代,辣椒在当地成了很好的替代品。到了清代,辣椒的种植和食用逐渐普及,那时候湖南人、湖北人已经食辣成性,顿顿离不开辣椒了!到了康熙年间,随着“湖广填四川”的移民风潮,辣椒开始轰轰烈烈地入川,花椒的“麻”碰上辣椒的“辣”,为川菜注入了新的灵魂。如今,我们国家已经是世界上最大的辣椒生产、消费和出口国,俗话说“湖南人不怕辣,贵州人辣不怕,四川人怕不辣”,但其实不止这些省份,“辣”已逐渐成为了国民口味,备受欢迎的菜品有水煮鱼、麻辣火锅、酸辣粉、麻辣烫等。
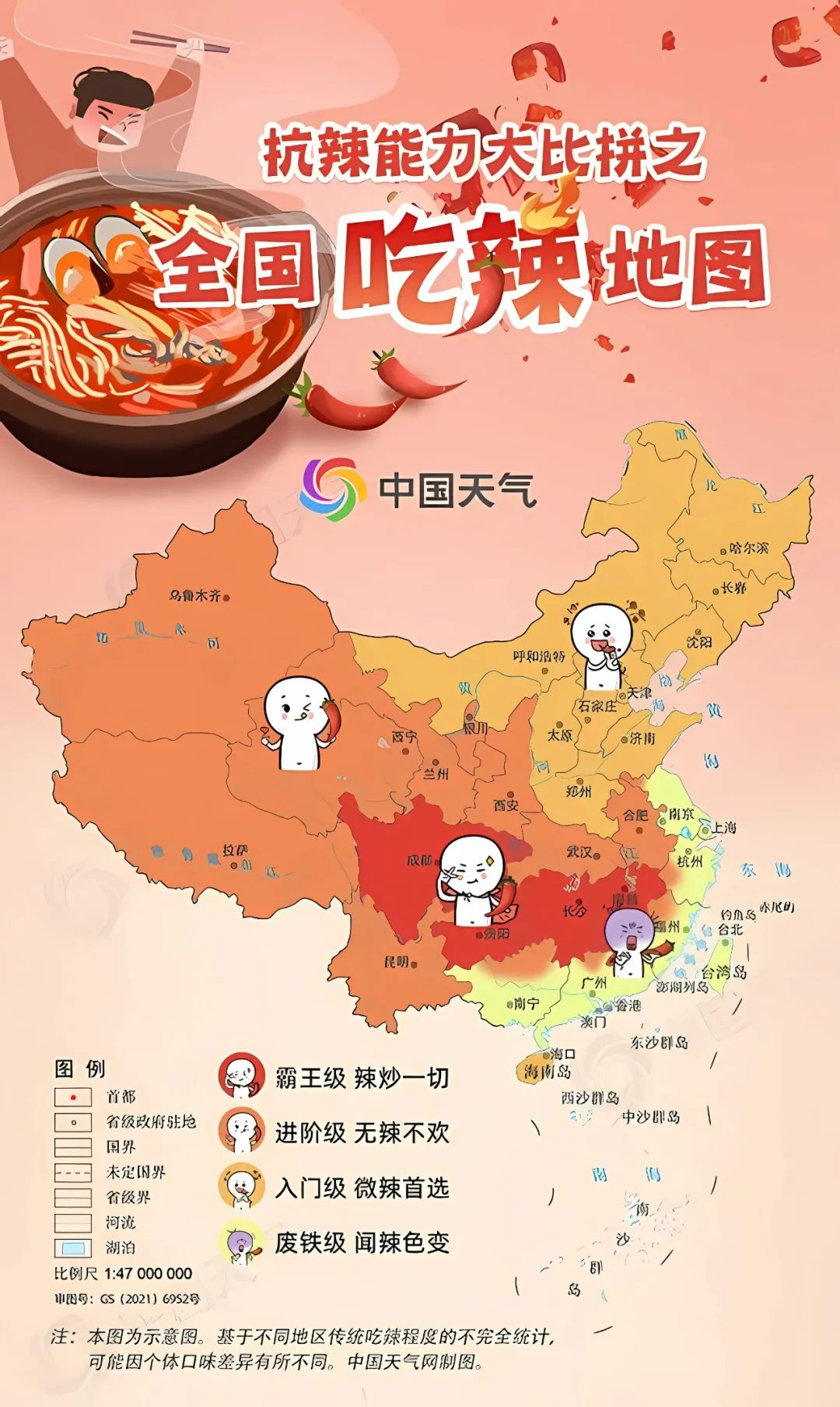
图5 全国吃辣地图。图片来源:中国天气网。注:该图为不同地区吃辣程度的不完全统计。
辣度的计算:1912年,化学家史高维尔发明了测量辣度的方法——“史高维尔感官测试”(Scoville W L, 1912),让训练有素的品尝者品尝含有辣椒提取物的糖水,通过稀释样品,直到品尝者无法再感受到任何辛辣味,记录品尝者不再能感受到辣味时的最高稀释倍数,这个稀释倍数就是该辣椒的史高维尔辣度单位(SHU)。该方法具有一定的主观性,后来使用高效液相色谱(HPLC)精确定量辣椒素含量(Hoffman et al., 1983),但由于SHU指标已广为人知,因此现在会将HPLC的测量值转换为SHU来表示辣椒素含量。
在我国,公认最辣的是“涮涮辣”(云南特有的种质资源,做菜时在汤里涮涮,整锅汤就会有辣味,故而得名)和海南黄灯笼椒,辣度分别为44万SHU和15万SHU。目前世界上最辣的辣椒是2023年由美国人培养出来的“辣椒X”,辣度为320万SHU,之前最辣辣椒“卡莱罗纳死神椒”的辣度为220万SHU。

图6 云南“涮涮辣”。图片来源:边看边游。

图7 海南黄灯笼椒。图片来源:百度。
快速解辣:水并不能缓解舌头上的灼痛,因为辣椒素溶于脂肪和油,而不是水。所以,乳制品是最佳选择,冷温也会有很大的帮助,因此冰全脂牛奶或冰淇淋是缓解灼烧感很好的选择。
解密“辣”基因
先说目前对辣椒素类物质合成途径的认识:目前已鉴定出23种辣椒素类物质,这些物质的差异在于脂肪侧链的长度、是否存在双键、分支点和相对辣度的不同。在不同品种中辣椒素类物质的含量并不相同,其中含量占比最高的是辣椒素(69%),其次是二氢辣椒素(22%),再次是降二氢辣椒素(7%),其余物质仅占少量。辣椒素类物质合成涉及两个前体物质,香草基胺和C8~C13支链脂肪酸,它们最终由辣椒素合成酶CS(又称为AT3或Pun1)催化生成辣椒素类物质。
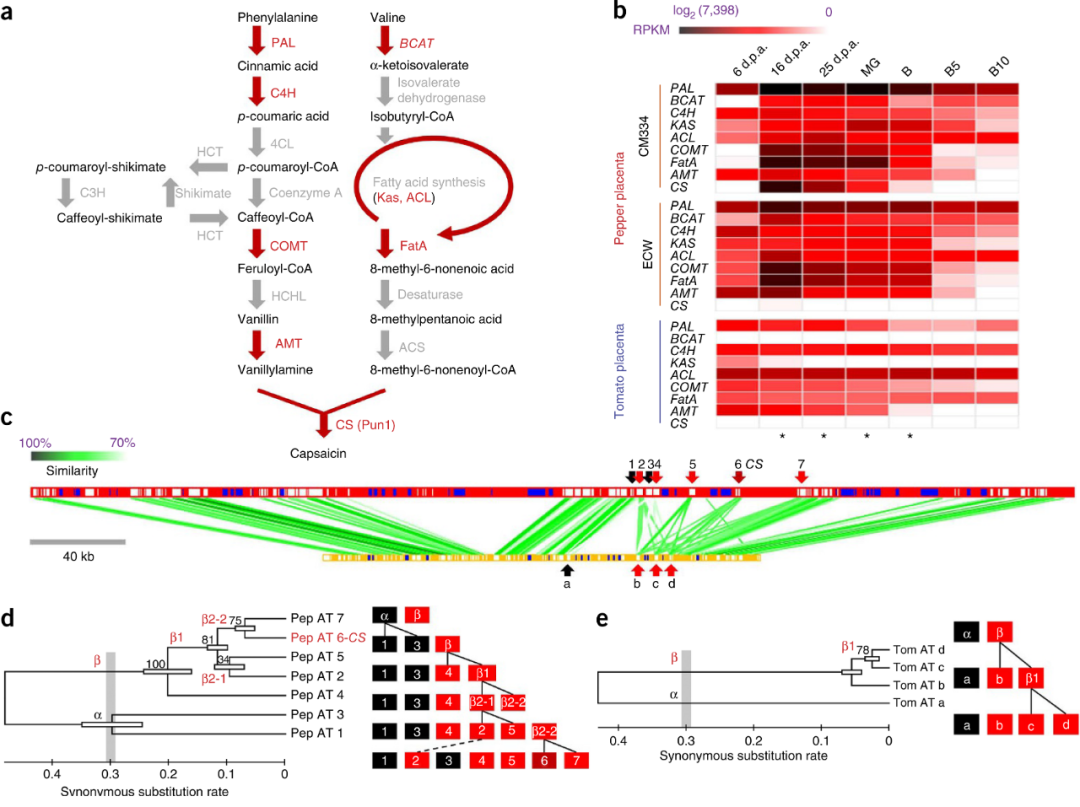
图8 辣椒素的生物合成途径(Kim et al., 2014)。(a)苯丙氨酸支链涉及苯丙氨酸裂解酶(PAL)、肉桂酸水解酶(C4H)、对香豆酸水解酶(C3H)、咖啡酸-O-甲基转移酶(COMT)、氨基转移酶(AMT/pAMT/Pun2);缬氨酸支链涉及支链氨基酸转移酶(BCAT)、β-酮脂酰-ACP合酶(KAS)、酰基运载蛋白(ACL)、酰基-ACP-硫脂酶(FatA)、酰基CoA合成酶(ACS);最后,由两条支链合成的香草基胺和支链脂肪酸经辣椒素合成酶(CS/AT3/Pun1)合成为辣椒素;(b)对辣椒和番茄中辣椒素合成相关基因的RPKM值进行比较;(c)辣椒和番茄中的CS基因序列的微共线性分析;(d、e)CS基因在辣椒和番茄中的复制模型。注:图(a)中标为红色的基因是指用于后续分析的基因,并非指合成通路中所有的关键酶基因。
研究辣椒素类物质合成的文献多不胜数,伯小远简要介绍一下其中的四篇。
2009年,康奈尔大学Michael Mazourek团队在Plant Physiology杂志上发表了一篇题为“Genome sequence of the hot pepper provides insights into the evolution of pungency in Capsicum species”的研究论文,作者整合生物信息学、计算建模和实验数据的信息,建立了辣椒素类物质生物合成模型CapCyc,CapCyc包括苯丙氨酸生物合成、辣椒素合成的直接前体香草基胺的合成、支链氨基酸的合成和代谢以及支链脂肪酸的合成等4方面。该模型为研究辣椒素类物质合成途径提供了指导意义。
2014年,首尔大学Doil Choi团队在Nature Genetics杂志上发表了一篇题为“Genome sequence of the hot pepper provides insights into the evolution of pungency in Capsicum species”的研究论文,作者通过对CM334(辛辣辣椒)、ECW(非辛辣辣椒)进行全基因组测序,鉴定了辣椒基因组中属于CapCyc模型的44个基因。另外,比较转录组学分析结果显示辣椒素合成途径的关键基因在辣椒和番茄中表现出显著差异表达,表明辣椒素合成途径的关键基因在辣椒中被激活表达是辣椒能够合成辣椒素的原因。而且作者深入比较了辣椒和番茄中辣椒素合成酶基因CS基因的进化,辣椒中CS基因的七个拷贝经历了五轮不对称串联复制,而番茄中CS基因的四个拷贝经历了两次复制事件,认为辣椒在最后一轮复制中赋予了CS基因在辣椒素合成中的作用。
2014年,由遵义市农业科学研究院牵头,联合四川农业大学、华南农业大学、深圳华大基因和墨西哥生物多样性基因组学国家重点实验室等13家单位在PANS杂志上发表了一篇题为“Whole-genome sequencing of cultivated and wild peppers provides insights into Capsicum domestication and specialization”的研究论文,作者对栽培种遵辣1号及其野生祖先Chiltepin进行全基因组测序,鉴定了辣椒基因组中属于CapCyc模型的51个基因,与番茄、马铃薯和拟南芥中的同源基因相比,其中13个基因在辣椒中存在独立进化的特异性重复,这种改变可能导致基因功能改变或出现新的功能,例如,辣椒与番茄在进化上分离后,辣椒中的AT3-D1、AT3-D2在保守基序中发生氨基酸替换(K390R),并最终负责了辣椒素的合成。
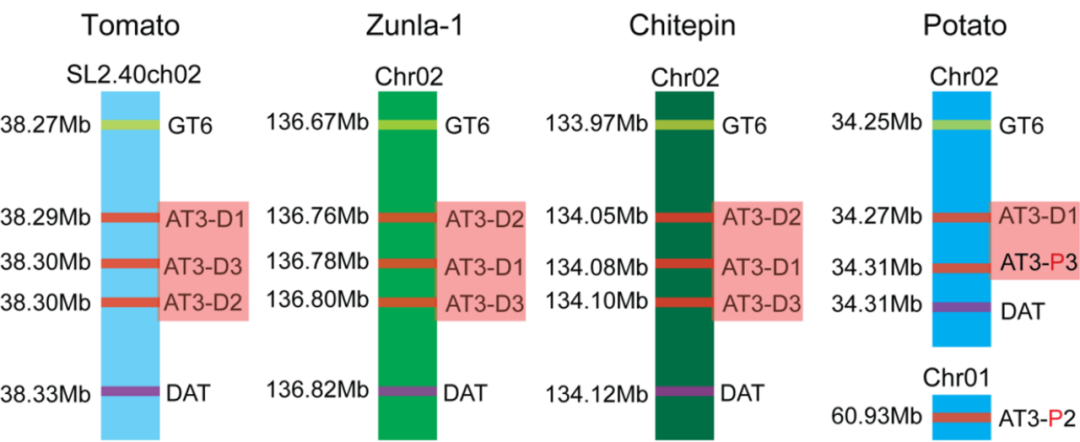
图9 在番茄、辣椒和马铃薯中AT3 基因在基因组中的定位(Qin et al., 2014)。马铃薯上的AT3-P2 、AT3-P3 为假基因。
2024年5月,北京大学现代农业研究院郭立、何航团队在Nature Communications杂志上发表了一篇题为“Two telomere-to-telomere gapless genomes reveal insights into Capsicum evolution and capsaicinoid biosynthesis”的研究论文,作者分别组装了栽培辣椒G1-36576(Capsicum annuum)和野生辣椒PI 645680(Capsicum rhomboideum )的端粒到端粒(T2T)无缺口基因组。其中,发现在辣椒属所有植物中,无论是否产辣椒素,都含有不同数量的辣椒素生物合成通路基因。辣椒素合成酶基因CS 在茄科植物中以串联重复的形式出现,栽培辣椒中有七个拷贝,野生辣椒中有四个拷贝,辣椒素生物合成基因在辣椒果实中高度表达,但在番茄、马铃薯、酸浆和野生辣椒中几乎不表达。
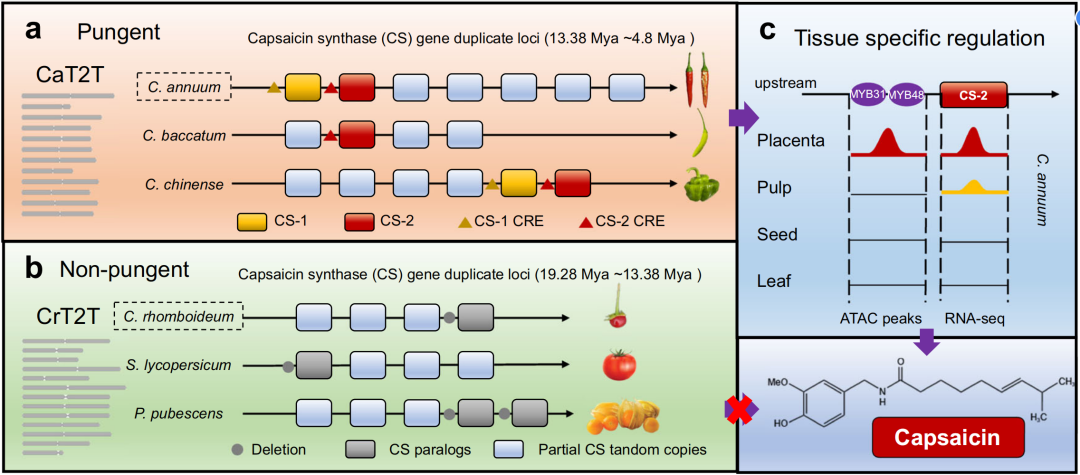
图10 辣椒和茄科植物中CS基因的进化模型(Chen et al., 2024)。(a)辛辣的辣椒品种至少具有一个功能性的CS 基因;(b)非辛辣的野生辣椒、番茄和酸浆缺乏功能性的CS 基因;(c)通过ATAC-seq鉴定,辛辣辣椒在胎座组织特异性打开CS 基因周围的染色质区域来实现辣椒素的组织特异性调控,而非辛辣物种由于缺乏功能性的CS 基因,不能进行辣椒素的生物合成。
目前的研究表明,有些辣椒不辣是由于其辣椒素类物质合成过程中的关键酶基因发生了缺失或突变,例如,辣椒素合成酶基因CS/AT3/Pun1、氨基转移酶基因AMT(又称为pAMT 或Pun2)、酮酰基-ACP还原酶基因CaKR1等。
2005年,康奈尔大学Molly M. Jahn团队在The Plant Journal杂志上发表了一篇题为“The Pun1 gene for pungency in pepper encodes a putative acyltransferase”的研究论文,作者发现SB2-66(来自抑制消减杂交文库的cDNA克隆)与辣味共分离,并在遗传图谱上与Pun1处于同一位置,文中将该基因称为AT3,且非辣味基因型在该基因启动子至第一个外显子的区域内缺失了2.5kb。Northern blot实验表明AT3在胎座组织中特异转录,并且AT3不在甜椒中转录。VIGS实验表明,和野生型相比,沉默AT3的植株中辣椒素含量减少了50%以上。
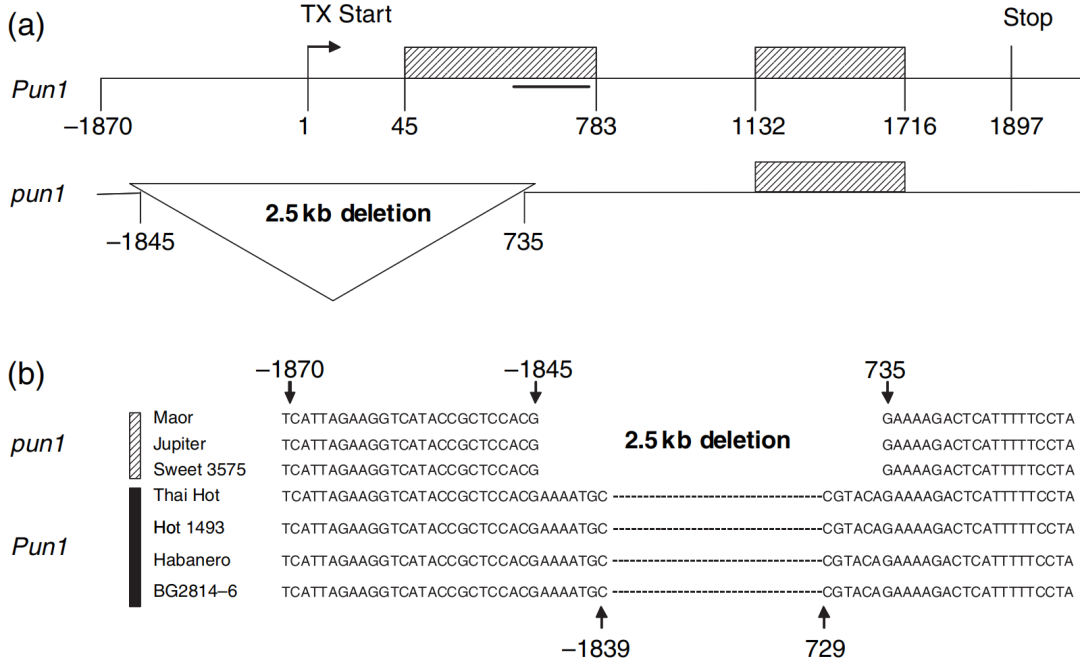
图11 辣味(Pun1/Pun1)和非辣味(pun1/pun1)基因型的Pun1基因座的基因组DNA序列和结构(Stewart et al., 2005)。(a)Pun1基因座示意图,pun1等位基因中的大片段缺失用倒三角形表示;(b)pun1基因型和Pun1基因型。
在前述“Whole-genome sequencing of cultivated and wild peppers provides insights into Capsicum domestication and specialization”的研究论文中,作者对栽培种遵辣1号和Chiltepin进行全基因组测序,也发现AT3-D1 基因的编码区在无辣味的品种中发生了大片段的丢失,导致其蛋白质翻译过程异常,不能够合成与辣味有关的物质。
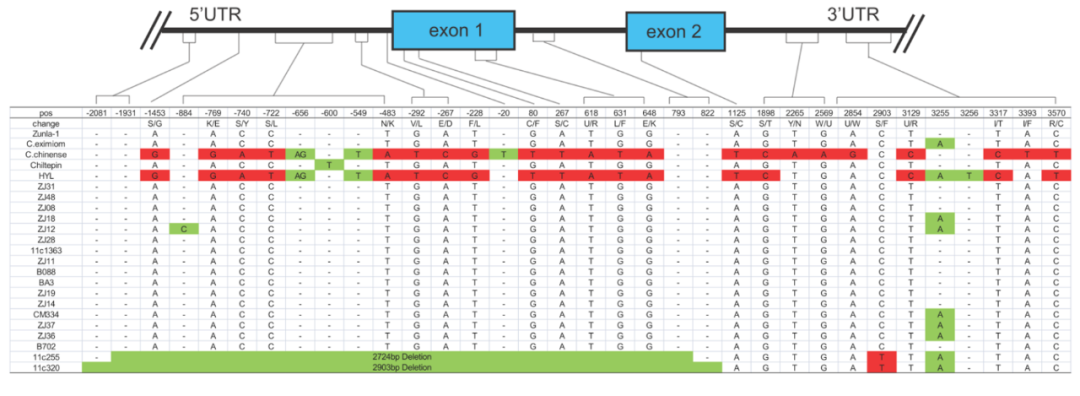
图12 AT3-D1 在20个栽培种中的基因型(Qin et al., 2014)。非辣品种11c250和11c255的AT3-D1有2724bp、2930bp的片段缺失。
表1 CS /AT3 /Pun1 基因的5种等位基因变异形式(改编自Yamaguchi et al., 2024)。

备注:上篇文章中2724bp、2930bp片段缺失的基因型未在此列,伯小远查看多篇资料发现它们均未被认定为单独的基因型,因此认为研究者们可能把这两种类型归入了pun11基因型中。
在辣椒素类物质合成通路上,若AMT基因发生突变,则香草醛无法生成香草基胺而生成香草醇,最终生成辣椒素酯类,而辣椒素酯类无辣味或低辣味。目前已发现11种形式的AMT基因型(表2)。
表2 AMT 基因的11种等位基因变异形式(改编自Tanaka et al., 2018)。
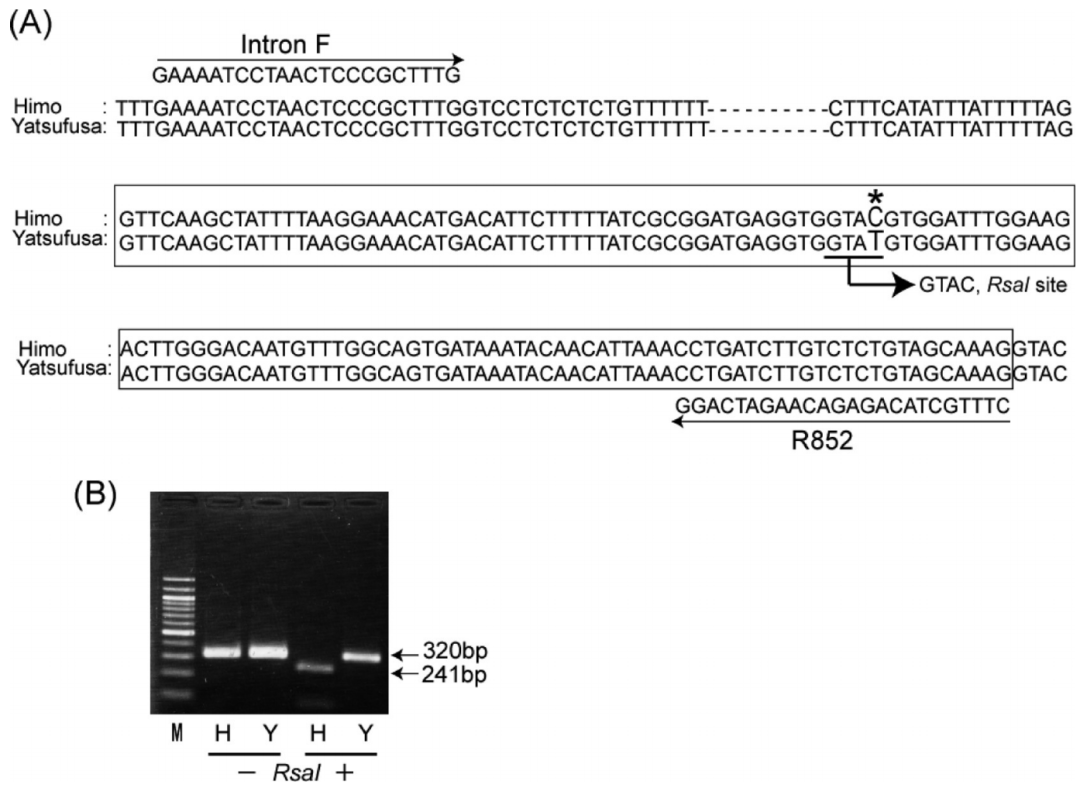
图13 为表1中的第2种基因型(Tanaka et al., 2010a)。(A)相比Yatsufusa(辛辣品种),Himo(非辛辣品种)在AMT 基因的第755bp处的T突变为C,导致半胱氨酸突变为精氨酸;(B)由于序列突变后形成了RsaI酶切位点,因此可以PCR扩增后将片段酶切,从条带大小判断基因型。
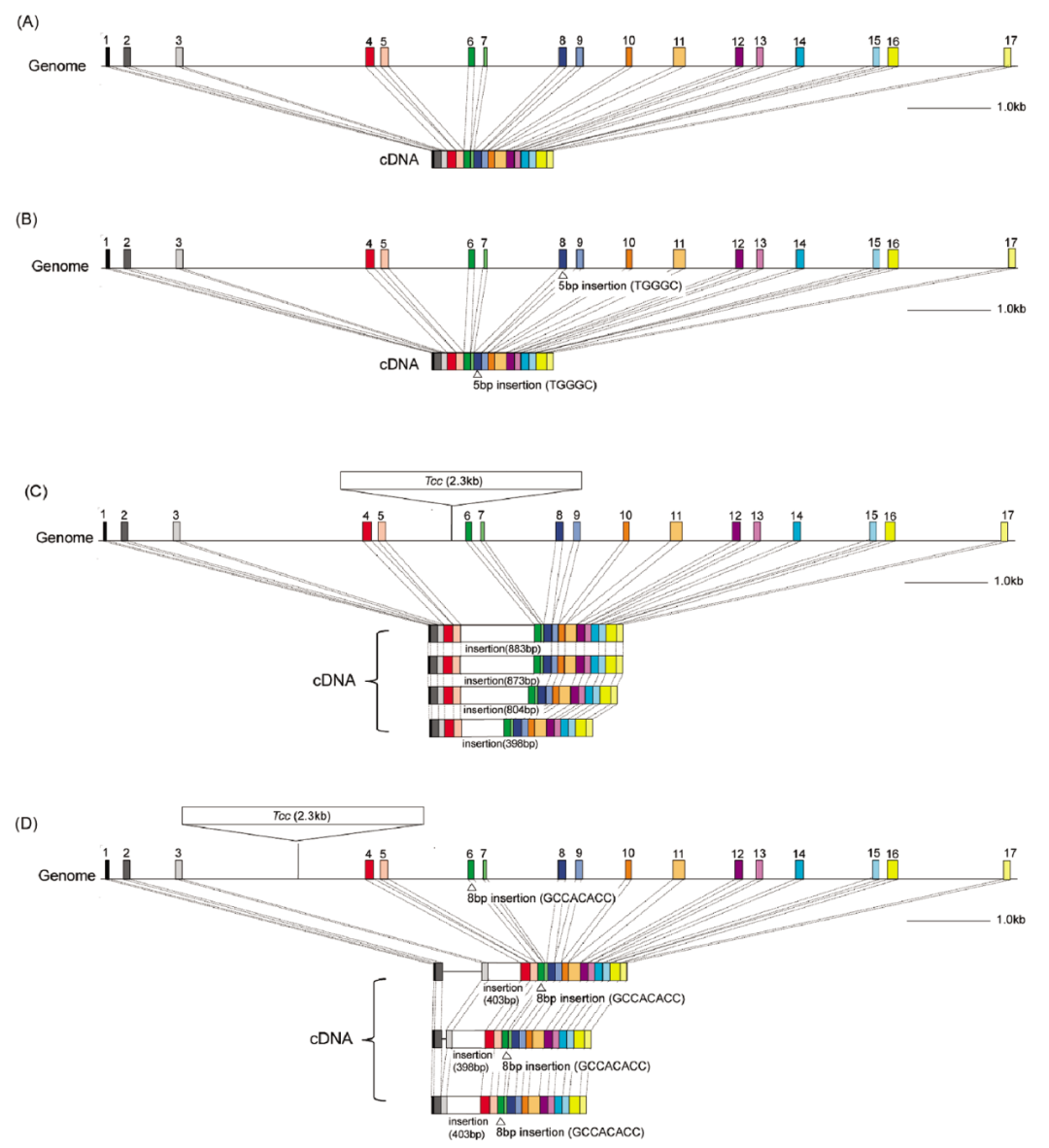
图14 (B-D)为表1中的第3、4、5种基因型(Tanaka et al., 2010b)。
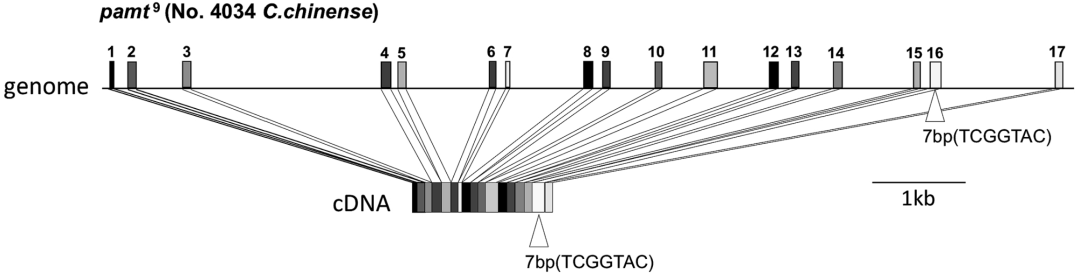
图15 为表1中的第9种基因型(Tanaka et al., 2018)。
以上,伯小远仅列举表1中的其中几种突变类型,大家了解一下即可。其实从CS/AT3 /Pun1 基因和AMT /pAMT /Pun2 基因存在如此多的基因型来看,可考虑“预测+组学+基因编辑”的方法,对这两个基因的CDS区、启动子区或UTR区进行突变,或许能得到不同辣味的辣椒新种质资源。如果受辣椒遗传转化体系的影响,可考虑“单倍体诱导+基因编辑”的方法来克服,可参考文章“青出于蓝-单倍体诱导技术的衍生”。
2018年,近畿大学Sota Koeda团队在Theoretical and Applied Genetics杂志上发表了一篇题为“Mutation in the putative ketoacyl-ACP reductase CaKR1 induces loss of pungency in Capsicum”的研究论文,作者利用哈瓦那辣椒(辛辣品种)和No.3341(非辛辣品种)的F2群体定位到一个与辣椒素合成有关的基因——酮酰基-ACP还原酶基因CaKR1。在No.3341中,CaKR1第一个内含子中插入了一个4.5kb的转座子,导致产生一个缺失催化结构域的截短蛋白。VIGS实验显示沉默CaKR1导致辣椒素含量降低。
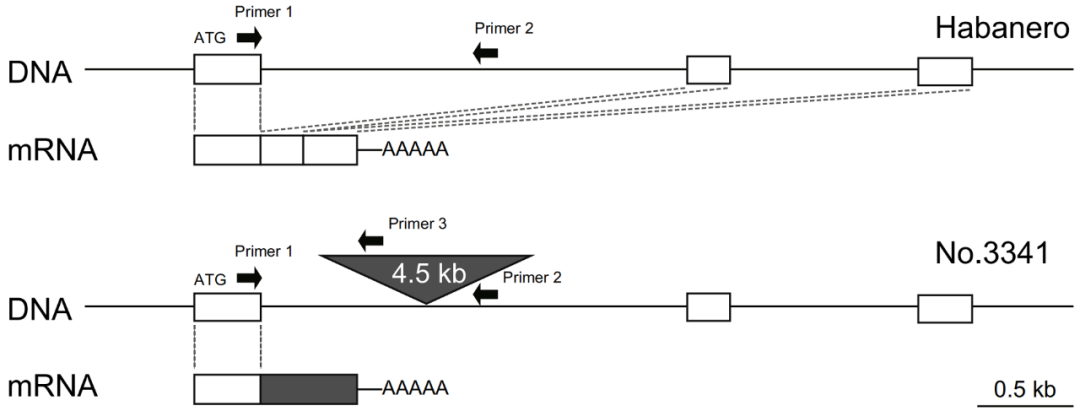
图16 在No.3341品种中,CaKR1基因的第一个内含子中插入了hAT-Tam3/Ac转座子(Koeda et al., 2019)。
在前文提到的“涮涮辣”、海南黄灯笼椒、辣椒X等超辣品种都属于黄灯笼辣椒(Capsicum chinense ),该栽培种的特点是含有很高的辣椒素,但原因未知。
2019年,华南农业大学雷建军团队在New Phytologist杂志上发表了一篇题为“Natural variations in the MYB transcription factor MYB31 determine the evolution of extremely pungent peppers”的研究论文,作者利用卡莱罗纳死神椒(极辛辣品种)和CA1(微辣品种)的群体定位到一个与辣味有关的基因MYB31,研究发现,MYB31直接靶向激活辣椒素合成酶基因AT3。作者也发现,WRKY9与MYB31以及辣椒素合成途径相关基因共表达,而WRKY9可激活MYB31基因,进而发现MYB31基因启动子变异是不同栽培种拥有不同辣味水平的原因:在Capsicum chinense中,WRKY9与MYB31启动子中的W-box元件结合并高度激活MYB31基因的表达,而在其他四个栽培种中,MYB31启动子中的W-box元件由于突变或缺失导致WRKY9对MYB31基因的激活减弱或消失。
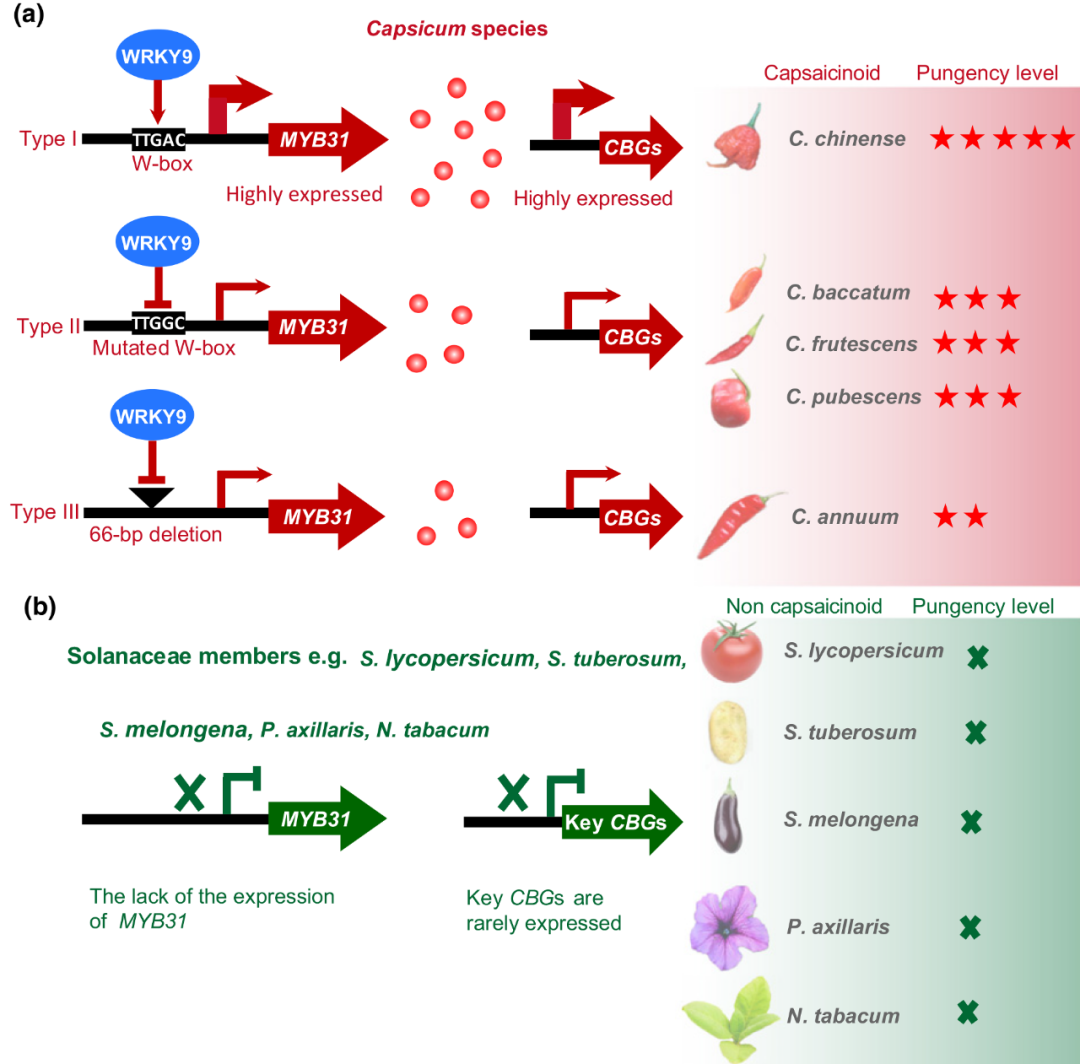
图17 辣椒属辣椒素类物质合成的模型,以及极辣种形成的原因(Zhu et al., 2019)。(a)MYB31 的表达及其启动子的变化决定了极辛辣的栽培种的形成;(b)在其他茄科植物中,MYB31 同源基因未表达,导致这些物种中关键辣椒素合成途径相关基因(CBGs)未被激活,无法合成辣椒素类物质。
分析表明,辣椒在约3600万年前与番茄、马铃薯分离,由此辣椒属从茄科中开始独立进化(Qin et al., 2014)。辣椒素合成途径可能在大约1340万年前(Capsicum rhomboideum 和Capsicum baccatum /Capsicum annuum 分化)和500万年前(Capsicum baccatum 和Capsicum annuum 分化)之间出现(Chen et al., 2024)。在前述多篇论文中,均发现辣椒素合成相关基因的同源基因在其他茄科作物番茄、马铃薯中也存在。辣椒素合成途径关键基因在辣椒果实中高度表达,而在其他茄科作物则微弱表达,辣椒素合成途径关键基因在辣椒中被激活表达是辣椒属植物能够合成辣椒素的原因。
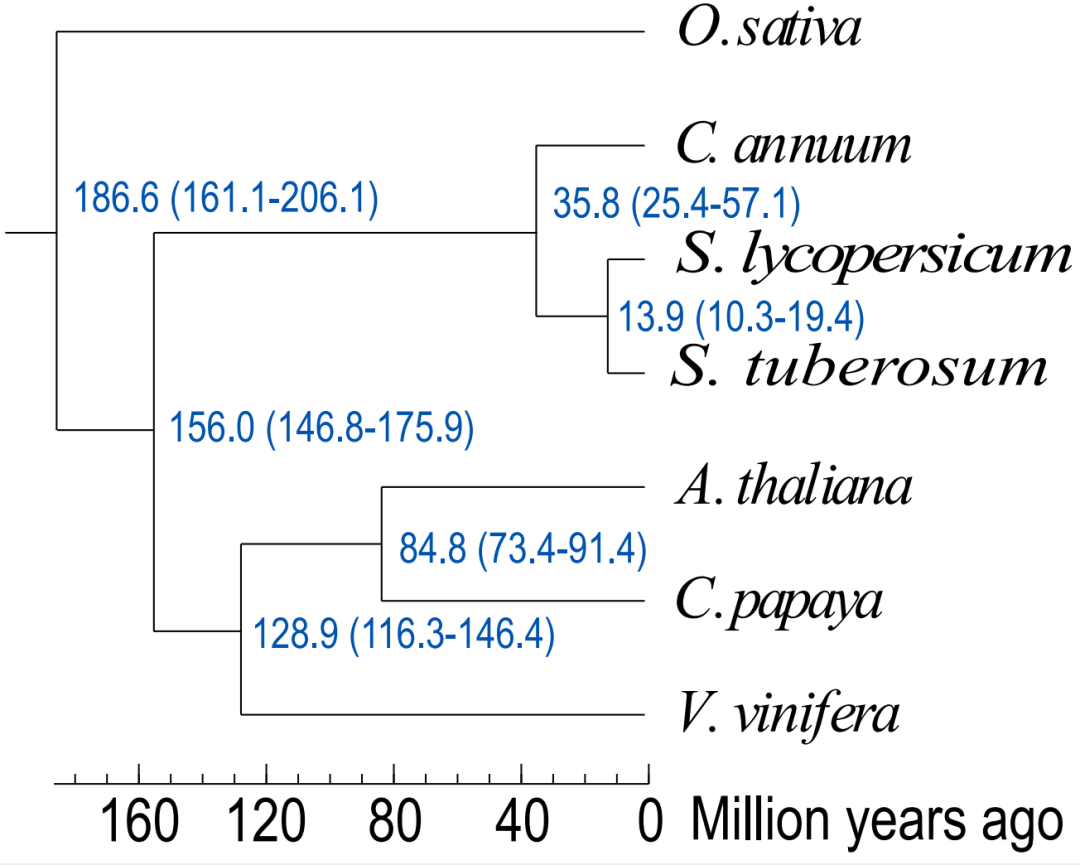
图18 辣椒与水稻、番茄、马铃薯、拟南芥、番木瓜和葡萄之间的基因组差异(Qin et al., 2014)。

图19 Capsicum annuum 和相关被子植物的系统基因组学分析(Chen et al., 2024)。
2019年,巴西维索萨联邦大学Agustin Zsögön团队在Trends in Plant Science 杂志上发表了一篇题为“Capsaicinoids: Pungency beyond Capsicum ”的研究论文,作者认为,番茄中本来就有辣椒素生物合成的基因,通过基因编辑技术,可以重新“唤醒”这些基因,制造辣椒味番茄,成为获取辣椒素合成的新来源。
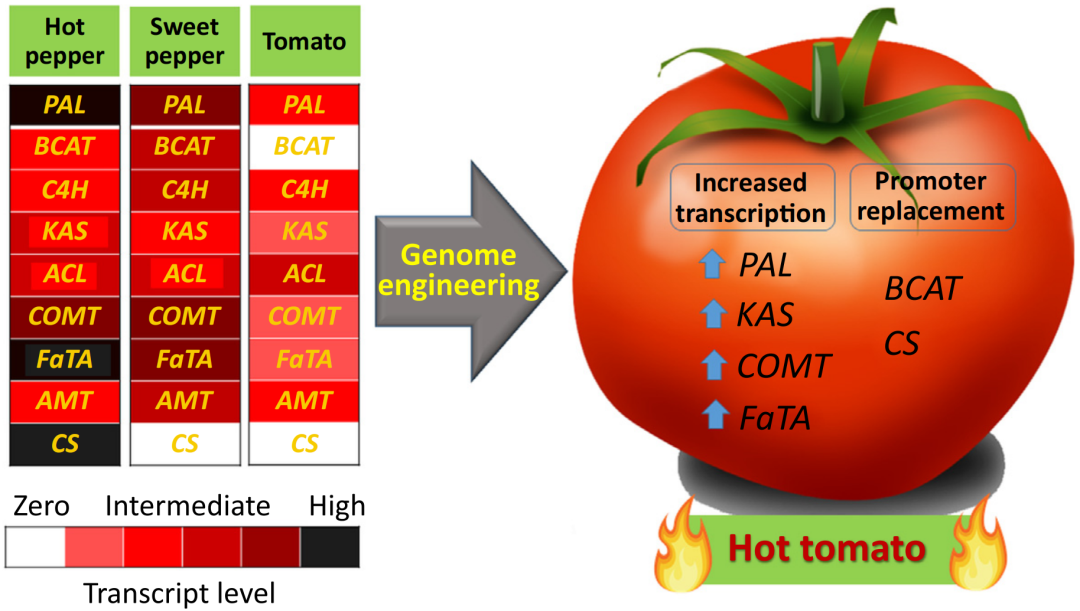
图20 在辣椒、甜椒和番茄中,与辣椒素类物质合成有关的基因转录图谱(Naves et al., 2019)。利用基因编辑技术,提高番茄中PAL、KAS 、COMT 和FaTA的表达,并激活BCAT 、CS 的表达,可能可以得到辣椒味的番茄。
在本篇文章中,伯小远首先科普了一些关于辣椒有趣的知识点,然后简要概述了辣椒素合成相关的分子机制研究进展。解析辣椒素合成相关的分子机制对开发及培育辣椒新种质有重要的意义,研究者除了关注前面提到的辣椒素合成相关基因,还可以关注调控辣椒素类物质合成过程中关键酶基因表达的调控基因例如MYB31,挖掘这些基因不同的基因型可用于开发分子标记,或者对应用基因编辑技术提供新思路。另外,大家一定要看看图17的那篇文献,伯小远最初就是看了它才决定写本篇文章的,作者逻辑清晰、环环相扣,讲述了一个完整且生动的故事,大家千万不要错过喔。现在,文章也看完了,可以想想今天中午吃什么了,水煮鱼?麻辣火锅?酸辣粉?还是麻辣烫呢?
雷建军,朱张生,孙彬妹,陈国菊,陈长明,曹必好,辣椒素类物质生物合成及其分子生物学机理研究进展,园艺学报,2018,45 (9):1739–1749.
Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D (1997) The capsaicin receptor: a heat-activated ion channel in the pain pathway. NATURE 389: 816-824
Chen, W., Wang, X., Sun, J., Wang, X., Zhu, Z., Ayhan, D. H., … & Guo, L. (2024). Two telomere-to-telomere gapless genomes reveal insights into Capsicum evolution and capsaicinoid biosynthesis. Nature Communications, 15(1), 4295.
Dhamodharan, K., Vengaimaran, M., & Sankaran, M. (2023). Pharmacological Properties and Health Benefits of Capsicum Species: A Comprehensive Review. IntechOpen. doi: 10.5772/intechopen.104906
Hoffman, P. G., Lego, M. C., & Galetto, W. G. (1983). Separation and quantitation of red pepper major heat principles by reverse-phase high-pressure liquid chromatography. Journal of Agricultural and Food Chemistry, 31(6), 1326-1330.
Kirii, E., Goto, T., Yoshida, Y., Yasuba, K. I., & Tanaka, Y. (2017). Non-pungency in a Japanese chili pepper landrace (Capsicum annuum) is caused by a novel loss-of-function Pun1 allele. The Horticulture Journal, 86(1), 61-69.
Kim S, Park M, Yeom SI, Kim YM, Lee JM, Lee HA, Seo E, Choi J, Cheong K, Kim KT, Jung K, Lee GW, Oh SK, Bae C, Kim SB, Lee HY, Kim SY, Kim MS, Kang BC, Jo YD, Yang HB, Jeong HJ, Kang WH, Kwon JK, Shin C, Lim JY, Park JH, Huh JH, Kim JS, Kim BD, Cohen O, Paran I, Suh MC, Lee SB, Kim YK, Shin Y, Noh SJ, Park J, Seo YS, Kwon SY, Kim HA, Park JM, Kim HJ, Choi SB, Bosland PW, Reeves G, Jo SH, Lee BW, Cho HT, Choi HS, Lee MS, Yu Y, Do CY, Park BS, van Deynze A, Ashrafi H, Hill T, Kim WT, Pai HS, Ahn HK, Yeam I, Giovannoni JJ, Rose JK, Sorensen I, Lee SJ, Kim RW, Choi IY, Choi BS, Lim JS, Lee YH, Choi D (2014) Genome sequence of the hot pepper provides insights into the evolution of pungency in Capsicum species. NAT GENET 46: 270-278
Koeda S, Sato K, Saito H, Nagano AJ, Yasugi M, Kudoh H, Tanaka Y (2019) Mutation in the putative ketoacyl-ACP reductase CaKR1 induces loss of pungency in Capsicum. THEOR APPL GENET 132: 65-80
Naves ER, de Avila SL, Sulpice R, Araujo WL, Nunes-Nesi A, Peres L, Zsogon A (2019) Capsaicinoids: Pungency beyond Capsicum. TRENDS PLANT SCI 24: 109-120
Qin C, Yu C, Shen Y, Fang X, Chen L, Min J, Cheng J, Zhao S, Xu M, Luo Y, Yang Y, Wu Z, Mao L, Wu H, Ling-Hu C, Zhou H, Lin H, Gonzalez-Morales S, Trejo-Saavedra DL, Tian H, Tang X, Zhao M, Huang Z, Zhou A, Yao X, Cui J, Li W, Chen Z, Feng Y, Niu Y, Bi S, Yang X, Li W, Cai H, Luo X, Montes-Hernandez S, Leyva-Gonzalez MA, Xiong Z, He X, Bai L, Tan S, Tang X, Liu D, Liu J, Zhang S, Chen M, Zhang L, Zhang L, Zhang Y, Liao W, Zhang Y, Wang M, Lv X, Wen B, Liu H, Luan H, Zhang Y, Yang S, Wang X, Xu J, Li X, Li S, Wang J, Palloix A, Bosland PW, Li Y, Krogh A, Rivera-Bustamante RF, Herrera-Estrella L, Yin Y, Yu J, Hu K, Zhang Z (2014) Whole-genome sequencing of cultivated and wild peppers provides insights into Capsicum domestication and specialization. P NATL ACAD SCI USA 111: 5135-5140
Scoville, W. L. (1912). Note on capsicums. The Journal of the American Pharmaceutical Association (1912), 1(5), 453-454.
Stewart CJ, Kang BC, Liu K, Mazourek M, Moore SL, Yoo EY, Kim BD, Paran I, Jahn MM (2005) The Pun1 gene for pungency in pepper encodes a putative acyltransferase. PLANT J 42: 675-688
Stewart Jr, C., Mazourek, M., Stellari, G. M., O’Connell, M., & Jahn, M. (2007). Genetic control of pungency in C. chinense via the Pun1 locus. Journal of experimental botany, 58(5), 979-991.
Stellari GM, Mazourek M, Jahn MM (2010) Contrasting modes for loss of pungency between cultivated and wild species of Capsicum. HEREDITY 104: 460-471
Tanaka Y, Hosokawa M, Miwa T, Watanabe T, Yazawa S (2010a) Newly mutated putative-aminotransferase in nonpungent pepper (Capsicum annuum) results in biosynthesis of capsinoids, capsaicinoid analogues. J AGR FOOD CHEM 58: 1761-1767
Tanaka Y, Hosokawa M, Miwa T, Watanabe T, Yazawa S (2010b) Novel loss-of-function putative aminotransferase alleles cause biosynthesis of capsinoids, nonpungent capsaicinoid analogues, in mildly pungent chili peppers (Capsicum chinense). J AGR FOOD CHEM 58: 11762-11767
Tanaka, Y., Fukuta, S., Koeda, S., Goto, T., Yoshida, Y., & Yasuba, K. I. (2018). Identification of a novel mutant pAMT allele responsible for low-pungency and capsinoid production in chili pepper: accession ‘No. 4034’(Capsicum chinense). The Horticulture Journal, 87(2), 222-228.
Tewksbury JJ, Nabhan GP (2001) Seed dispersal. Directed deterrence by capsaicin in chilies. NATURE 412: 403-404
Tewksbury JJ, Reagan KM, Machnicki NJ, Carlo TA, Haak DC, Penaloza AL, Levey DJ (2008) Evolutionary ecology of pungency in wild chilies. P NATL ACAD SCI USA 105: 11808-11811
Yamaguchi, M., Kondo, F., Nemoto, K., & Matsushima, K. (2024). An 18.5-kbp Deletion in the Genomic Region, Including the Pun1, is Responsible for Non-pungency Traits in the Japanese Sweet Pepper ‘Sampo Oamanaga’(Capsicum annuum). The Horticulture Journal, QH-100.
Zhu Z, Sun B, Cai W, Zhou X, Mao Y, Chen C, Wei J, Cao B, Chen C, Chen G, Lei J (2019) Natural variations in the MYB transcription factor MYB31 determine the evolution of extremely pungent peppers. NEW PHYTOL 223: 922-938
























