本文内容速览:
植物中的PTMs已经成为广大研究者研究的热点,小远在往期推文“蛋白翻译后修饰——乙酰化”、“蛋白翻译后修饰——泛素化”以及“蛋白翻译后修饰——磷酸化(二)”中介绍了几种常见的修饰及研究方法,虽然PTMs的种类繁多,但是其研究套路仍然有相通的地方,因此小远在此给大家总结了关于PTMs的通用研究套路,希望对大家有所帮助。
图1 Plant PTM Viewer对植物中33种PTMs的统计(Plant PTM Viewer网站)。(A)植物种发生33种PTMs的修饰位点;(B)植物中发生33种PTMs的蛋白。
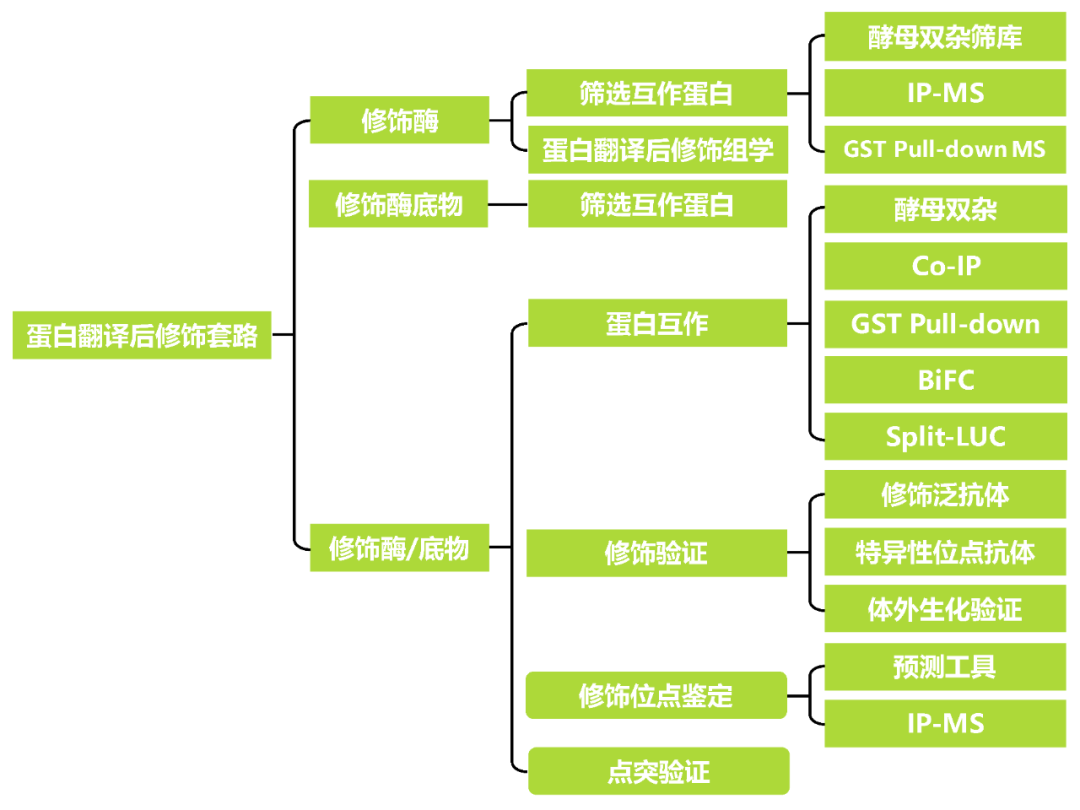
2.1修饰酶
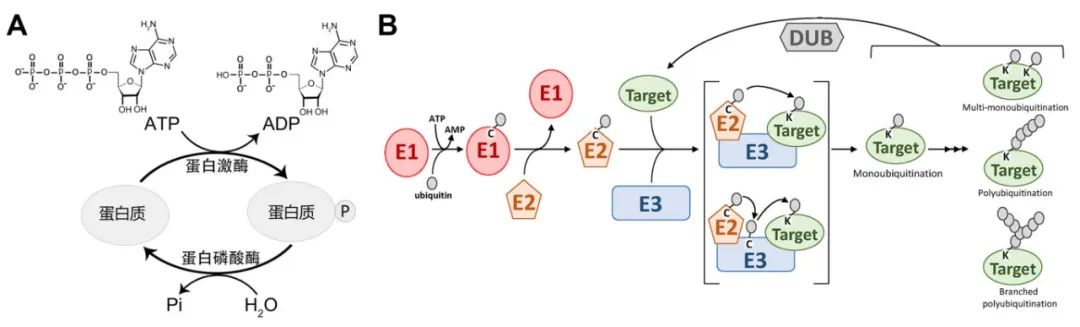
PTMs的相关酶包括激酶、磷酸酶、转移酶和连接酶等,这些酶中有些是关键的修饰酶,而有些只是辅助修饰过程的酶,目前关于修饰的研究中可能关注更多的是修饰酶。有些修饰例如磷酸化修饰等是可逆的(图2),因此这些可逆的修饰除了有修饰酶例如激酶,也有与之对应的去修饰酶例如磷酸酶。由于去修饰酶也可介导修饰,因此也 属于修饰酶。对于修饰酶来说,可以通过互作蛋白的筛选和蛋白翻译后修饰组学鉴定其底物,接下来小远将从这两个方向进行相关的案例分享。
关于筛选互作蛋白的方法有很多,例如酵母筛库以及IP-MS等,这些方法的相关介绍可以查看往期推文“酵母建库+酵母筛库”和“筛选目的蛋白的互作蛋白方法之IP-MS”。
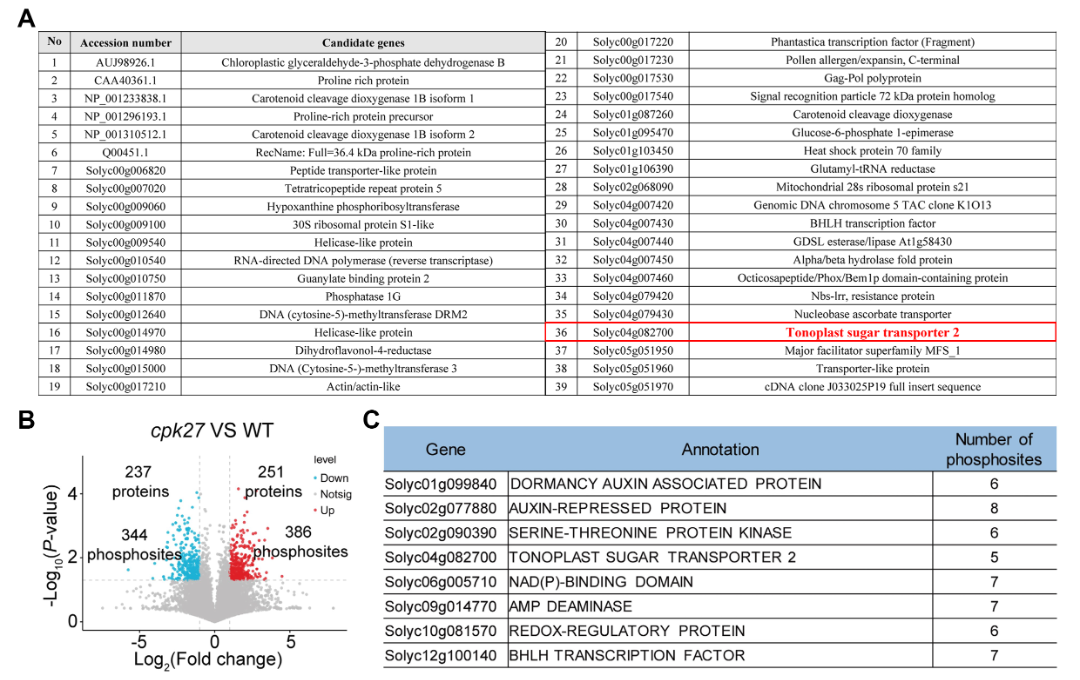
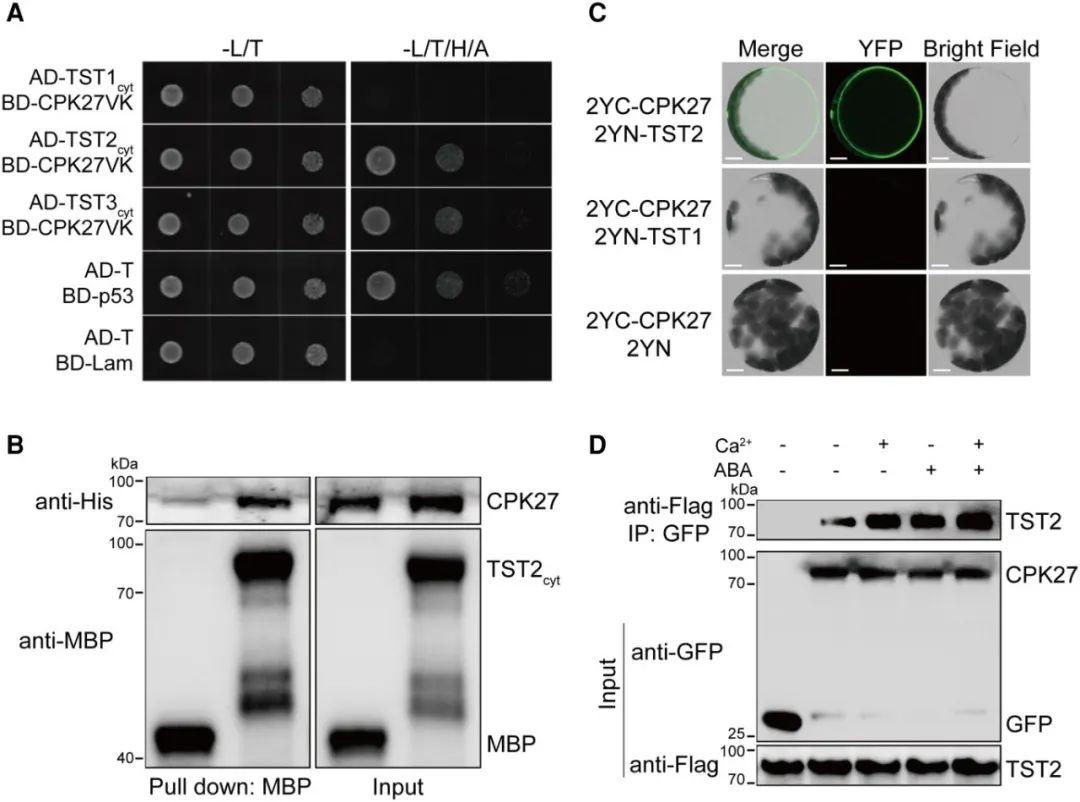
2024年3月,浙江大学胡璋健课题组在Plant Physiology杂志上发表了一篇题为“Phosphorylation of sugar transporter TST2 by protein kinase CPK27 enhances drought tolerance in tomato”的研究论文,作者为了解析番茄中钙依赖性蛋白激酶CPK27如何通过调控可溶性糖的积累来提高耐旱性,对CPK27的靶标底物进行了筛选。有意思的是,作者通过酵母筛库鉴定到了CPK27的互作蛋白液泡膜糖转运蛋白TST2(图3A),也通过磷酸化修饰组学鉴定到了有5个磷酸化位点的TST2(图3B),两种实验方法的结果说明了TST2很有可能是CPK27的磷酸化底物。
在这篇文章中,作者通过两种方法进行了CPK27底物的筛选,这两种方法都筛选到了同一个底物,有些文章中只用了一种方法进行筛选,因此大家实际进行筛选的时候可以选一种方法也可以两种方法都选用。此外,小远认为如果目的蛋白是修饰酶的话,通过蛋白翻译后修饰组学筛选底物可能是最优选择,因为通过组学可以分析出不同材料或处理中修饰上调/下调的蛋白及其修饰位点数,可以比酵母筛库获得更多有关于候选底物的修饰信息,从而帮助我们更好地进行下一步实验。
在植物基因功能研究中,如果想研究某个底物蛋白上的修饰以及寻找其修饰酶的话,那么与2.1中所述方法一致,可以通过筛选互作蛋白的方法来进行筛选。
2024年2月,山东大学丁兆军课题组在The Plant Cell杂志上发表了一篇题为“MAC3A and MAC3B mediate degradation of the transcription factor ERF13 and thus promote lateral root emergence”的研究论文,作者在之前的研究中发现高浓度的生长素会导致乙烯响应元件结合因子ERF13的降解,为了深入探究这一过程,在该论文中,作者期望筛选到ERF13的互作蛋白中的泛素连接酶,旨在通过泛素化过程解释ERF13的降解。与原本预想的一致,作者通过IP-MS成功筛选到了候选的泛素连接酶MAC3B(图4),后续通过一系列的分子实验证明了MAC3B介导了ERF13的泛素化降解。
在前面提到的“Phosphorylation of sugar transporter TST2 by protein kinase CPK27 enhances drought tolerance in tomat”研究论文中,作者为了验证CPK27和TST2的互作关系,通过酵母双杂、Pull-down、BiFC以及Co-IP验证了两者确实互作(图5),这说明CPK27很有可能介导了TST2的磷酸化修饰。
修饰验证
检测一个蛋白的修饰情况最常用的方法就是通过抗体进行WB实验。但是有些修饰例如磷酸化修饰,由于其独特的性质,除了用抗体检测修饰蛋白之外,还可以通过Phos-tag胶进行WB分离及显示磷酸化蛋白,从而也能实现对磷酸化情况的检测,不过本文旨在总结和介绍修饰的通用套路,所以该方法就不过多介绍,感兴趣的可以自行了解。
修饰的抗体主要分为两种类型,一种是修饰的泛抗体,另外一种是修饰的特异性位点抗体。泛抗体只能检测某种修饰或特定的一类氨基酸残基上的修饰情况,简而言之就是无法通过这种抗体检测蛋白中某个具体氨基酸残基上的修饰情况。相反,特异性位点抗体就可以检测蛋白中某个具体氨基酸残基上的修饰情况。
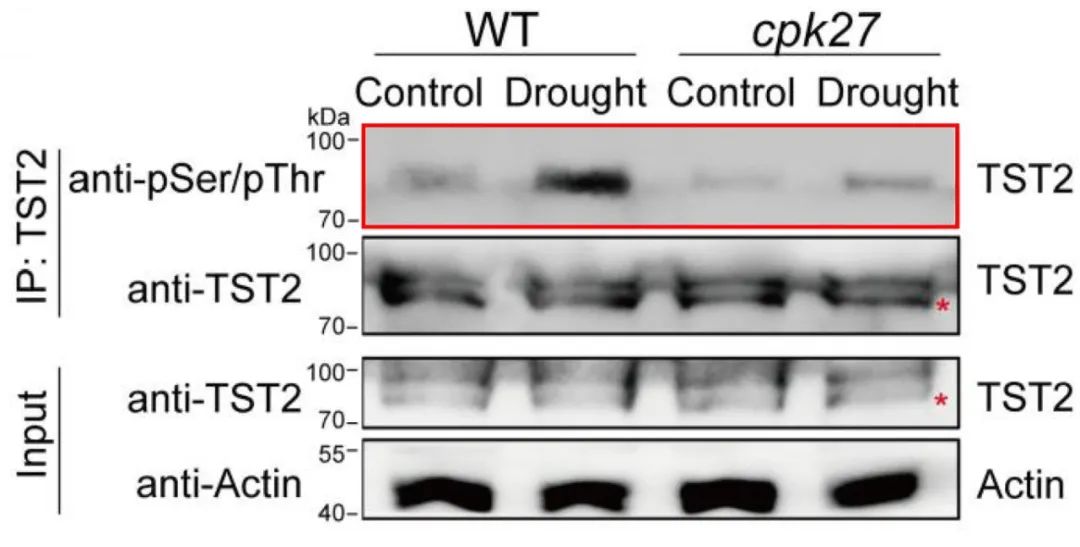
在上述“Phosphorylation of sugar transporter TST2 by protein kinase CPK27 enhances drought tolerance in tomat”的研究论文中,验证了CPK27和TST2的互作关系后,作者通过磷酸化泛抗体(抗磷酸化丝氨酸/苏氨酸)WB实验证明TST2上存在磷酸化修饰,同时在cpk27突变体中检测到TST2的磷酸化修饰程度降低(图6)。此外,干旱条件处理后,WT相比于cpk27突变体中TST2的磷酸化差异更明显(图6),这说明TST2可能通过CPK27介导的磷酸化修饰响应了干旱条件。
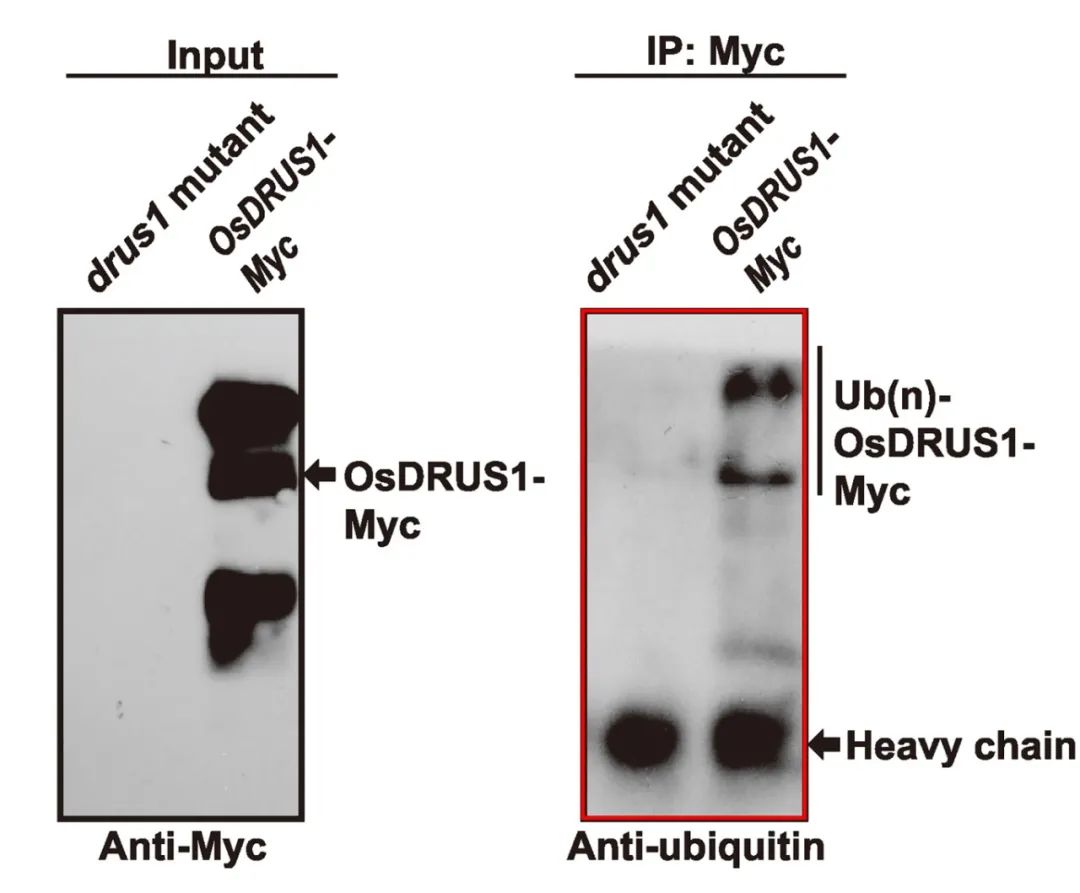
2020年11月,华南农业大学周海课题组在Genomics, Proteomics & Bioinformatics杂志上发表了一篇题为“Ubiquitinome Profiling Reveals the Landscape of Ubiquitination Regulation in Rice Young Panicles”的研究论文,作者为了验证蛋白泛素化修饰组学的可靠性,通过泛素化泛抗体检测了OsDRUS1在突变前后的泛素化情况,结果显示突变体中OsDRUS1几乎看不到修饰的条带,但是稳转OsDRUS1-Myc的材料中可以看到明显的修饰条带(图7),这说明OsDRUS1确实发生了泛素化修饰,也进一步证实了组学结果的可靠性。
图7 通过泛素化泛抗体检测OsDRUS1上的泛素化修饰情况(Zhu et al., 2020)。
上面介绍了通过泛抗体检测蛋白修饰情况的相关文章,接下来小远给大家分享通过特异性位点抗体检测蛋白修饰情况的相关案例。
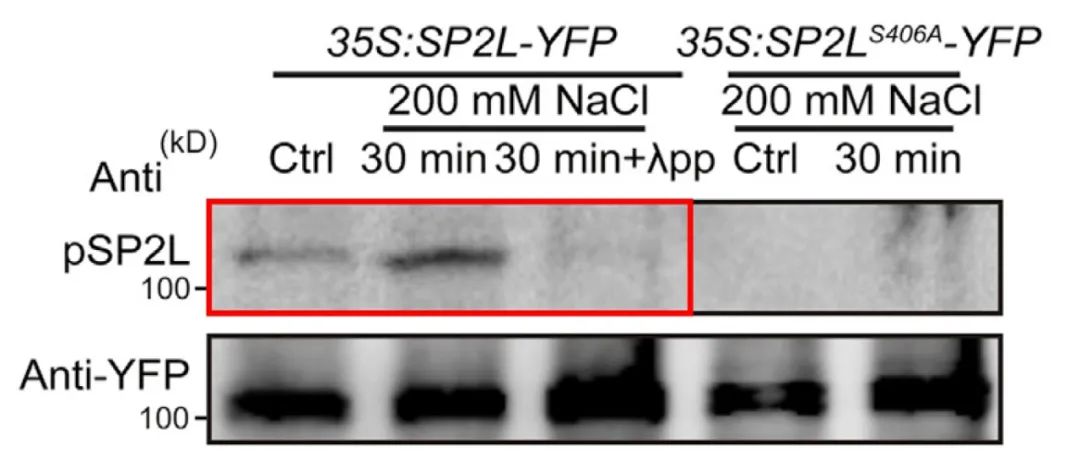
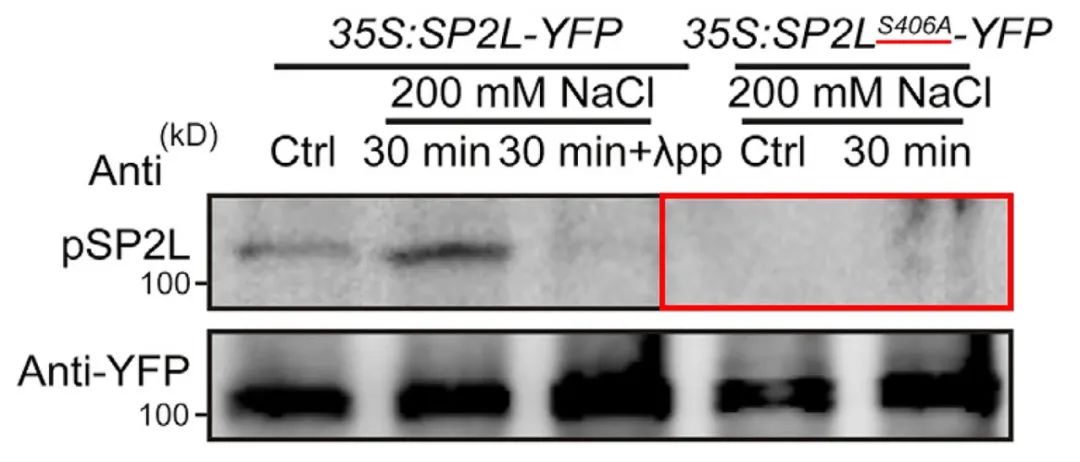
2022年10月,中国科学院分子植物科学卓越创新中心赵杨课题组在Developmental Cell杂志上发表了一篇题为“Root twisting drives halotropism via stress-induced microtubule reorientation”的研究论文,作者为了验证SP2L 406号丝氨酸残基(Ser406)上的磷酸化是否跟盐胁迫相关,通过该位点的特异性磷酸化抗体进行WB检测,发现盐胁迫会导致Ser406残基上的磷酸化增强,并且这种趋势可以被磷酸酶消除(图8),这说明SP2L Ser406残基上的磷酸化确实是受盐胁迫所调控的。
图8 通过SP2L Ser406磷酸化抗体检测SP2L上的磷酸化情况(Yu et al., 2022)。
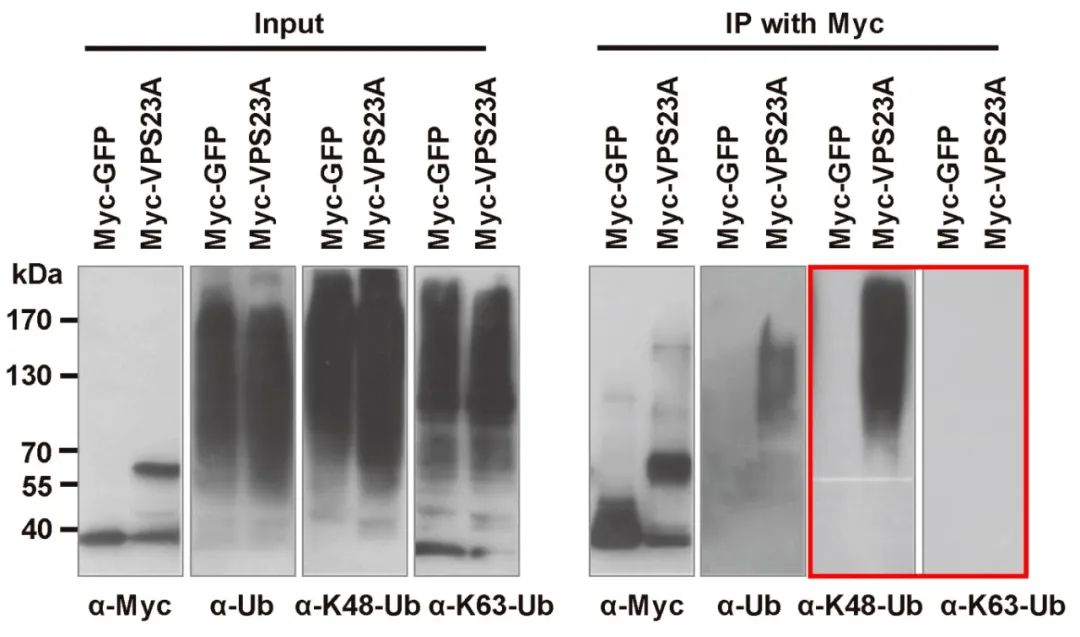
2020年9月,中国科学院遗传与发育生物学研究所谢旗课题组在Molecular Plant杂志上发表了一篇题为“ESCRT-I Component VPS23A Is Targeted by E3 Ubiquitin Ligase XBAT35 for Proteasome-Mediated Degradation in Modulating ABA Signaling”的研究论文,为了验证VPS23A是否会被泛素化降解以及被泛素化的位点,作者通过48位赖氨酸(K48)和63位赖氨酸(K63)泛素化抗体进行WB检测,发现VPS23A主要通过K48残基上的泛素化从而被降解(图9)。
图9 通过K48和K63位泛素化抗体检测VPS23A的泛素化情况(Yu et al., 2020)。
前面提到的这些都是体内检测修饰情况的方法,对于磷酸化等研究比较多的修饰还可以通过体外的方法进行检测。
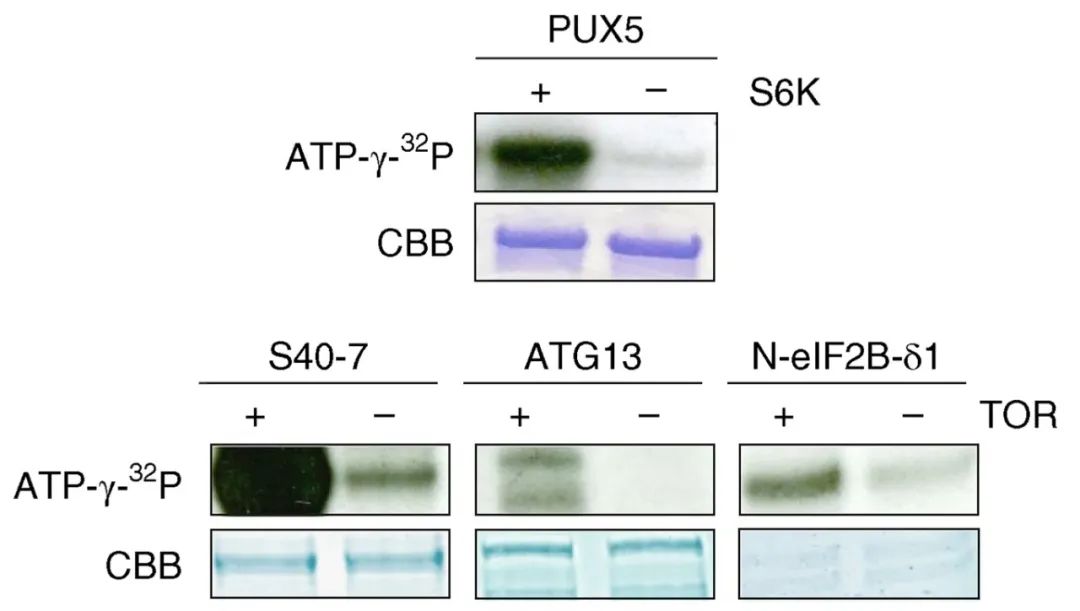
2019年3月,比利时根特大学Geert De Jaeger课题组在Nature Plants杂志上发表了一篇题为“Capturing the phosphorylation and protein interaction landscape of the plant TOR kinase”的研究论文,为了进一步证实TOR(雷帕霉素靶激酶)可以磷酸化PUX5、S40-7、ATG13以及eIF2B-δ1,作者通过在体外模拟磷酸化反应,证实了这些底物确实可以被TOR磷酸化。同样的,泛素化也可以通过体外的方法进行模拟,相关案例可见往期推文“蛋白翻译后修饰——泛素化(二)”。
修饰位点鉴定
在确定了修饰酶确实可以修饰底物后,通常还会进行具体的修饰位点鉴定。目前鉴定底物的修饰位点通常有两种方法,一是通过各种修饰位点的预测网站进行预测,二是先IP富集底物后,再进行质谱(MS)分析。目前预测网站主要针对研究比较多的修饰,小远给大家总结了部分修饰位点的预测网站,由于小远没有一一用过,具体预测效果还是要大家自行尝试哦。
表1 部分蛋白修饰位点预测网站。
预测网站针对的修饰类型有限,预测结果也不一定准确,最准确的方法还是通过IP富集底物后再进行MS分析,这个方法与寻找互作蛋白时用的IP-MS类似,不同的是这里只需将底物蛋白IP富集下来,分析底物蛋白上修饰的类型及对应的位置即可。
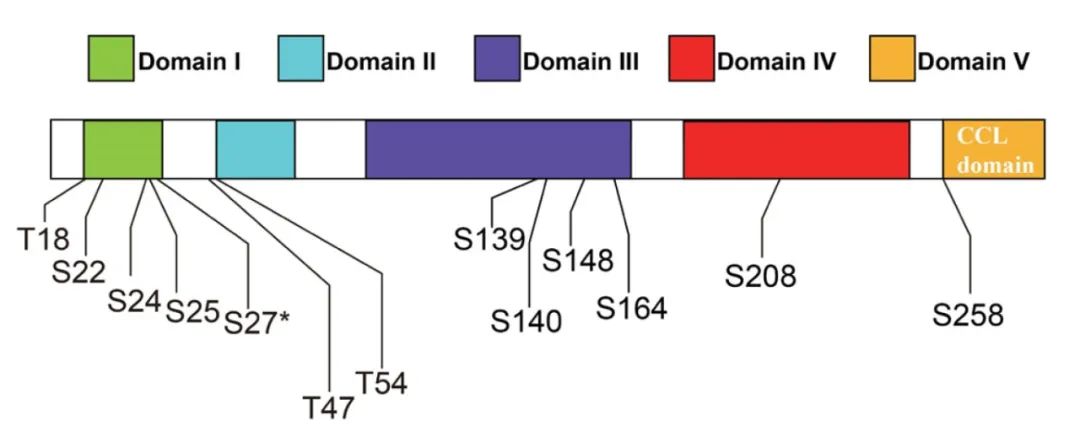
2023年9月,清华大学陈浩东课题组在Cell杂志上发表了一篇题为“Amyloplast sedimentation repolarizes LAZYs to achieve gravity sensing in plants”的研究论文,为了探究向重力性关键调控因子LAZY如何介导调控植物的向重力性,作者通过MS分析重力刺激前后LAZY的磷酸化差异,共鉴定到其存在13个磷酸化位点(图11),并且这些位点的磷酸化水平在重力刺激后普遍上调,这暗示植物的向重力性可能与LAZY的磷酸化有关。
图11 通过MS鉴定LAZY上的磷酸化修饰位点(Chen et al., 2023)。
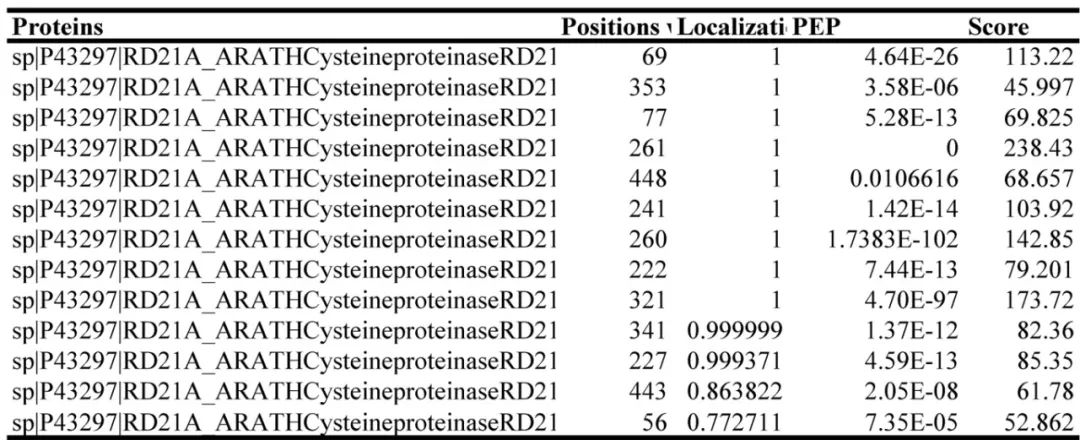
2023年11月,华中农业大学姜道宏课题组在Plant Physiology杂志上发表了一篇题为“Protist ubiquitin ligase effector PbE3-2 targets cysteine protease RD21A to impede plant immunity”研究论文,作者为了鉴定泛素连接酶PbE3-2泛素化RD21A具体的位点信息,将RD21A IP下来后进行MS分析,共计分析到13个泛素化位点(图12)。
点突验证
在鉴定到具体的修饰位点后,为了进一步说明该位点发生了修饰,可以将修饰位点的氨基酸进行突变后验证修饰情况,即点突验证。正常来说如果底物某个氨基酸残基上发生了修饰,这个氨基酸突变成其他氨基酸后就会导致底物上的修饰程度降低。在前面提到的“Root twisting drives halotropism via stress-induced microtubule reorientation”一文中,在鉴定完SP2L的Ser406残基上存在磷酸化修饰后,作者将S(Ser)突变成A(Ala)后,发现SP2L上的磷酸化基本消失了(图13),这进一步说明了SP2L的磷酸化主要发生在Ser406残基上。
References: