本文内容速览:
(3)诱导型启动子(Inducible promoter),即在某些特定的物理或化学信号刺激后,这类启动子可以有效调控基因的转录水平,使其显著提升。
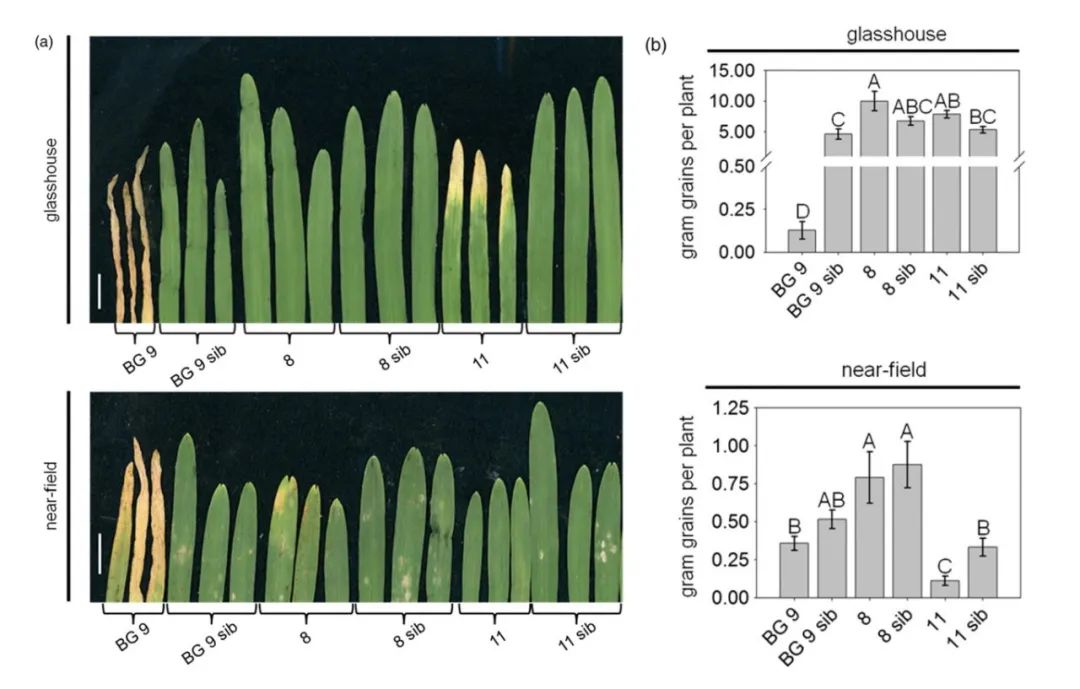
图1 Hv‑Ger4c::Ta‑Lr34res大麦显示叶尖坏死(LTN)降低,对生长的影响也降低(Boni et al., 2018)。(a)为了评估LTN,取了五叶阶段大麦的第一片叶子,在温室条件下,虽然编号为8的Hv‑Ger4c::Ta‑Lr34res大麦表现出LTN,但是与由自身启动子驱动Ta‑Lr34res表达的BG9株系相比,LTN水平降低。(b)为了评估生长参数,将植物培养直至成熟,收获10株单独的植物并测定每株植物的籽粒重量。
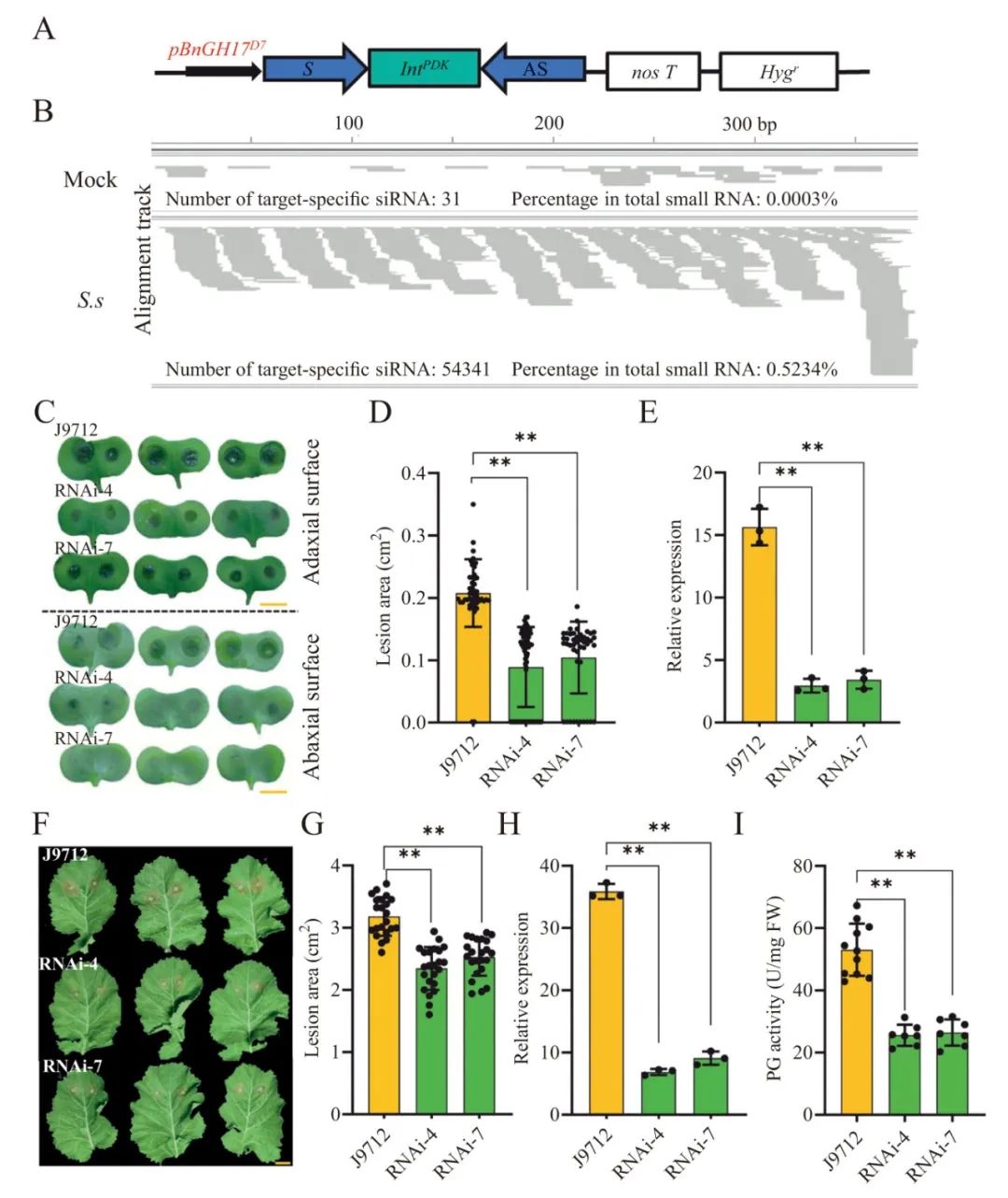
图2 甘蓝型油菜中核盘菌SsPG1的宿主诱导基因沉默(HIGS)(Lin et al., 2022)。(A)HIGS载体示意图。(B)HIGS转基因T1植物未接种叶片(Mock)和接种叶片(S.s)中SsPG1的小RNA分析。(C、D、F、G)通过子叶接种(C、D)和离体叶片接种(F、G)来评估HIGS转基因甘蓝型油菜对核盘菌的抗病性,接种后48小时对接种位置的侵染情况进行拍照和测量。(E、H)SsPG1在核盘菌感染的油菜子叶(E)和叶片(H)中的表达量。(I)在感染后24小时测定受核盘菌感染的油菜叶片中多聚半乳糖醛酸酶(PG)的活性。
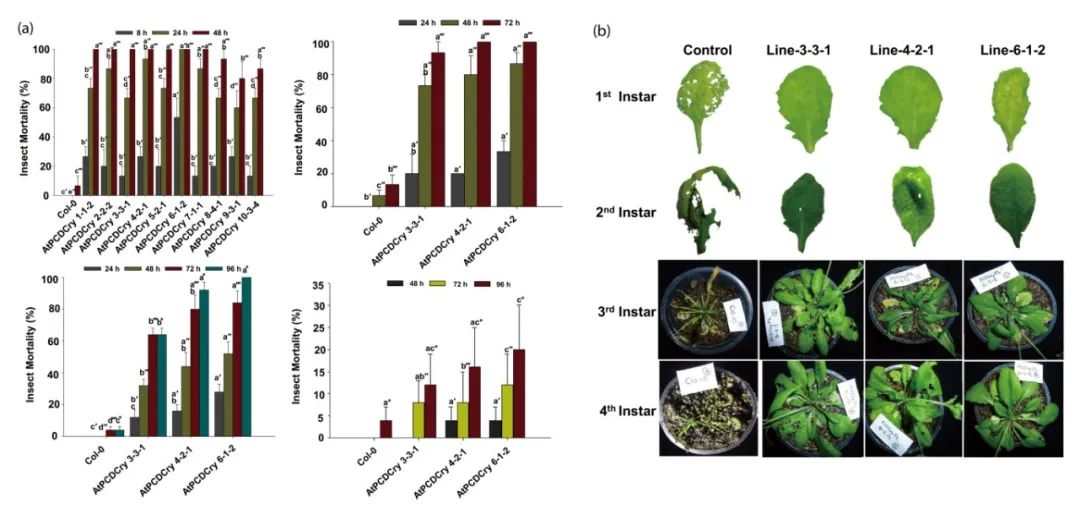
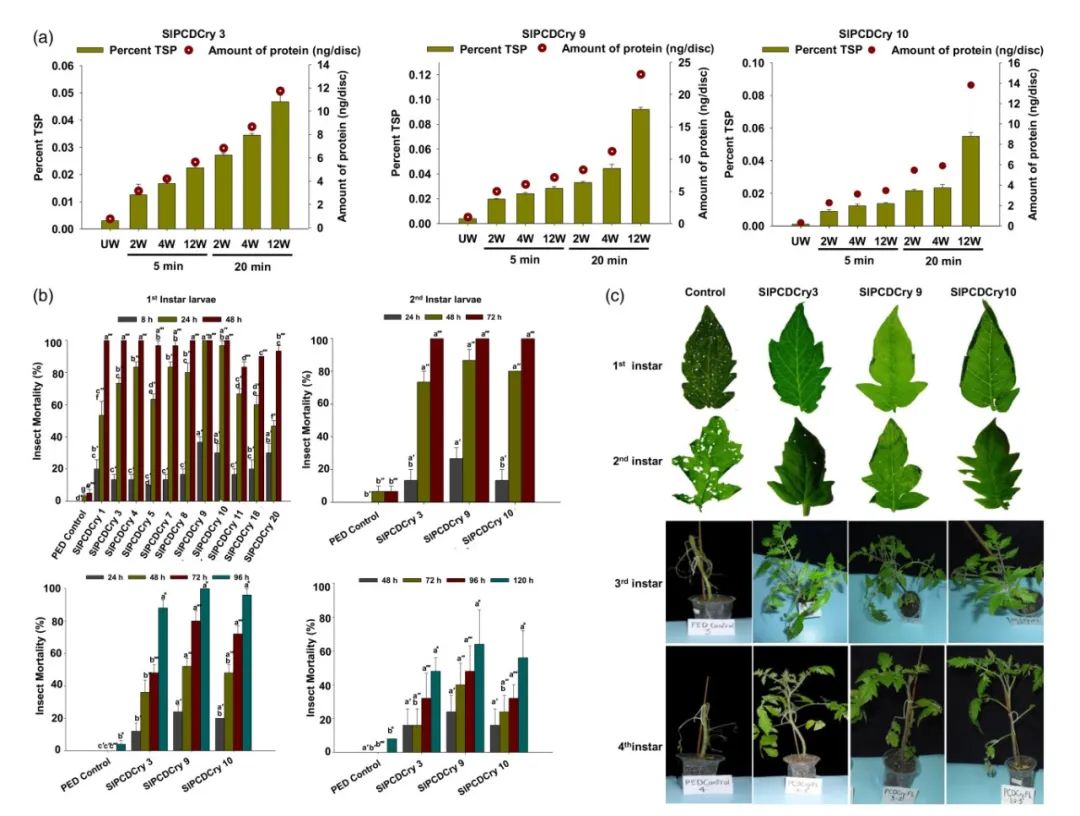
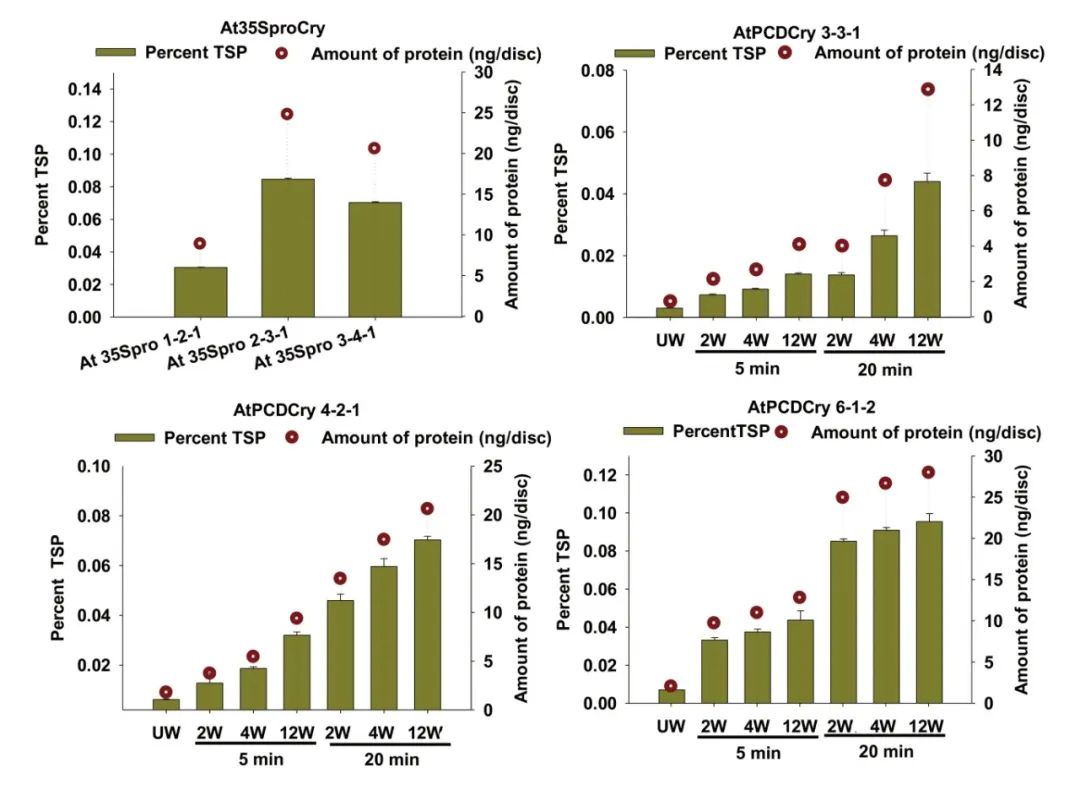 图3 在CaMV35S和RbPCD1启动子驱动下不同转基因株系中CryIAc的表达水平(Pandey et al., 2019)。对于CaMV35S株系,使用CryIAc特异性抗体通过DAS-ELISA在叶片圆盘(177mm2)中估算表达水平。对于RbPCD1pro::cryIAc植株的伤口诱导表达,先将叶片用不同数量的刺孔(2、4和12)处理并保持5或20分钟,然后从植株上切取叶片圆盘再进行检测,UW表示未受伤,W表示受伤。
图3 在CaMV35S和RbPCD1启动子驱动下不同转基因株系中CryIAc的表达水平(Pandey et al., 2019)。对于CaMV35S株系,使用CryIAc特异性抗体通过DAS-ELISA在叶片圆盘(177mm2)中估算表达水平。对于RbPCD1pro::cryIAc植株的伤口诱导表达,先将叶片用不同数量的刺孔(2、4和12)处理并保持5或20分钟,然后从植株上切取叶片圆盘再进行检测,UW表示未受伤,W表示受伤。
图4 在RbPCD1启动子驱动下表达cryIAc的转基因拟南芥植物对不同发育阶段的棉铃虫幼虫的抗性评估(Pandey et al., 2019)。(a)不同RbPCD1pro::cryIAc转基因拟南芥植株叶片上喂养的各龄期幼虫死亡率随时间的变化。(b)通过对三个独立转基因系进行的叶片损伤(第一和第二龄幼虫)和整株植物损伤(第三和第四龄幼虫)检测,研究转基因RbPCD1pro::cryIAc拟南芥株系对不同发育阶段棉铃虫幼虫的抗性。
Ayadi M, Mieulet D, Fabre D, et al. Functional analysis of the durum wheat gene TdPIP2; 1 and its promoter region in response to abiotic stress in rice[J]. Plant Physiology and Biochemistry, 2014, 79: 98-108.
Agarwal P K, Gupta K, Lopato S, et al. Dehydration responsive element binding transcription factors and their applications for the engineering of stress tolerance[J]. Journal of Experimental Botany, 2017, 68(9): 2135-2148.
Behnam B, Iuchi S, Fujita M, et al. Characterization of the promoter region of an Arabidopsis gene for 9-cis-epoxycarotenoid dioxygenase involved in dehydration-inducible transcription[J]. DNA research, 2013, 20(4): 315-324.
Boni R, Chauhan H, Hensel G, et al. Pathogen‐inducible Ta‐Lr34res expression in heterologous barley confers disease resistance without negative pleiotropic effects[J]. Plant biotechnology journal, 2018, 16(1): 245-253.
Fang H, Liu X, Thorn G, et al. Expression analysis of histone acetyltransferases in rice under drought stress[J]. Biochemical and Biophysical Research Communications, 2014, 443(2): 400-405.
Himmelbach A, Liu L, Zierold U, et al. Promoters of the barley germin-like GER4 gene cluster enable strong transgene expression in response to pathogen attack[J]. The Plant Cell, 2010, 22(3): 937-952.
Kim I J, Lee J, Han J A, et al. Citrus Lea promoter confers fruit-preferential and stressinducible gene expression in Arabidopsis[J]. Canadian journal of plant science, 2011, 91(3): 459-466.
Lee S C, Kim S H, Kim S R. Drought inducible OsDhn1 promoter is activated by OsDREB1A and OsDREB1D[J]. Journal of Plant Biology, 2013, 56: 115-121.
Risk J M, Selter L L, Chauhan H, et al. The wheat Lr34 gene provides resistance against multiple fungal pathogens in barley[J]. Plant Biotechnology Journal, 2013, 11(7): 847-854.
Lin L, Fan J, Li P, et al. The Sclerotinia sclerotiorum-inducible promoter pBnGH17D7 in Brassica napus: isolation, characterization, and application in host-induced gene silencing[J]. Journal of Experimental Botany, 2022, 73(19): 6663-6677.
Lai C, Que Q, Pan R, et al. The single-stranded DNA-binding gene Whirly (Why1) with a strong pathogen-induced promoter from Vitis pseudoreticulata enhances resistance to Phytophthora capsici[J]. International Journal of Molecular Sciences, 2022, 23(14): 8052.
Manavalan L P, Chen X, Clarke J, et al. RNAi-mediated disruption of squalene synthase improves drought tolerance and yield in rice[J]. Journal of experimental botany, 2012, 63(1): 163-175.
Nakashima K, Tran L S P, Van Nguyen D, et al. Functional analysis of a NAC‐type transcription factor OsNAC6 involved in abiotic and biotic stress‐responsive gene expression in rice[J]. The Plant Journal, 2007, 51(4): 617-630.
O’toole J C. Rice and water: the final frontier In: the first international conference on rice for the future[J]. Bangkok, Thailand, 2004: 1-26.
Pandey S P, Singh A P, Srivastava S, et al. A strong early acting wound‐inducible promoter, RbPCD1pro, activates cryIAc expression within minutes of wounding to impart efficient protection against insects[J]. Plant Biotechnology Journal, 2019, 17(7): 1458-1470.
Perera M R, Jones M G K. Expression of the peroxidase gene promoter (Shpx6b) from Stylosanthes humilis in transgenic plants during insect attack[J]. Entomologia experimentalis et applicata, 2004, 111(3): 165-171.
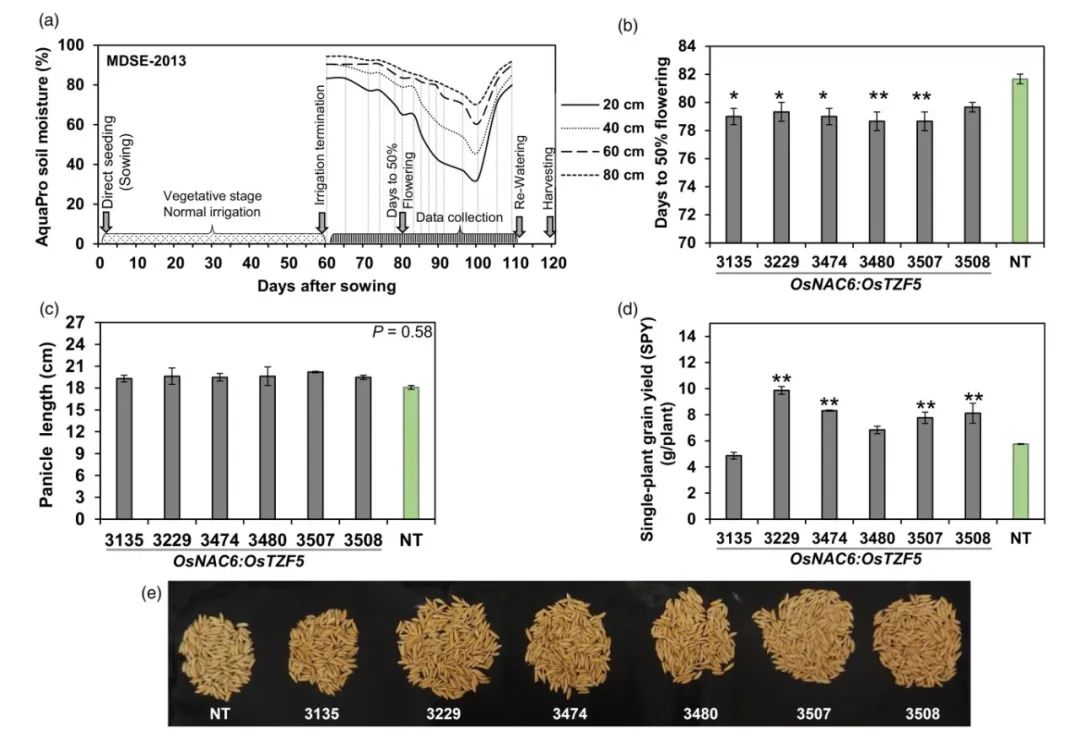
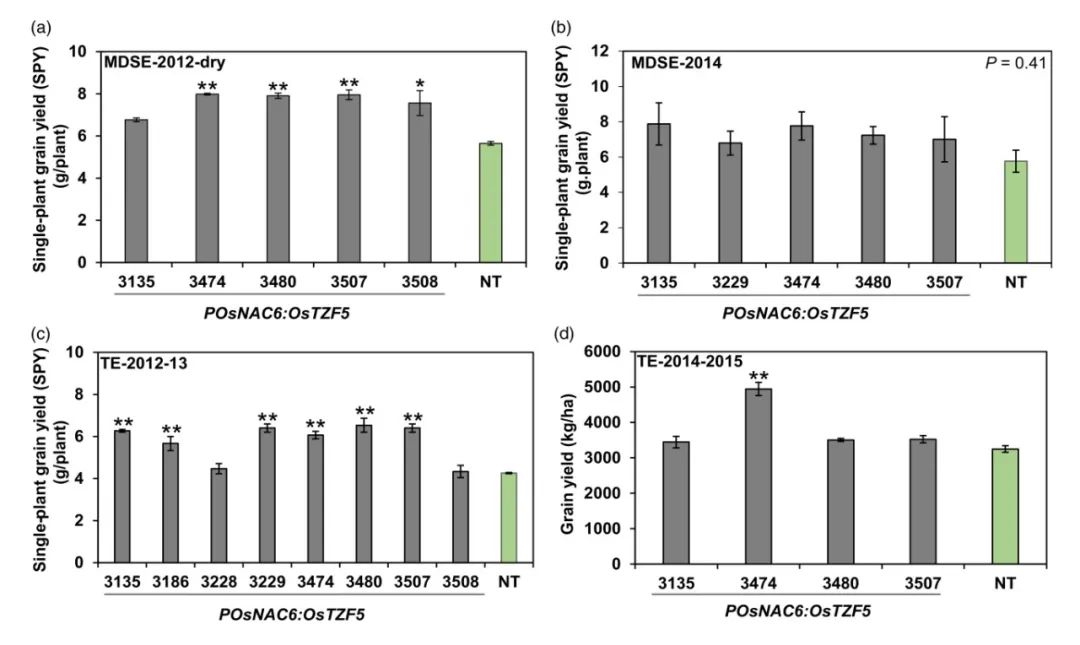
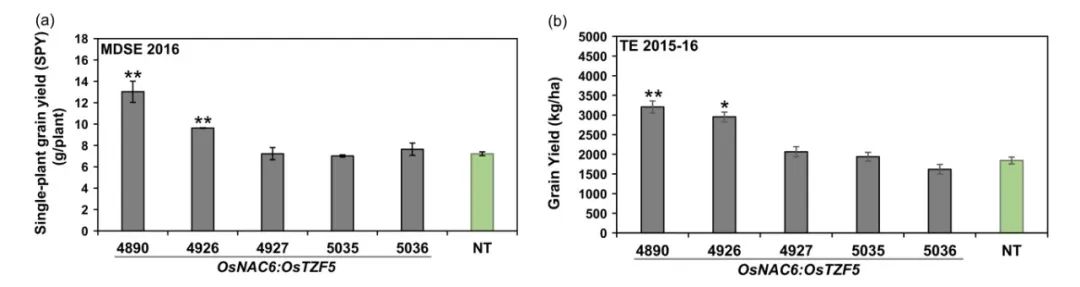
Selvaraj M G, Jan A, Ishizaki T, et al. Expression of the CCCH-tandem zinc finger protein gene OsTZF5 under a stress-inducible promoter mitigates the effect of drought stress on rice grain yield under field conditions[J]. Plant Biotechnology Journal, 2020, 18(8): 1711-1721.
Yamaguchi-Shinozaki K, Shinozaki K. Characterization of the expression of a desiccation-responsive rd29 gene of Arabidopsis thaliana and analysis of its promoter in transgenic plants[J]. Molecular and General Genetics MGG, 1993, 236: 331-340.
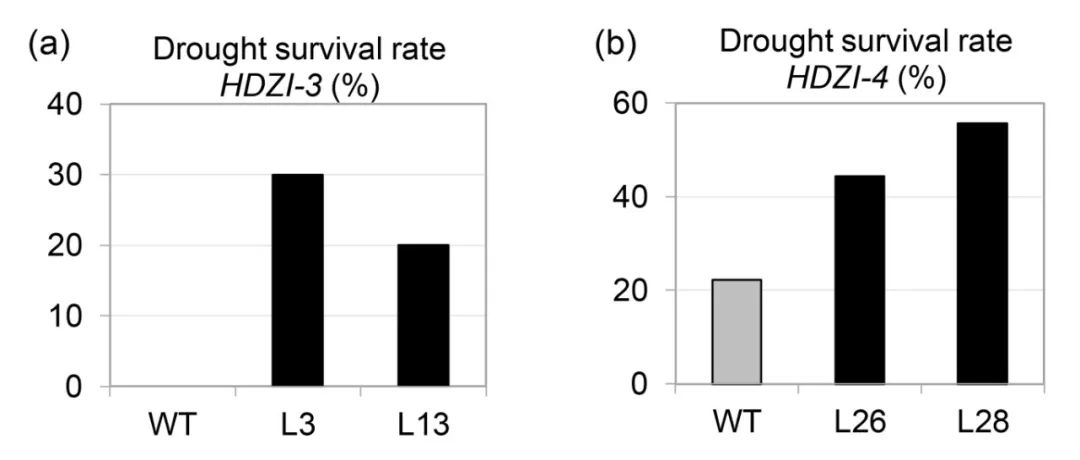
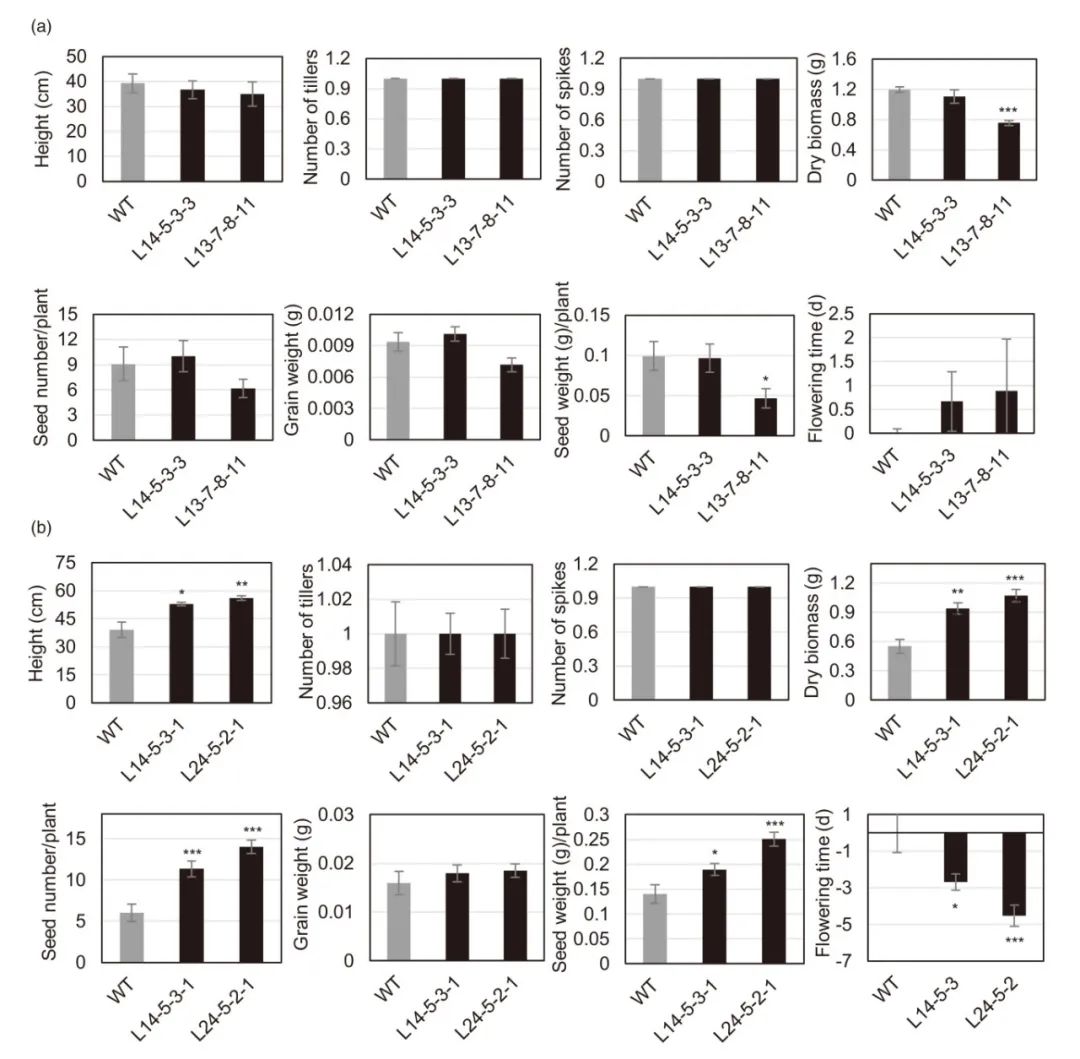
Yang Y, Al-Baidhani H H J, Harris J, et al. DREB/CBF expression in wheat and barley using the stress-inducible promoters of HD-Zip I genes: impact on plant development, stress tolerance and yield[J]. Plant biotechnology journal, 2020, 18(3): 829-844.
Zahur M, Maqbool A, Irfan M, et al. Functional analysis of cotton small heat shock protein promoter region in response to abiotic stresses in tobacco using Agrobacterium-mediated transient assay[J]. Molecular biology reports, 2009, 36: 1915-1921.
何康. 水稻病原诱导启动子POs2H16顺式作用元件的分离与鉴定[D]. 泰安:山东农业大学,2016.
关丽梅, 马伟华, 林拥军, 等. 一个水稻褐飞虱为害诱导型启动子的克隆[J]. 植物保护, 2016, 42(1): 19-25.
牟少亮, 申磊, 石星辰. 水稻OsERF96应答病原菌的表达及启动子的功能分析[J]. 植物遗传资源学报,2017,18(1): 133-138.