文本内容速览:
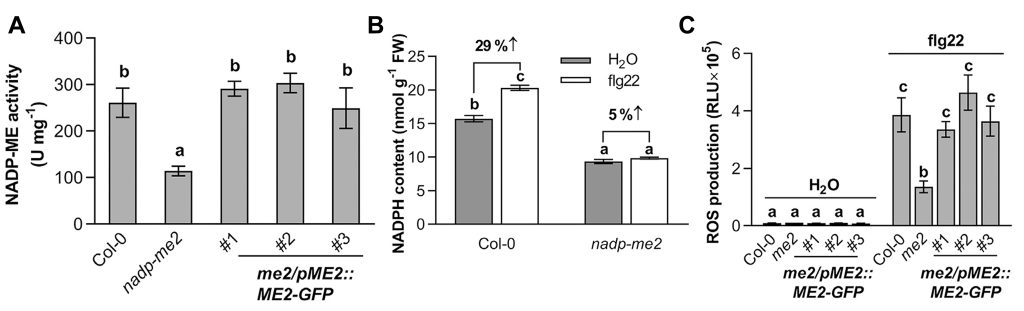
植物PTI反应中的ROS主要是由膜结合的NADPH氧化酶RBOHs激活所产生,这些酶催化O2形成O2·−,随后通过过氧化物酶将其转化为H2O2(Wang et al., 2020)。NADPH作为产生H2O2的原料,其来源一直被研究和探讨。2022年5月,浙江大学梁岩课题组在Molecular Plant上发表了一篇题为“The receptor-like cytosolic kinase RIPK activates NADP-malic enzyme 2 to generate NADPH for fueling the ROS production”的研究论文。该论文中,作者鉴定到了拟南芥中一个催化NADPH产生的酶NADP-ME2,发现该酶的缺失会导致其活性降低,进而导致NADPH的含量下降(图3A、B)。此外,在nadp-me2突变体发生PTI反应后拟南芥ROS爆发显著减弱(图3C)。
图3 NADP-ME2酶活、NADPH的含量以及ROS爆发情况的测定(Wu et al., 2022)。
当植物生活在复杂的环境中时,除了要应对各种生物胁迫之外,还需要应对各种非生物胁迫,例如干旱、高温、高盐和强光等。非生物胁迫中的ROS有两个主要来源,包括由于代谢活动中断而产生的代谢性ROS和作为非生物胁迫响应信号传导网络的一部分而产生的信号性ROS(Choudhury et al., 2017)。与生物胁迫不同,ROS无法直接应对各种非生物胁迫带来的不利影响,因此ROS只能“曲线救国”,通过其他间接手段帮助植物应对非生物胁迫。代谢性ROS可以直接改变限速酶的氧化还原状态,控制细胞内的代谢通量,从而改变不同的代谢反应,以抵消非生物胁迫的影响(Miller et al., 2010)。此外,ROS还可以通过氧化修饰(OxiPTMs)对关键调控蛋白进行调节,以传递信号的方式提高植物对非生物胁迫的适应(Noctor and Foyer, 2016)(图4)。关于OxiPTMs会在后续内容中给大家介绍哦!
图4 非生物胁迫中的ROS(Choudhury et al., 2017)。
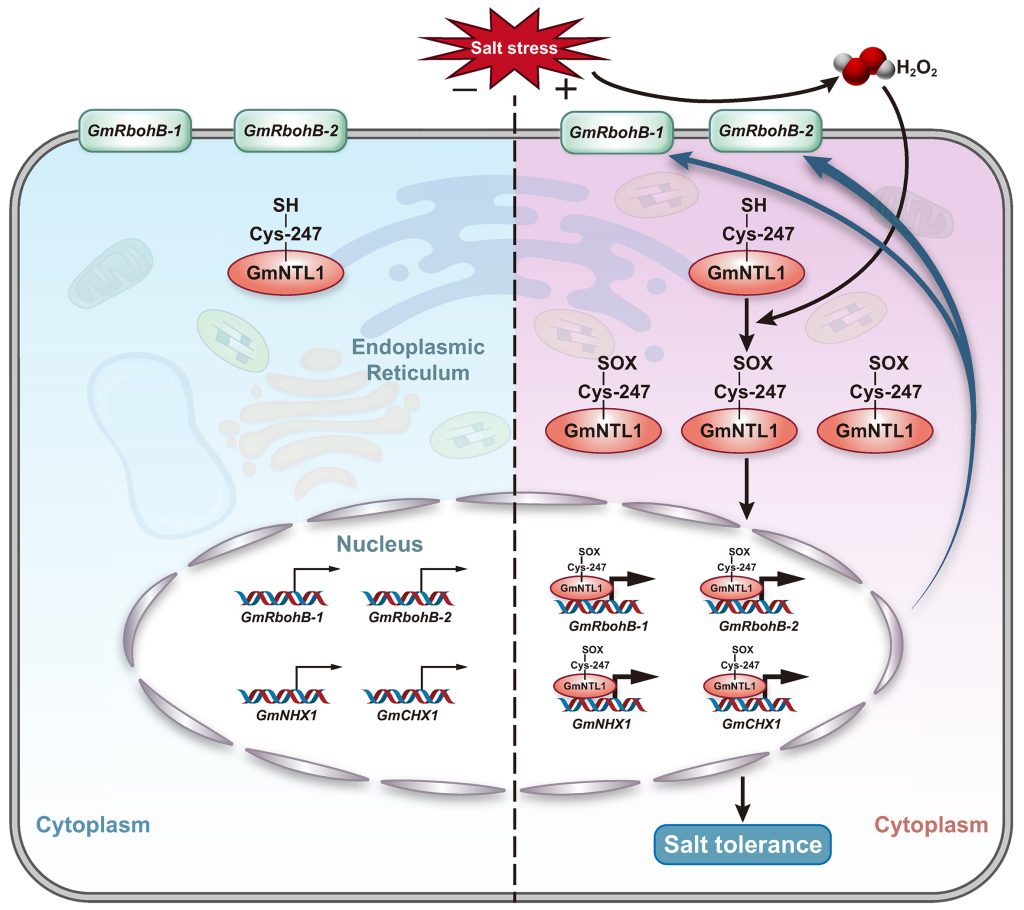
2023年9月,山东大学向凤宁课题组在The Plant cell杂志上发表了一篇题为“H2O2-dependent oxidation of the transcription factor GmNTL1 promotes salt tolerance in soy bean”的研究论文。该研究中,作者发现了大豆中一个可能参与盐胁迫的膜结合转录因子GmNTL1。在盐以及H2O2的诱导下,GmNTL1的定位从内质网转移到细胞核,进一步研究发现,GmNTL1介导的耐盐性依赖于H2O2。为了深入探究H2O2与GmNTL1在耐盐过程中的内在联系,作者首先猜测H2O2是否直接对GmNTL1进行了氧化修饰,通过对GmNTL1可能的氧化修饰位点进行验证,发现GmNTL1的第247位Cys被H2O2氧化,并且该位点对于GmNTL1的入核至关重要。在解析完GmNTL1的上游通路后,作者最后鉴定到了GmNTL1下游调控耐盐的关键靶标GmNHX1和GmCHX1。综上,盐诱导的H2O2介导了GmNTL1半胱氨酸翻译后修饰并促进其迁移,增强了其转录激活下游靶基因的能力,从而提高大豆的耐盐性(图5)。
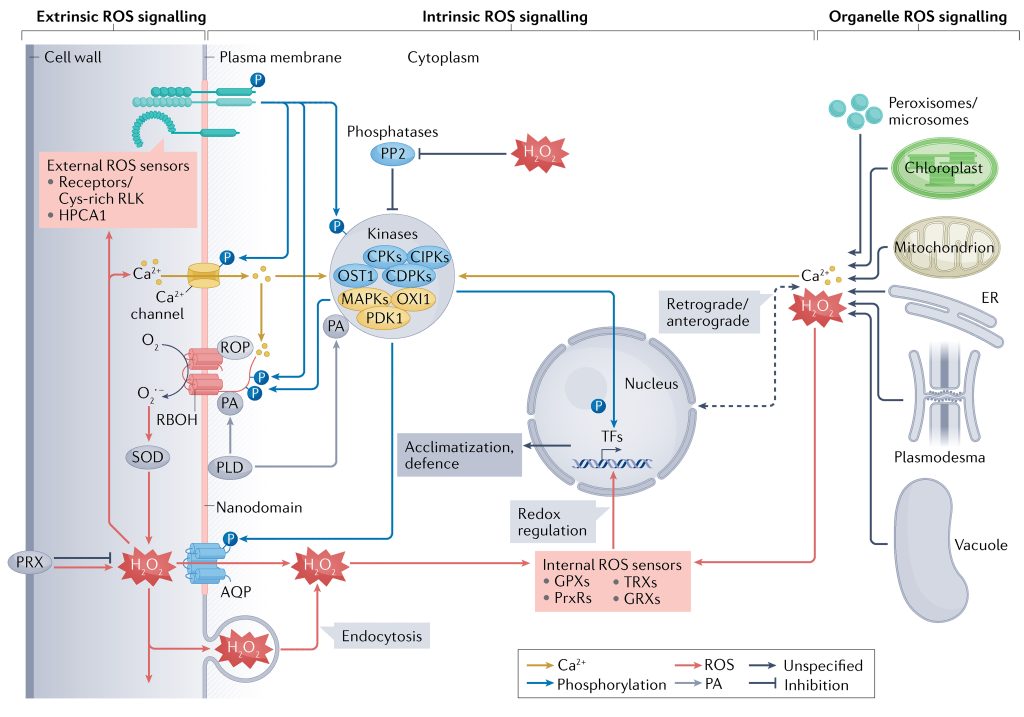
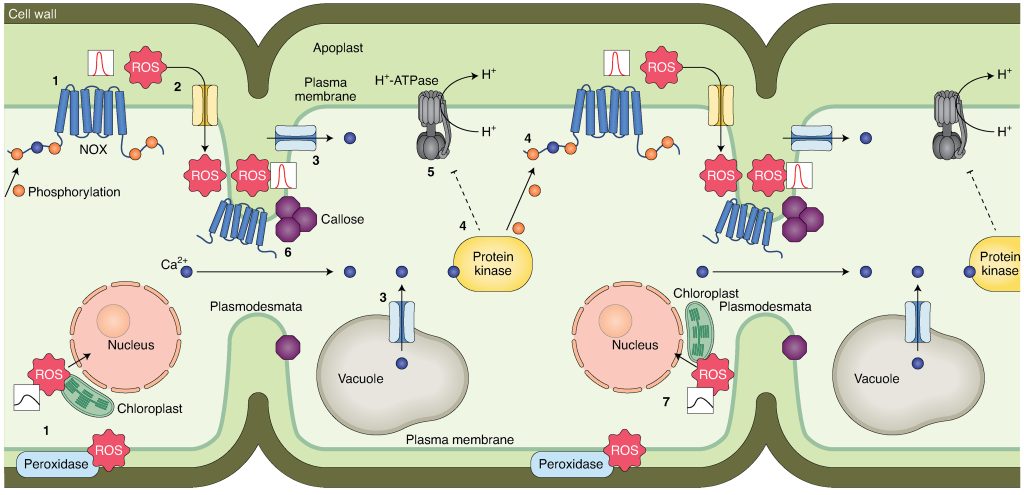
在植物复杂的亚细胞环境中,ROS的感知和不同信号传导途径的激活可以发生在不同的区域。总的来说,ROS信号可以分为外源性(质外体和细胞壁)、内源性(细胞质和细胞核)和细胞器(叶绿体、线粒体、过氧化物酶体和其他细胞器)。在胁迫条件下,这些不同区域的ROS信号保持相互作用或者相互独立(Mittler et al., 2022)。
外源性ROS信号传导的过程中,起主要作用的是RBOHs、AQPs(水通道蛋白)和细胞壁结合过氧化物酶(Maurel et al., 2015; Mittler et al., 2022; Wang et al., 2020)。此外,细胞膜上的Ca2+通道以及各种膜受体在向下传递信号的过程中也起着重要作用(Castro et al., 2021; Ravi et al., 2023)。RBOHs被称为“ROS信号传导的引擎”,其胞质的氨基或羧基末端可以受到例如磷酸化/去磷酸化等过程的调节,从而调控ROS的生成(Kimura et al., 2020)。为了在胞内向下传递信号,ROS必须进入细胞,通常可以通过AQPs进入细胞内,此外也可以通过胞吞的方式进入(Golani et al., 2013)(图6)。
内源性ROS信号传导的过程中,细胞质基质会接收外源性和细胞器中的ROS。细胞质基质包含许多调节ROS生成和清除的酶(Mittler et al., 2022),这些酶可以调节细胞质基质中ROS的含量,从而对细胞质基质中ROS下游的信号中枢进行调节。除了细胞质基质外,细胞核也接收ROS信号并调控不同基因的表达情况。此外细胞核中也存在氧化还原调节蛋白,它们可以对核中的ROS信号进行调节,进而也参与对下游基因的调控(Gutsche and Zachgo, 2016; Murmu et al., 2010)(图6)。
细胞器ROS信号传导过程中,细胞器作为ROS产生的主要场所可以产生ROS,同时也能自主清除ROS,从而调控自身ROS水平(Waszczak et al., 2018)。除了自主调控ROS的含量从而调控信号传递之外,细胞器之间或从细胞器到细胞核的ROS信号也可以进行传递,然而有些ROS信号不会穿过细胞质或仅在很短的距离内穿过细胞质(Ding et al., 2019)。除此之外,不同细胞器之间的ROS也可以通过中间信号的介导进行传递,导致被传递细胞器中ROS含量的改变(Mittler et al., 2022)(图6)。
图6 细胞内的ROS信号传递过程(Mittler et al., 2022)。
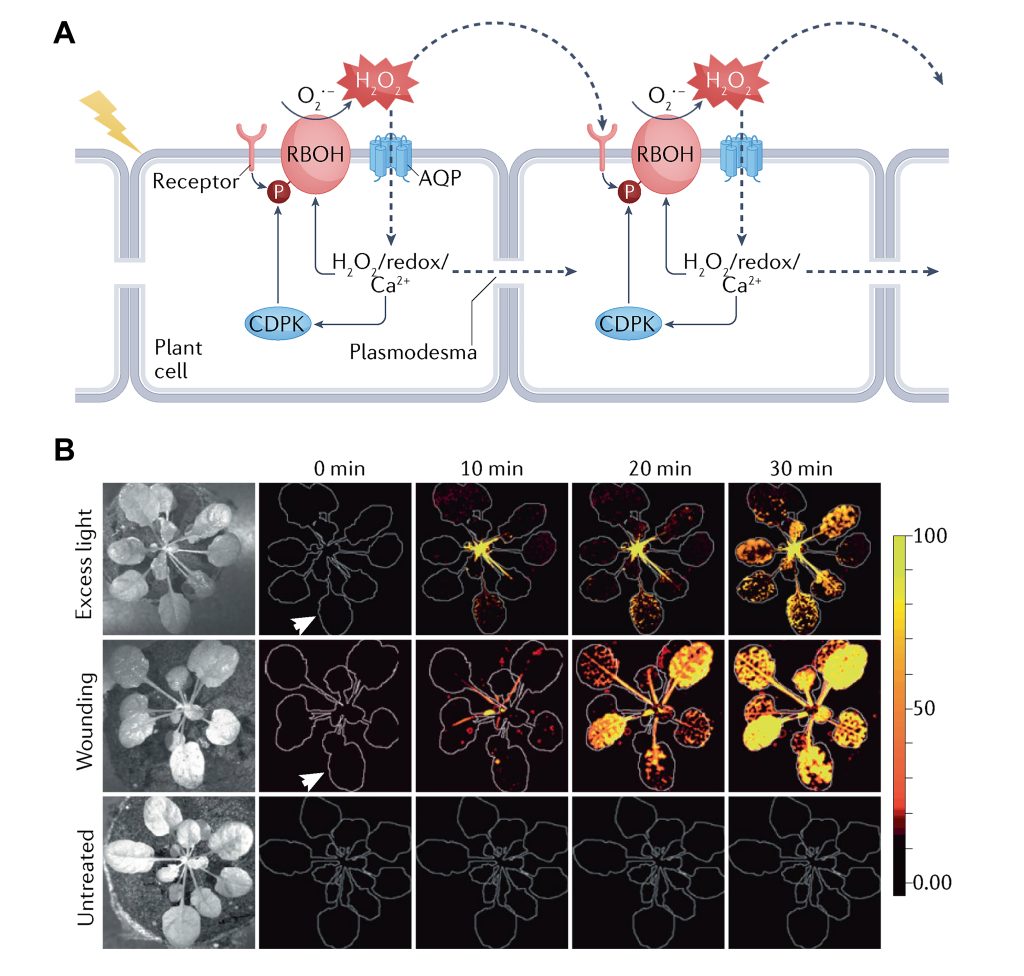
上节中,小远和大家探讨了胞内的ROS传递,相信大家对细胞内ROS传递的过程有了一定的了解。实际上,植物中ROS在传递时,不可能只限制在一个细胞中,通常还需要在一个长距离的区域中进行传递,因为当一个细胞感知胁迫后,是需要将信号传递给其他细胞乃至整个植物,这样才能应对胁迫。但是在前面提到ROS存在的时间一般非常短(图1),因此不太可能长距离的运输。因此,ROS在细胞间长距离运输时首先是单个细胞ROS含量的改变,然后被邻近细胞感知后导致其ROS含量也发生改变,以这种方式在细胞间传播,这种传播方式也被称为“ROS波”(Castro et al., 2021)(图7A)。ROS波在相邻细胞间的传播是通过胞间连丝或质外体途径(Fichman et al., 2021)。此外,在谈到ROS信号的长距离传递时,很容易让人联想到植物免疫中的系统获得性抗性(Systemic Acquired Resistance, SAR),因为SAR的特点是局部防御信号的激发导致了植物远端乃至整株的防御反应。但遗憾的是,目前的研究显示ROS波和SAR之间的关系好像并不明显,SAR是通过N-羟基哌啶酸(N-hydroxy-pipecolic acid, NHP)及水杨酸(Salicylic Acid, SA)等物质诱导产生的(Yildiz et al., 2021)。有意思的是,ROS波是一个十分快速的过程,而NHP的转移是一个相对滞后的过程。此外,在番茄rbohD和rbohF突变体中,H2O2水平降低的同时NHP前体哌啶酸(Pipecolic acid)的含量也降低(Gilroy et al., 2014; Wang et al., 2018)。这些说明ROS可能作为SAR的一个指示,提醒植物做好SAR的前期准备。
图7 胞间ROS信号传递的过程(Mittler et al., 2022)。(A)胞间ROS信号传递示意图。(B)拟南芥受到胁迫后ROS从局部扩展到整株的过程。
ROS信号被传导后,细胞要接收这个信号并对其作出反应,这就需要ROS信号被感知。但是,由于ROS的性质,其不太可能通过类似“配体-受体”的方式被感知,反而更有可能通过氧化修饰被感知,细胞通过改变修饰后蛋白的结构、定位以及活性等,从而对ROS信号作出反应(Castro et al., 2021; Zhou et al., 2023)。
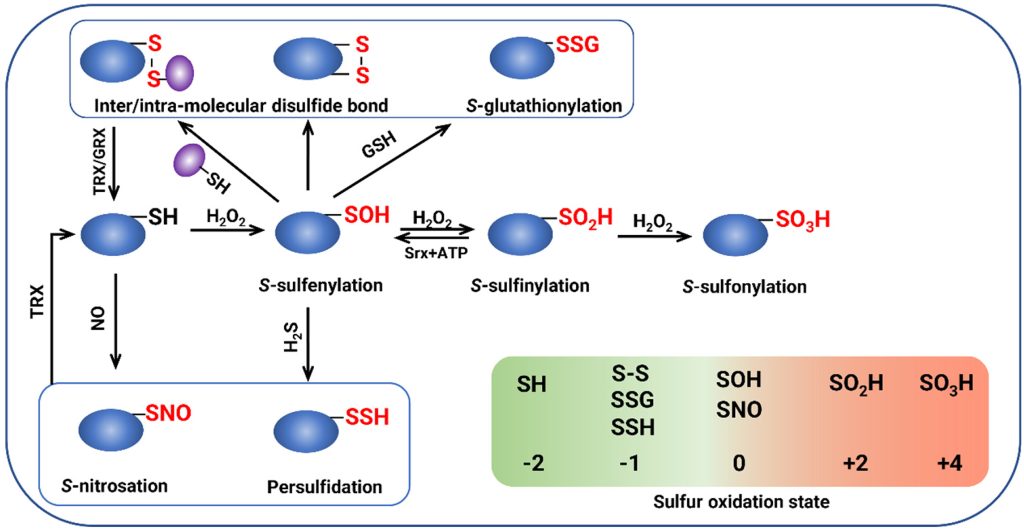
OxiPTMs(氧化修饰)是指具有氧化还原活性的小分子(如H2O2等)在蛋白质半胱氨酸巯基上发生的共价修饰。常见的OxiPTMs有次磺酸(-SOH)、亚磺酸(-SO2H)、磺酸(-SO3H)等(图8),这些修饰可以影响植物的生长发育和逆境响应过程(Zhou et al., 2023)。相关案例可见“2.2非生物胁迫中的ROS”哦!
图8 OxiPTMs的产生和相互转变(Zhou et al., 2023)。
在前面几个小节中,小远与大家探讨了植物遭受胁迫时ROS的作用以及如何进行信号传递和被感知。这些关于ROS描述主要针对遭受胁迫后的植物,但实际上植物除了可以通过ROS去对外界胁迫作出反应之外,植物本身还会通过ROS信号调控顶端分生组织分化、细胞壁木质化、气孔与花发育、种子萌发以及根系发育等生理过程(Mhamdi and Van Breusegem 2018; Wang et al., 2023)(图9)。由于ROS信号的传递以及感知在2.3中已经介绍过,此处就不作过多介绍。想要了解ROS对植物生长发育调节的具体案例大家可以自行查阅文献哦!
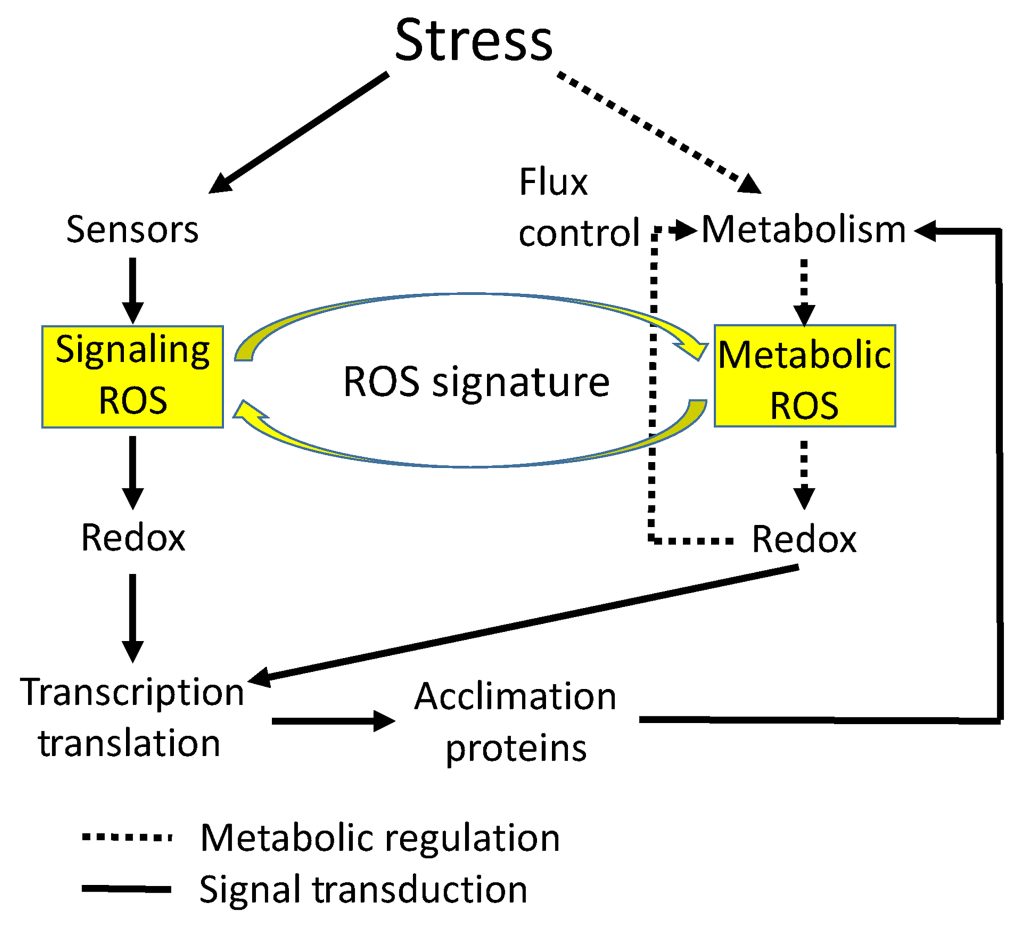
在第二部分中,小远给大家介绍了ROS信号的作用、传递以及如何被感知等方面,相信大家对ROS如何发挥作用有了大概的了解。原本被认为是有害物质的ROS可以传递信号并帮助植物抵御各种胁迫,由于其在传递信号过程中起到关键作用,ROS被认为是第二信使的概念逐渐被广泛认可(Qi et al., 2024)。对于ROS何时对细胞有毒害作用,何时又扮演着第二信使的重要角色,这可能取决于细胞内ROS的含量,异常高含量的ROS可能会起负面作用,而低含量的ROS起着传递信号的积极作用(Wang et al., 2023)。此外,有意思的是,在前面的描述中,ROS信号在不同胁迫下的信号好像是相互分离的,但有研究发现,ROS信号可以将不同胁迫(生物或非生物)联系起来(Berrios and Rentsch 2022)。
图10 植物细胞中ROS产生的部位(Castro et al., 2021)。
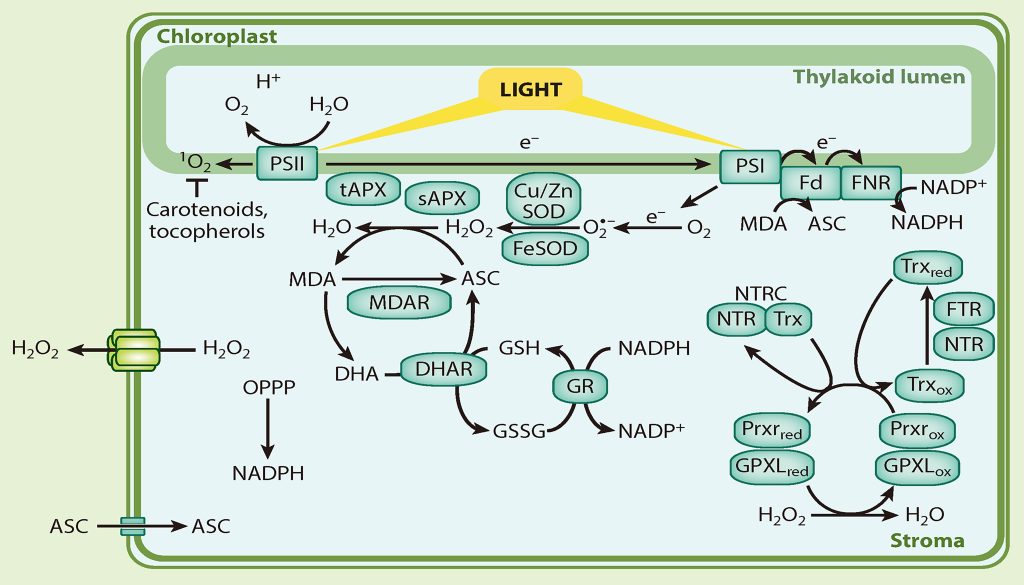
众所周知,叶绿体是光合作用的场所。在光照条件下,光系统Ⅰ和Ⅱ会产生ROS,主要的ROS类型有O2·−、H2O2和1O2等(Castro et al., 2021)。针对这几种ROS,叶绿体都有对应的系统进行清除。对于光系统Ⅰ产生的O2·−和H2O2来说,O2·−可被超氧化物歧化酶(SODs)在类囊体膜的基质中歧化或自发形成H2O2(Asada 2006)。H2O2被抗坏血酸过氧化物酶(APXs)、谷胱甘肽过氧化物酶(GPXLs)和过氧化物酶(Prxrs)解毒(Asada 2006)。对于光系统Ⅱ产生的1O2来说,虽然目前还没有直接清除1O2的酶,但是可以通过与其他分子反应从而清除1O2,例如生育酚和类胡萝卜素等(Krieger-Liszkay and Trebst 2006; Ramel et al., 2012)。
图11 叶绿体中的ROS(Waszczak et al., 2018)。
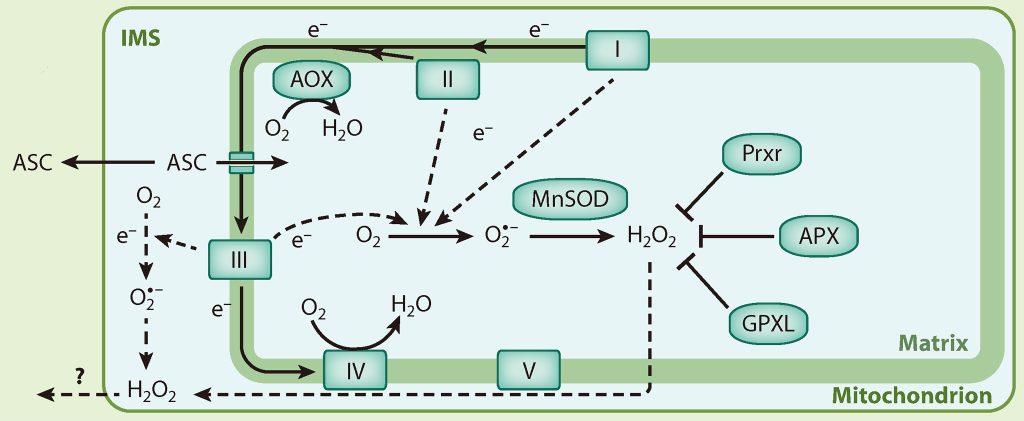
线粒体是细胞呼吸作用的场所,其ROS的产生与线粒体电子传递链(mETC)密切相关。线粒体复合体I、II和III被认为是产生O2·−的主要来源,这三个复合体都产生并向线粒体基质中释放O2·−,此外,复合体III还可以向膜间隙中释放O2·−(Huang et al., 2016)。线粒体基质中的O2·−可以转变为H2O2,最终被一系列氧化酶所清除,这与叶绿体中H2O2的清除类似。而膜间隙中的H2O2可以被抗坏血酸(ASC)所清除,由于线粒体外膜的通透性,还有可能转移到细胞质基质中被清除(Waszczak et al., 2018)。
Foyer CH, Noctor G. Oxidant and antioxidant signalling in plants: a re-evaluation of the concept of oxidative stress in a physiological context. Plant Cell Environ, 2005, 28: 1056-1071.
Asada K. Production and scavenging of reactive oxygen species in chloroplasts and their functions. Plant Physiol, 2006, 141: 391-396.
Berrios L, Rentsch JD. Linking Reactive Oxygen Species (ROS) to Abiotic and Biotic Feedbacks in Plant Microbiomes: The Dose Makes the Poison. Int J Mol Sci, 2022, 23.
Castro B, Citterico M, Kimura S et al. Stress-induced reactive oxygen species compartmentalization, perception and signalling. Nat Plants, 2021, 7: 403-412.
Choudhury FK, Rivero RM, Blumwald E et al. Reactive oxygen species, abiotic stress and stress combination. Plant J, 2017, 90: 856-867.
Ding X, Jimenez-Gongora T, Krenz B et al. Chloroplast clustering around the nucleus is a general response to pathogen perception in Nicotiana benthamiana. Mol Plant Pathol, 2019, 20: 1298-1306.
Fichman Y, Myers RJ, Jr., Grant DG et al. Plasmodesmata-localized proteins and ROS orchestrate light-induced rapid systemic signaling in Arabidopsis. Sci Signal, 2021, 14.
Gilroy S, Suzuki N, Miller G et al. A tidal wave of signals: calcium and ROS at the forefront of rapid systemic signaling. Trends Plant Sci, 2014, 19: 623-630.
Golani Y, Kaye Y, Gilhar O et al. Inositol polyphosphate phosphatidylinositol 5-phosphatase9 (At5ptase9) controls plant salt tolerance by regulating endocytosis. Mol Plant, 2013, 6: 1781-1794.
Gutsche N, Zachgo S. The N-Terminus of the Floral Arabidopsis TGA Transcription Factor PERIANTHIA Mediates Redox-Sensitive DNA-Binding. PLoS One, 2016, 11: e0153810.
Huang S, Van Aken O, Schwarzländer M et al. The Roles of Mitochondrial Reactive Oxygen Species in Cellular Signaling and Stress Response in Plants. Plant Physiol, 2016, 171: 1551-1559.
Kim CY, Song H, Lee YH. Ambivalent response in pathogen defense: A double-edged sword? Plant Commun, 2022, 3: 100415.
Kimura S, Hunter K, Vaahtera L et al. CRK2 and C-terminal Phosphorylation of NADPH Oxidase RBOHD Regulate Reactive Oxygen Species Production in Arabidopsis. Plant Cell, 2020, 32: 1063-1080.
Krieger-Liszkay A, Trebst A. Tocopherol is the scavenger of singlet oxygen produced by the triplet states of chlorophyll in the PSII reaction centre. J Exp Bot, 2006, 57: 1677-1684.
Maurel C, Boursiac Y, Luu DT et al. Aquaporins in Plants. Physiol Rev, 2015, 95: 1321-1358.
Mhamdi A, Van Breusegem F. Reactive oxygen species in plant development. Development, 2018, 145.
Miller G, Suzuki N, Ciftci-Yilmaz S et al. Reactive oxygen species homeostasis and signalling during drought and salinity stresses. Plant Cell Environ, 2010, 33: 453-467.
Mittler R. ROS Are Good. Trends Plant Sci, 2017, 22: 11-19.
Mittler R, Zandalinas SI, Fichman Y et al. Reactive oxygen species signalling in plant stress responses. Nat Rev Mol Cell Biol, 2022, 23: 663-679.
Murmu J, Bush MJ, DeLong C et al. Arabidopsis basic leucine-zipper transcription factors TGA9 and TGA10 interact with floral glutaredoxins ROXY1 and ROXY2 and are redundantly required for anther development. Plant Physiol, 2010, 154: 1492-1504.
Noctor G, Foyer CH. Intracellular Redox Compartmentation and ROS-Related Communication in Regulation and Signaling. Plant Physiol, 2016, 171: 1581-1592.
Qi F, Li J, Ai Y et al. DGK5β-derived phosphatidic acid regulates ROS production in plant immunity by stabilizing NADPH oxidase. Cell Host Microbe, 2024.
Ramel F, Birtic S, Cuiné S et al. Chemical quenching of singlet oxygen by carotenoids in plants. Plant Physiol, 2012, 158: 1267-1278.
Ravi B, Foyer CH, Pandey GK. The integration of reactive oxygen species (ROS) and calcium signalling in abiotic stress responses. Plant Cell Environ, 2023, 46: 1985-2006.
Raymond J, Segrè D. The effect of oxygen on biochemical networks and the evolution of complex life. Science, 2006, 311: 1764-1767.
Van Breusegem F, Dat JF. Reactive oxygen species in plant cell death. Plant Physiol, 2006, 141: 384-390.
Wang C, Liu R, Lim GH et al. Pipecolic acid confers systemic immunity by regulating free radicals. Sci Adv, 2018, 4: eaar4509.
Wang P, Liu WC, Han C et al. Reactive oxygen species: Multidimensional regulators of plant adaptation to abiotic stress and development. J Integr Plant Biol, 2023.
Wang R, He F, Ning Y et al. Fine-Tuning of RBOH-Mediated ROS Signaling in Plant Immunity. Trends Plant Sci, 2020, 25: 1060-1062.
Waszczak C, Carmody M, Kangasjärvi J. Reactive Oxygen Species in Plant Signaling. Annu Rev Plant Biol, 2018, 69: 209-236.
Wu B, Li P, Hong X et al. The receptor-like cytosolic kinase RIPK activates NADP-malic enzyme 2 to generate NADPH for fueling ROS production. Mol Plant, 2022, 15: 887-903.
Yildiz I, Mantz M, Hartmann M et al. The mobile SAR signal N-hydroxypipecolic acid induces NPR1-dependent transcriptional reprogramming and immune priming. Plant Physiol, 2021, 186: 1679-1705.
Yuan M, Ngou BPM, Ding P et al. PTI-ETI crosstalk: an integrative view of plant immunity. Curr Opin Plant Biol, 2021, 62: 102030.
Yuan M, Jiang Z, Bi G et al. Pattern-recognition receptors are required for NLR-mediate plant immunity. Nature, 2021, 592: 105-109.
Zhang W, Zhi W, Qiao H et al. H2O2-dependent oxidation of the transcription factor GmNTL1 promotes salt tolerance in soybean. Plant Cell, 2023, 36: 112-135.
Zhou H, Huang J, Willems P et al. Cysteine thiol-based post-translational modification: What do we know about transcription factors? Trends Plant Sci, 2023, 28: 415-428.