本文内容速览:
今天,伯小远给大家带来了关于水稻中抗稻瘟病的相关研究进展,一起来走走科学家们的探索之路,相信对大家的科研也会有所启发。
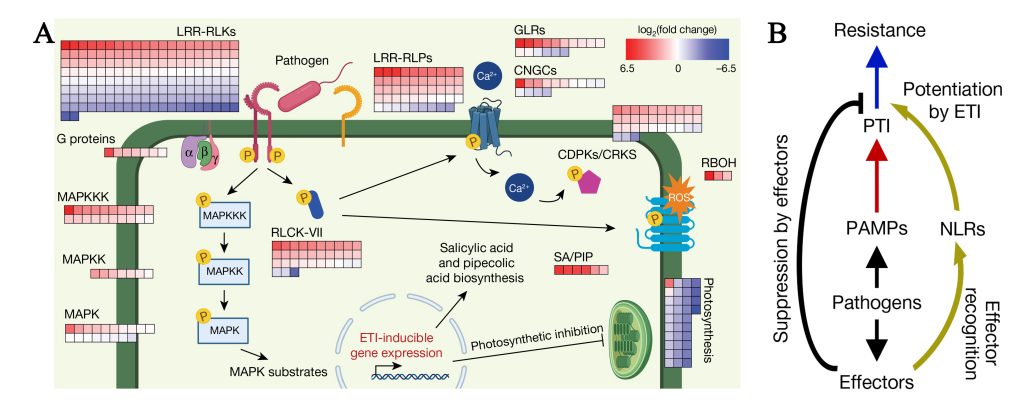
图1 PTI和ETI分子机制图(Ngou et al., 2021)。(A)热图表示ETIAvrRps4诱导4h后PTI信号通路基因表达水平的变化;(B)植物免疫示意图,来自病原菌的PAMPs被植物PRR识别并诱导PTI(红色箭头),病原菌分泌效应蛋白以抑制PTI,效应蛋白被NLR识别并诱导ETI(深黄色箭头),从而增强PTI以产生更强的免疫反应(蓝色箭头)。
在PTI防御机制中,植物细胞表面的模式识别受体(Pattern-recognition receptors, PRRs)识别病原菌分泌的PAMPs分子而激发非特异性免疫反应。植物中PRRs分为类受体蛋白激酶(Receptor-like kinases, RLKs)和类受体蛋白(Receptor-like proteins, RLPs)等。PAMPs被PRRs识别后,PRRs激活触发细胞内激酶RLCKs和MAPKs的磷酸化,活化的RLCK磷酸化并激活膜内钙通道(CNGC、GLRs和OSCA1.3)和NADPH氧化酶RBOHD,分别诱导Ca2+内流和活性氧(Reactive oxygen species,ROS)爆发。MAPK磷酸化级联诱导植物信号转导,导致免疫防御基因的表达,从而抑制病原菌的侵入(杨俊等,2018)。例如几丁质(一种来自于真菌细胞壁的PAMP)被细胞表面的CEBiP 和 CERK1 受体识别,诱发宿主植物发生胼胝体积累和ROS爆发等一系列植物防御措施(Mentlak et al., 2012)。
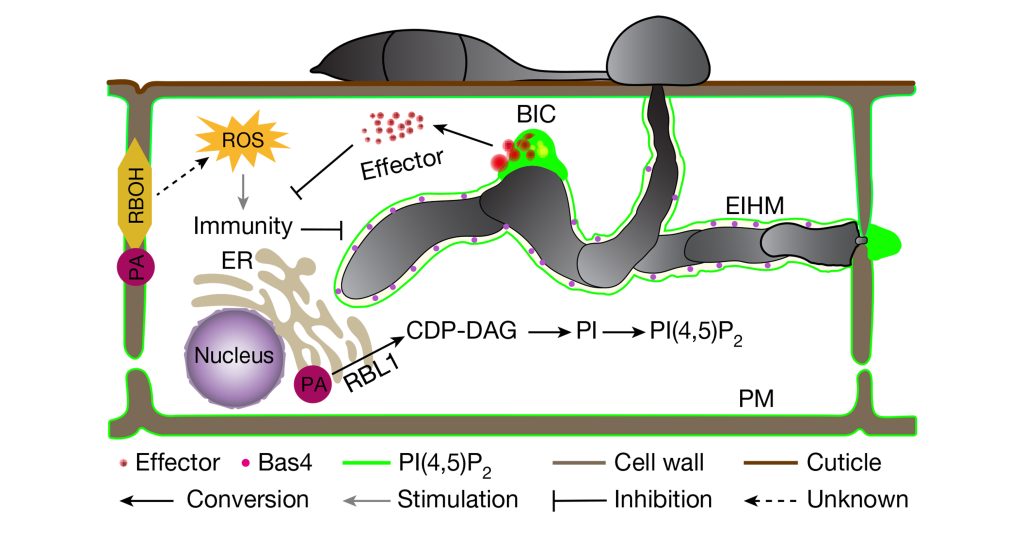
病原菌为了克服植物PTI反应,在侵染植物时会分泌效应蛋白来抑制植物免疫反应使植物感病(Effector-triggered susceptibility, ETS)。根据分泌的最终目的地的不同将效应蛋白分为经生物营养界面复合(Biotrophic lnterfacial complex, BIC)结构进入寄主细胞内的细胞质效应因子和侵染菌丝细胞壁与寄主包膜之间的交界面菌丝膜(Extra-lnvasive hyphal membrane, EIHM)结构的质外体效应因子。植物为了克服ETS反应,进化出了第二种防御机制ETI,ETI是指位于胞内的具有核苷酸结合位点和富含亮氨酸重复序列蛋白(NLRs,Nucleotide-binding,Leucine-rich Repeat proteins)直接或通过激素等信号分子来间接地感知病原菌的效应因子从而触发的植物特异性免疫(Zhai et al., 2022;曹妮等,2019)。
2020年11月,中国农业科学院植物保护研究所王国梁课题组在Molecular Plant杂志上发表了一篇题为“Two VOZ transcription factors link an E3 ligase and an NLR immune receptor to modulate immunity in rice”的研究论文,作者通过酵母双杂文库筛选结合Split-LUC和GST Pull-down等实验发现E3泛素连接酶APIP10能够与OsVOZ1和OsVOZ2在体外和体内相互作用,并且能够通过26S蛋白酶体途径促进体内OsVOZ1和OsVOZ2蛋白的降解。
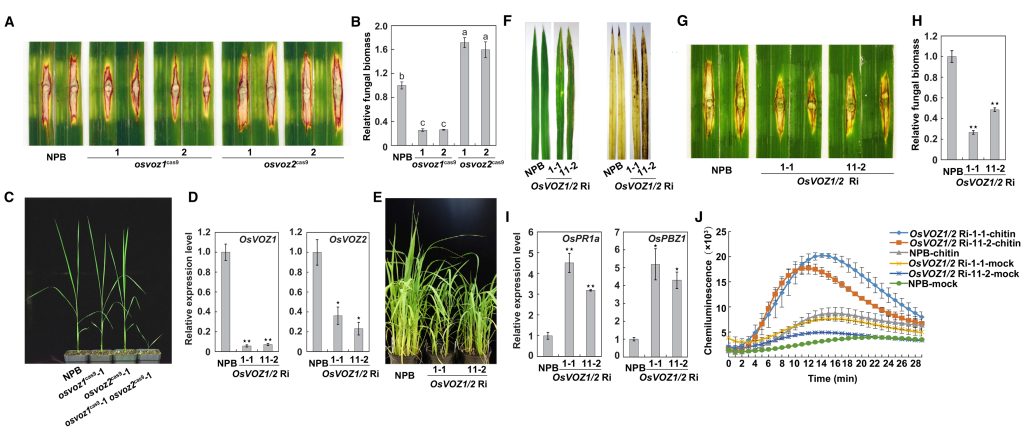
OsVOZ1和OsVOZ2两者之间能够形成异源二聚体,并且OsVOZ1能够促进OsVOZ2的转录激活活性。使用CRISPR/Cas9技术获得osvoz1和osvoz2的突变体,稻瘟菌接种实验结果显示OsVOZ1在水稻稻瘟病抗性中起负调节作用,而OsVOZ2起正调节作用。由于osvoz1/osvoz2双突变体不能正常生长,幼苗期就会死亡,于是构建了OsVOZ1/2 RNAi(OsVOZ1/2 Ri)株系,表型分析、抗性基因(OsPR1a和OsPBZ1)表达分析以及几丁质处理结果显示OsVOZ1和 OsVOZ2具有冗余功能,共同作为水稻PTI信号转导的负调控因子发挥作用(图3)。
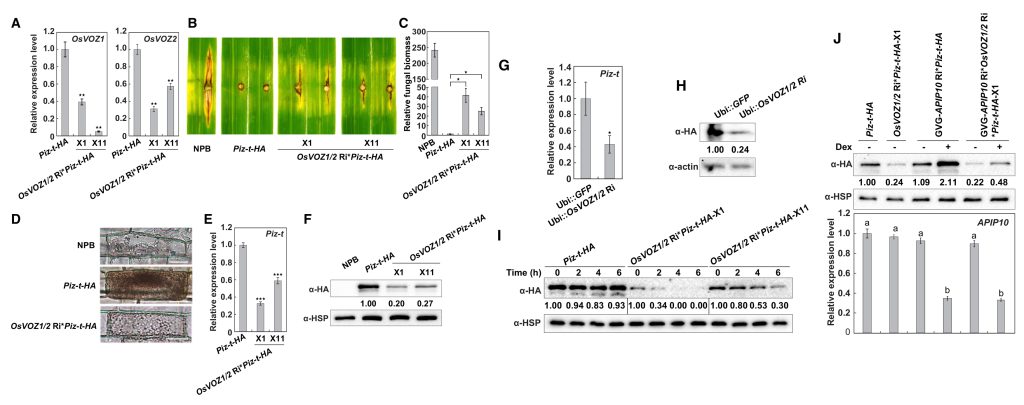
图3 OsVOZ1/2基因双重沉默提高了水稻对稻瘟病的抗性(Wang et al., 2021)。(A-B)osvoz1、osvoz2和NPB幼苗在接种稻瘟菌后叶片的病害症状(A)和相对真菌生物量(B);(C)5周大的 osvoz1、osvoz2、osvoz1/osvoz2和NPB幼苗;(D)OsVOZ1/2 Ri品系中OsVOZ1和OsVOZ2的相对转录水平;(E)温室中八周龄的OsVOZ1/2 Ri和NPB植株;(F)OsVOZ1/2 Ri转基因植株的细胞死亡表型和ROS积累;(G-H)OsVOZ1/2 Ri和NPB幼苗在接种稻瘟菌后叶片的病害症状(G)和相对真菌生物量(H);(I)OsVOZ1/2 Ri幼苗中防御基因OsPR1a和OsPBZ1的表达;(J)几丁质在OsVOZ1/2 Ri叶片中诱导ROS爆发。
进一步研究发现,OsVOZ1和OsVOZ2能够与Piz-t蛋白互作。为了分析OsVOZ1和OsVOZ2在Piz-t介导的ETI中是否存在功能冗余,作者构建了Piz-t-HA株系和OsVOZ1/2 Ri*Piz-t-HA株系(通过遗传杂交实验将Piz-t-HA引入OsVOZ1/2 Ri株系),结果显示OsVOZ1/2正调控Piz-t介导的PTI反应。随后通过对GVG-APIP10 Ri*Piz-t-HA(通过遗传杂交实验将GVG-APIP10 Ri引入Piz-t-HA株系)和 GVG-APIP10 Ri*OsVOZ1/2 Ri*Piz-t-HA(通过遗传杂交实验将GVG-APIP10 Ri引入OsVOZ1/2 Ri*Piz-t-HA株系)株系进行检测,结果显示APIP10能够抑制OsVOZ1/2的转录,并促进Piz-t的积累(图4)。
图4 OsVOZ1/2基因双重沉默可减少Piz-t的积累、依赖于ROS的细胞死亡反应以及对含有AvrPiz-t的稻瘟菌的抗性(Wang et al., 2021)。(A)与Piz-t-HA植物相比,OsVOZ1/2 Ri*Piz-t-HA植物中OsVOZ1和OsVOZ2的表达受到抑制;(B-C)NPB、Piz-t-HA和OsVOZ1/2 Ri*Piz-t-HA植株在接种含有AvrPiz-t的稻瘟菌后叶片的病害症状(B)和相对真菌生物量(C);(D)水稻叶鞘细胞内接种稻瘟菌48小时后免疫响应细胞死亡(深褐色);(E)OsVOZ1/2 Ri*Piz-tHA植物的Piz-t转录水平低于Piz-t-HA植物;(F)在OsVOZ1/2 Ri*Piz-t-HA植株中,Piz-t蛋白积累减少;(G)Ubi::OsVOZ1/2 Ri在Piz-t-HA原生质体中瞬时表达时,Piz-t 的表达量减少;(H)Ubi::OsVOZ1/2 Ri在Piz-t-HA原生质体中瞬时表达时Piz-t积累减少;(I)OsVOZ1/2 Ri*Piz-t-HA植物和Piz-t-HA植物中Piz-t的稳定性;(J)上图表示沉默APIP10会增强Piz-t的积累,下图表示APIP10在相应植株中的表达情况。
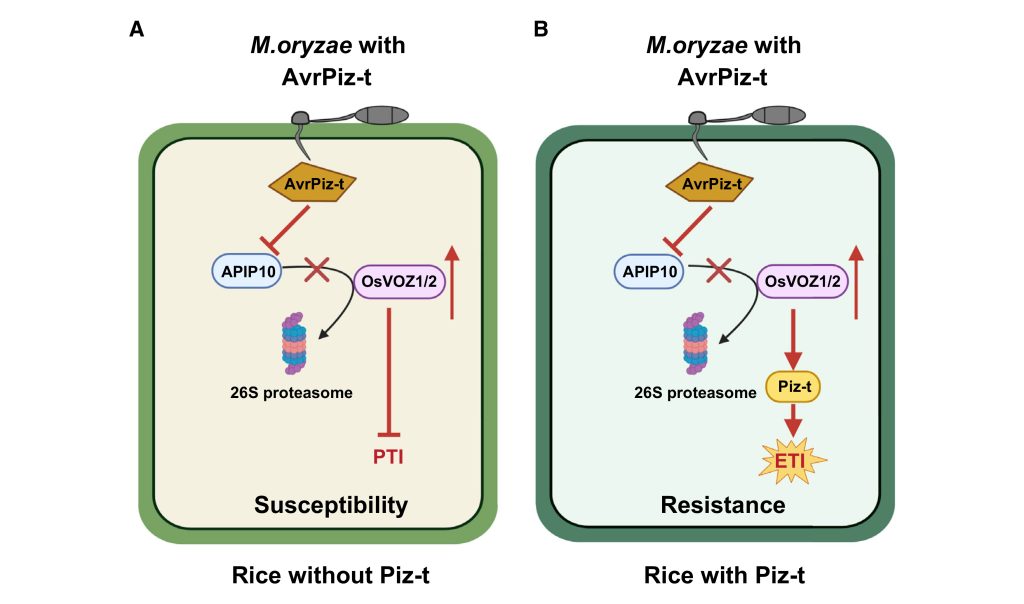
综上所述,该研究揭示了OsVOZ1/2转录因子作为桥梁连通泛素连接酶APIP10和Piz-t,参与负调控稻瘟菌的基础抗性和正调控NLR受体蛋白Piz-t介导的ETI反应(图5)。
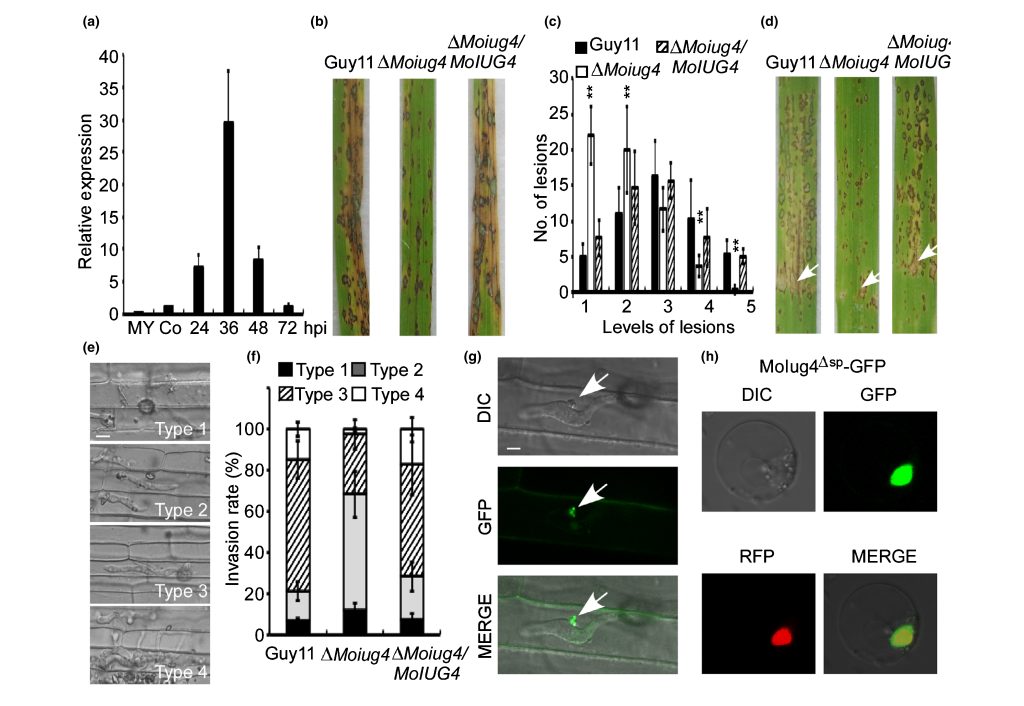
2022年4月,南京农业大学植物保护学院张正光课题组在New Phytologist杂志上发表了一篇题为“MoIug4 is a novel secreted effector promoting rice blast by counteracting host OsAHL1-regulated ethylene gene transcription”的研究论文,作者从稻瘟菌基因组中鉴定出一个新型效应蛋白MoIug4,发现其突变菌株致病能力下降,回补后突变菌株致病能力恢复。对水稻接种不同菌株,发现Moiug4突变菌株的侵染菌丝扩展受阻,这表明MoIug4效应蛋白对于稻瘟菌的致病性是重要的。激光共聚焦显微镜观察结果显示MoIug4是经过BIC结构进入细胞内的细胞质效应蛋白,并且定位在细胞核(图6)。
图6 稻瘟菌侵染水稻时MoIug4作为细胞质效应分子发挥作用(Liu et al., 2022)。(a)稻瘟菌侵染期间MoIug4的表达变化;(b)水稻叶片致病性测定;(c)病害程度的量化;(d) 向4周龄水稻幼苗叶片接种Guy11、ΔMoiug4突变体菌株和回补菌株;(e)四种不同类型的侵入性菌丝(IH)(1. 仅注射、2. 只有单个侵入性菌丝,没有分支、3. IH延伸但仅限于一个植物细胞、4. IH具有许多分支并延伸到周围细胞);(f)对每种侵染菌丝形状进行统计分析;(g)在侵染过程中观察到全长MoIug4在水稻鞘细胞中的定位;(h)MoIug4在水稻原生质中的定位。
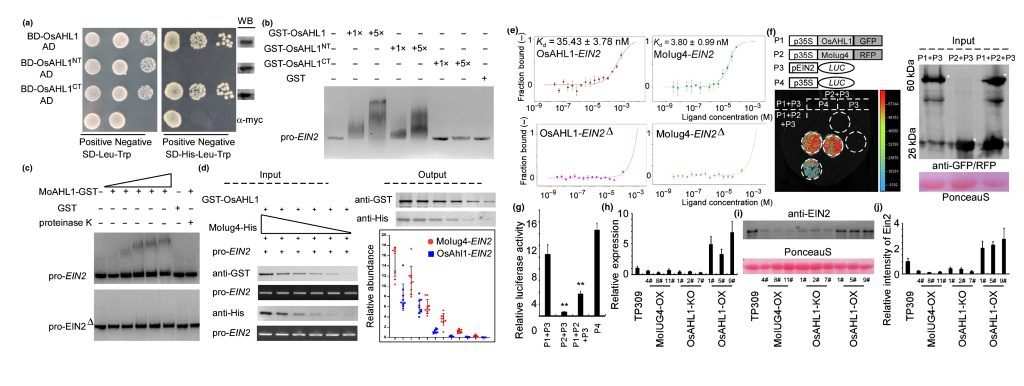
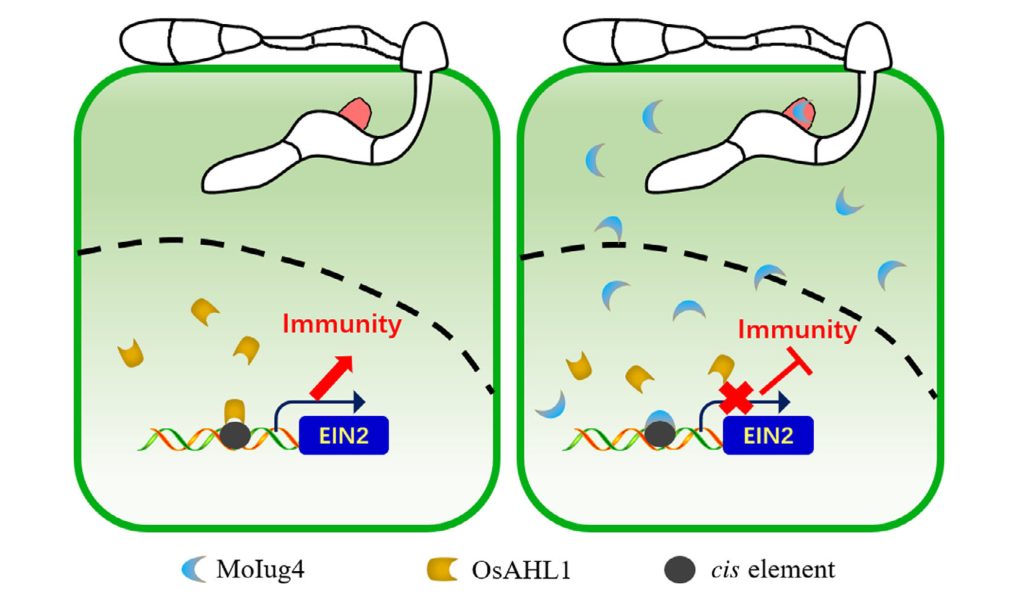
PAMP触发的ROS积累是宿主植物防止病原体入侵的一个有效策略,DAB染色分析的结果显示突变菌株具有较高的ROS水平,当使用了抑制NADPH氧化酶活性的DPI和CAG后,突变菌株致病能力恢复,这表明ROS能够抑制稻瘟菌的致病力。RT-qPCR检测不同菌株接种水稻后SA、JA和ET相关基因的表达量,结果显示SA和JA相关基因表达在Guy11和Moiug4突变菌株中无明显差异,ET相关基因表达在Moiug4突变菌株接种水稻中显著上调,作者推测MoIug4可能通过调控OsEIN2和OsEIN3来参与乙烯信号通路,ChIP-Seq和DNA Pull-down的结果证明了MoIug4与OsEIN2启动子特异性结合;随后通过酵母双杂交文库筛选结合Y2H和BiFC等实验发现MoIug4与OsAHL1的N端互作;对OsAHL1进行基因编辑和过表达,结果显示OsAHL1能够提高水稻对稻瘟菌的抗性;OsAHL1作为转录激活因子同样与OsEIN2启动子区域结合,但其结合亲和力明显弱于MoIug4(图7)。
图7 OsAHL1的正常转录是水稻免疫所必需的,转录过程还受到MoIug4的调控(Liu et al., 2022)。(a)在酵母中检测OsAHL1、OsAHL1NT和OsAHL1CT片段的活性;(b)EMSA测定OsEIN2全长启动子与纯化的 GST-OsAHL1、GST-OsAHL1NT、GST-OsAHL1CT的互作;(c)OsEIN全长启动子和顺式元件突变启动子(EIN2Δ)与OsAHL1的互作;(d)在体外试验中,OsEIN2启动子与MoIug4的亲和力高于OsAHL1;(e)微尺度热泳(MST)测定表明,MoIug4和OsEIN2启动子的亲和力高于OsAHL1对OsEIN2启动子;(f)Split-LUC实验测定MoIug4和OsAHL1与OsEIN2启动子的相互作用;(g)荧光素酶活性测定;(h)RT-qPCR检测MoIUG4-OX、OsAHL1-KO和OsAHL1-OX株系中OsEIN2的表达;(i和j)WB检测MoIUG4-OX、OsAHL1-KO和OsAHL1-OX株系中OsEIN2蛋白含量。
综上所述,稻瘟菌效应蛋白MoIug4竞争性结合OsEIN2启动子进而抑制OsAHL1介导的转录以及ET信号通路介导的宿主免疫,最终导致水稻感病(图8)。
此外,2022年5月,中国农业科学院植物保护研究所刘文德课题组在Molecular Plant Pathology杂志上发表了一篇题为“Two Magnaporthe appressoria specific (MAS) proteins, MoMas3 and MoMas5, are required for suppressing host innate immunity and promoting biotrophic growth in rice cells”的研究论文,作者同样鉴定出两个稻瘟菌效应蛋白MoMas3和MoMas5,水稻叶鞘接种实验发现∆Momas3和∆Momas5突变菌株的IH在寄主细胞中的生长受到限制,该突变菌株还能诱导水稻抗病基因PR1和PBZ1的表达,增强水稻对突变菌株的抗性导致突变菌株的致病力减弱。综上,该研究发现了两个新的效应蛋白,通过抑制水稻的免疫反应来促进稻瘟菌的侵染过程。
2023年10月,中国农业大学植物保护学院赵文生课题组在Plant Biotechnology Journal杂志上发表了一篇题为“The GRAS protein OsDLA involves in brassinosteroid signalling and positively regulates blast resistance by forming a module with GSK2 and OsWRKY53 in rice”的研究论文。作者鉴定到一个参与水稻叶夹角调控和油菜素甾醇(Brassinosteroids, BRs)响应的相关基因OsDLA,随后通过Y2H、GST Pull-down、Co-IP、BiFC和Split-LUC实验证明OsDLA能够与水稻BR信号转导的核心负调控因子GSK2在体内和体外发生蛋白互作,体内激酶检测和体外磷酸化实验的结果说明Ser281和Ser283是OsDLA被GSK2磷酸化的关键位点,并且可以通过26S蛋白酶体使OsDLA磷酸化并降解。
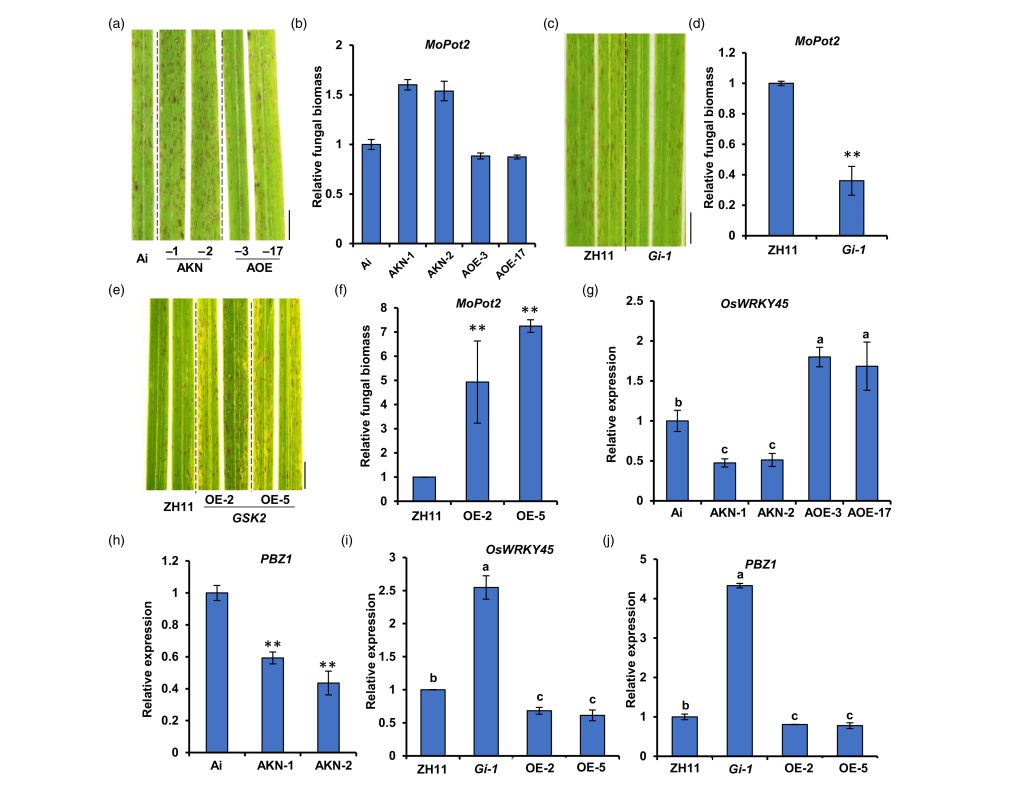
稻瘟病接种实验结果显示osdla突变体更加感病,OsDLA过表达株系更加抗病,表明OsDLA正向调控水稻对稻瘟病的抗性,而GSK2则起着相反的作用。BR含量检测分析的结果显示osdla突变体中BR含量相比于野生型明显降低,对野生型水稻进行24-表油菜素内酯(24-epiBL)喷施处理后也能够提高水稻的抗病性,这表明BR在水稻抗稻瘟病中扮演正调控作用(图9)。
图9 OsDLA和GSK2在稻瘟病抗性中起相反的作用(Meng et al., 2023)。(a-b)OsDLA-OE株系、osdla株系和Ai野生型幼苗在接种稻瘟菌后叶片的病害症状(a)和相对真菌生物量(b);(c-d)GSK2-RNAi株系和ZH11幼苗在接种稻瘟菌后叶片的病害症状(c)和相对真菌生物量(d);(e-f)GSK2-OE株系和ZH11幼苗在接种稻瘟菌后叶片的病害症状(e)和相对真菌生物量(f);(g-h)OsDLA-OE株系、osdla株系和Ai野生型幼苗中OsWRKY45(g)和PBZ1(h)转录水平分析;(i-j)GSK2-RNAi株系、GSK2-OE株系和ZH11幼苗中OsWRKY45(i)和PBZ1(j)转录水平分析。
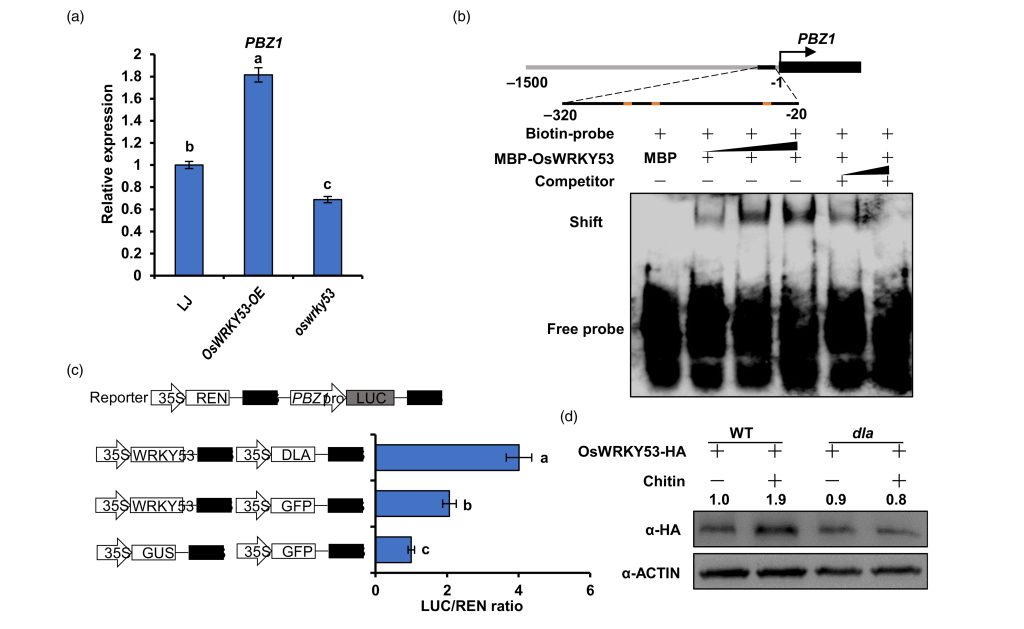
由于OsWRKY53已经被报道作为GSK2的底物,因此作者进一步对OsWRKY53和OsDLA的互作关系进行验证,结果显示OsWRKY53和OsDLA存在蛋白相互作用,并且能够抑制GSK2对OsWRKY53的磷酸化水平而促进OsWRKY53蛋白的积累。EMSA和Dual-LUC的实验结果表明OsDLA促进了OsWRKY53对下游PBZ1的转录。此外,野生型株系中OsWRKY53的表达还受到几丁质的诱导,在osdla突变体中表达则没有显著变化(图10)。
图10 OsWRKY53激活水稻免疫反应依赖OsDLA的参与(Meng et al., 2023)。(a)PBZ1在OsWRKY53-OE株系和oswrky53株系中PBZ1转录水平分析;(b)OsWRKY53在EMSA测定中直接与PBZ1启动子结合;(c)转录激活实验表明,OsDLA促进了OsWRKY53对PBZ1表达的调控;(d)几丁质处理结果显示OsWRKY53在野生型中显著积累,但在osdla敲除植株中不积累。
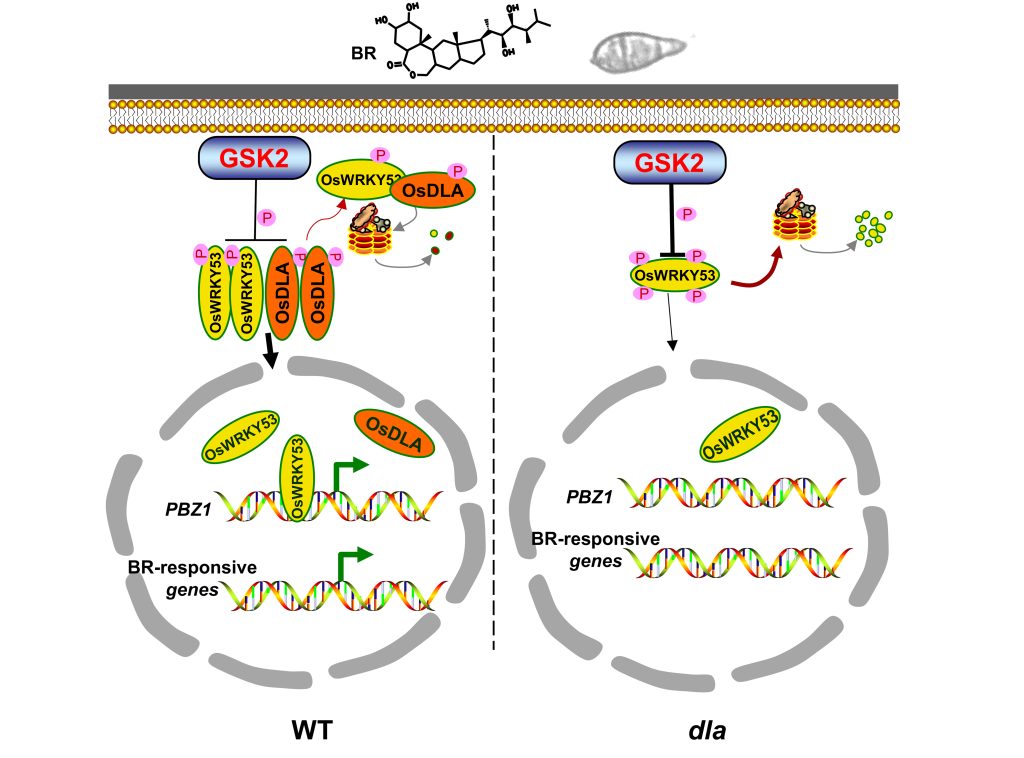
综上所述,OsDLA的表达受到稻瘟菌侵染和BR处理的诱导,OsDLA与OsWRKY53互作抑制了GSK2对OsWRKY53的降解。OsDLA不仅促进OsWRKY53激活BR响应基因的表达,而且还激活PR基因PBZ1的转录,进而提高水稻的抗病性(图11)。
杨俊, 吕东平. 植物PTI天然免疫信号转导研究进展[J]. 中国生态农业学报, 2018, 26(10): 1585-1592.
Dean R, Van Kan J A L, Pretorius Z A, et al. The Top 10 fungal pathogens in molecular plant pathology[J]. Molecular plant pathology, 2012, 13(4): 414-430.
Heese A, Hann D R, Gimenez-Ibanez S, et al. The receptor-like kinase SERK3/BAK1 is a central regulator of innate immunity in plants[J]. Proceedings of the National Academy of Sciences, 2007, 104(29): 12217-12222.
Hu K M, Qiu D Y, Shen X L, et al. Isolation and manipulation of quantitative trait loci for disease resistance in rice using a candidate gene approach[J]. Molecular plant, 2008, 1(5): 786-793.
Li G, Gong Z, Dulal N, et al. A protein kinase coordinates cycles of autophagy and glutaminolysis in invasive hyphae of the fungus Magnaporthe oryzae within rice cells[J]. Nature Communications, 2023, 14(1): 4146.
Liu X, Gao Y, Guo Z, et al. MoIug4 is a novel secreted effector promoting rice blast by counteracting host OsAHL1‐regulated ethylene gene transcription[J]. New Phytologist, 2022, 235(3): 1163-1178.
Meng F, Zheng X, Wang J, et al. The GRAS protein OsDLA involves in brassinosteroid signalling and positively regulates blast resistance by forming a module with GSK2 and OsWRKY53 in rice[J]. Plant Biotechnology Journal, 2023.
Ngou B P M, Ahn H K, Ding P, et al. Mutual potentiation of plant immunity by cell-surface and intracellular receptors[J]. Nature, 2021, 592(7852): 110-115.
Sha G, Sun P, Kong X, et al. Genome editing of a rice CDP-DAG synthase confers multipathogen resistance[J]. Nature, 2023: 1-7.
Wu Z, Tong M, Tian L, et al. Plant E3 ligases SNIPER 1 and SNIPER 2 broadly regulate the homeostasis of sensor NLR immune receptors[J]. The EMBO journal, 2020, 39(15): e104915.
Yuan M, Jiang Z, Bi G, et al. Pattern-recognition receptors are required for NLR-mediated plant immunity[J]. Nature, 2021, 592(7852): 105-109.
Zhai K, Liang D I, Li H, et al. NLRs guard metabolism to coordinate pattern-and effector-triggered immunity[J]. Nature, 2022, 601(7892): 245-251.