本次推文概览如下:
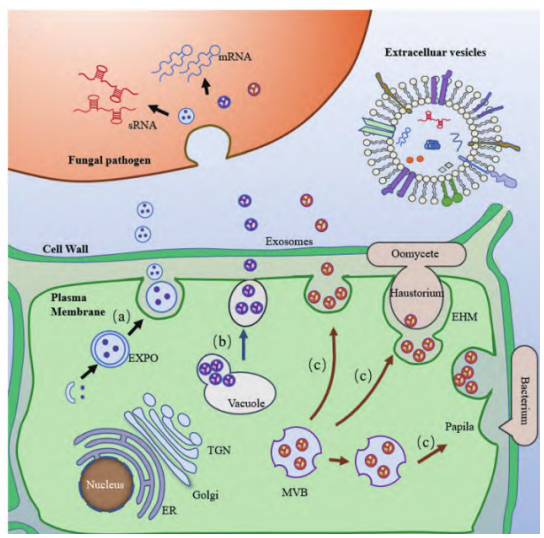
2018年美国加州大学河滨分校金海翎研究团队在Science上发表了题为“Plants send small RNAs in extracellular vesicles to fungal pathogen to silence virulence genes”的研究论文。在该研究论文中,作者通过拟南芥-灰霉菌的致病系统,发现拟南芥细胞通过分泌外泌体样的细胞外囊泡将sRNAs传递到灰酶菌中,含有sRNA的囊泡能够聚集在感染部位并被灰霉菌吸收,从而导致灰霉菌中的关键致病基因被沉默,促进植物免疫反应。
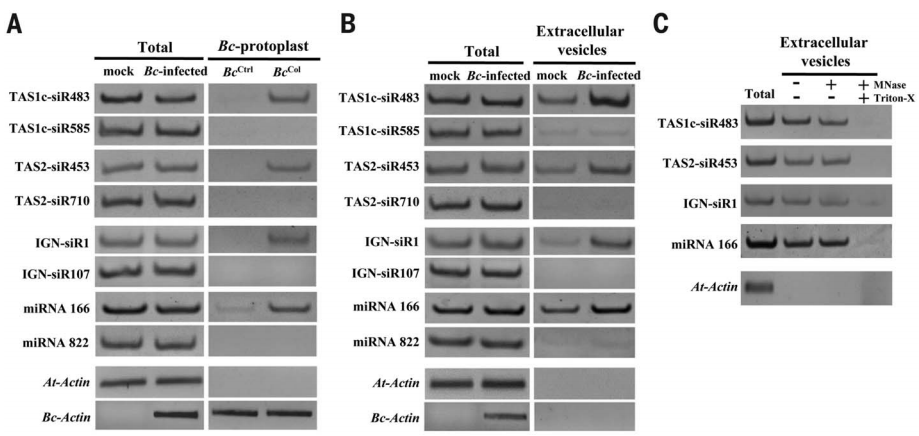
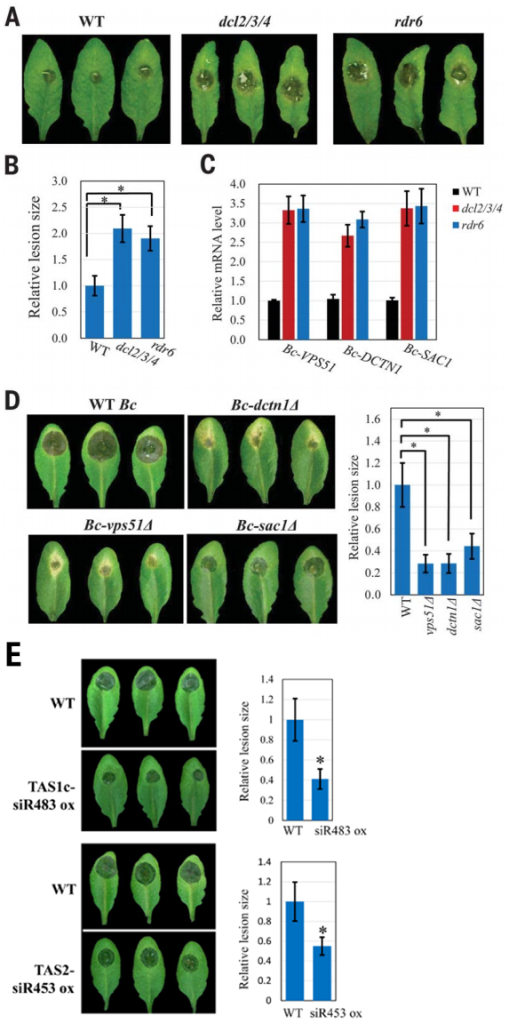
作者首先从拟南芥被感染的部位分离的灰霉菌原生质体中鉴定出了42个拟南芥sRNAs。对42个sRNAs进行分析并结合半定量RT-PCR反应,发现TAS1c-siR483和TAS1c-siR585、TAS2-siR453和TAS2-siR710、IGN-siR1和IGN-siR107、miRNA166和miRNA822这四组由相同的前体mRNA产生,但仅每组中的前者在灰霉菌的原生质体中富集,且前者在从灰霉菌侵染的拟南芥叶片的质外体液分离出的囊泡中也被检测到,富集的量前者也远高于后者,并通过核酸酶保护测定实验证明了来自拟南芥的sRNAs不会被核酸酶消化,证明了植物内源性sRNAs可以通过细胞外囊泡运输到真菌细胞内(图2)。
图2 植物内源性sRNAs通过细胞外囊泡转移到真菌细胞中(Cai et al., 2018)。Total:拟南芥叶片中的sRNAs;BCCtrl:未侵染拟南芥叶片的灰霉菌;BCCol:从拟南芥被感染的部位分离的灰霉菌。(A)灰霉菌原生质体中TAS1c-siR483、TAS2-siR453、IGN-siR1及miRNA166的半定量RT-PCR;(B)拟南芥叶片质外体囊泡中TAS1c-siR483、TAS2-siR453、IGN-siR1及miRNA166的半定量RT-PCR;(C)MNase:微藻核酸酶,Triton X-100:细胞裂解液。
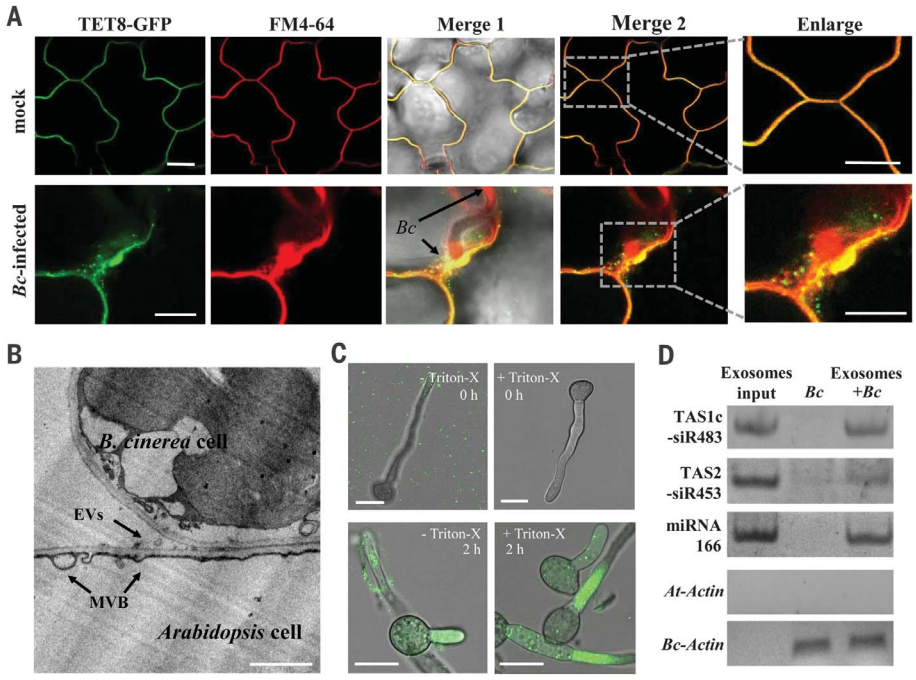
拟南芥四次穿膜蛋白TET8、TET9与哺乳动物外泌体标志物蛋白CD63类似,同时与灰霉菌侵染拟南芥相关(Boavida et al., 2013),通过分析TET8-GFP在拟南芥叶片中的定位,并结合透射电镜观察拟南芥叶片中的细胞外囊泡说明TET8标记的细胞外囊泡是植物外泌体(图3A、B)。将灰霉菌与TET8-GFP标记的外泌体共同培养并结合半定量实验证明真菌细胞可以吸收植物外泌体,同时外泌体可以将植物的sRNAs转移到真菌细胞中(图3C、D)。
图3 四次穿膜蛋白标记的外泌体将植物的sRNAs转移到真菌细胞中(Cai et al., 2018)。(A)灰霉菌诱导TET8-GFP标记的囊泡在感染部位聚集,FM4-64是一种内吞性的膜染料;(B)透射电镜观察到细胞外囊泡来源于多泡体MVBs;(C)TET8-GFP标记的外泌体被真菌细胞吸收;(D)真菌体内可以检测到植物外泌体。
通过观察TET8-GFP和TET9-YFP的共定位,并分别构建TET8、TET9的单突突变体和二者的双突突变体,结合表型实验说明TET8和TET9共协调运输植物的sRNAs到真菌细胞中,从而促进植物对真菌免疫反应(图4)。
图4 TET8和TET9共调控sRNAs的运输分泌和植物的免疫反应(Cai et al., 2018)。(A)TET8-GFP、TET9-YFP共定位于侵染部位的囊泡中;(B、D、E)TET8、TET9双突突变体、单突突变体致病性;(C)感染TET8-TET9双突变体分离纯化的真菌原生质体中,宿主转移的sRNAs的积累减少。
拟南芥三突突变体(dcl2/3/4)影响反式siRNA和异染色质的生物发生,rdr6突变体影响反式siRNA的形成(Xie et al., 2005)。TAS1c-siR483靶向2个灰霉菌基因BC1G_10728——编码液泡蛋白分选蛋白Bc-Vps51和BC1G_10508——编码dynactin复合物的大亚基Bc-DCTN1,DCTN结合动力蛋白II和动力蛋白并协调囊泡运输(Steinmetz and Akhmanova, 2008)。BC1G_08464编码一种肌动蛋白(SAC1)样磷酸肌醇磷酸酶抑制因子,调节分泌运输(Liu and Bankaitis, 2010),通过构建Bc-Vps51、Bc-DCTN1、BcSAC1突变体和拟南芥TAS1c-siR483和TAS2-siR453的过表达株系,结合致病性实验表明植物内源性sRNAs可以沉默真菌致病性相关基因来触发植物免疫反应(图5)。以上结果表明植物细胞外囊泡尤其是外泌体可以通过运输sRNAs促进植物与真菌病原体之间的跨界交流,从而触发植物免疫反应。
2020年中国科学院大学植物生理生态研究所陈晓亚团队在Molecular Plant上发表了题为“Lipidomic Analysis Reveals the Importance of GIPCs in Arabidopsis Leaf Extracellular Vesicles”的研究论文。在该研究论文中,作者对拟南芥莲座叶进行了脂质组学分析,揭示了鞘脂在EVs中高峰度富集,建立了拟南芥叶片EVs脂质图谱,同时也表明了EVs中的脂质可参与植物免疫反应,为植物EVs的产生和功能研究提供了新的思路。
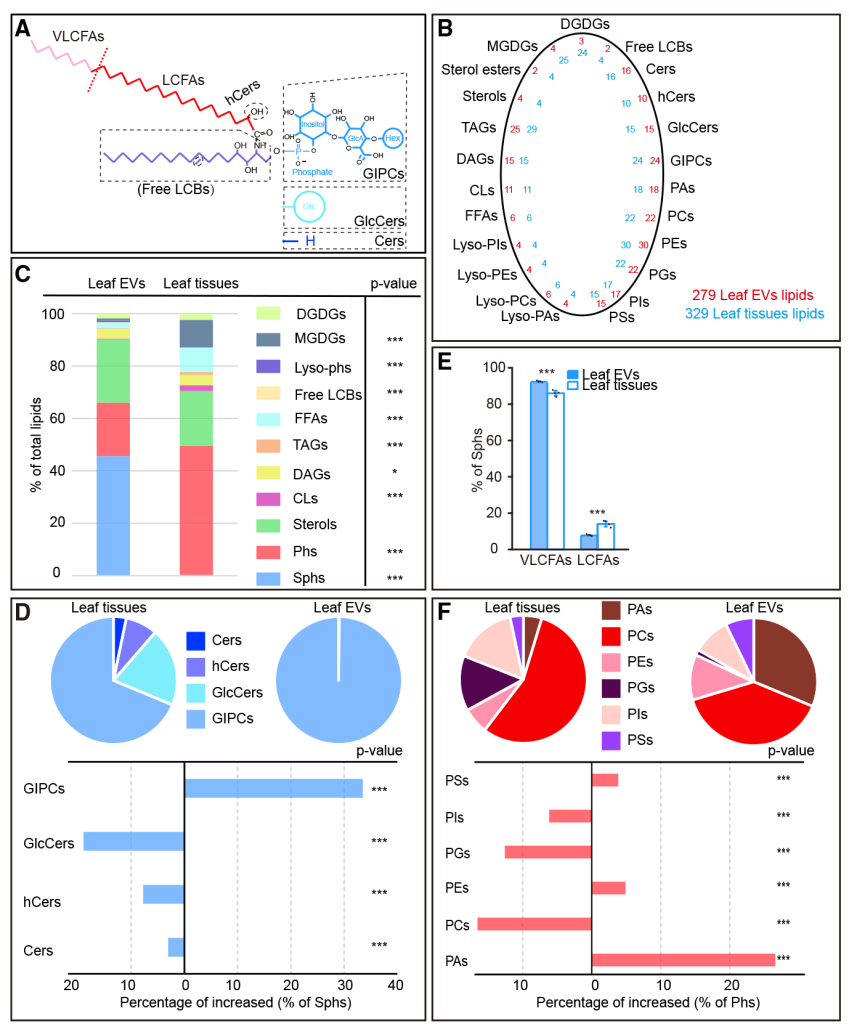
作者首先对拟南芥叶片EVs和全叶组织进行了脂质组学分析,发现拟南芥叶片EVs中存在23类、279种脂质,而总叶片中有329种;在叶片EVs中GIPCs(糖基醇磷酸神经酰胺)占总数的99%,而在全叶组织中GIPCs仅占60%;脂肪链分析显示EV鞘脂中超长链脂肪酸的比列高达90%,除此之外GIPCs可感知植物病原微生物释放的NLP(坏死和乙烯诱导肽1样蛋白毒素);甘油磷脂分析显示EVs中PCs和PAs含量丰富,说明鞘脂类的GIPCs可区分EV与其他细胞膜,并参与植物免疫反应(图6),PAs参与生物互作(Teng et al., 2018)。
图6 叶片EVs和全叶组织的脂质谱(Liu et al., 2020)。(A)四类鞘脂的结构示意图,虚线圈表示长链碱基或长链脂肪酸的修饰,红色链代表16-18碳链,粉色链代表超过18个C的链;(B)总脂质种类,红色代表叶片EVs,蓝色代表全叶组织;(C)主要脂质的分类;(D)叶片EVs和全叶组织中四类鞘脂的分布;(E)鞘脂中脂肪酸链的分布;(F)膜磷脂的分布。
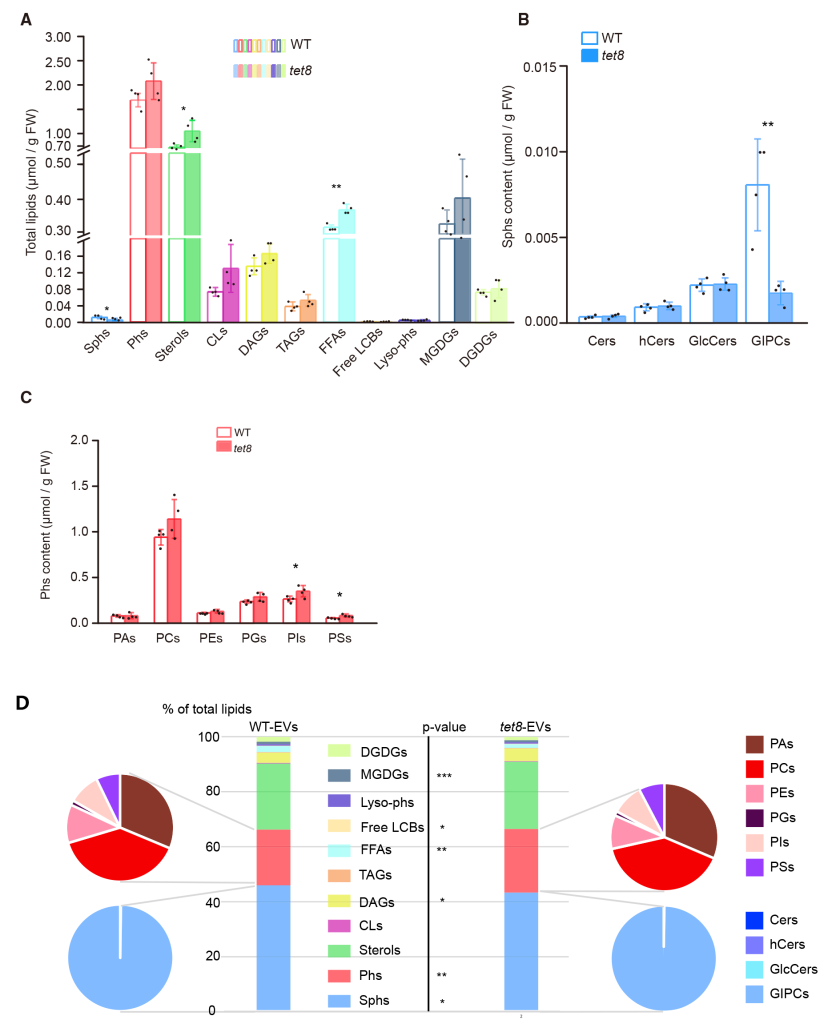
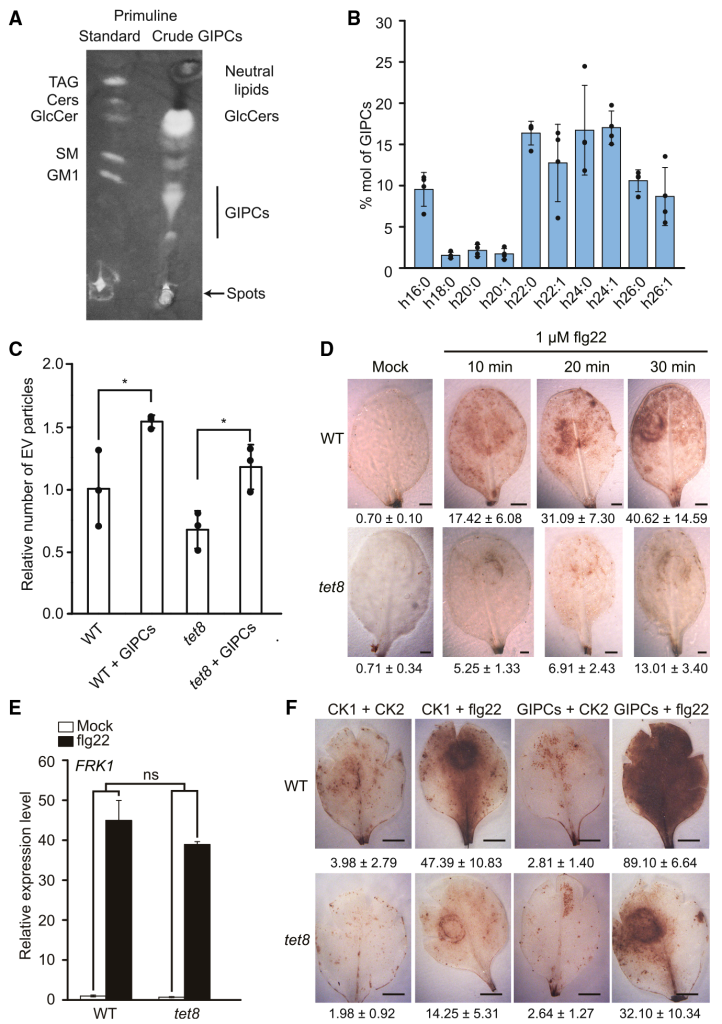
通过分析tet8突变体叶片和野生型拟南芥叶片中的EVs,并分析各自的脂质组成,发现tet8缺失导致EVs产生量、GIPCs含量下降(图7)。通过对拟南芥莲坐叶片喷洒外源GIPCs同时检测野生型拟南芥叶片和tet8缺失突变体叶片产生的活性氧实验,说明GIPCs可部分恢复tet8突变体EVs的分泌和活性氧爆发的损伤(图8)。综上说明,细胞外囊泡通过GIPCs的高度富集,进而参与细胞间的通讯反应和植物与病原微生物的互作反应。
图7 tet8缺失突变体鞘脂含量降低(Liu et al., 2020)。(A)野生型和tet8缺失突变体叶片组织中不同脂质的含量;(B)叶片组织中四类鞘脂含量,tet8缺失突变体叶片组织中GIPCs显著下降;(C)野生型和tet8缺失突变体叶片组织中膜磷脂的主要种类;(D)野生型和tet8缺失突变体叶片EVs总脂质的相对含量,饼状图代表鞘脂和磷脂的分布。误差条表示SDs,黑点表示每个重复的单个值(n=4),采用双尾Student’s t-test,*P<0.05,**P<0.01,***P<0.005。
图8 GIPCs可以恢复tet8缺失突变体EVs分泌和活性氧造成的损伤(Liu et al., 2020)。(A)粗叶GIPCs的薄层色谱分析;(B)LC-MS分析测定叶片来源的纯化GIPCs的脂肪酸组成,横坐标代表不同链长的羟基脂肪酸,纵坐标代表占比;(C)GIPCs预处理的叶片EVs释放量升高,设置野生型的值为1,三次独立重复实验数据取均值,黑点代表每次重复的单个值,采用双尾Student’s t-test,***P<0.001;(D)经flg22(细菌病原体相关分子模式鞭毛蛋白的一种肽)处理的野生型和tet8缺失突变体叶片的活性氧检测,对照组用无菌水处理,图片下方的值表示染色面积占总叶面积的百分比;(E)flg22处理1h后野生型和tet8缺失突变体叶片中FRK1(flg22应答基因flg22诱导的受体样激酶1)的相对表达量,将对照组野生型叶片表达设为1,以AtUBQ5作为内标,三次生物重复数据取均值,采用双尾Student’s t-test检验,n表示无显著差异。(F)GIPCs处理12h,野生型和tet8缺失突变体叶片的活性氧检测。比列尺为1mm,CK1代表0.01%的Tween20+0.5%甲醇,CK2代表灭菌水处理。
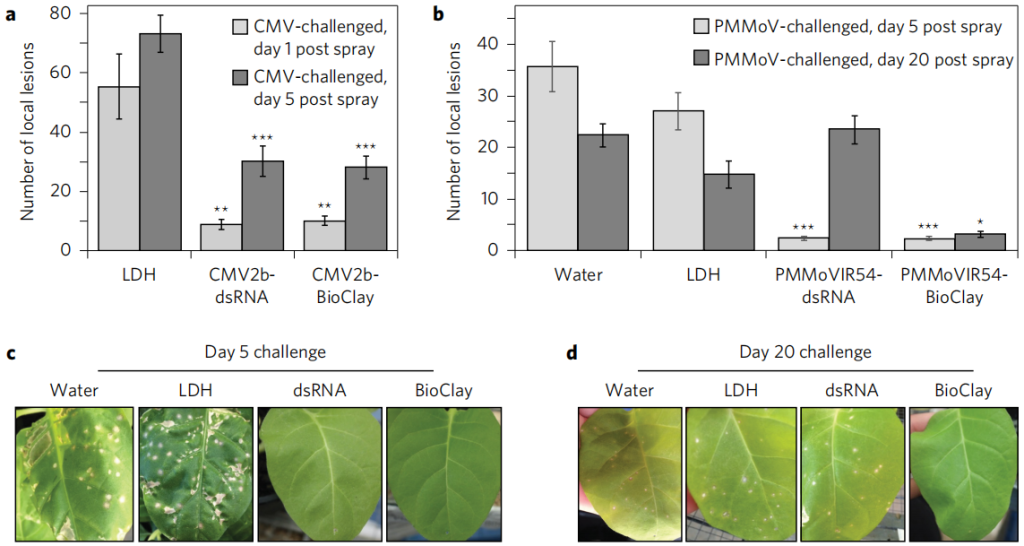
上述文章主要是通过植物内源EVs运输sRNAs或者脂质运输介导植物与微生物的互作。基于EVs可以保护sRNAs不被细胞内源核酸酶降解的机制,以脂质体或纳米颗粒制造的人工囊泡应运而生,它是一种由脂质双分子层包裹的球状囊泡,具有无毒、高相容性的特点。2017年,昆士兰大学农业与食品创新联盟在Nature Plants上发表了题为“Clay nanosheets for topical delivery of RNAi for sustained protection against plant viruses”的研究论文,该研究论文证明了病原体特异性双链RNA(dsRNA)可以装载在人工设计的双氢氧化物粘土纳米片(LHD)上,从而局部应用dsRNA提高植物对病毒的抗性。
伯小远通过以上3个文献案例给大家分享了植物内源EVs可以通过运输sRNAs、脂质参与植物的免疫反应及人工囊泡的应用,那么除此之外植物EVs还有没有其他功能的呢?答案当然是肯定的!
2022年日内瓦大学植物与植物生物系Marie Barberon研究团队在Nature Communications杂志上发表了题为“Extracellular vesiculo-tubular structures associated with suberin deposition in plant cell walls”的研究论文,该研究论文表明胞外囊泡管状结构(EVBs)与细胞壁中木质素的沉积相关,在早期和晚期对分泌途径抑制会干扰EVB的形成和木栓素的积累。同时证明了木质素前体或生物合成酶向质外体的运输及植物中次生壁的形成都需要EVB。
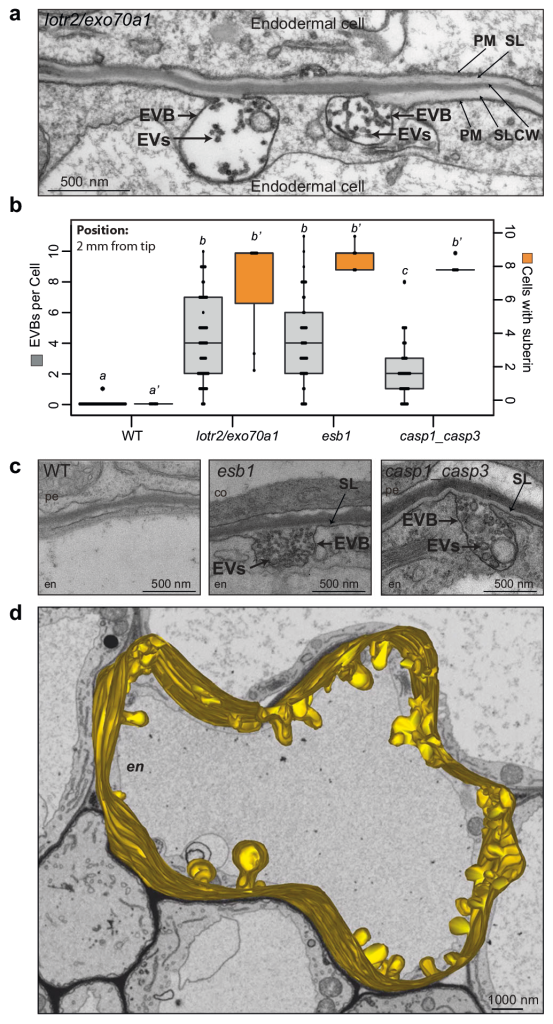
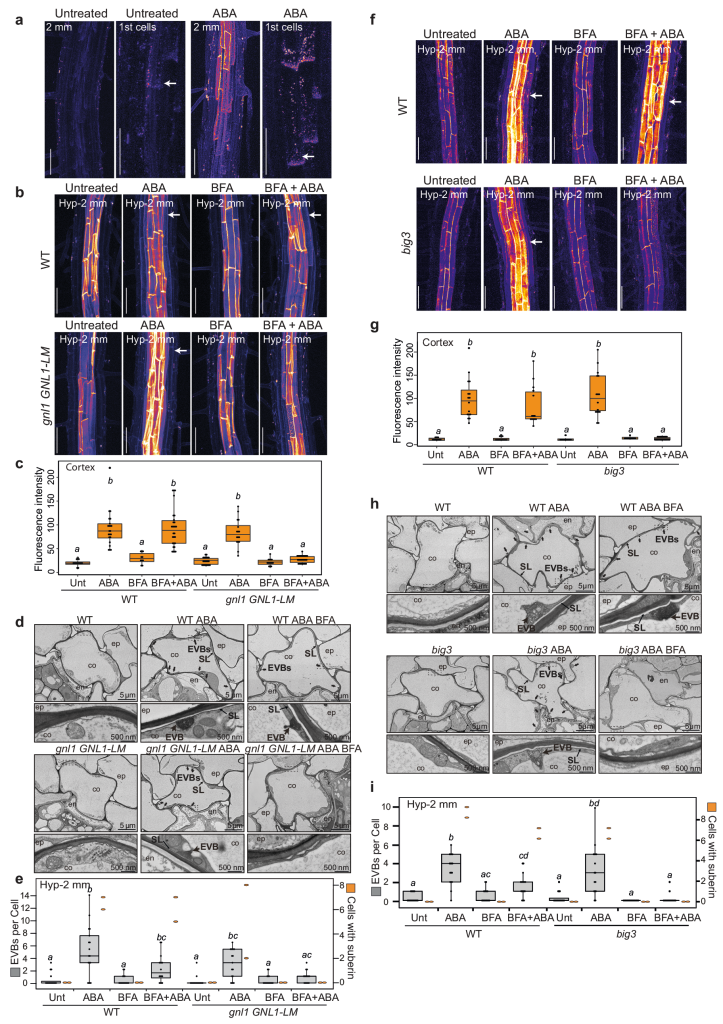
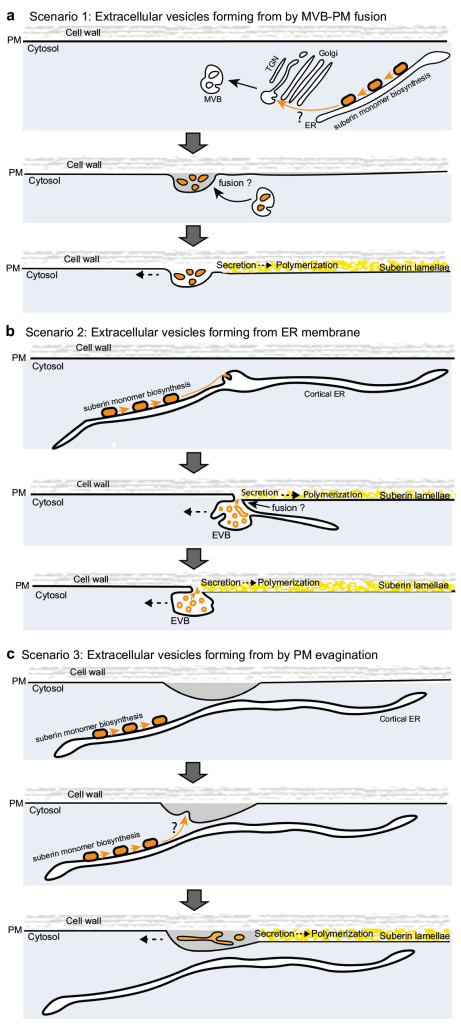
作者首先筛选鉴定出了与拟南芥内胚层形成障碍相关的突变体lotr2/exo70a1,并对内胚层进行了超微结构分析,发现仅在突变体中存在囊泡与质膜融合的过程。同时发现esb1(木栓蛋白1)和casp1/casp3(凯氏带条形膜结构域蛋白1/3)突变体中也存在囊泡质膜融合过程,说明细胞外囊泡管状结构在内胚层屏障突变体中积累(图10)。木质素的脂质性可以用荧光黄染色来显示(Andersen et al., 2018; Naseer, et al., 2012),通过ABA、BFA(布雷非德菌素A,可逆性蛋白转运抑制剂)处理拟南芥根部,发现BFA处理阻碍了突变体细胞壁中ABA依赖型木质素的积累,同时降低了ABA诱导的皮质细胞中EVB的数量,说明EVB参与了木质素沉积的过程(图11)。结合实验结果作者构建了EVB运输木质素单体的生物模型(图12)。
图10 细胞外囊泡管状结构在内胚层屏障突变体中积累(De et al., 2022)。(a)透射电镜观察lotr2/exo70a1突变体离根尖2mm处的内胚层图片;(b)野生型、lotr2/exo70a1、esb1和casp1_casp3突变体离根尖2mm处的透射电镜横截面处,内胚层EVB的数量(灰色左轴),脱落细胞的数量(橙色右轴),不同字母表示基因型或生长条件差异显著P<0.05;(c)WT、esb1/casp1_casp3突变体的内胚层切片;(d)lotr2/exo70a1突变体的质膜及EVB的3D模型(黄色部分)。注:均使用透射电镜观察,CW:细胞壁、SL:亚木质素片层、PM:质膜、EVBs:胞外囊泡管状结构、EV:胞外囊泡。
图11 EVB参与分泌依赖性木质素沉积过程(De et al., 2022)。(a)ABA处理与未处理的野生型植株,左边是在根尖2mm处拍摄,右图是第一批木栓化的细胞箭头指示;(b、c)ABA、BFA处理野生型和gnl1 GNL1-LM(对BFA敏感)在下胚轴2mm处的照片和荧光强度测定;(d、h)透射电镜观察ABA、BFA处理或不处理WT和gnlGNL1-LM系,或big3(BFA抑制的鸟嘌呤核苷酸交换因子)突变体的皮质细胞;(e、i)透射电镜观察野生型、gnl1 GNL1-LM及big3突变体全根皮层横截面处的EVB(灰色左轴)和木栓化细胞的数量(橙色右轴);(f、g)ABA、BFA处理与未处理野生型和big3突变体下胚轴2mm处的图片和荧光强度测定,箭头指示皮层亚木质素。注:箱型图中不同字母表示基因型与生长条件之间存在显著差异P<0.05。
References:
张雪萍, 鲁雨晴, 张月倩等. 植物细胞外囊泡及其分析技术的进展[J]. 生物技术通报, 2023, 39(05): 32-43.
Cong M, Tan S, Li S, et al. Technology insight: Plant-derived vesicles—How far from the clinical biotherapeutics and therapeutic drug carriers? [J]. Advanced Drug Delivery Reviews, 2022, 182.
Saman S, Kim W, Raya M, et al. Exosome-associated tau is secreted in tauopathy models and is selectively phosphorylated in cerebrospinal fluid in early alzheimer Disease[J]. Journal of Biological Chemistry, 2012, 287(6): 3842-9.
Regente M, Corti-monzon G, Maldonado A M, et al. Vesicular fractions of sunflower apoplastic fluids are associated with potential exosome marker proteins[J]. FEBS Letters, 2009, 583(20): 3363-6.
Rutter B D, Innes R W. Extracellular vesicles isolated from the leaf apoplast carry stress-response proteins[J]. Plant Physiology, 2017, 173(1): 728-41.
Cai Q, Qiao L, Wang M, et al. Plants send small RNAs in extracellular vesicles to fungal pathogen to silence virulence genes[J]. Science, 2018, 360(6393): 1126-9.
Boavida L C, Qin P, Broz M, et al. Arabidopsis tetraspanins are confined to discrete expression domains and cell types in reproductive tissues and form homo-and heterodimers when expressed in yeast[J]. Plant Physiology, 2013, 163(2): 696-712.
Xie Z, Allen E, Wilken A, et al. DICER-LIKE 4 functions in trans-acting small interfering RNA biogenesis and vegetative phase change in Arabidopsis thaliana[J]. Proceedings of the National Academy of Sciences, 2005, 102(36): 12984-9.
Steinmetz M O, Akhmanova A. Capturing protein tails by CAP-Gly domains[J]. Trends in Biochemical Sciences, 2008, 33(11): 535-45.
Liu Y, Bankaitis V A. Phosphoinositide phosphatases in cell biology and disease[J]. Progress in Lipid Research, 2010, 49(3): 201-17.
Dunn T M. A post-genomic approach to understanding sphingolipid metabolism in Arabidopsis thaliana[J]. Annals of Botany, 2004, 93(5): 483-97.
Markham J E, Jaworski J G. Rapid measurement of sphingolipids from Arabidopsis thaliana by reversed-phase high-performance liquid chromatography coupled to electrospray ionization tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2007, 21(7): 1304-14.
Van Meer G, Voelker D R, Feigenson G W. Membrane lipids: where they are and how they behave[J]. Nature Reviews Molecular Cell Biology, 2008, 9(2): 112-24.
Liu N-J, Wang N, Bao J-J, et al. Lipidomic analysis reveals the importance of GIPCs in Arabidopsis leaf extracellular vesicles[J]. Molecular Plant, 2020, 13(10): 1523-32.
Teng Y, Ren Y, Sayed M, et al. Plant-derived exosomal microRNAs shape the gut microbiota[J]. Cell Host & Microbe, 2018, 24(5): 637-52.e8.
Mitter N, Worrall E A, Robinson K E, et al. Clay nanosheets for topical delivery of RNAi for sustained protection against plant viruses[J]. Nature Plants, 2017, 3(2).
De Bellis D, Kalmbach L, Marhavy P, et al. Extracellular vesiculo-tubular structures associated with suberin deposition in plant cell walls[J]. Nature Communications, 2022, 13(1).
Andersen T G, Naseer S, Ursache R, et al. Diffusible repression of cytokinin signalling produces endodermal symmetry and passage cells[J]. Nature, 2018, 555(7697): 529-533.
Naseer S, Lee Y, Lapierre C, et al. Casparian strip diffusion barrier in Arabidopsis is made of a lignin polymer without suberin[J]. Proceedings of the National Academy of Sciences, 2012, 109(25): 10101-6.