近年来,基因编辑技术已成为农业革命的中坚力量,为我们提供了精确修改植物基因的工具。虽然基因编辑技术已经被广泛应用于基因敲除或降低基因表达,但要改进农艺性状,则需要对特定基因进行超表达。因此,我们需要一种方法来提高基因表达,而不涉及外源基因的引入。近日比利时根特大学Frédéric Van Ex课题组在Plant Biotechnology Journal上发表了题为“Coordinated gene upregulation in maize through CRISPR/Cas-mediated enhancer insertion”的文章。作者在玉米基因组中找到了一个12个碱基对的植物增强子,被命名为“PE”。当PE增强子被插入到植物内源启动子后,可提高目标基因的表达。
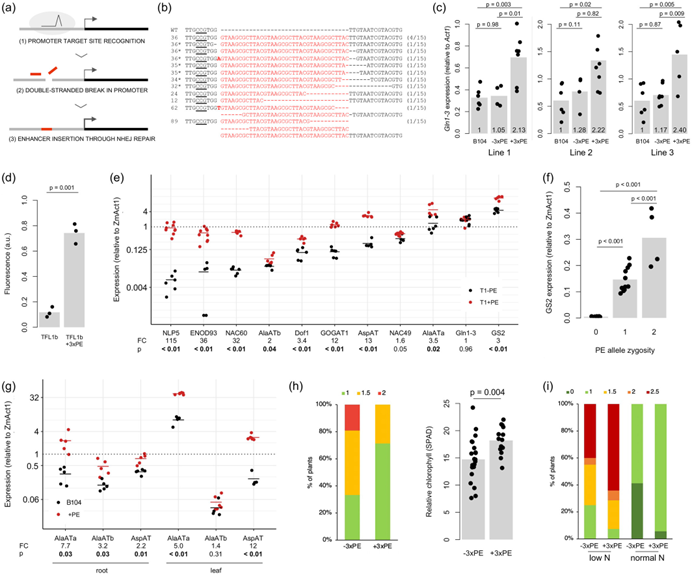
 作者首先在玉米基因组中鉴定了一个 12 bp 回文序列 GTAAGCGCTTAC(“植物增强子”,PE),它与根癌农杆菌章鱼碱合酶启动子中已知的转录增强子元件相似,并且也存在于大豆、水稻和大麦等其他作物的基因组中。利用基因枪法将涂有(i)靶向谷氨酰胺合成酶1-3(Gln1-3)核心启动子的合成单向导RNA(sgRNA),(ii)PE三聚体(3xPE)作为双链寡脱氧核苷酸(dsODN)两端有两个保护性硫代磷酸酯键,并且没有任何目标同源序列,以及(iii)携带除草剂抗性标记和荧光蛋白表达盒的质粒,允许在再生过程中进行选择和目视筛选的金颗粒转入到含有表达Cas9 的品系的未成熟的玉米胚胎中。经检测在目标启动子中携带 dsODN 衍生的插入片段的再生株系占39% ,并且对五个随机选择的品系的后代进行测试证实插入是可遗传的。并且目标基因Gln1-3表达显着增加两倍,在大豆中 3xPE 可使含有GFP标签的株系荧光增强六倍。作者继续对另外10个不同的基因的启动子进行CRISPR/Cas介导的PE增强子插入,发现90%以上的基因均可被增强表达,同时对转基因植株进行全基因组测序发现并未产生脱靶现象。
同时,作者进行了小规模的表型实验验证。已有研究表明丙氨酸氨基转移酶(AlaAT)的表达增加会提高谷物的氮利用效率,而GS2的表达增加会提高小麦的氮吸收效率。作者利用CRISPR/Cas介导的PE增强子插入分别增强了AlaAT和GS2基因达表达,增加AlaAT表达的植物在低氮条件下叶片衰老趋势减慢和相对叶绿素含量提高,表明它们对低氮更具耐受性(图1h)。相反,表达GS2植物叶片衰老速率增加,特别是在正常氮水平下,表明PE插入可以显著影响作物表型。这项研究提供了一种有效的方法,通过编辑技术实现目标基因的上调表达,从而改进作物农艺相关性状。这项技术为农业领域带来更多创新和突破,同时为增加未来的农业生产力提供更多解决方案。
作者首先在玉米基因组中鉴定了一个 12 bp 回文序列 GTAAGCGCTTAC(“植物增强子”,PE),它与根癌农杆菌章鱼碱合酶启动子中已知的转录增强子元件相似,并且也存在于大豆、水稻和大麦等其他作物的基因组中。利用基因枪法将涂有(i)靶向谷氨酰胺合成酶1-3(Gln1-3)核心启动子的合成单向导RNA(sgRNA),(ii)PE三聚体(3xPE)作为双链寡脱氧核苷酸(dsODN)两端有两个保护性硫代磷酸酯键,并且没有任何目标同源序列,以及(iii)携带除草剂抗性标记和荧光蛋白表达盒的质粒,允许在再生过程中进行选择和目视筛选的金颗粒转入到含有表达Cas9 的品系的未成熟的玉米胚胎中。经检测在目标启动子中携带 dsODN 衍生的插入片段的再生株系占39% ,并且对五个随机选择的品系的后代进行测试证实插入是可遗传的。并且目标基因Gln1-3表达显着增加两倍,在大豆中 3xPE 可使含有GFP标签的株系荧光增强六倍。作者继续对另外10个不同的基因的启动子进行CRISPR/Cas介导的PE增强子插入,发现90%以上的基因均可被增强表达,同时对转基因植株进行全基因组测序发现并未产生脱靶现象。
同时,作者进行了小规模的表型实验验证。已有研究表明丙氨酸氨基转移酶(AlaAT)的表达增加会提高谷物的氮利用效率,而GS2的表达增加会提高小麦的氮吸收效率。作者利用CRISPR/Cas介导的PE增强子插入分别增强了AlaAT和GS2基因达表达,增加AlaAT表达的植物在低氮条件下叶片衰老趋势减慢和相对叶绿素含量提高,表明它们对低氮更具耐受性(图1h)。相反,表达GS2植物叶片衰老速率增加,特别是在正常氮水平下,表明PE插入可以显著影响作物表型。这项研究提供了一种有效的方法,通过编辑技术实现目标基因的上调表达,从而改进作物农艺相关性状。这项技术为农业领域带来更多创新和突破,同时为增加未来的农业生产力提供更多解决方案。