近日,加拿大英属哥伦比亚大学李昕教授团队在国际知名植物学期刊《Plant Biotechnology Journal》上在线发表了题为“RAS signalling genes can be used as host-induced gene silencing targets to control fungal diseases caused by Sclerotinia sclerotiorum and Botrytis cinerea”的研究论文。该团队通过正向遗传学手段鉴定出在核盘菌的发育和侵染过程中扮演重要角色的基因SsGAP1,并通过对其在灰葡萄孢菌中同源基因的研究揭示了其功能的保守性和重要性。同时,该团队将GAP1作为寄主诱导的基因沉默(HIGS)的靶标,在烟草中瞬时表达和拟南芥转基因植物中稳定表达后均看到了对核盘菌病斑扩展的抑制效果。除此之外,以GAP1作为HIGS靶标的转基因拟南芥对灰葡萄孢菌也表现出了明显的抗性,起到了“一石二鸟”的效果。加拿大英属哥伦比亚大学李昕教授和四川大学张跃林教授为该论文的共同通讯作者,实验室已毕业博士研究生徐妍为论文第一作者。

核盘菌[Sclerotinia sclerotiorum (Lib.) de Bary]是一种危害极大的植物病原真菌,能够感染超过600多种植物包括油菜,大豆,花生等重要经济作物,造成严重的经济损失。核盘菌侵染植物时会形成菌核。菌核可以存活于土壤表层长达10年之久,是核盘菌在田间菌量累积的重要来源。由于全基因组序列信息发布较晚以及多核性等限制因素,目前对核盘菌研究还处于起步阶段,这也使得我们对这一“臭名昭著”的土传真菌知之甚少。
李昕教授研究团队在先前筛选核盘菌不产菌核突变体的过程中发现了一个表型奇特的突变体R213。与野生型菌株不同的是,R213突变体完全丧失了产菌核的能力,而且菌丝异常黑化,致病能力显著减弱。与R213相同的突变体表型在历来的研究中从未见报道。通过对R213进行全基因组测序及分析,该团队确定了正是由于在SsGAP1这一基因上的移码突变造成了R213的全部表型缺陷。值得一提的是,该团队对SsGAP1在另一重要植物病原真菌-灰葡萄孢菌(Botrytis cinerea)中的同源基因BcGAP1也进行了敲除,结果显示BcGAP1在灰葡萄孢菌的菌核形成、产孢以及侵染寄主植物等方面占有着举足轻重的地位。
SsGAP1是RAS-GTP水解酶的活化蛋白(RAS-GTPase activating protein),负责调控RAS从GTP-bound的活性态向GDP-bound的非活性态的转变。因此,SsGAP1功能的丧失会使RAS处于持续激活状态,从而导致了R213突变体的表型缺陷(图1)。基于此,该团队推断,在Ssgap1突变体中被持续激活的RAS可能在核盘菌各种生物学进程中起负面作用。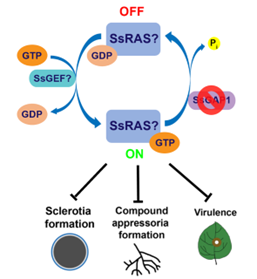 图1 SsGAP1参与了核盘菌菌核形成以及致病过程
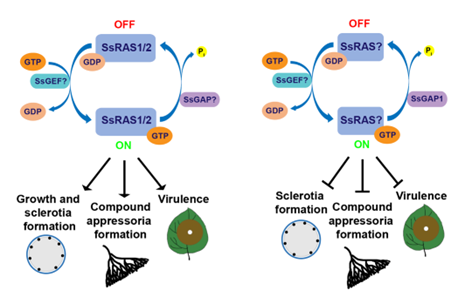
为了明确在Ssgap1突变体中被激活的RAS究竟是哪一个,该团队对核盘菌的两个RAS基因SsRAS1和SsRAS2进行了敲除以及突变体表型分析。然而,Ssras1 和Ssras2的突变体均表现出了严重的表型缺陷,包括菌丝生长、菌核发育、附着胞形成以及致病能力(图2)。这个结果说明与之前设想的起负面作用不同的是,SsRAS1和SsRAS2是核盘菌发育和侵染所不可或缺的。结合之前的结论,该研究揭示了RAS在核盘菌中生物学功能的两面性(图3)。同时,酵母双杂的结果显示SsGAP1和SsRAS1存在物理上的相互作用,更加揭示了RAS信号通路的复杂性。后续将需要更深入的研究来解析RAS在核盘菌中的作用机制。
图2 SsRAS1/2对核盘菌生长、菌核形成以及致病不可或缺
图3 RAS在核盘菌中生物学功能的两面性
由于目前尚未发现对核盘菌有完全抗性的种质资源,因此培育抗病品种仍是防治该真菌的重要途径。寄主诱导的基因沉默(HIGS)是一种基于RNA干扰的技术。该技术在寄主中表达人工设计的靶向病原菌重要基因的RNAi载体,使得在寄主与病原物互作的过程中,寄主产生的小干扰RNA或者双链RNA被病原物摄入,沉默病原生物相应基因的表达,从而降低病原物的致病能力,使寄主获得对病原生物的抗性。目前,HIGS技术已经成功运用于病原菌,病毒,线虫的防治中。然而,限制HIGS技术的应用的一个关键因素是对病原物靶标的筛选。该研究发现的SsGAP1,SsRAS1和SsRAS2都对核盘菌侵染植物有重要贡献,因此可作为理想的HIGS靶标。与期望相符的是,当在烟草中表达分别以这三个基因为靶标的HIGS载体时均观察到了明显的抑菌效果。同时,含有以GAP1为HIGS靶标的拟南芥转基因植物对核盘菌和灰葡萄孢菌都表现出了显著的抗性。该团队研究成果展示出了筛选HIGS靶标的高效性,也因此可以借鉴到其它真菌中,提高对植物抗病品种的研发效率。
图1 SsGAP1参与了核盘菌菌核形成以及致病过程
为了明确在Ssgap1突变体中被激活的RAS究竟是哪一个,该团队对核盘菌的两个RAS基因SsRAS1和SsRAS2进行了敲除以及突变体表型分析。然而,Ssras1 和Ssras2的突变体均表现出了严重的表型缺陷,包括菌丝生长、菌核发育、附着胞形成以及致病能力(图2)。这个结果说明与之前设想的起负面作用不同的是,SsRAS1和SsRAS2是核盘菌发育和侵染所不可或缺的。结合之前的结论,该研究揭示了RAS在核盘菌中生物学功能的两面性(图3)。同时,酵母双杂的结果显示SsGAP1和SsRAS1存在物理上的相互作用,更加揭示了RAS信号通路的复杂性。后续将需要更深入的研究来解析RAS在核盘菌中的作用机制。
图2 SsRAS1/2对核盘菌生长、菌核形成以及致病不可或缺
图3 RAS在核盘菌中生物学功能的两面性
由于目前尚未发现对核盘菌有完全抗性的种质资源,因此培育抗病品种仍是防治该真菌的重要途径。寄主诱导的基因沉默(HIGS)是一种基于RNA干扰的技术。该技术在寄主中表达人工设计的靶向病原菌重要基因的RNAi载体,使得在寄主与病原物互作的过程中,寄主产生的小干扰RNA或者双链RNA被病原物摄入,沉默病原生物相应基因的表达,从而降低病原物的致病能力,使寄主获得对病原生物的抗性。目前,HIGS技术已经成功运用于病原菌,病毒,线虫的防治中。然而,限制HIGS技术的应用的一个关键因素是对病原物靶标的筛选。该研究发现的SsGAP1,SsRAS1和SsRAS2都对核盘菌侵染植物有重要贡献,因此可作为理想的HIGS靶标。与期望相符的是,当在烟草中表达分别以这三个基因为靶标的HIGS载体时均观察到了明显的抑菌效果。同时,含有以GAP1为HIGS靶标的拟南芥转基因植物对核盘菌和灰葡萄孢菌都表现出了显著的抗性。该团队研究成果展示出了筛选HIGS靶标的高效性,也因此可以借鉴到其它真菌中,提高对植物抗病品种的研发效率。