本文内容速览:
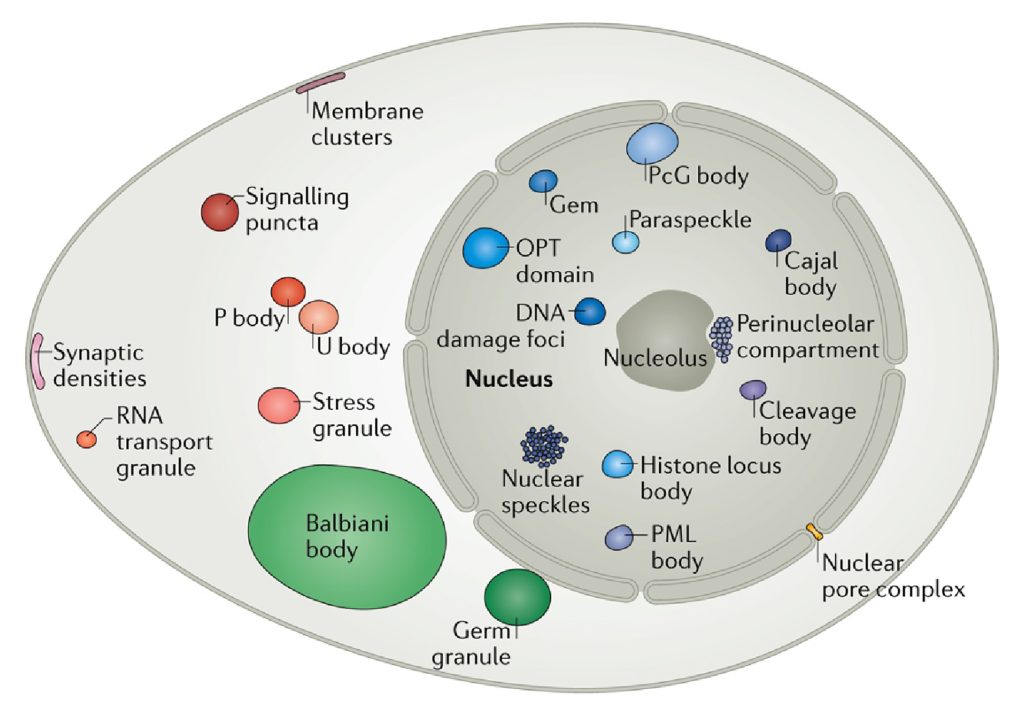
图1 真核细胞的细胞核、细胞质和细胞膜中各种凝聚体的示意图(Banani et al., 2017)。
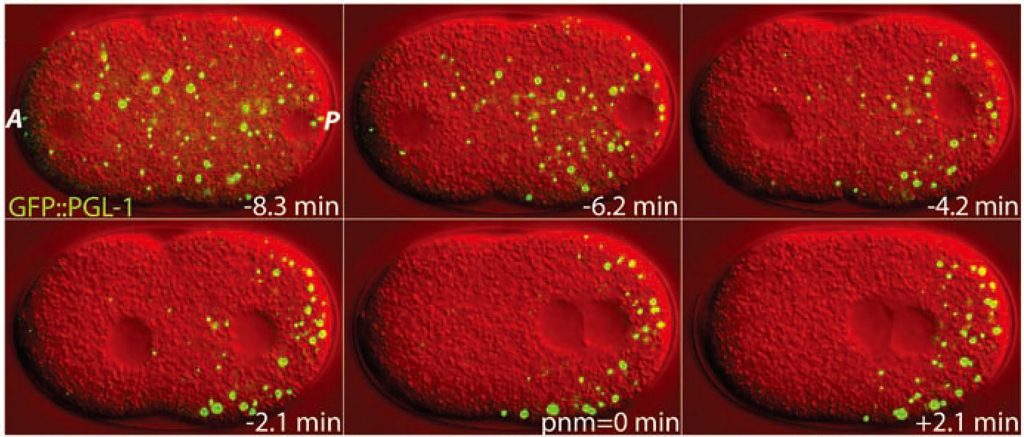
早在1898年,Montgomery等人就发现了细胞中的核仁是一种比较致密的液态无膜基质,但是作者并没有对其如何形成做出解释(Montgomery and Tho, 1898)。早期这种类似核仁的无膜细胞间室被称之为细胞体、核体、无膜细胞器等。2009年,Hyman等人提出细胞内通过“相分离(Phase separation)”的方式聚集细胞内的特定分子,形成了没有膜包裹的细胞间室(Brangwynne et al., 2009)。相分离这个概念听起来像是物理学的名词,事实上也确实如此。为了更好地理解这一概念,这里我们介绍一种现象——乳化,乳化是指一种液相分散在另外一个不溶的液相内,形成大量的小液滴(Ravera et al., 2021),最常见的乳化现象是将油和水混合后形成的浑浊体系。有意思的是,细胞内部也是一种液体环境,在一些条件下也会形成如Brangwynne等人观察到的P body的液滴。在2017年,Banani等人将这种通过相分离形成的细胞间室称为“分子生物凝聚体”或简称为“凝聚体”,其主要包括蛋白质、核酸以及细胞内的其他分子成分(Banani et al., 2017),这个专业名词很好地描述了各种分子在空间上相互聚集从而形成无膜结构的过程。
目前研究最多的相分离为液-液相分离(Liquid-liquid phase separation, LLPS),相变后大分子有两种形态,一种是低浓度可溶的,另一种是高浓度的液相凝聚体。溶质相和液滴相可以相互转化,表明这是一种高度动态和可逆的过程(Xu et al., 2021)。正常情况下,凝聚体保持一种液相状态,但在某些情况下,液态的凝聚体可能会出现向类固态的转变,而这种转变通常是不可逆的(Emenecker et al., 2021; Xu et al., 2021)。早期这种转变被认为是一种病理性的特征,例如淀粉样纤维的形成发生在阿尔茨海默病中(Murray et al., 2017),但后来发现这种凝聚体的类固态的转变可能对于细胞来说是有利的(Woodruff et al., 2018)。在此处我们就不着重讨论这个过程,感兴趣的小伙伴可以自己了解一下哦!
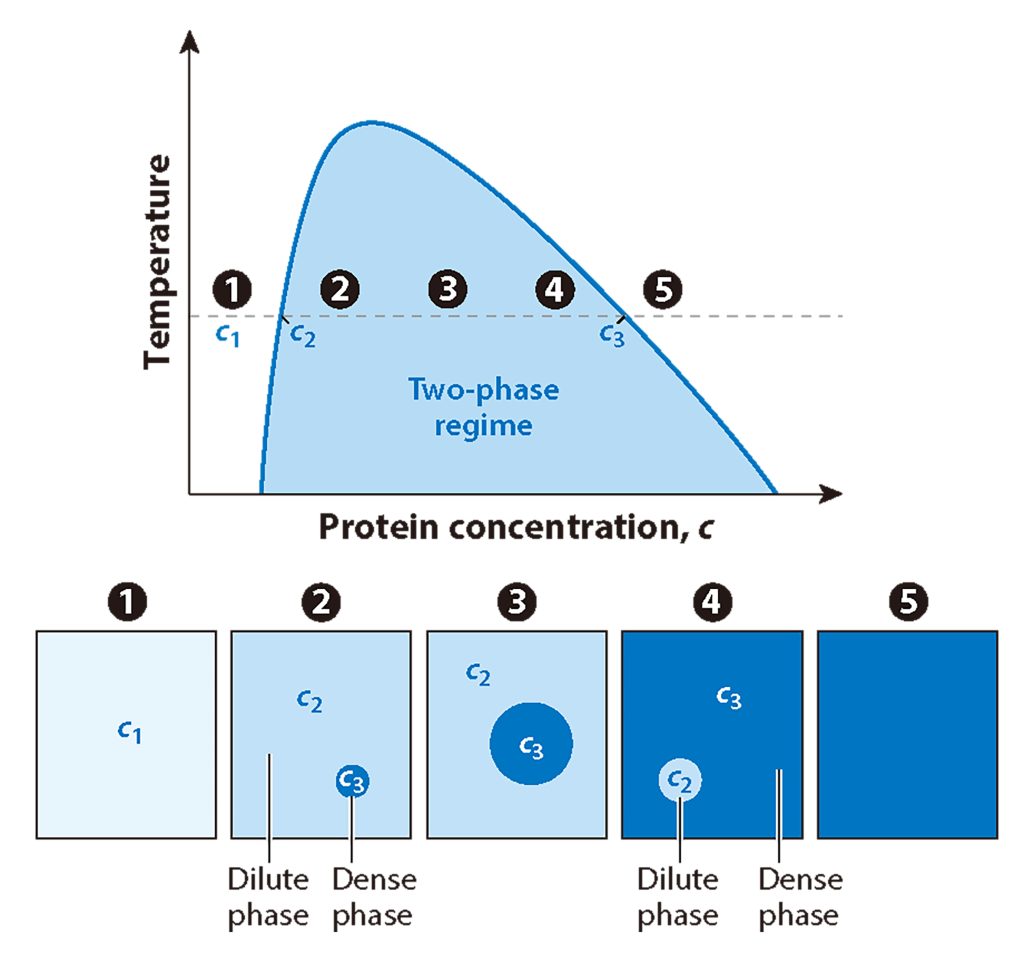
图3 简化的体外液-液相分离(LLPS)相图(Emenecker et al., 2021)。x轴表示蛋白质浓度,y轴表示温度、pH等条件。在固定温度下(图中水平线表示),随着蛋白质浓度从相对较低的浓度(c1)增加到较高的浓度(高于c2的浓度),蛋白质将从均匀分布在整个系统(白色的单相状态)到存在于两相状态(蓝色)。在两相体系中,贫蛋白稀相和富蛋白稀相共存(1-2)。随着总蛋白浓度超过c2,额外的蛋白将被招募到系统的密相中,导致密相体积增加,稀相体积相应减少(2-3)。密相(c3)和稀相(c2)中的蛋白浓度保持不变。随着总蛋白浓度的进一步增加,当总蛋白浓度仍处于两相状态时,系统在能量上更有利于发生反转转变,此时液滴以多数密集相(3-4)的形式存在。最后,随着蛋白浓度的进一步增加,系统将退出两相状态,超过密集的相浓度(c3),从而再次均匀分布在单相状态。一旦再次进入单相状态,总浓度可以继续增加,并超过在密相液滴内观察到的浓度(5)。
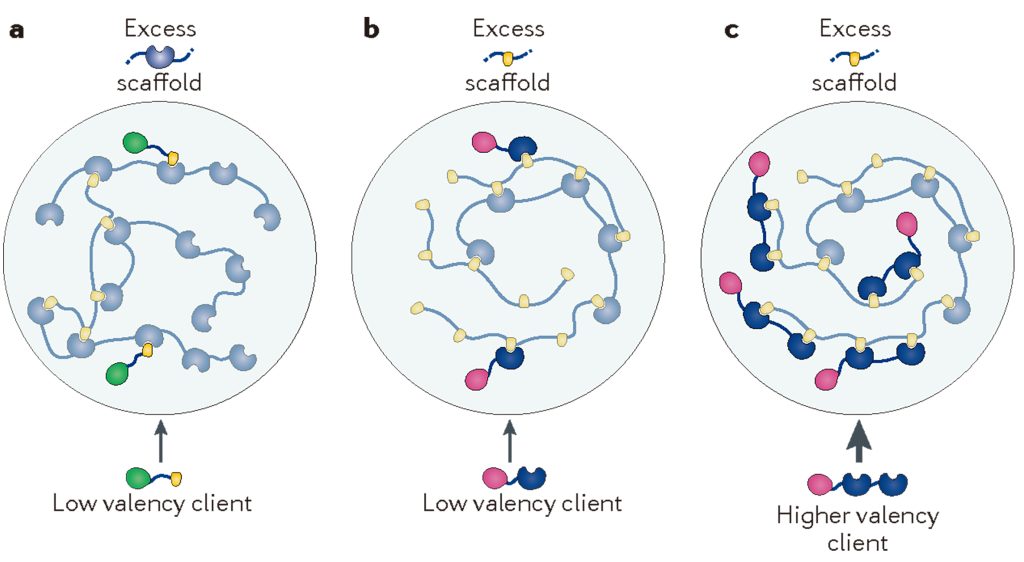
前面提到,大分子之间的相互作用是发生相分离的关键因素,那么具体到底需要什么条件才能够相分离呢?之前我们对于分子之间互作的认知主要集中在强的、特定的互作,但是对于较弱的、非特定的互作并没有过多的关注。实际上,考虑强相互作用和弱相互作用之间的耦合,以及多价促进相分离的能力对于理解多价生物分子是十分重要的(Semenov and Rubinstein, 1998; Banani et al., 2017),这也是相分离发生的分子基础。例如蛋白质与RNA等多价分子包含许多模块,可以促进与多个伙伴的分子间和分子内相互作用,这是它们相分离和形成凝聚体不可或缺的一个特征(Harmon et al., 2017)。在支架与客户蛋白理论中,支架分子是相分离的驱动分子,而在相分离形成液滴后参与到液滴当中的则被称为是客户蛋白(Banani et al., 2017; Posey et al., 2018),这个过程与水结冰时需要凝结核是类似的。
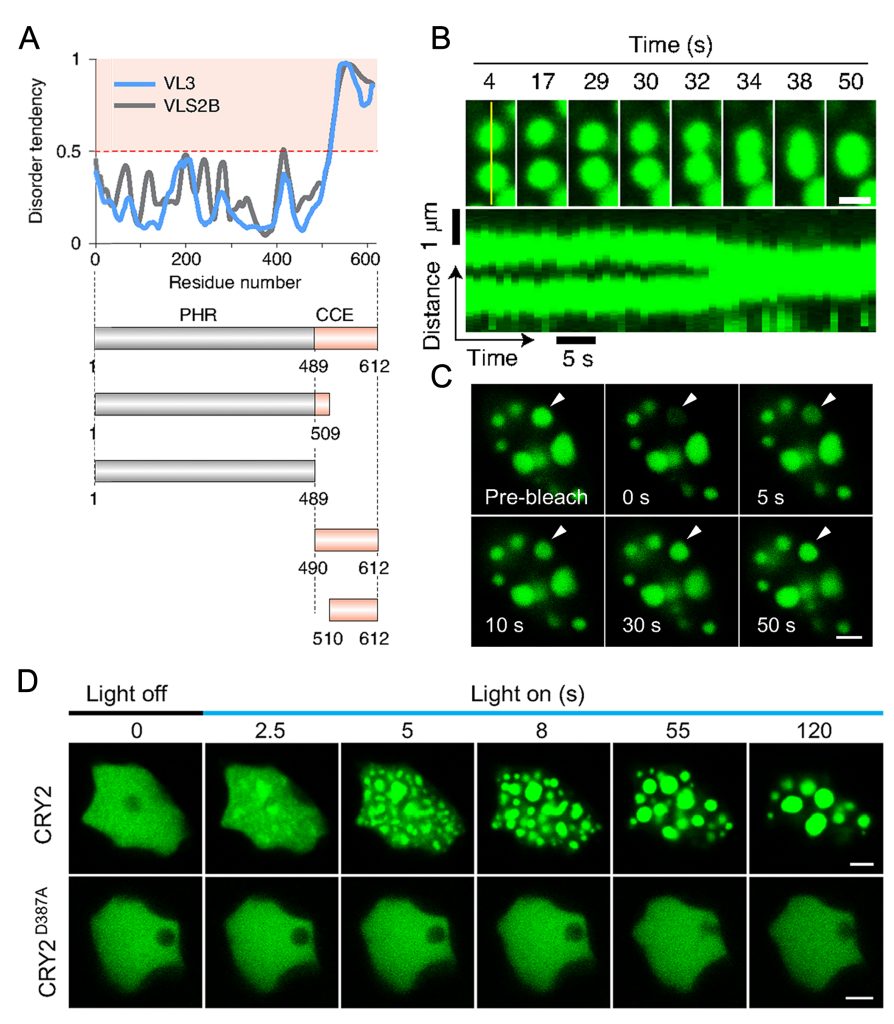
相分离的蛋白质通常包含多价串联结构域、低复杂度结构域(LCDs)、内部无序区域(IDRs)、类朊病毒样结构域(PrLDs)或RNA结合域(RBDs),通常发生相分离的蛋白包含其中一种结构域,但是有时也会同时有多种(Banani et al., 2017; Emenecker et al., 2020; Emenecker et al., 2021; Liu et al., 2023)。包含这些结构域的蛋白中内部无序蛋白(IDPs)约占真核蛋白质组的三分之一。从酵母到植物、动物和人类的许多研究表明,IDPs具有特别高的相分离倾向(Xu et al., 2021)。IDRs的一个共同特征是它们包含低复杂度序列区域(LCRs),LCRs由限制性氨基酸组成,包括串联重复序列(TRs),如聚天冬酰胺(polyN)和聚谷氨酰胺(polyQ)(Toretsky and Wright, 2014; van der Lee et al., 2014)。此外值得一提的是,分子伴侣(Gu et al., 2020)和蛋白翻译后修饰(Luo et al., 2021)对相分离有着调控作用,可能起着开关相分离的作用。
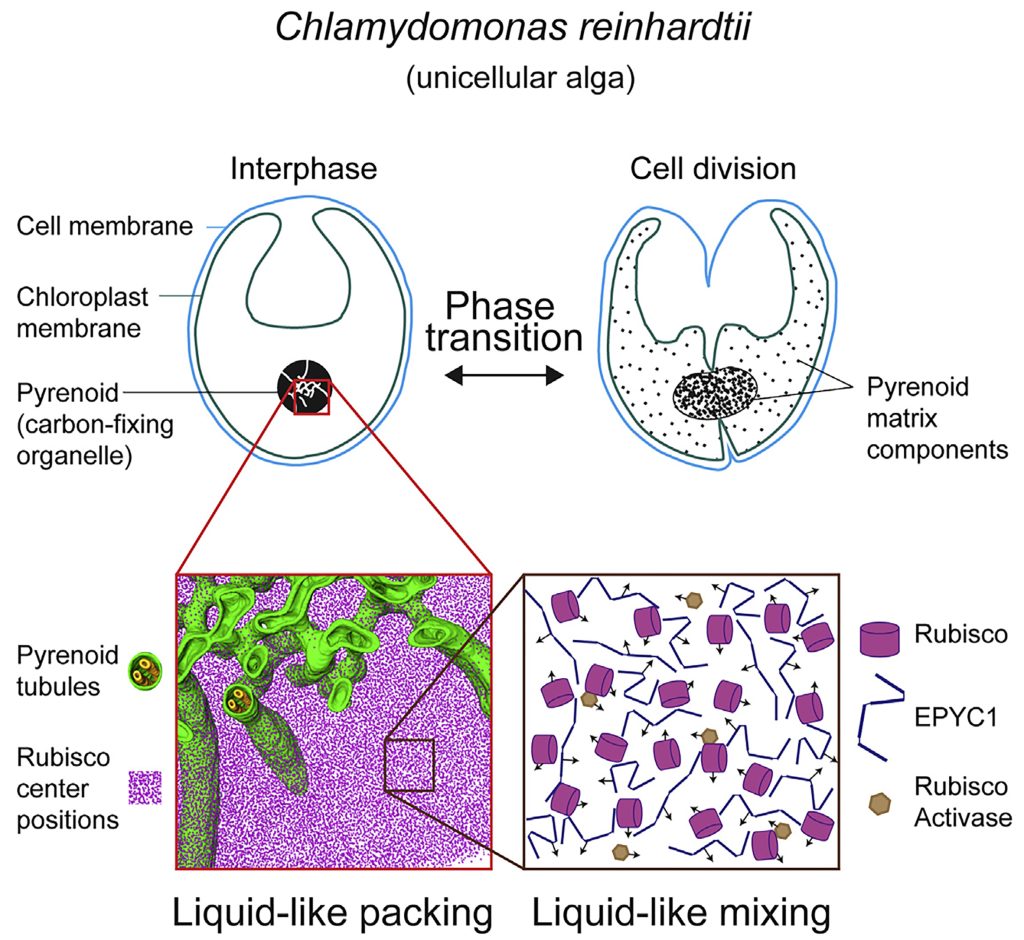
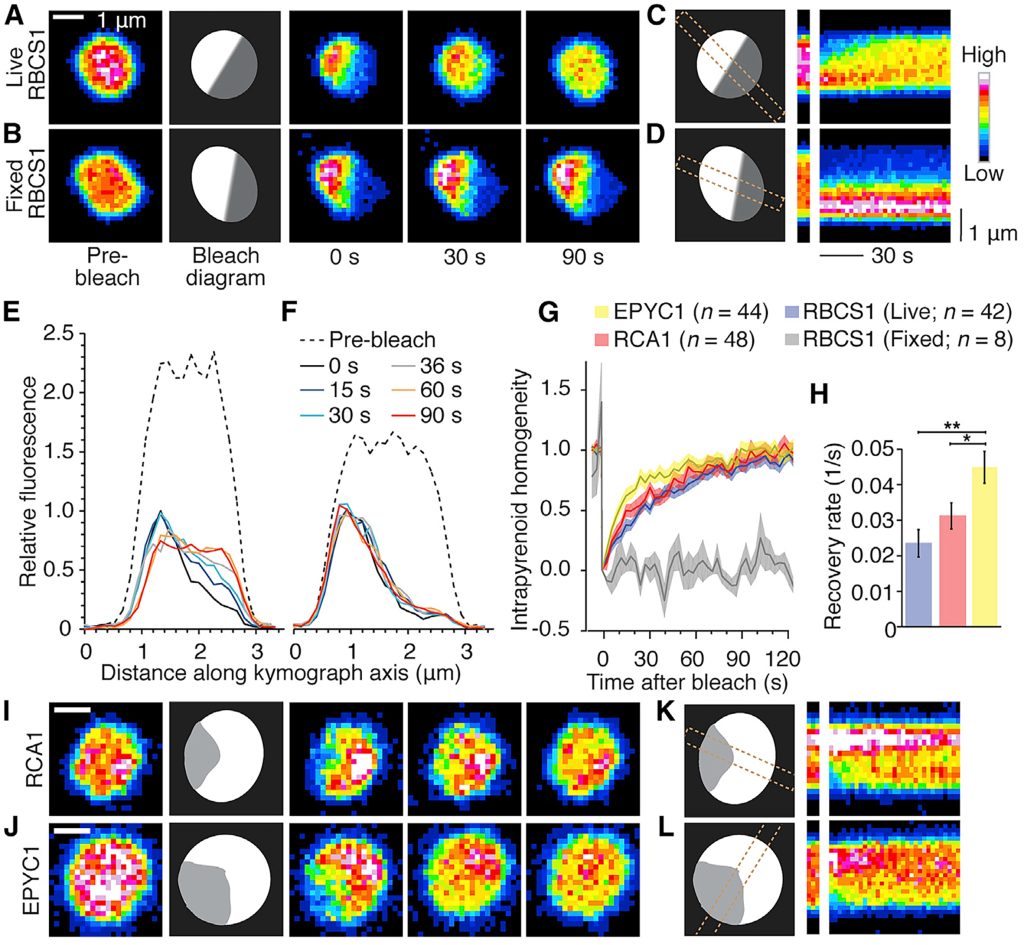
图5 单细胞藻类衣藻的细胞分离以及蛋白核结构模型图(Freeman Rosenzweig et al., 2017)。红色部分表示二氧化碳固定酶Rubisco以及与其互作的EPYC1和RAC1形成的基质,黄色与绿色的整体结构表示蛋白核。整个整体在细胞内呈现液体的状态,可以进行LLPS。
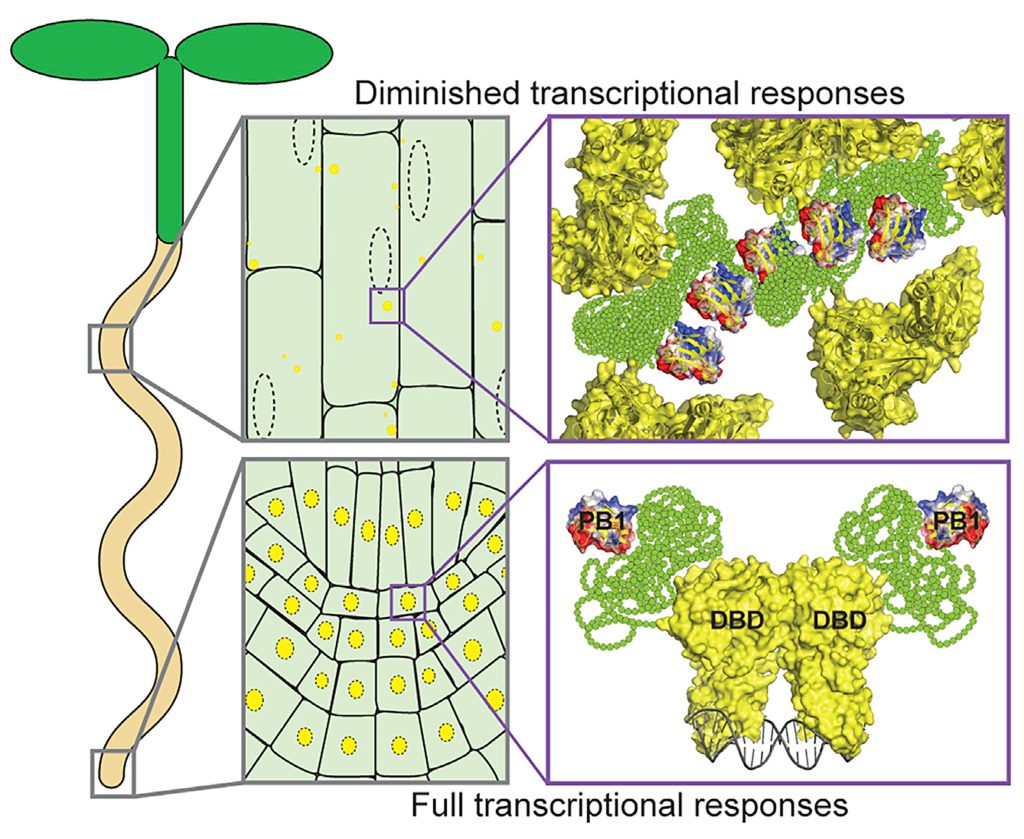
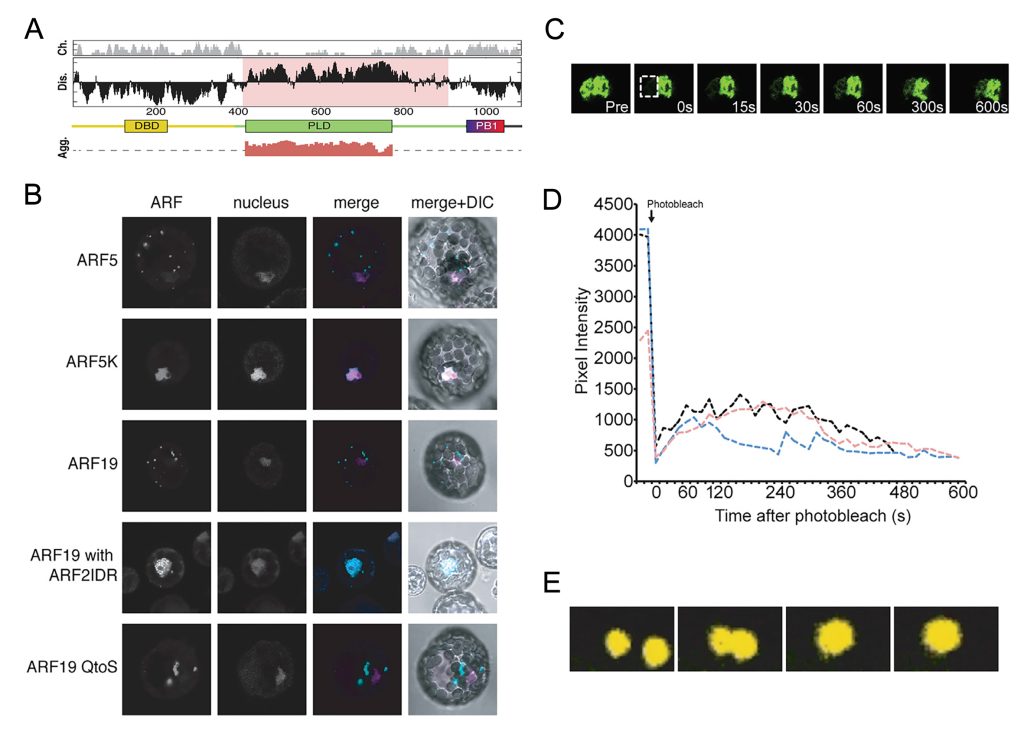
图7 ARF在拟南芥中不同组织细胞中的定位(Powers et al., 2019)。在生长素不敏感的细胞中,ARF蛋白定位于细胞质中的凝聚体。ARF蛋白的组装形成受PB1结构域和MR结构域中的IDR驱动。相反,ARF蛋白在生长活跃、生长素高度敏感的组织(如根尖)中定位于细胞核。这种不同的定位反应着LLPS对于植物激素信号通路的调控。
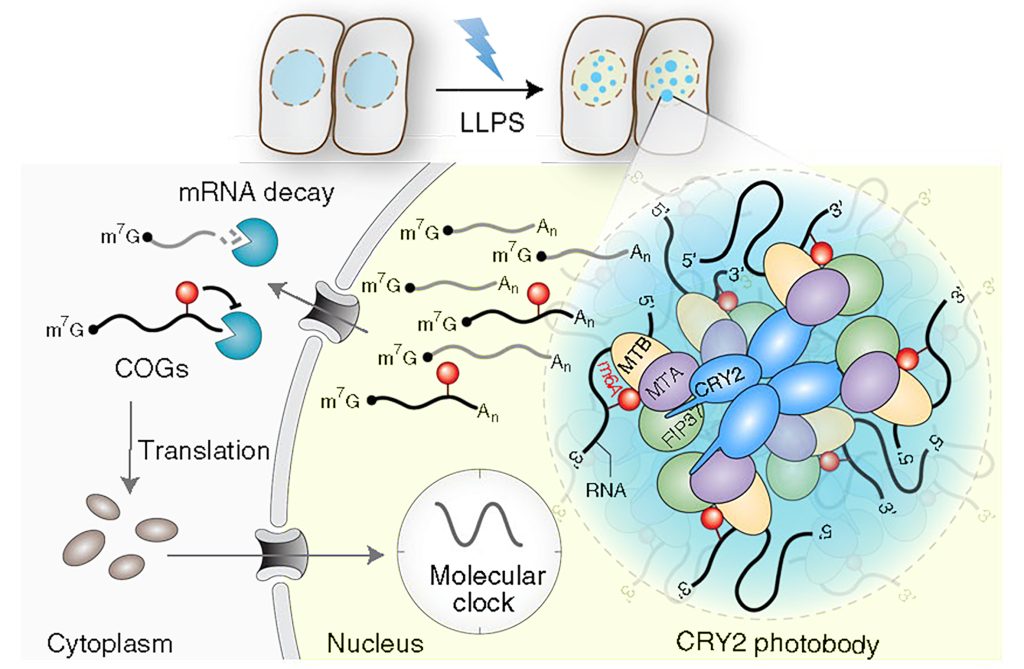
图9 植物细胞CRY LLPS介导的m6A修饰假设模型(Wang et al., 2021)。在蓝光下,CRY经过LLPS形成凝聚体,并与MTA、MTB和FIP37相互作用。该凝聚体可以调控mRNA的甲基化修饰,从而保证mRNA的稳定,最终未被降解的mRNA可以正常翻译成蛋白质并调节下游通路。
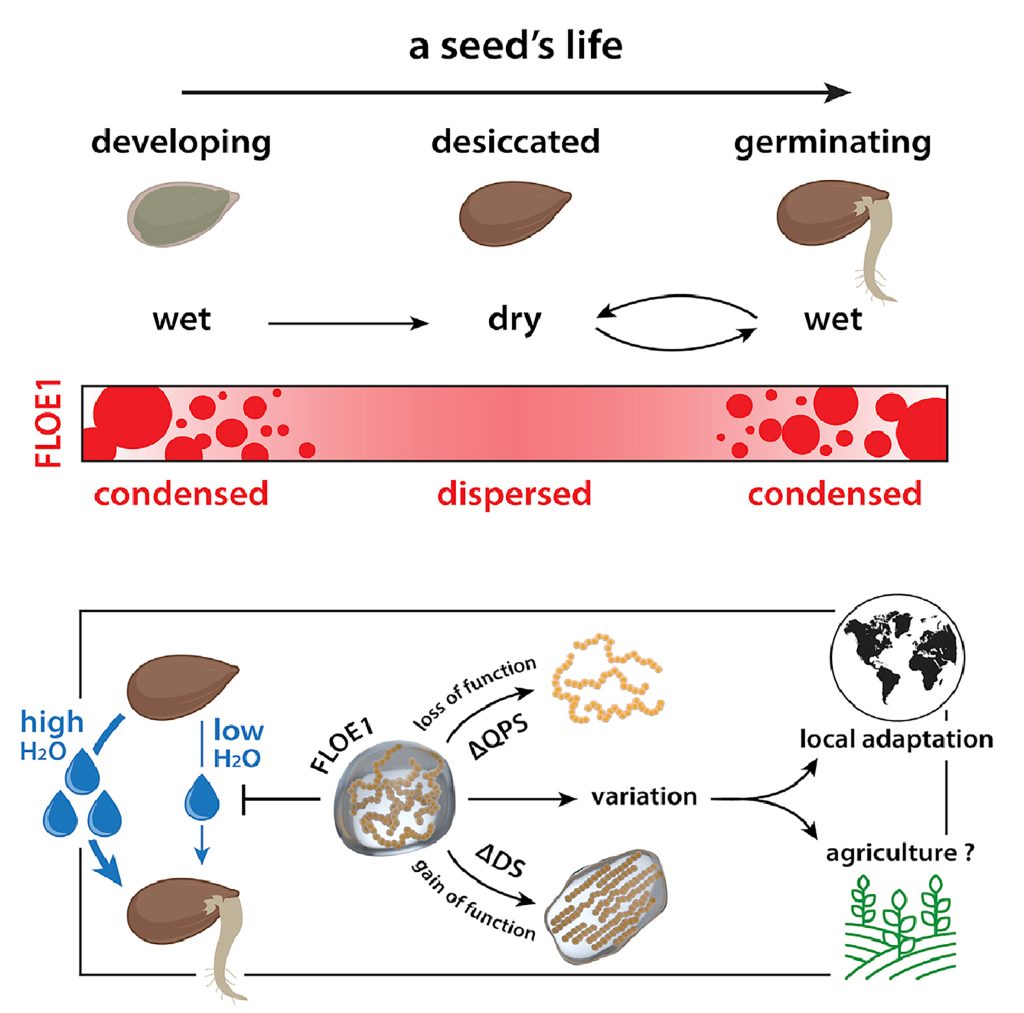
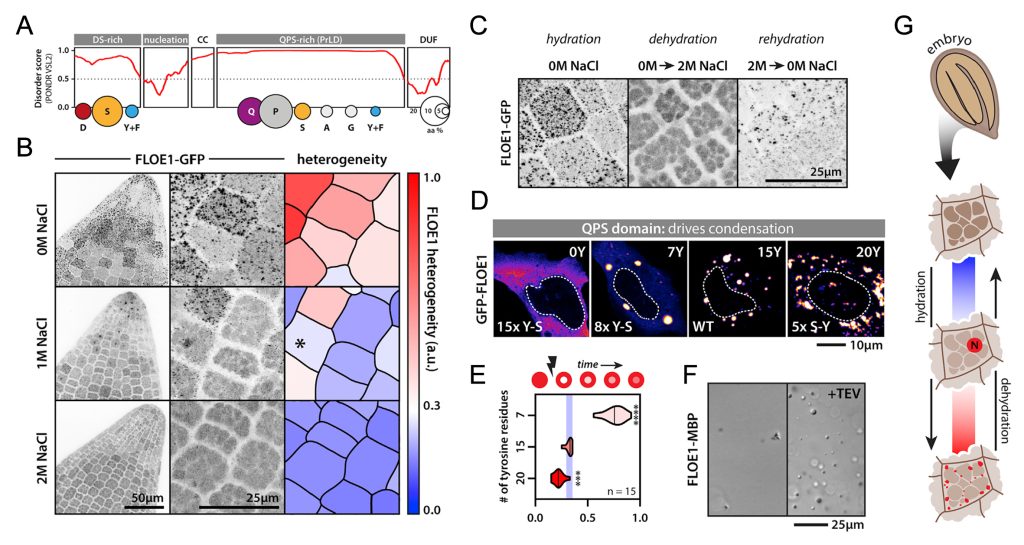
图11 FLOE1通过LLPS识别外界水分条件从而调控种子萌发过程示意图(Dorone et al., 2021)。种子萌发需要一定的水分条件,这对于植物的生长的来说至关重要,FLOE1具有发生LLPS的多个结构域,可以感知外界水分条件的情况进而发生LLPS,在水分较少时抑制种子的萌发,在水分充足时促进种子的萌发。
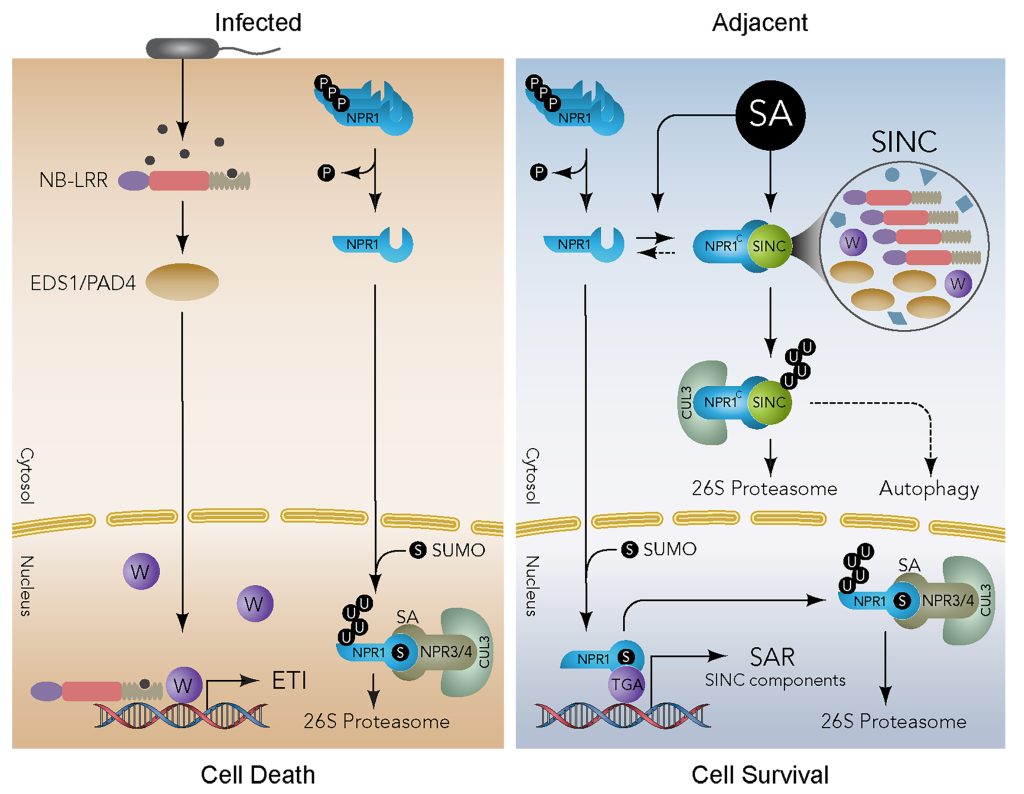
图13 NPR1在细胞内LLPS形成凝聚体(SINC)(Zavaliev et al., 2020)。在ETI过程中,感染的细胞通过病原体效应因子激活NB-LRR,并通过激活下游通路如EDS1/PAD4等启动细胞死亡程序。同时,SA的增加导致NPR1在S55/59位点去磷酸化,释放NPR1单体进入细胞核。NPR1在细胞核内的SUMOylation不仅是其转录辅助因子活性所必需的,而且还能促进其被NPR3/4-CRL3复合体降解,从而消除其对ETI的抑制作用。在邻近的细胞中,由于病原体载量低,ETI变得不必要,通过SA介导的核NPR1的激活,诱导SAR基因的转录,包括SINC成分,并在细胞质中形成SINCs,隔离和降解参与细胞死亡的蛋白质,细胞生存程序成为主导。
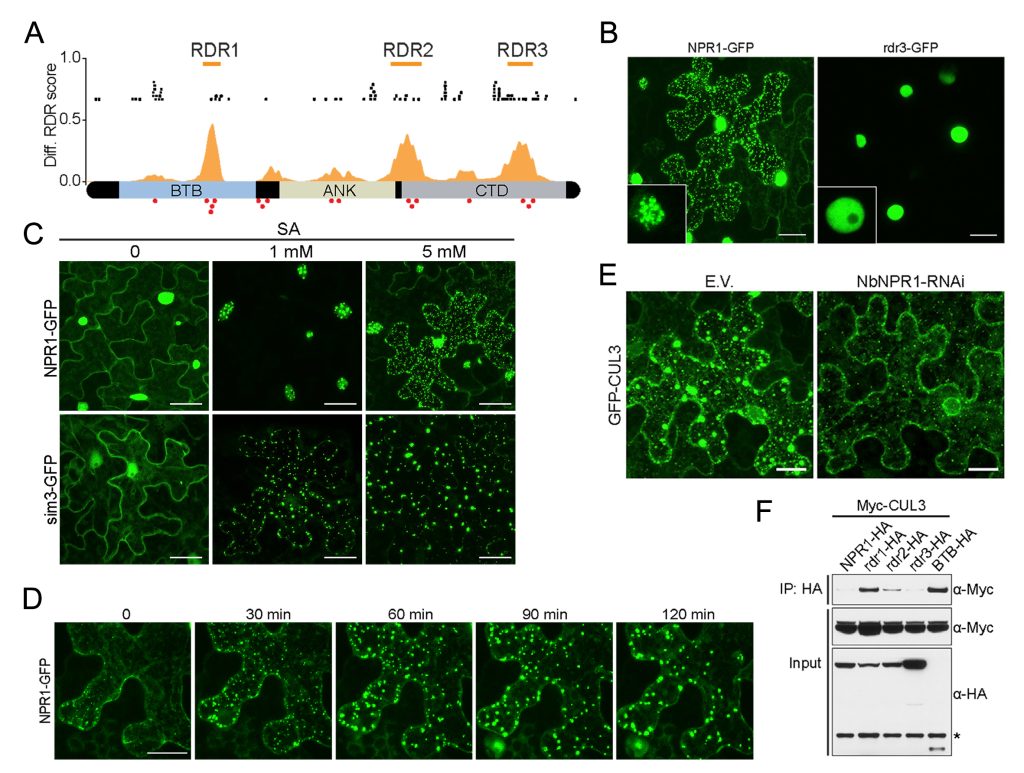
图14 NPR1在SA的诱导下进行LLPS,并且作为支架蛋白招募客户蛋白CUL3(Zavaliev et al., 2020)。(A)预测到NPR1具有LLPS的结构域RDR。(B)NPR1可以细胞核以及质中发生LLPS,而RDR3的缺失导致NPR1不能发生LLPS,说明RDR3是LLPS的关键结构域。(C-D)NPR1 LLPS的发生受到SA浓度以及作用时长的影响。当NPR1的SUMO化修饰位点突变时,在较低浓度下NPR1就可以发生LLPS,说明细胞质中的NPR1发生LLPS需要一定的浓度。(E-F)CUL3能与NPR1互作,并且这需要RDR3序列的存在。这说明CUL3是NPR1发生LLPS时形成的凝聚体中的客户蛋白。
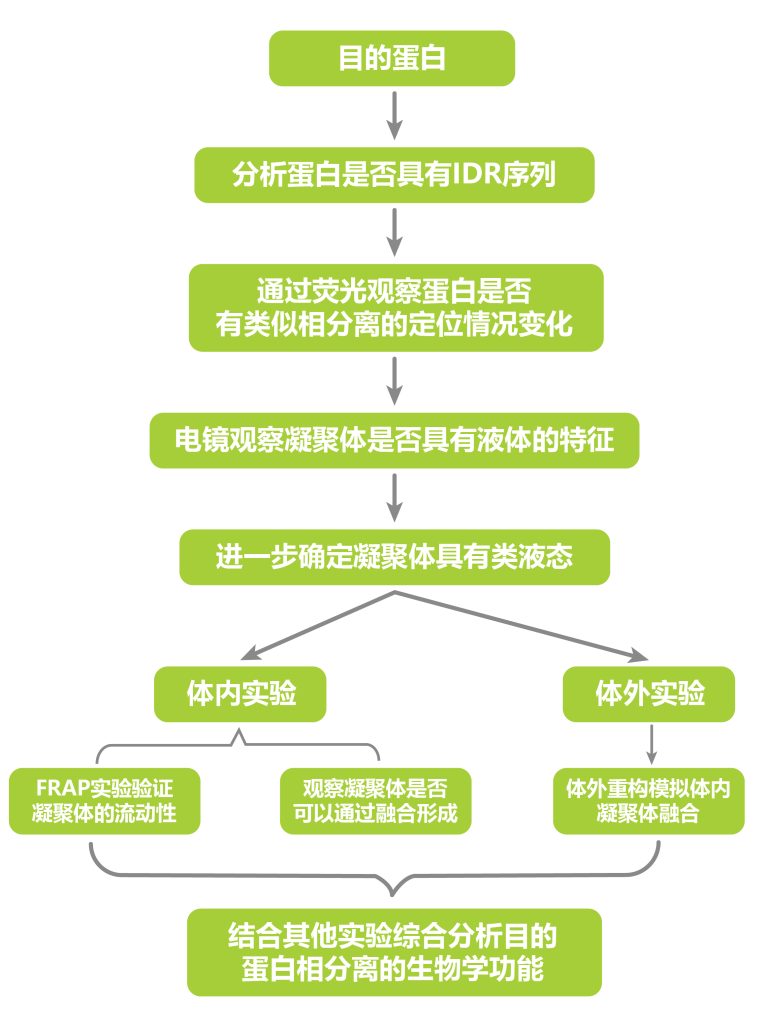
上面分享的文献介绍了LLPS在植物中的部分作用,除了上面列举的作用之外,LLPS还在植物光信号感知、蛋白质分选、花粉壁的形成、开花以及干细胞的发育等过程中起着重要作用,感兴趣的小伙伴可以自行了解一下哦!尽管几个研究的方向不同,但是在LLPS的研究部分还是有一些相似的地方,接下来就让伯小远来给大家总结一下针对LLPS研究的实验思路:
References:
Banani SF, Lee HO et al. Biomolecular condensates: organizers of cellular biochemistry. Nat Rev Mol Cell Biol, 2017, 18: 285-298.
Brangwynne CP, Eckmann CR et al. Germline P granules are liquid droplets that localize by controlled dissolution/condensation. Science, 2009, 324: 1729-1732.
Dorone Y, Boeynaems S et al. A prion-like protein regulator of seed germination undergoes hydration-dependent phase separation. Cell, 2021, 184: 4284-4298.e4227.
Emenecker RJ, Holehouse AS et al. Emerging Roles for Phase Separation in Plants. Dev Cell, 2020, 55: 69-83.
Emenecker RJ, Holehouse AS et al. Biological Phase Separation and Biomolecular Condensates in Plants. Annu Rev Plant Biol, 2021, 72: 17-46.
Freeman Rosenzweig ES, Xu B et al. The Eukaryotic CO(2)-Concentrating Organelle Is Liquid-like and Exhibits Dynamic Reorganization. Cell, 2017, 171: 148-162.e119.
Gu J, Liu Z et al. Hsp40 proteins phase separate to chaperone the assembly and maintenance of membraneless organelles. Proc Natl Acad Sci U S A, 2020, 117: 31123-31133.
Harmon TS, Holehouse AS et al. Intrinsically disordered linkers determine the interplay between phase separation and gelation in multivalent proteins. Elife, 2017, 6.
Kumaraswamy G. Thermodynamics of high polymer solutions. Resonance, 2017, 22: 415-426.
Liu Q, Liu W et al. Liquid-liquid phase separation in plants: Advances and perspectives from model species to crops. Plant Commun, 2023, 100663.
Luo YY, Wu JJ et al. Regulation of liquid-liquid phase separation with focus on post-translational modifications. Chem Commun (Camb), 2021, 57: 13275-13287.
Montgomery J, Tho SH. Comparative cytological studies, with especial regard to the morphology of the nucleolus. J Morphol, 1898, 15: 265-582.
Murray DT, Kato M et al. Structure of FUS Protein Fibrils and Its Relevance to Self-Assembly and Phase Separation of Low-Complexity Domains. Cell, 2017, 171: 615-627.e616.
Posey AE, Holehouse AS et al. Phase Separation of Intrinsically Disordered Proteins. Methods Enzymol, 2018, 611: 1-30.
Powers SK, Holehouse AS et al. Nucleo-cytoplasmic Partitioning of ARF Proteins Controls Auxin Responses in Arabidopsis thaliana. Mol Cell, 2019, 76: 177-190.e175.
Ravera F, Dziza K et al. Emulsification and emulsion stability: The role of the interfacial properties. Adv Colloid Interface Sci, 2021, 288: 102344.
Semenov AN, Rubinstein M. Thermoreversible Gelation in Solutions of Associative Polymers. 1. Statics. Macromolecules, 1998, 31: 1373-1385.
Toretsky JA, Wright PE. Assemblages: functional units formed by cellular phase separation. J Cell Biol, 2014, 206: 579-588.
van der Lee R, Lang B et al. Intrinsically disordered segments affect protein half-life in the cell and during evolution. Cell Rep, 2014, 8: 1832-1844.
Wang X, Jiang B et al. A photoregulatory mechanism of the circadian clock in Arabidopsis. Nat Plants, 2021, 7: 1397-1408.
Woodruff JB, Hyman AA et al. Organization and Function of Non-dynamic Biomolecular Condensates. Trends Biochem Sci, 2018, 43: 81-94.
Xu X, Zheng C et al. Phase separation in plants: New insights into cellular compartmentalization. J Integr Plant Biol, 2021, 63: 1835-1855.
Zavaliev R, Mohan R et al. Formation of NPR1 Condensates Promotes Cell Survival during the Plant Immune Response. Cell, 2020, 182: 1093-1108.e1018.
Zhang H, Elbaum-Garfinkle S et al. RNA Controls PolyQ Protein Phase Transitions. Mol Cell, 2015, 60: 220-230.
Zhang H, Ji X et al. Liquid-liquid phase separation in biology: mechanisms, physiological functions and human diseases. Sci China Life Sci, 2020, 63: 953-985.