本次推文内容速览:
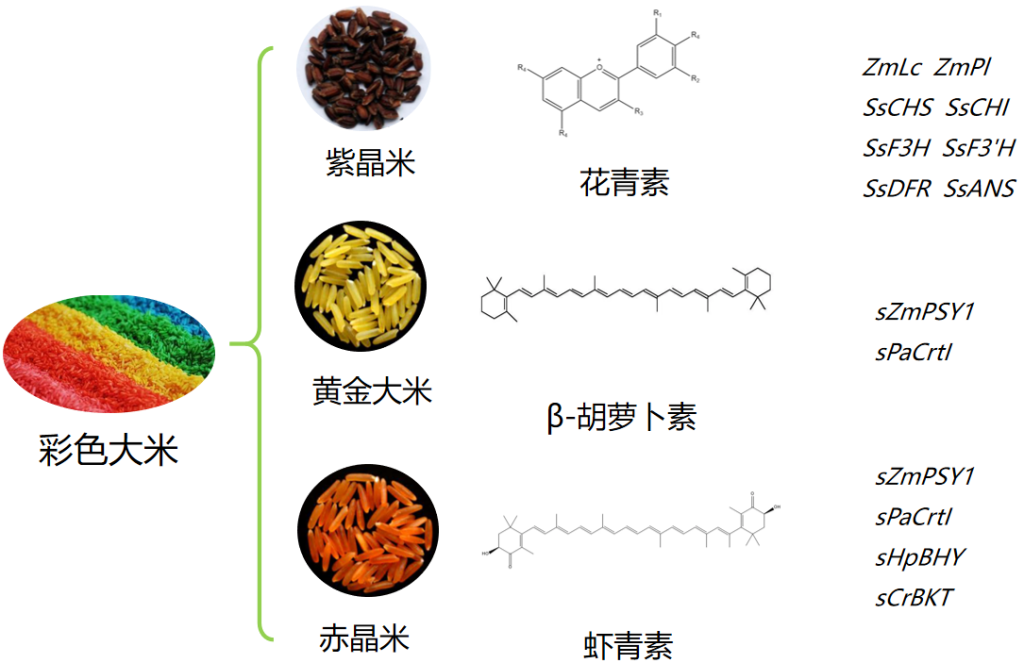
水稻是我国非常重要的粮食作物之一,为了将我们的饭碗牢牢地端在自己手里,科研先驱者们付出了不懈地努力,经过了漫长的探索过程。从袁隆平院士研发的杂交水稻解决了中国人的温饱问题(席德, 2015),再到李家洋院士团队研发的双季早粳稻品种,让以后每年好吃的优质新米可以提前两三个月端上餐桌,我国特色粮食安全之路越走越稳健,越走越宽广。当然,除了提高水稻产量、研制能够对抗恶劣环境的新品种外,我国科学家还尤其热衷于让水稻更有营养。我们平常吃的米饭都是白色半透明的或带有很浅的黄色,那“黄金大米”、“赤晶米”和“紫晶米”等为什么会带有颜色而且更有营养呢?科学家们是如何研制出这些水稻的呢?今天,伯小远就为大家讲讲更有营养的彩色大米——“紫晶米”、“黄金大米”和“赤晶米”。
胚乳中没有花青素,那为什么科学家们要研制出“紫晶米”呢?这是因为花青素具有高抗氧化活性,摄入花青素有益于人类健康,降低患某些癌症、心血管疾病、糖尿病和其他慢性疾病的风险(Zhang et al., 2014)。而胚乳是我们主要食用的部分,通过吃“紫晶米”,既可以填饱肚子又可以补充花青素,岂不是一举两得?
图2 花青素的化学结构式。已知花青素有20多种,食物中重要的有6种,即天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、牵牛花色素和锦葵色素(图片来源:百度)。
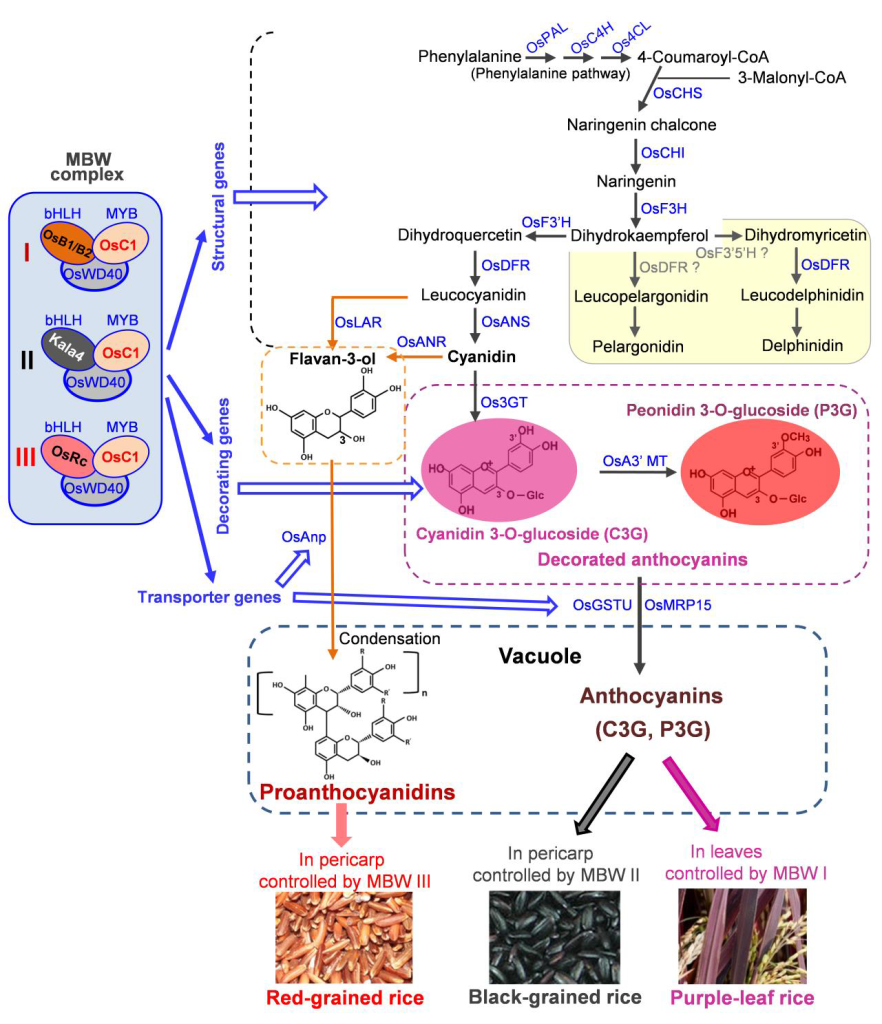
如何在胚乳中表达花青素呢?那就需要从表达花青素的黑粒和红粒水稻以及紫叶水稻中寻找答案。植物中花青素生物合成途径是较为复杂的,涉及调控花青素代谢产物的形成、修饰和运输的保守蛋白质,同时也涉及控制花青素相关基因在各种器官和组织中时空表达的调节蛋白。在紫叶稻中,调节蛋白包括OsC1(玉米中ZmC1编码的MYB-R2R3型转录因子Colored 1的同源蛋白)、OsB1和OsB2(玉米中bHLH型转录因子Booster 1的同源蛋白)以及OsWD40(WD40型转录因子),这些蛋白质相互作用形成MYB-bHLH-WD40(MBW)复合物,该复合物激活叶片中花青素生物合成基因(Sakamoto et al., 2001)(图3)。
图3 不同水稻品种的花青素/原花青素生物合成途径和上游苯丙氨酸途径(Zhu et al., 2017)。来自同源基因或等位基因变异的bHLH变体形成了不同类型的MBW复合物(MBWⅠ/Ⅱ/Ⅲ),激活不同组织/器官中3类下游基因(结构基因、辅助基因和转运基因)的表达,促进花青素/原花青素的产生。OsRc是OsB1/OsB2的同源蛋白,其作用是控制红粒水稻果皮中原花青素的产生和种子休眠。OsF3’5’H和OsDFR在所指示的步骤中可能具有低活性,因此,花青素生物合成的两个分支(黄色背景)受到抑制。矢车菊色素(Cyanidin)是花青素在水稻中的主要形式。合成的花青素和原花青素通过转运蛋白转运到细胞的液泡中。
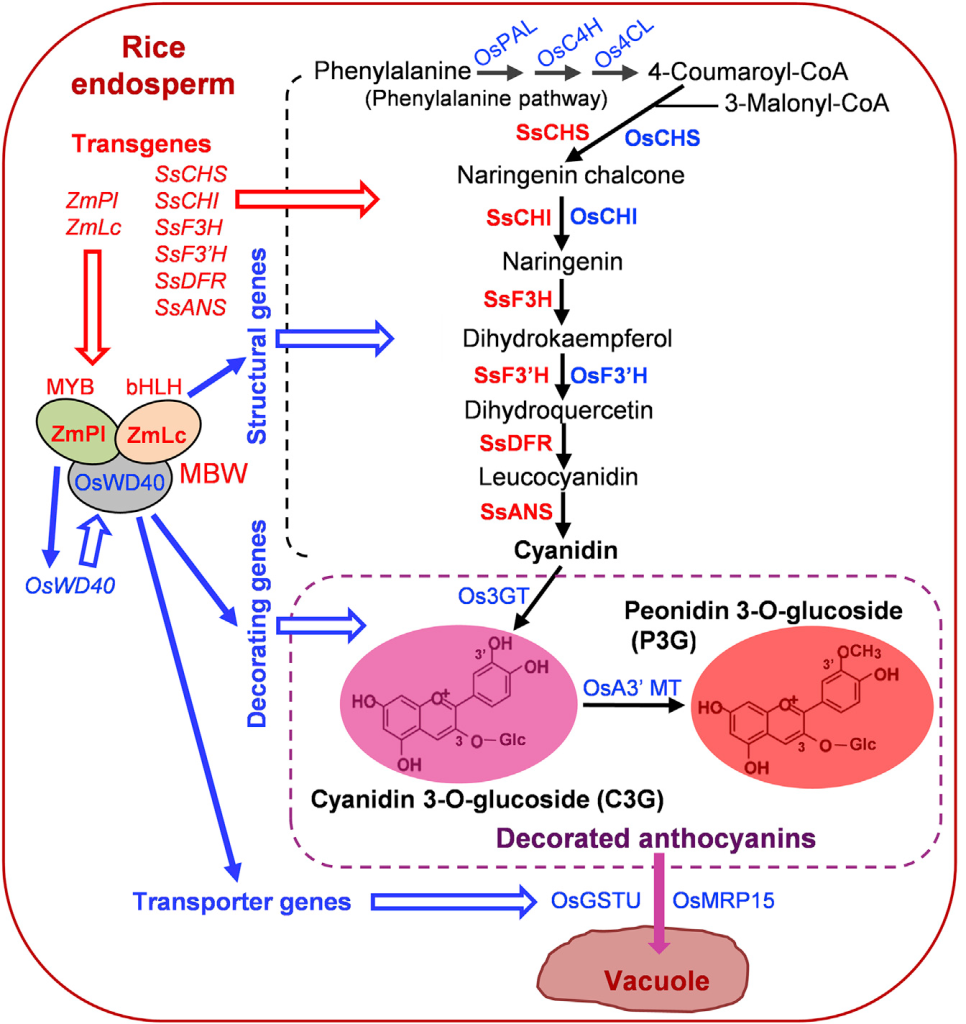
最初,科学家们尝试在水稻胚乳中人工合成花青素并没有取得成功。例如:将来自玉米的两个调控基因ZmR-S和ZmC1(分别编码bHLH和MYB型转录因子)在水稻胚乳中表达,结果并没有产生花青素,只产生了中间类黄酮产物(Shin et al., 2006)。2017年,华南农业大学生命科学学院刘耀光教授带领的研究团队在Molecular Plant在线发表题为“Development of ‘Purple Endosperm Rice’ by Engineering Anthocyanin Biosynthesis in the Endosperm with a High-Efficiency Transgene Stacking System”的研究论文。该研究团队首先设计了需要在水稻胚乳中进行花青素生物合成的相关基因,并通过一种高效多基因叠加系统TGSII对花青素生物合成相关基因进行组装,成功研制出胚乳含有丰富花青素的转基因大米——“紫晶米”(Zhu et al., 2017)。
图4 紫晶米即“紫色胚乳水稻”(Purple Endosperm Rice,PER)未抛光和抛光的谷粒表型(Zhu et al., 2017)。黑粒稻(BGR1)、ZH11为对照。在具有浅紫色颗粒的PER-Z#2中,缺少SsCHS、SsCHI和SsF3’H这三个基因。
为了弄清楚许多水稻品种不产生花青素的原因,以及为什么前人在水稻胚乳中进行花青素生物合成的尝试没有奏效,该团队分析了不同水稻品种中花青素合成途径中各基因的序列。序列分析表明,调控基因OsB1和OsB2以及结构基因OsDFR在不产生花青素的水稻品种中存在缺陷,包括在该研究中用于转化的粳稻品种ZH11和籼稻品种HG1。此外,对公共转录组数据的分析表明,调控基因OsC1和大多数编码花青素途径蛋白质的基因在水稻胚乳中沉默或低水平表达。这说明只进行花青素合成途径中调控基因或结构基因的转基因并不能使水稻胚乳中产生花青素(Zhu et al., 2017)。
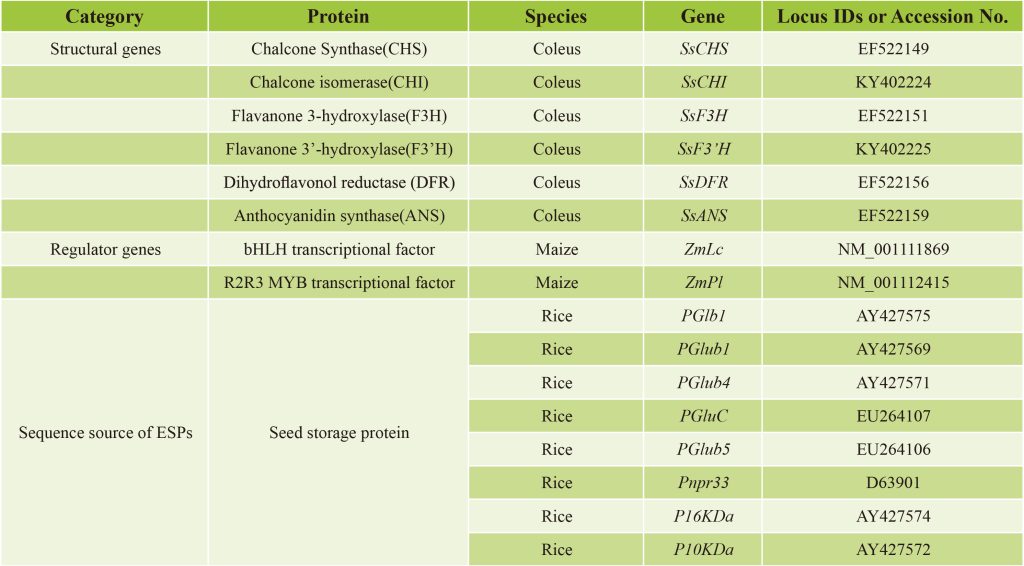
由此,该研究团队探索了一种新的策略,让两个调控基因和花青素生物合成完整途径中的六个结构基因在水稻胚乳中表达,这些基因都由胚乳特异性启动子控制。研究者选择玉米的bHLH型转录因子基因ZmLc(Leaf color)和MYB型转录因子基因ZmPl(Purple leaf)这两个调控基因,以激活花青素生物合成基因。ZmPl是ZmC1的同源蛋白,但具有更强的活性。基于植物花青素途径基因的高序列保守性,该研究团队从彩叶草(Solenostemon scutellarioides)中分离出花青素生物合成的6个结构基因的cDNA,包括SsCHS、SsCHI、SsF3H、SsF3’H、SsDFR和SsANS。对于驱动这些基因表达的启动子,该研究团队从水稻中扩增出8个胚乳特异性启动子(Endosperm-specific promoters,ESPs),可用于设计谷类作物胚乳中的各种代谢途径。该研究团队利用高效多基因叠加系统TGSII将2个调控基因和6个结构基因组装到一起,构建成含有8个基因的双元载体,经过水稻的遗传转化后,在ESPs的控制下,最终在水稻胚乳中成功合成出花青素(Zhu et al., 2017)。
表1 紫晶米中用于花青素生物合成的相关基因(Zhu et al., 2017)。
第一代“黄金大米”(Golden Rice 1)于2000年问世,该转基因水稻中表达了水仙花(Narcissus pseudonarcissus)的八氢番茄红素合成酶(Phytoene synthase)基因NpPsy1和欧文氏菌(Erwinia uredovora)的胡萝卜素去饱和酶(Carotene desaturase)基因crtI以调控β-胡萝卜素在胚乳中的合成,其中类胡萝卜素含量为1.6µg/g,但科学家们很快意识到其谷粒中所含的β-胡萝卜素太少而不足以在田间实践。所以在第一代“黄金大米”的基础上,先正达公司Jacqueline A Paine等人通过多种植物Psy基因的转基因测试,发现玉米中一种Psy基因显著增加了类胡萝卜素的积累,将ZmPsy1与第一代“黄金大米”中crtI基因一起在水稻中表达,创制出了第二代“黄金大米”(Golden Rice 2)。与第一代“黄金大米”相比,类胡萝卜素总量增加了23倍(最高37µg/g),而且β-胡萝卜素会优先积累(Paine et al., 2005)。英国先正达公司最早获得了培育“黄金大米”的专利。
2018年,华南农业大学生命科学学院刘耀光教授带领的研究团队在Molecular Plant在线发表题为“From Golden Rice to aSTARice: Bioengineering Astaxanthin Biosynthesis in Rice Endosperm”的研究论文。该研究团队对水稻胚乳的虾青素从头生物合成进行了设计,使用高效多基因叠加系统TGSII对4个合成基因进行组装,通过转基因研制出首个胚乳合成虾青素的“赤晶米”(Zhu et al., 2018)。
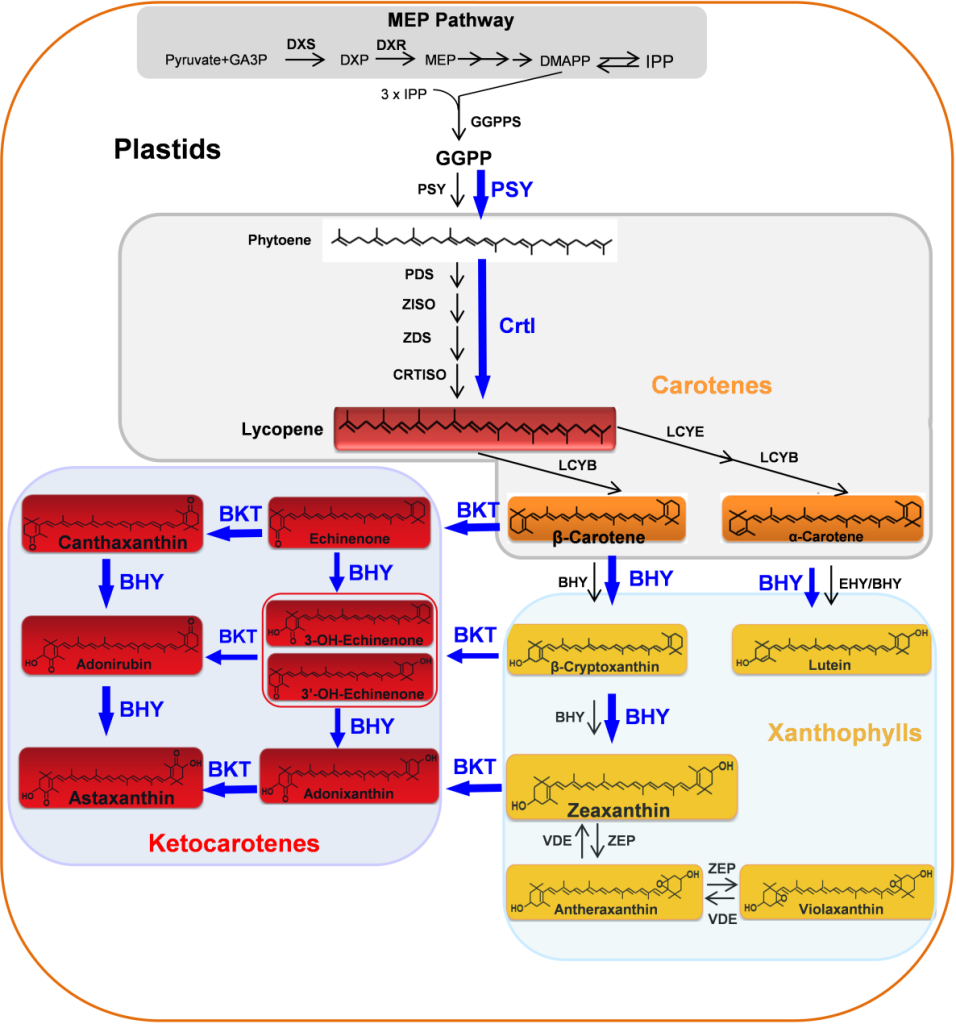
该研究团队首先对虾青素的合成途径以及已有的报道进行研究。已有的研究表明,虾青素由β-胡萝卜素通过β-胡萝卜素酮化酶(β-carotene ketolase,BKT)和β-胡萝卜素羟化酶(β-carotene hydroxylase,BHY)催化合成(Higuera-Ciapara et al., 2006)。BHY基因广泛存在于高等植物中,但BKT基因仅存在于某些微藻、细菌和酵母中,而不存在于大多数高等植物中(Zhu et al., 2009)。据研究报道,虾青素已经能够在烟草、胡萝卜、西红柿、生菜、马铃薯和玉米(Hasunuma et al., 2008;Jayaraj et al., 2008;Huang et al., 2013;Harada et al., 2014;Campbell et al., 2015;Farre´ et al., 2016)中进行生物合成,主要的方法是在有天然β-胡萝卜素作为虾青素前体的情况下,通过在这些植物中引入两种(BHY和BKT)或一种(BKT)转基因,从而实现虾青素的生物合成。然而,水稻中虾青素的工程化生物合成相对困难,因为水稻胚乳不产生虾青素的前体。前人在水稻胚乳中生产虾青素的一些尝试没有成功,例如:使用粒子轰击共转PSY、CrtI和BKT基因,所得转基因水稻在胚乳中只产生低水平的角黄素(Canthaxanthin),而不产生虾青素(Bai et al., 2017)。根据文献,该研究团队总结了通过转基因方法在植物中生物合成类胡萝卜素/酮类胡萝卜素/虾青素的生物途径。
图7 推测在水稻胚乳中虾青素从头生物合成途径(Zhu et al., 2018)。据推测,在水稻胚乳中由转基因编码的八氢番茄红素合成酶(PSY)和胡萝卜素去饱和酶(CrtI)(蓝色)产生的β-胡萝卜素,可以被另外两种转基因编码的β-胡萝卜素羟化酶(BHY)和β-胡萝卜酮化酶(BKT)(蓝色)催化,产生目标终产物虾青素。其他酶(黑色)由植物物种的内源性胡萝卜素生成基因编码。
为了确定水稻胚乳中虾青素生物合成所需的基因,研究者分析了公开的水稻转录组数据,发现胚乳中的内源性胡萝卜素合成基因(包括OsBHY)是沉默表达的或以非常低的水平表达。由于第二代“黄金大米”品种通过表达PSY和CrtI产生了β-胡萝卜素,研究者们推断,水稻胚乳中虾青素的有效从头生物合成可能需要引入和表达BKT和BHY,以及PSY和CrtI(Zhu et al., 2018)。
由此,研究者基于玉米的PSY1、欧文氏菌(Pantea ananatis,原名Erwinia uredovora)CrtI、莱茵衣藻(Chlamydomonas reinhardtii)BKT和雨生血球菌(Haematococcus pluvialis)BHY的蛋白质序列,经过密码子优化并合成产生了sZmPSY1、sPaCrtI、sCrBKT和sHpBHY四个基因。由于中间产物和最终类胡萝卜素产物是在质体中合成的,将来自豌豆(Pisum sativum)核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)小亚基的质体转运肽的序列与非植物来源的sPaCrtI、sCrBKT和sHpBHY融合(玉米PSY1含有质体转运肽)。在构建载体时,这四个基因分别由来自水稻球蛋白基因Glb1和水稻谷蛋白基因GluB4、GluC和GluB1的胚乳特异性启动子调控。通过高效多基因叠加系统TGSII将这些基因组装到一起,构建成一个含有4个合成基因的双元载体,通过水稻遗传转化,最终在水稻胚乳中成功合成出虾青素。作为比较,研究者还构建了包含PSY和CrtI两个基因和编码PSY、CrtI和BKT三个基因的载体,分别创制出产生富含β-胡萝卜素的“黄金大米”和富含角黄素的大米(Zhu et al., 2018)。
图8 野生型(WT)和黄金大米(GR)、角黄素大米(CR)和虾青素大米(AR或aSTARice)。转基因品系谷粒的横截面显示,色素均匀分布在谷粒的胚乳中(Zhu et al., 2018)。
表2 用于类胡萝卜素和虾青素生物合成的相关基因(Zhu et al., 2018)。
尽管如此,水稻胚乳作为生物反应器也有一些局限性。相比于生命周期短作为生物反应器的植物或使用瞬时表达系统,水稻的生命周期较长(约4-5个月),增加了由于恶劣天气等原因失败的风险。
席德. 改变世界的一粒种子——记杂交水稻之父袁隆平[M]. BEIJING BOOK CO. INC., 2015.
Bai C, Berman J, Farre G, et al. Reconstruction of the astaxanthin biosynthesis pathway in rice endosperm reveals a metabolic bottleneck at the level of endogenous β-carotene hydroxylase activity[J]. Transgenic research, 2017, 26: 13-23.
Campbell R, Morris W L, Mortimer C L, et al. Optimising ketocarotenoid production in potato tubers: effect of genetic background, transgene combinations and environment[J]. Plant Science, 2015, 234: 27-37.
Farré G, Perez-Fons L, Decourcelle M, et al. Metabolic engineering of astaxanthin biosynthesis in maize endosperm and characterization of a prototype high oil hybrid[J]. Transgenic research, 2016, 25: 477-489.
Higuera-Ciapara I, Felix-Valenzuela L, Goycoolea F M. Astaxanthin: a review of its chemistry and applications[J]. Critical reviews in food science and nutrition, 2006, 46(2): 185-196.
Karnaukhova E, Ophir Y, Golding B. Recombinant human alpha-1 proteinase inhibitor: towards therapeutic use[J]. Amino Acids, 2006, 30: 317-332.
Ou J, Guo Z, Shi J, et al. Transgenic rice endosperm as a bioreactor for molecular pharming[J]. Plant Cell Reports, 2014, 33: 585-594.
Paine J A, Shipton C A, Chaggar S, et al. Improving the nutritional value of Golden Rice through increased pro-vitamin A content[J]. Nature biotechnology, 2005, 23(4): 482-487.
Sakamoto W, Ohmori T, Kageyama K, et al. The Purple leaf (Pl) locus of rice: the Pl w allele has a complex organization and includes two genes encoding basic helix-loop-helix proteins involved in anthocyanin biosynthesis[J]. Plant and cell physiology, 2001, 42(9): 982-991.
Shin Y M, Park H J, Yim S D, et al. Transgenic rice lines expressing maize C1 and R‐S regulatory genes produce various flavonoids in the endosperm[J]. Plant Biotechnology Journal, 2006, 4(3): 303-315.
West K P, Darnton-Hill I. Vitamin A deficiency[J]. Nutrition and health in developing countries, 2008: 377-433.
Yeum K J, Russell R M. Carotenoid bioavailability and bioconversion[J]. Annual review of nutrition, 2002, 22(1): 483-504.
Zhu Q, Tan J, Liu Y G. Molecular farming using transgenic rice endosperm[J]. Trends in Biotechnology, 2022.
Zhang L, Shi J, Jiang D, et al. Expression and characterization of recombinant human alpha-antitrypsin in transgenic rice seed[J]. Journal of Biotechnology, 2013, 164(2): 300-308.
Zhu Q, Yu S, Zeng D, et al. Development of “purple endosperm rice” by engineering anthocyanin biosynthesis in the endosperm with a high-efficiency transgene stacking system[J]. Molecular plant, 2017, 10(7): 918-929.
Zhang Y, Butelli E, Martin C. Engineering anthocyanin biosynthesis in plants[J]. Current opinion in plant biology, 2014, 19: 81-90.
Zhu Q, Zeng D, Yu S, et al. From golden rice to aSTARice: bioengineering astaxanthin biosynthesis in rice endosperm[J]. Molecular Plant, 2018, 11(12): 1440-1448.
Zhu C, Naqvi S, Capell T, et al. Metabolic engineering of ketocarotenoid biosynthesis in higher plants[J]. Archives of Biochemistry and Biophysics, 2009, 483(2): 182-190.
Hasunuma T, Miyazawa S I, Yoshimura S, et al. Biosynthesis of astaxanthin in tobacco leaves by transplastomic engineering[J]. The Plant Journal, 2008, 55(5): 857-868.

-1024x774.png)
-1024x618.png)