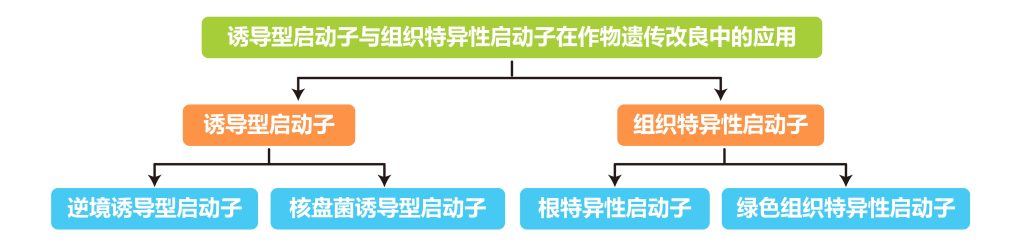
本文内容速览:
外源DNA序列通过连接到特定启动子的载体上从而在植物宿主中表达,启动子类型的选择决定基因的表达时间和部位。目前在农业生物技术领域广泛应用的主要是一些组成型的强启动子,比如CaMV 35S启动子和玉米Ubiquitin-1启动子,然而在利用这些启动子诱导目的基因转化水稻等作物来改良作物的品质时,往往会由于目的基因表达的时间(发育阶段特异性)或空间(组织器官特异性)不能很好地控制而导致改良效果不明显,或者由于这些组成型启动子诱导基因表达量太高而对植物的生长发育造成影响,这些都是目前利用组成型强启动子结合功能基因来改良作物品质时遇到的障碍。鉴于此,伯小远收集了一些关于利用诱导型启动子或组织特异性启动子在改良作物品质方面的应用案例。
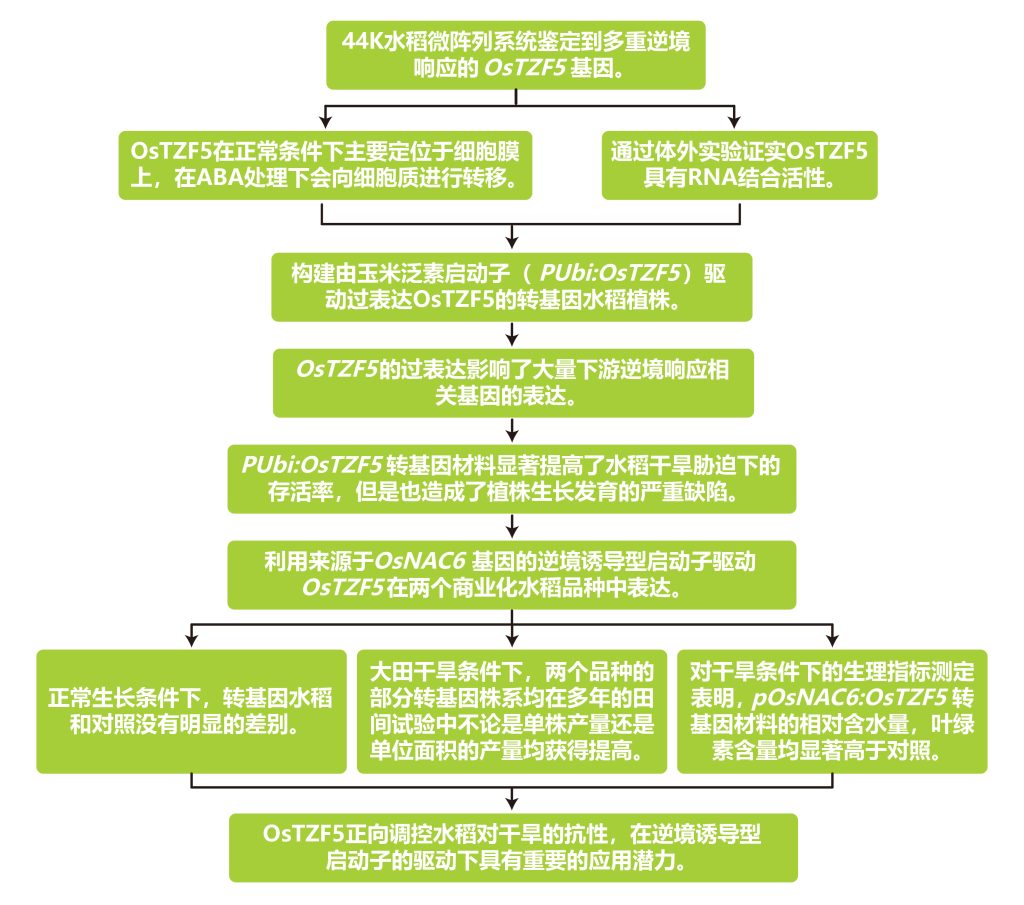
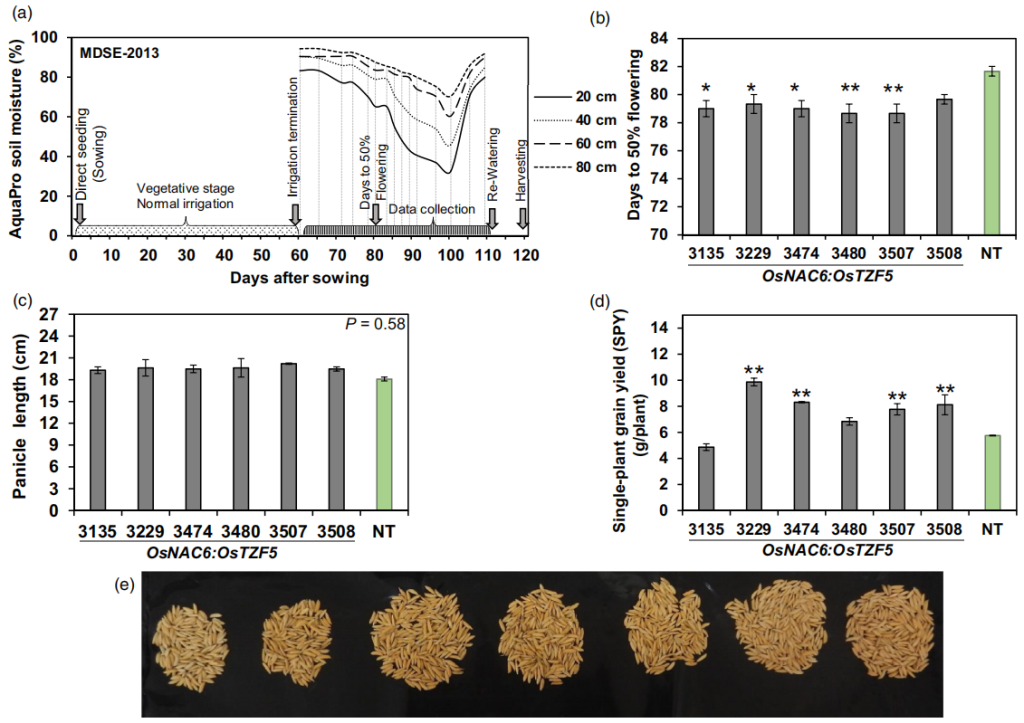
2020年在Plant Biotechnology Journal上发表的一篇题为“Expression of the CCCH-tandem zinc finger protein gene OsTZF5 under a stress inducible promoter mitigates the effect of drought stress on rice grain yield under field conditions”的研究论文,本研究利用逆境诱导型启动子OsNAC6调控水稻CCCH串联锌指蛋白OsTZF5在干旱条件下的表达,避开了组成型表达OsTZF5对植株生长发育的影响,最终在两个商业化水稻品种a中实现了干旱条件下的产量提升。
文章的整体实验与思路如下:
文章的一些主要结果:
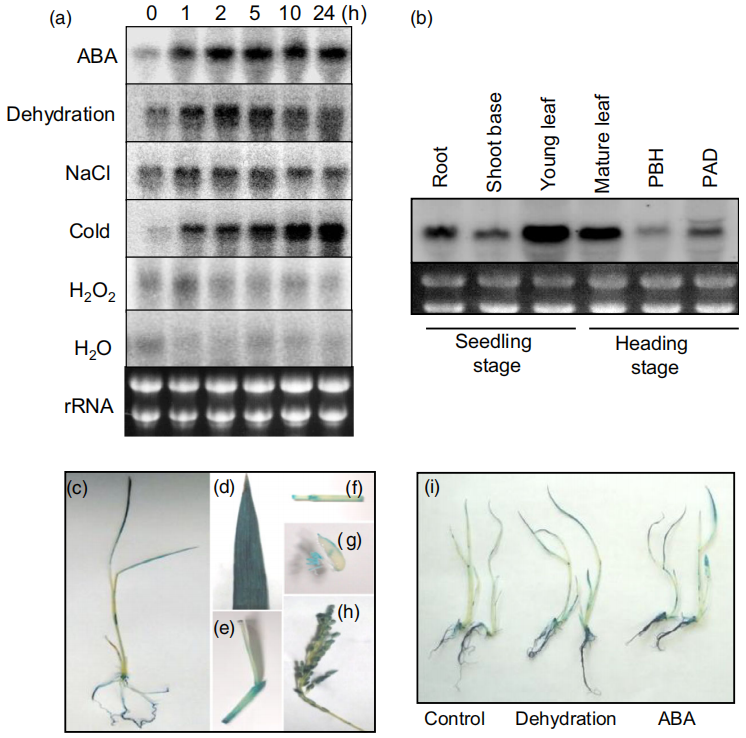
图1 OsTZF5的表达谱(Selvaraj et al., 2020)。(a)OsTZF5在不同应激和激素处理下的表达谱。将水培2周的水稻植株分别用ABA(10µM)、脱水、NaCl(250µM)、低温、H2O2(10µM)和H2O进行处理。每个处理的时间都标注在图片的最上面。(b)基于RNA凝胶印迹分析的OsTZF5在不同水稻组织中的表达谱。对于器官特异性表达,从苗期的根、茎基、幼叶、抽穗前(PBH)的幼叶、成熟叶和抽穗后的穗(PAH)中提取总RNA。(c-h)POsTZF5:GUS载体在水稻幼苗和不同组织中GUS活性的组织化学分析:(c)2周龄幼苗,(d)成熟叶片,(e)叶节,(f)节间纵剖面,(g)抽穗前穗和(h)抽穗后穗。(i)脱水和ABA(10μM)处理下转基因水稻POsTZF5:GUS植株的组织化学活性。
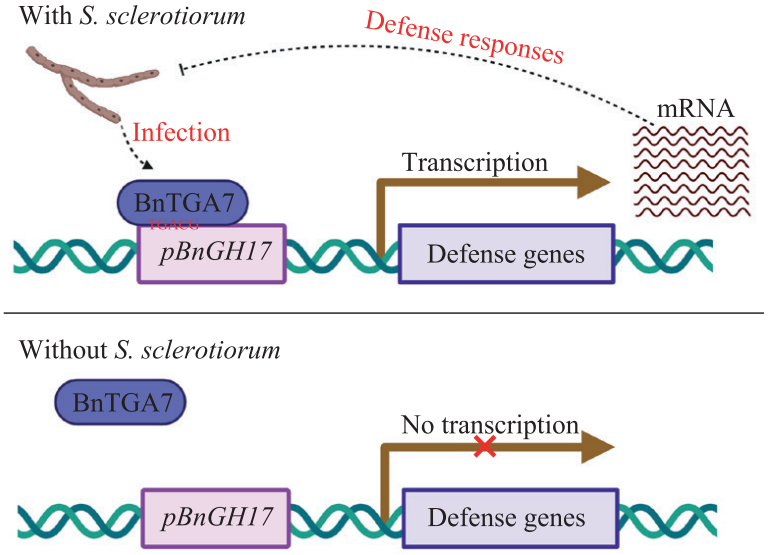
利用已鉴定的防御基因进行SSR抗性基因工程是一种很有前途的SSR控制策略。然而,防御基因的过表达可能导致植物生长缺陷(Ning et al., 2017)。因此,由核盘菌诱导启动子精确调控防御基因的表达,是培育抗SSR、产量稳定的甘蓝型油菜品种的最佳策略。
2022年发表在Journal of Experimental Botany上的一篇题为 “The Sclerotinia sclerotiorum-inducible promoter pBnGH17D7 in Brassica napus: isolation, characterization and application in host-induced gene silencing”的研究论文中,作者在甘蓝型油菜中鉴定和克隆了核盘菌诱导型启动子pBnGH17D7,发现该启动子的活性受到转录因子BnTGA7的调控,并将pBnGH17D7应用于油菜抗菌核病转基因育种。
文章的整体实验与思路如下:
文章的一些主要结果:
图3 BnGH17在甘蓝型油菜中的表达模式(Lin et al., 2022)。(A)通过转录组测序确定,在核盘菌感染后,油菜中诱导表达最强烈的基因(Wu et al., 2016a)。FPKM,每千个碱基转录物的片段数/百万个片段;Hpi,接种后数小时。(B)eFP(电子荧光象形图)查看器显示了基于在线转录组平台BnTIR(http://yanglab.hzau.edu.cn/BnTIR)的BnGH17(BnaC01g21880D)的组织表达模式。红色表示转录积累水平较高,黄色表示转录积累水平较低。TPM,每百万次映射读取的转录数。(C)qRT-PCR分析揭示了BnGH17在不同胁迫条件下的表达规律,包括非生物胁迫(PEG、冷、热、NaCl处理;绿色条);激素处理[水杨酸(SA)、脱落酸(ABA)、茉莉酸甲酯(MeJA)和乙烯利(ETH)]和H2O2处理(橙色条)。BnUBC9(BnaC08g12720D)作为内参基因。
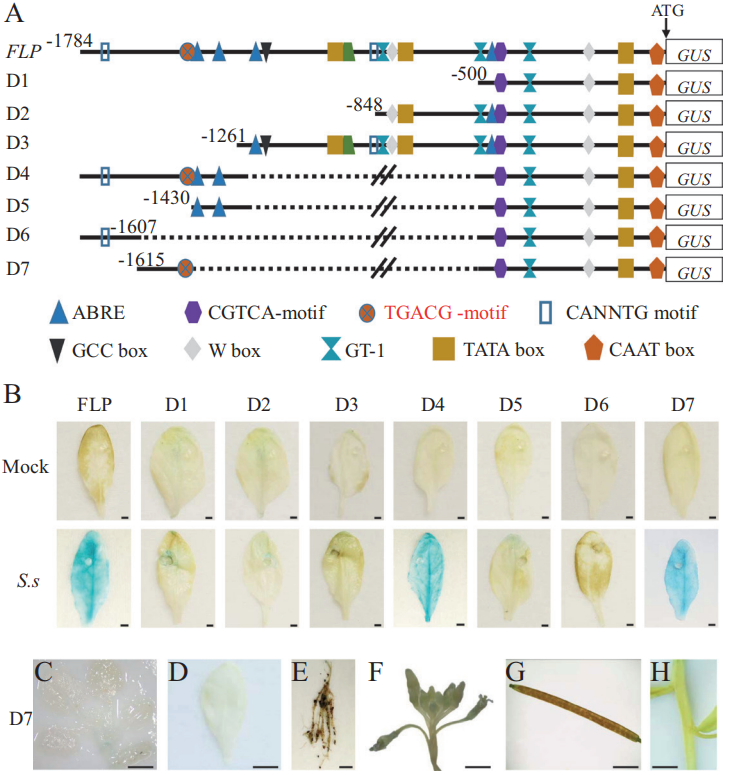
图4 pBnGH17在转基因拟南芥(T2)中的缺失分析(Lin et al., 2022)。(A)pBnGH17 5′缺失示意图。FLP,全长启动子。D1-D7,7个缺失启动子。pBnGH17中假定的顺式作用元件用不同的形状和颜色表示。所有位置都相对于起始密码子ATG进行表示。(B)接种核盘菌24h后携带pBnGH17缺失启动子的转基因拟南芥的组织化学GUS染色。(C-H)正常生长条件下不同组织中pBnGH17D7::GUS载体的组织化学GUS染色:(C)10日龄种子,(D)莲座叶,(E)成熟根,(F)花序,(G)发育中的种子,(H)茎。比例尺=5mm。
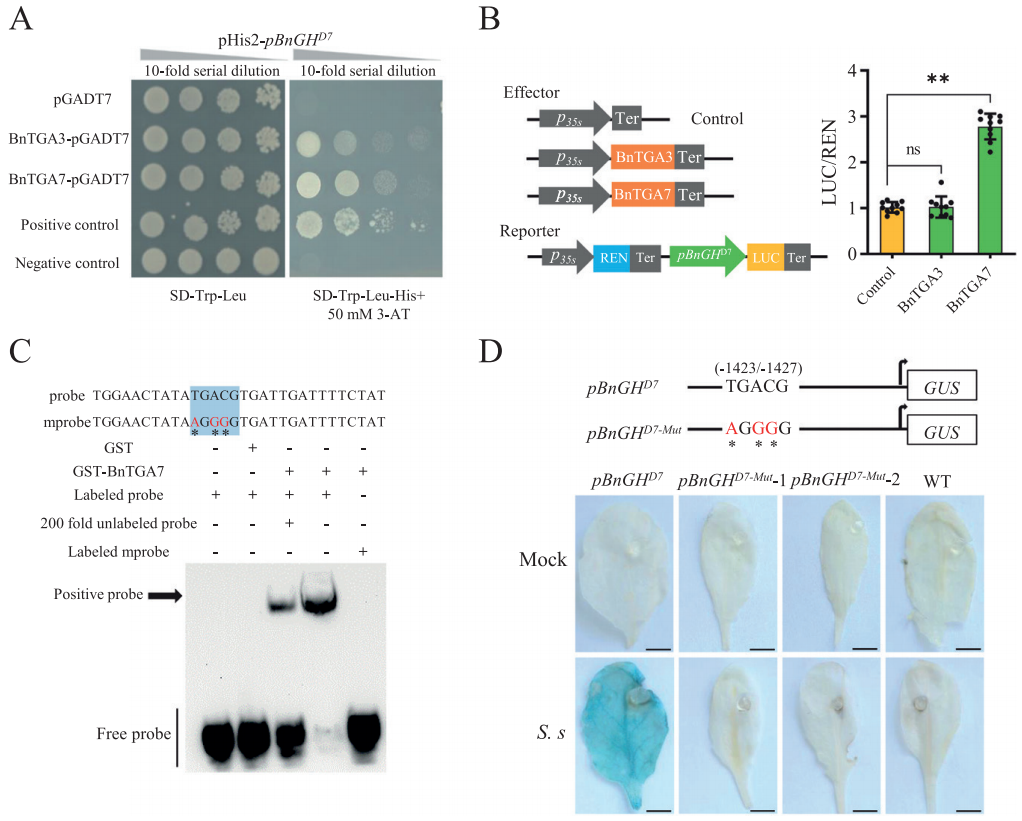
图5 BnTGA7直接与pBnGH17结合并激活pBnGH17(Lin et al., 2022)。(A)酵母单杂交检测BnTGA3/BnTGA7与pBnGH17D7的结合活性。阳性对照,p53HIS2和pGAD-Rec2-53。阴性对照,pHIS2和pGAD-Rec2-53。(B)在本氏烟草叶片中进行BnTGA3/BnTGA7与pBnGH17D7相互作用的双荧光素酶报告基因分析。将对照的LUC/REN值设为1进行校准。(C)重组BnTGA7蛋白与pBnGH17D7的TGACG基序特异性结合的EMSA实验。下划线表示TGACG基序序列,星号表示TGACG基序中突变的碱基。GST、GST-BnTGA7、标记探针、标记突变体探针和200倍未标记探针存在(+)或不存在(-)。(D)用核盘菌接种24h后,对含有突变启动子片段pBnGH17D7-Mut::GUS的两个独立转基因拟南芥株系(T1)进行组织化学GUS染色。在pBnGH17D7-Mut中,TGACG基序突变为AGGGG。阴性对照为Col-0(WT)。携带pBnGH17D7::GUS基因融合的转基因植株为阳性对照。
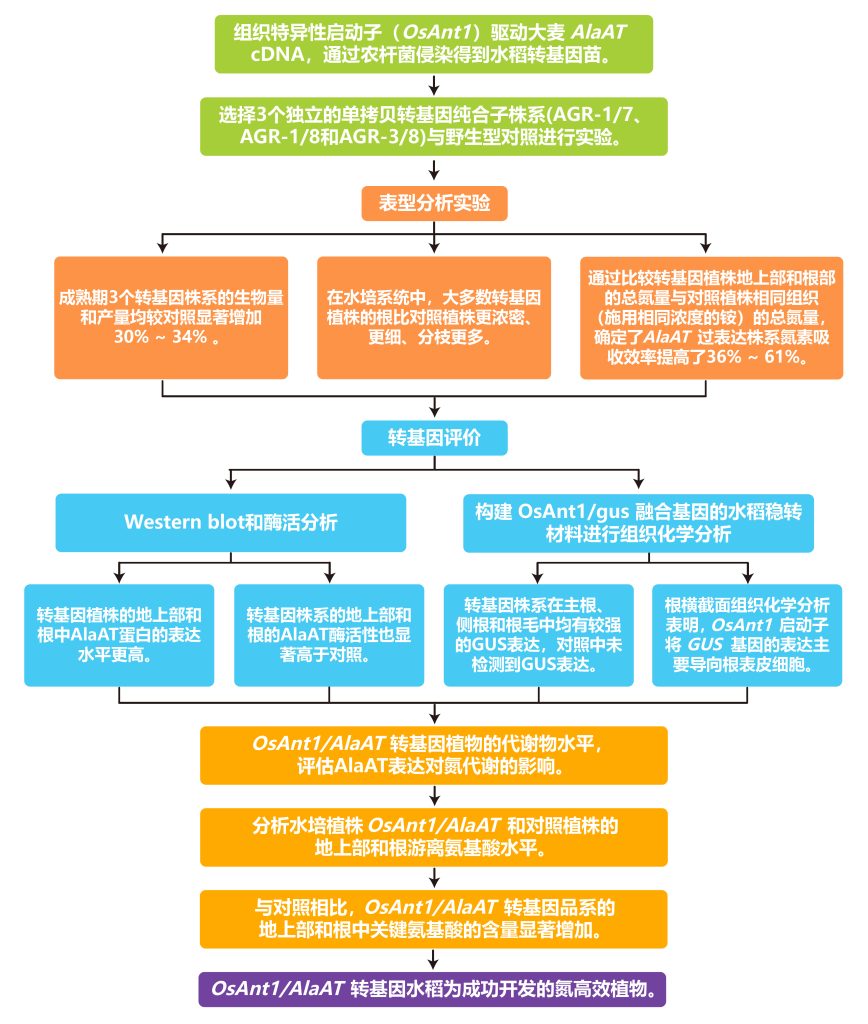
2008年发表在Plant Biotechnology Journal上的一篇题为“Genetic engineering of improved nitrogen use efficiency in rice by the tissue-specific expression of alanine aminotransferase”的研究论文中作者为了开发氮高效植物,通过水稻组织特异性启动子(OsAnt1)驱动的大麦AlaAT(丙氨酸转氨酶)cDNA,对水稻进行基因工程设计。在氮素供应充足的情况下,与对照植株相比,这一改良显著提高了水稻的生物量和产量。与此同时,转基因水稻植株的关键代谢产物和总氮含量也发生了显著变化,表明氮素吸收效率提高。开发更有效地吸收和利用氮的作物不仅可以提高氮肥的利用效率,从而降低生产成本,还会产生显著的环境效益。
文章的整体实验与思路如下:
文章的一些主要结果:
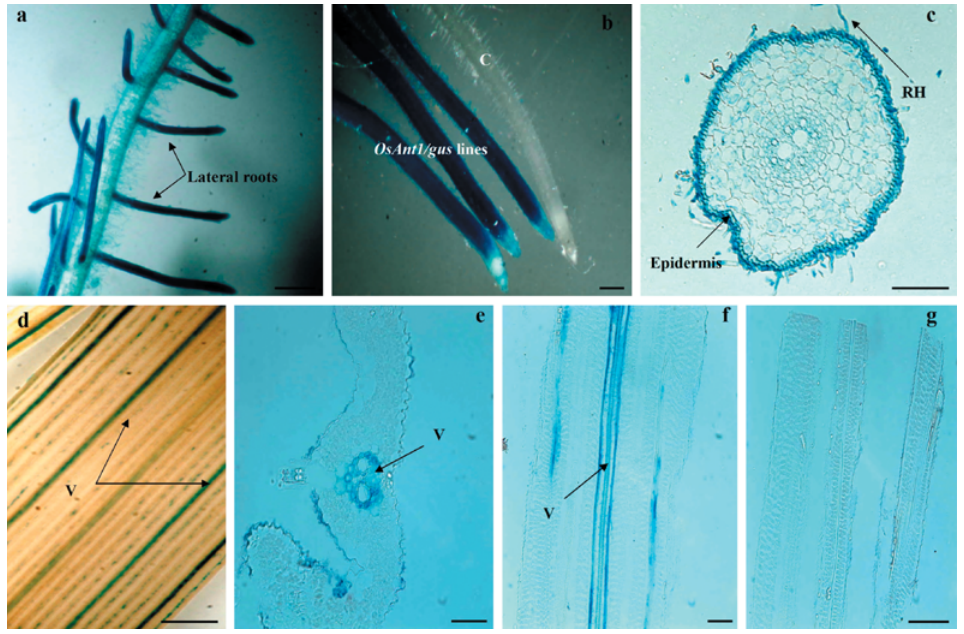
图7 OsAnt1/AlaAT转基因水稻与对照植株的比较(a-c)(Shrawat et al., 2008)。转基因植株(AGR-1/7)在以铵为氮源的水培液中分蘖数多,生长旺盛(a)。在水培液中转基因植株的根系比对照植株更茂盛、更细、分枝更多(b,c)。
迄今为止,为产生具有更强抗纹枯病的转基因水稻,采用了不同的遗传策略,这些策略涉及到致病相关(PR)蛋白或植物防御素基因的组成表达以及CaMV 35S或泛素启动子控制下的非特异性脂质转移蛋白(ns-LTPs)的表达。为了最大限度地减少转基因组成性表达引起的代谢负荷,降低纹枯病感染的有效性,诱导靶基因在感染部位的表达是非常可取的。
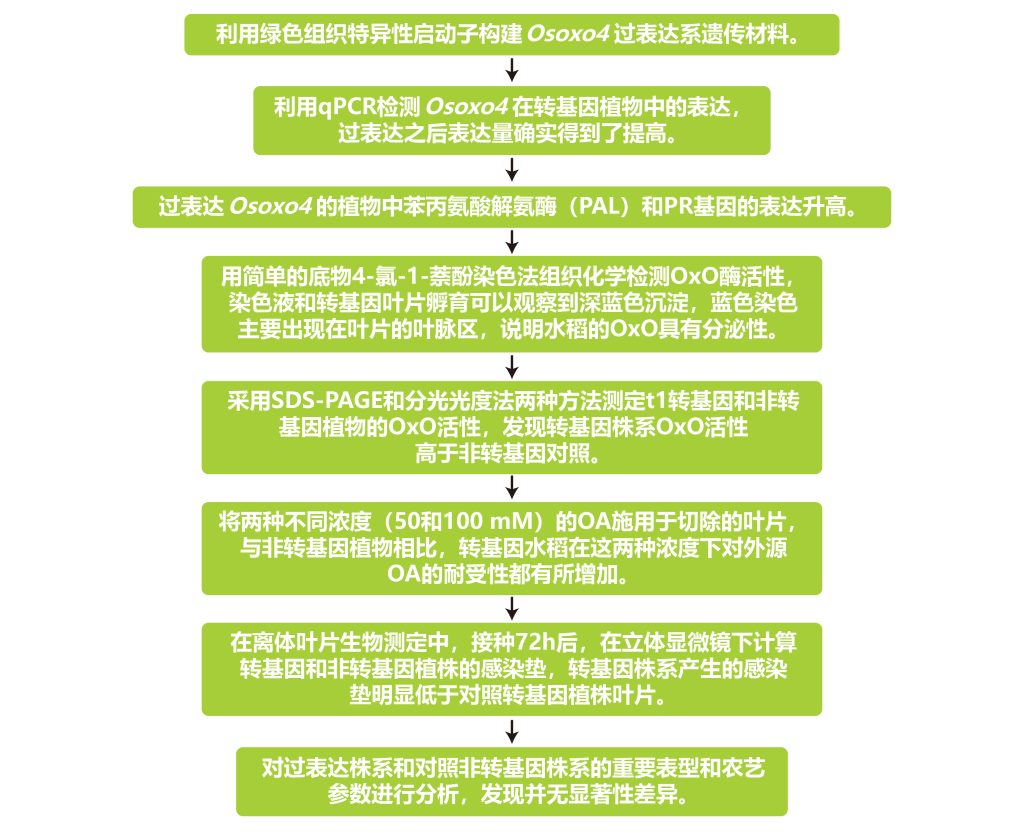
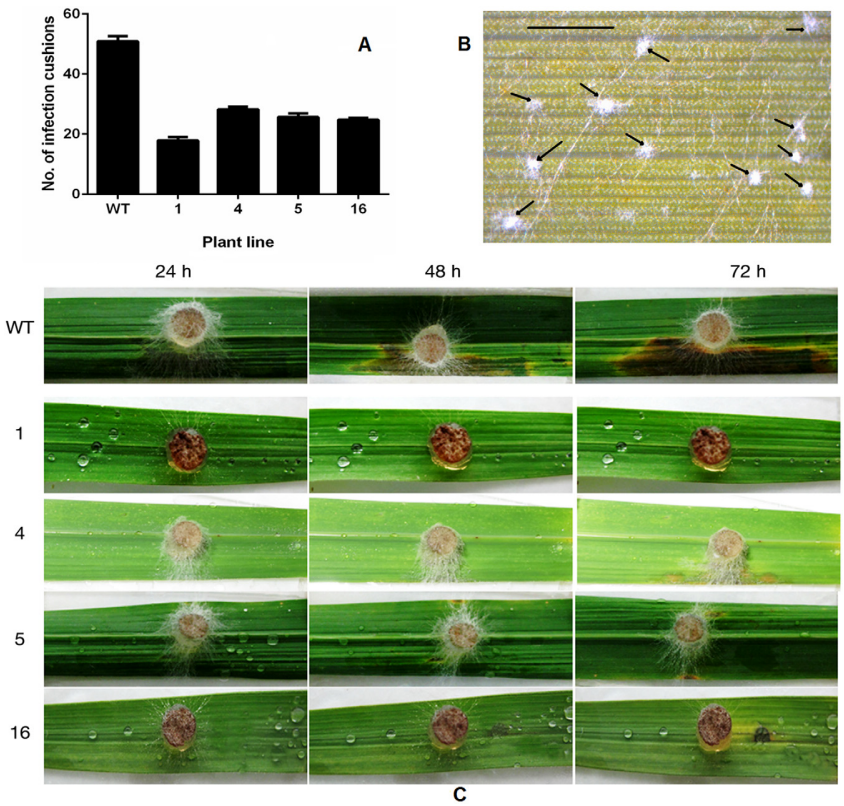
2013年发表在Molecular Plant Pathology上的一篇题为“Rice oxalate oxidase gene driven by green tissue-specific promoter increases tolerance to sheath blight pathogen (Rhizoctonia solani) in transgenic rice”的研究论文,该文章为了研究纹枯病的抗性,作者报道了以绿色组织特异性方式过表达水稻草酸氧化酶4(Osoxo4)基因的转基因水稻株系,该基因分解了R.solani(立枯丝核病菌)分泌的发病因子草酸(OA)。通过组织化学分析和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)显示,转基因植株的草酸氧化酶(OxO)活性高于非转基因对照植株。转基因水稻叶片对外源OA的耐受性优于对照水稻叶片。病原菌侵染后转基因植株中其它防御相关基因的表达量会升高。更重要的是,转基因植物对R.solani的持久抗性显著增强。Osoxo4在水稻中的过表达没有表现出任何有害的表型和农艺影响。研究结果表明,水稻OxO可以有效地用于植物遗传改良,以抵抗纹枯病,并可能抵抗其他由坏死性真菌引起的疾病,特别是那些分泌OA的病原菌造成的的病害。
文章的整体实验与思路如下:
文章的一些主要结果:
图9(i)PD540启动子构建用于组织特异性检测(Molla et al., 2013)。(ii)水稻草酸氧化酶4(Osoxo4)基因用于构建Osoxo4过表达系。(iii)用PD540:gus载体转化的水稻植株不同部位的组织化学β-葡萄糖苷酸酶基因(GUS)染色,仅在绿色组织部位为蓝色染色,表明PD540启动子具有绿色组织特异性。(A)成熟花序。(B)根。(C)幼穗。(D)鞘的横截面(TS)。(E)叶片的横截面。(F)叶舌和叶子。(G)成熟种子。(H)叶片纵剖面(LS)。
Lin L, Fan J, Li P, et al. The Sclerotinia sclerotiorum-inducible promoter pBnGH17D7 in Brassica napus: isolation, characterization, and application in host-induced gene silencing[J]. Journal of Experimental Botany, 2022, 73(19): 6663-6677.
Molla K A, Karmakar S, Chanda P K, et al. Rice oxalate oxidase gene driven by green tissue‐specific promoter increases tolerance to sheath blight pathogen (Rhizoctonia solani) in transgenic rice[J]. Molecular plant pathology, 2013, 14(9): 910-922.
Ning Y, Liu W, Wang G L. Balancing immunity and yield in crop plants[J]. Trends in plant science, 2017, 22(12): 1069-1079.
Selvaraj M G, Jan A, Ishizaki T, et al. Expression of the CCCH‐tandem zinc finger protein gene OsTZF5 under a stress‐inducible promoter mitigates the effect of drought stress on rice grain yield under field conditions[J]. Plant Biotechnology Journal, 2020, 18(8): 1711-1721.
Shrawat A K, Carroll R T, DePauw M, et al. Genetic engineering of improved nitrogen use efficiency in rice by the tissue‐specific expression of alanine aminotransferase[J]. Plant biotechnology journal, 2008, 6(7): 722-732.
Wu J, Zhao Q, Liu S, et al. Genome-wide association study identifies new loci for resistance to Sclerotinia stem rot in Brassica napus[J]. Frontiers in Plant Science, 2016, 7: 1418.