在先前的推文中有粉丝留言说想看有关MYB转录因子的介绍,于是小远就赶紧搜集了一些资料来和大家一起分享。在写这篇推文之前,小远还疑惑为啥MYB能被称为明星转录因子?这个疑惑在写文章的过程中很快就被解开了,因为MYB不仅功能强大,而且现有的研究成果也非常的多。MYB转录因子家族作为真核生物中的一类十分保守的转录因子家族,参与了多个发育过程,如根毛发育、花粉形成、种子萌发、花茎强度等方面;在植物遭受干旱、紫外线、冷胁迫、高温胁迫、盐胁迫等非生物胁迫时,MYB转录因子也参与其中并对其进行调节;此外,MYB转录因子还与某些经济作物的品质好坏密切(例如鲜花色泽、果实颜色等)相关。由于MYB的研究成果实在太多,在本次的推文中小远只能和大家分享其中的一小部分(MYB转录因子在非生物胁迫中的研究),希望大家通过阅读本文可以对MYB家族有一定的了解。
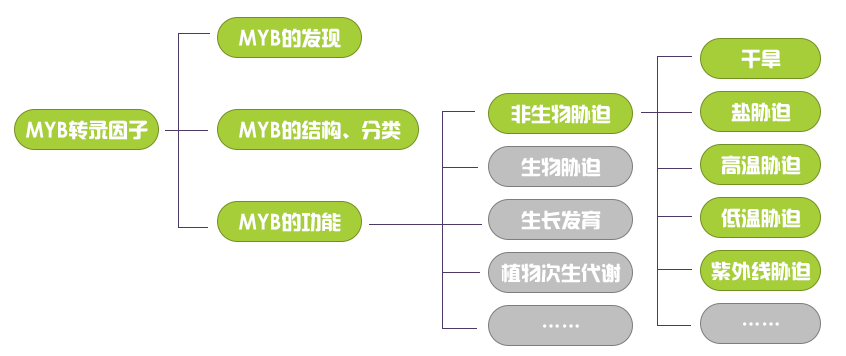
本次推文的主要内容(绿色部分)如下:
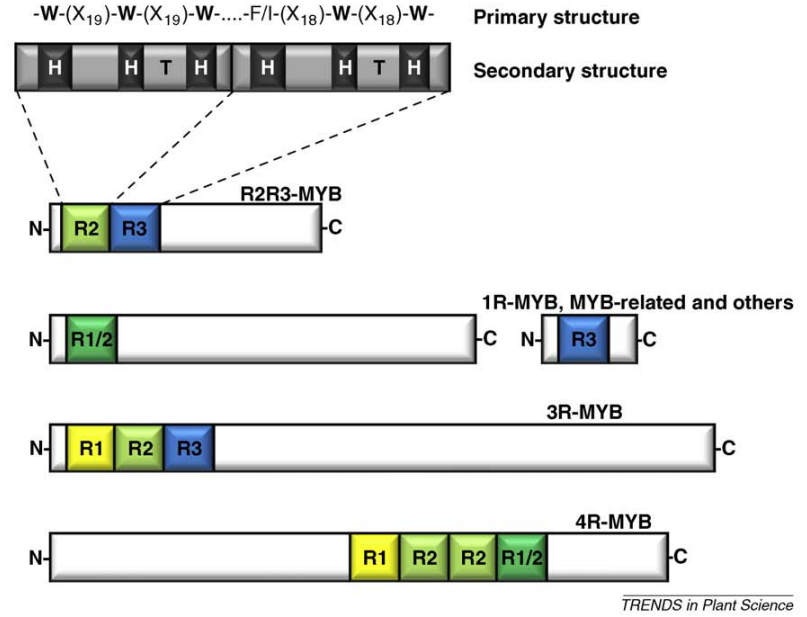
(1)1R(R1/2,R3-MYB)主要参与植物的形态发生、次生代谢、生物钟控制及花和果实的发育等生理过程。
(2)2R(R2R3-MYB)是植物MYB家族中数量最多的一类。根据蛋白质DNA结合区保守氨基酸的基序,2R类成员又可以分为28个亚类。这类MYB成员广泛参与植物初生及次生代谢、细胞分化、激素信号传导、生长发育调控、生物及非生物逆境响应等生命过程。
(3)3R(R1R2R3-MYB)存在于大多数真核生物基因组中,它们代表了相对保守的一个基因类别,在细胞周期控制方面起到重要的调控作用。
(4)4R(R1R2R2R1/2-MYB)是数量最少的一类MYB转录因子,其成员包含4个R1/R2重复。目前对植物中4R-MYB类蛋白质功能研究较少。
图3 转基因拟南芥在干旱胁迫下的表型(Wang et al., 2016)。WT:野生型;KO:ATMYB12敲除突变体;#3/#6:ATMYB12过表达植株。
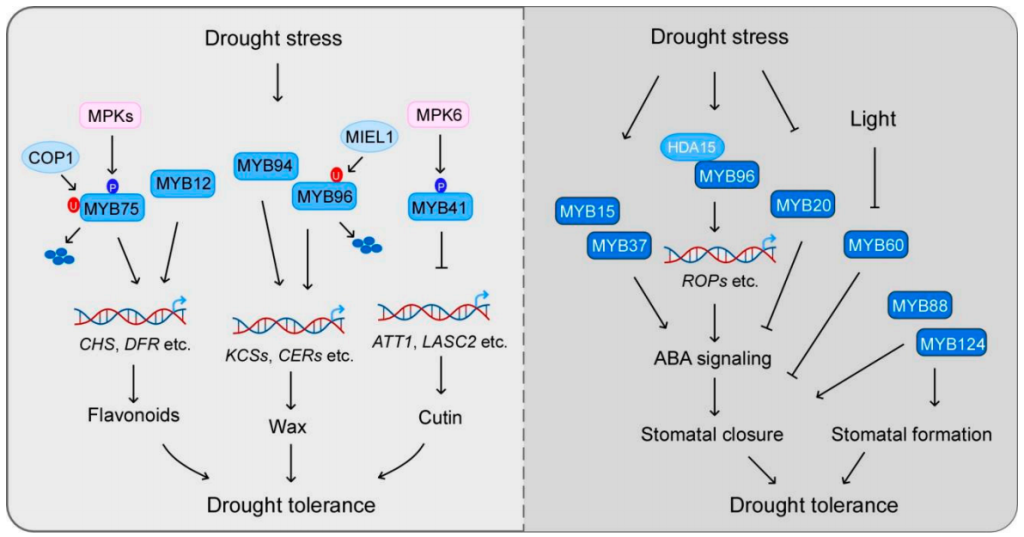
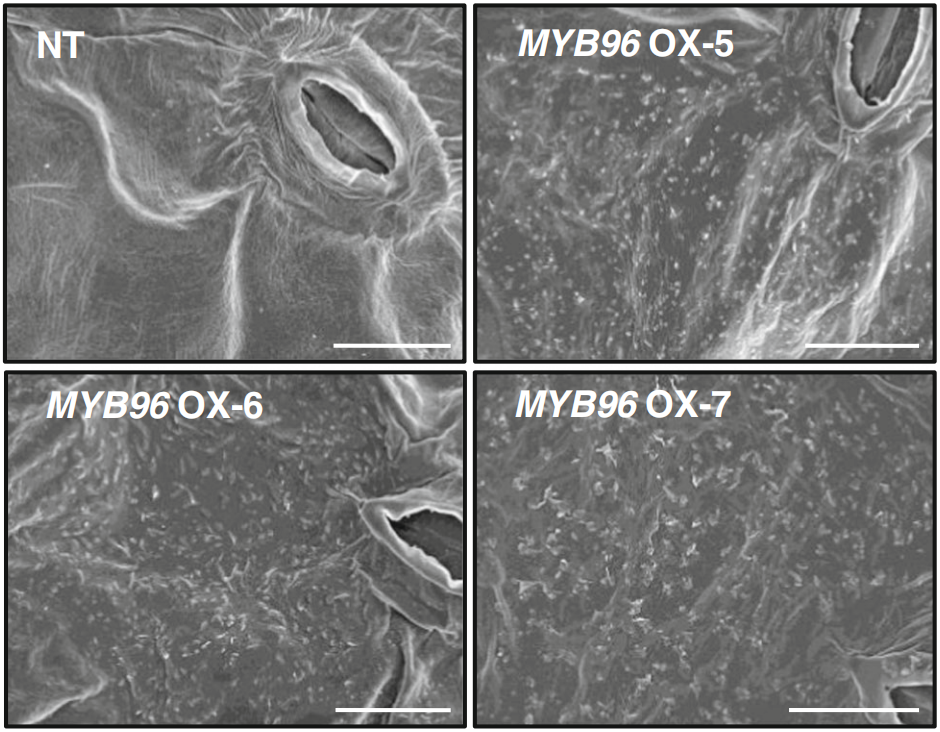
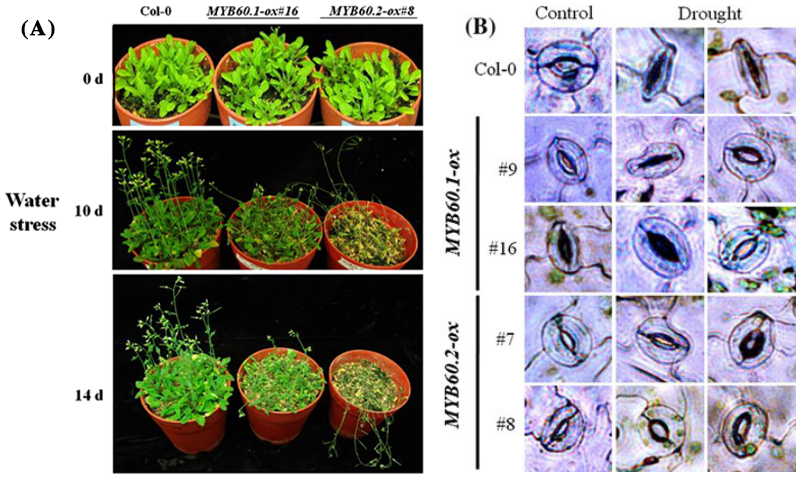
角质层是植物最重要的结构之一,它可以减少地上植物器官水分的散失。角质层的主要成分是角质和蜡,它们的生物合成受到MYB转录因子的广泛调控。研究表明,MYB41、MYB30、MYB94、MYB96、MYB16和MYB106等,可以通过调控角质和蜡的生物合成来影响植物对干旱胁迫的响应(图2)。在拟南芥中,MYB96的过表达可以促进表皮蜡质生物合成上调,从而提高拟南芥的耐旱性(图4)(Lee et al., 2014)。
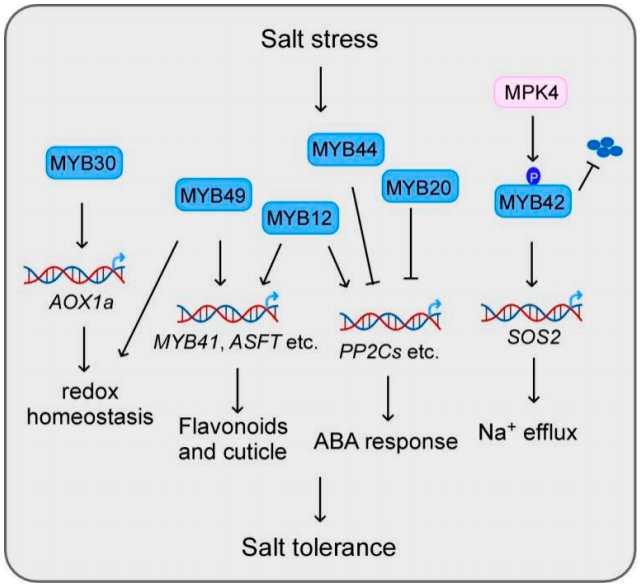
图6 MYB转录因子通过调节下游靶基因参与盐胁迫(Wang et al., 2021)。
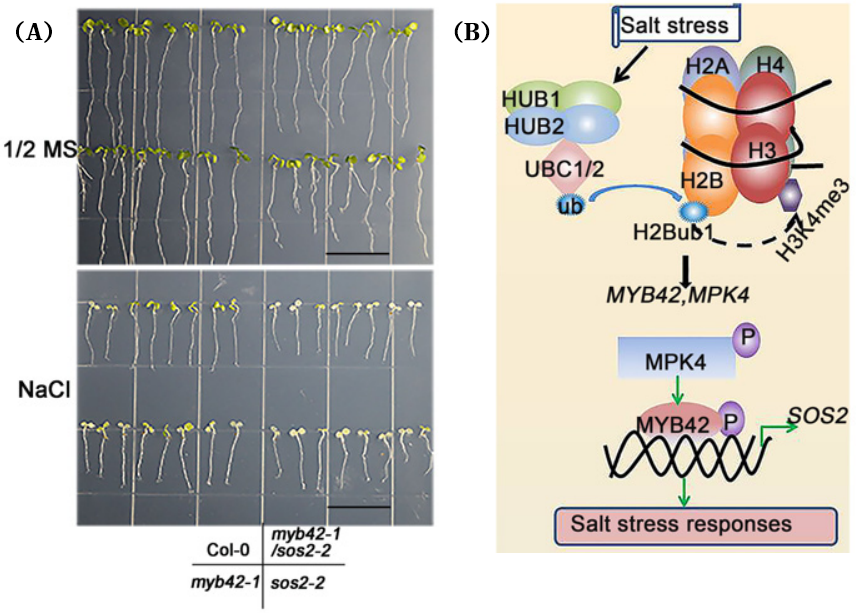
MYB49可以通过调节角质层形成和抗氧化防御来增加植物对盐胁迫的耐受性。MYB20通过直接与PP2Cs(ABA信号传导的主要负调节剂)启动子结合来负调节其表达,从而调控植物在盐胁迫条件下的耐受性。此外,MYB44也可以通过调节PP2Cs参与盐反应。盐诱导的PP2Cs基因如ABI1,ABI2,ATPP2CA,HAB1和HAB2在MYB44过表达的植物中减少,但在myb44突变体中增强。MYB7通过负调控ABI5在种子发芽期间参与盐胁迫反应,MYB7的突变会导致种子在发芽期间盐胁迫敏感。MYB42则是通过调控SOS2的表达来增强植物的耐盐性(图7)(Sun et al., 2020)。另外一些MYB转录因子,如MYB41和MYB15,其过表达可以增强植物在发芽和根系生长方面的耐盐性。而MYB52则负向调控植物的耐盐性,其过表达会导致种子萌发对盐胁迫超敏。
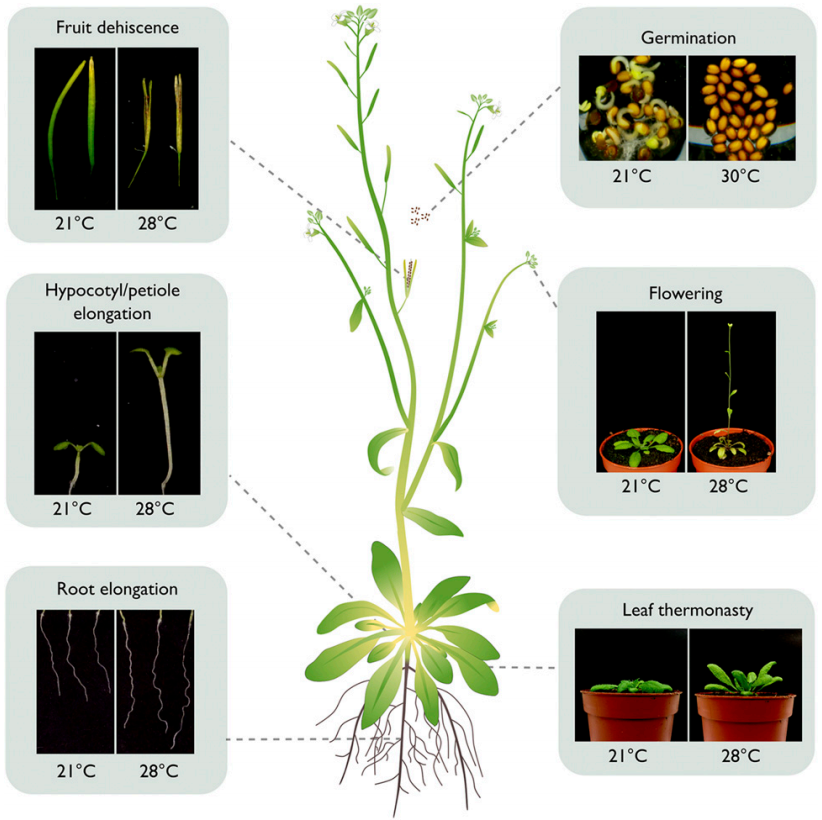
图8 高温可以影响种子萌发到开花结果各个阶段不同器官的生长发育(Vu et al., 2019)。
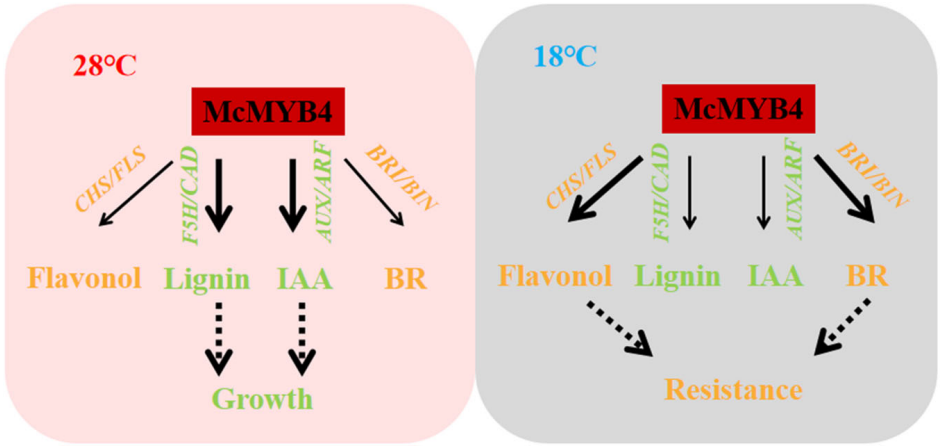
在植物响应高温胁迫的过程中,MYB类转录因子同样起到了非常重要的作用。OsMYB55能直接激活谷氨酸代谢相关基因,使过表达株系体内总氨基酸、谷氨酸、脯氨酸和精氨酸的含量提高,这些代谢产物大都能直接或间接提高植物对逆境的耐受性。MYB68在拟南芥对高温的响应过程中起着非常重要的作用,高温条件下,拟南芥根部MYB68的表达量显著增加,同时MYB68基因的突变体植株生长速率显著低于野生型。MYB30可以通过调节钙信号通路参与氧化和热应激反应,缺乏MYB30蛋白的植物在H2O2和热刺激下表现出[Ca2+]cyt的升高。高温还可以使CmMYB012直接与CmFNS、CmCHS、CmDFR、CmANS和CmUFGT的启动子结合并抑制其表达,导致黄酮类物质和花青素的减少,而黄酮和花青素的减少削弱了植物应对高温胁迫的能力(Zhou et al., 2021)。此外,Hao等人还发现McMYB4可以通过调节苯丙烷代谢和激素信号传导,协调苹果的生长和抗性,从而提高苹果的温度适应性(图9)(Hao et al., 2021)。
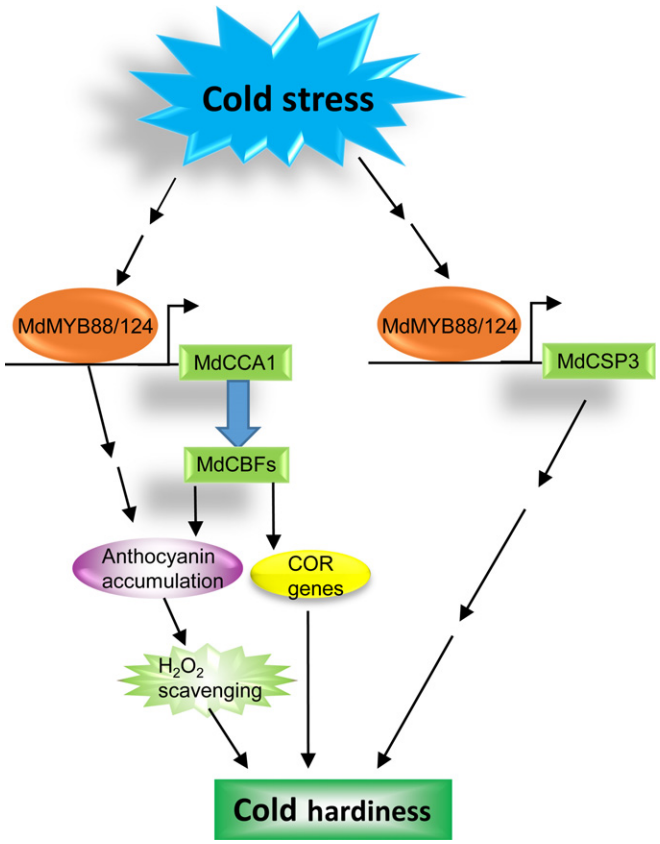
在拟南芥中,MYB15受低温诱导上调表达,MYB15蛋白通过与ICE1互作后结合到关键的冷反应转录因子CBFs启动子元件上来调控植株抗冻性,MYB15过表达导致CBFs表达和植株抗冻性降低,而myb15突变体则表现出CBFs表达和植株抗冻性增加,这表明MYB15负调控CBF的表达。而MYB96受到冷胁迫的诱导后,会通过调节CBF的表达来激活植株的抗冻能力。OsMYB3R-2主要通过上调细胞周期蛋白(Cyclin)基因OsCycB1;1和OsDREB1s的表达赋予植株耐冷性,而OsMYBS3则通过抑制OsDREB1B的表达负调控植株耐冷性。过表达OsMYB4基因可以大大提高水稻对低温,干旱和高盐等非生物胁迫的耐受能力。在白桦中过量表达BpMYB4基因同样能够提高白桦的耐低温能力。此外,在低温胁迫下,MdMYB88和MdMYB124可以作用于MdCCA1的上游,通过结合其启动子的AACCG基序直接调控其表达。激活MdCCA1后,可调节MdCBF基因的表达,诱导COR基因的表达并促进花青素的积累,后者有助于冷胁迫下H2O2的清除。MdMYB88和MdMYB124还可以直接调控MdCSP3的表达,MdCSP3则通过CBF独立的途径增强苹果的耐寒性(图10)(Xie et al., 2018)。
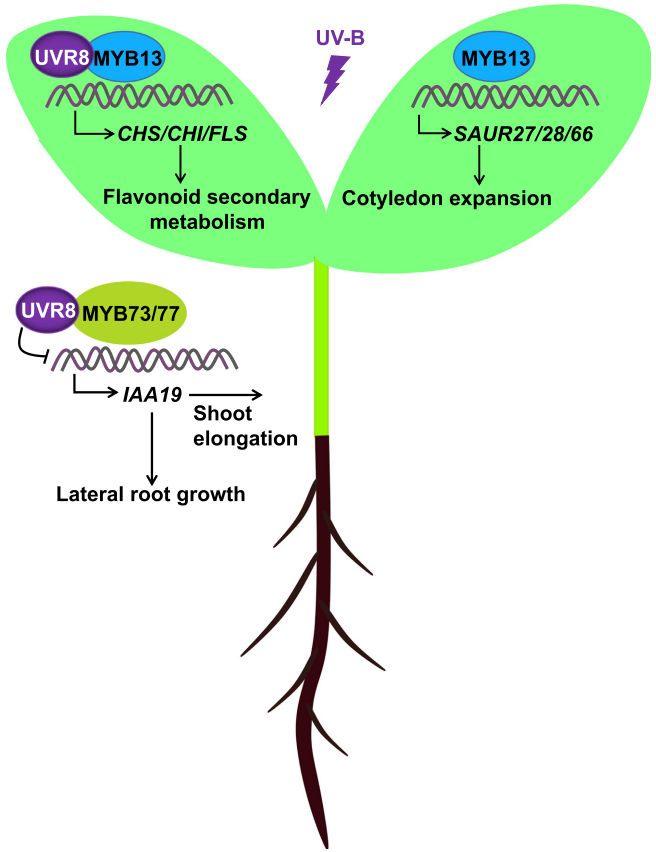
研究表明,MYB转录因子在植物对UV-B光的应答中具有重要作用。在苦荞中,MYB4R1可以通过与类黄酮、花青素生物合成通路的基因FtCHS、FtFLS以及FtUFGT启动子中的L-box基序结合,调节植物体内类黄酮和花青素的积累来响应UV-B(Liu et al., 2022)。在拟南芥中,MYB4是紫外线防晒物质合成的负调节因子,它可以抑制C4H基因的转录,该基因是紫外线防晒物质合成的关键酶。类似地,MYB7也参与抑制黄酮醇的生物合成。UV-B照射会抑制植物的下胚轴伸长、根生长,并诱导子叶扩张。在这个过程中,UVR8光感受器起着重要作用。MYB73和MYB77与UVR8以依赖UV-B的方式相互作用,并调节侧根生长。此外,UVR8还在UV-B照射下与MYB13相互作用并诱导MYB13靶基因(CHS/CHI/FLS)表达以刺激类黄酮次级代谢和子叶扩展(图11)(Xu et al., 2020)。
Cominelli E, Galbiati M, Vavasseur A, et al. A guard-cell-specific MYB transcription factor regulates stomatal movements and plant drought tolerance. Curr Biol. 2005, 15(13): 1196-200.
Chen Y, Yang X, He K, et al. The MYB transcription factor superfamily of Arabidopsis: expression analysis and phylogenetic comparison with the rice MYB family. Plant Mol Biol. 2006, 60(1): 107-24.
Dubos C, Stracke R, Grotewold E, et al. MYB transcription factors in Arabidopsis. Trends Plant Sci. 2010, 15(10): 573-81.
El-Kereamy A, Bi YM, Ranathunge K, et al. The rice R2R3-MYB transcription factor OsMYB55 is involved in the tolerance to high temperature and modulates amino acid metabolism. PLoS One. 2012, 7(12): e52030.
Hetherington AM, Woodward FI. The role of stomata in sensing and driving environmental change. Nature. 2003, 424(6951): 901-8.
Hao S, Lu Y, Peng Z, et al. McMYB4 improves temperature adaptation by regulating phenylpropanoid metabolism and hormone signaling in apple. Hortic Res. 2021, 8(1): 182.
Lee SB, Kim H, Kim RJ, et al. Overexpression of Arabidopsis MYB96 confers drought resistance in Camelina sativa via cuticular wax accumulation. Plant Cell Rep. 2014, 33(9): 1535-46.
Liu M, Sun W, Ma Z, et al. Integrated network analyses identify MYB4R1 neofunctionalization in the UV-B adaptation of Tartary buckwheat. Plant Commun. 2022, 3(6): 100414.
Oh JE, Kwon Y, Kim JH, et al. A dual role for MYB60 in stomatal regulation and root growth of Arabidopsis thaliana under drought stress. Plant Mol Biol. 2011,77(1-2): 91-103.
Paz-Ares J, Ghosal D, Wienand U, et al. The regulatory c1 locus of Zea mays encodes a protein with homology to myb proto-oncogene products and with structural similarities to transcriptional activators. EMBO J. 1987, 6(12): 3553-8.
Sun Y, Zhao J, Li X, et al. E2 conjugases UBC1 and UBC2 regulate MYB42-mediated SOS pathway in response to salt stress in Arabidopsis. New Phytol. 2020, 227(2): 455-472.
Vu LD, Xu X, Gevaert K, et al. Developmental Plasticity at High Temperature. Plant Physiol. 2019, 181(2): 399-411.
Wang F, Kong W, Wong G, et al. AtMYB12 regulates flavonoids accumulation and abiotic stress tolerance in transgenic Arabidopsis thaliana. Mol Genet Genomics. 2016, 291(4): 1545-59.
Wang X, Niu Y, Zheng Y. Multiple Functions of MYB Transcription Factors in Abiotic Stress Responses. Int J Mol Sci. 2021, 22(11): 6125.
Xie Y, Chen P, Yan Y, et al. An atypical R2R3 MYB transcription factor increases cold hardiness by CBF-dependent and CBF-independent pathways in apple. New Phytol. 2018, 218(1):201-218.
Xu Y, Zhu Z. UV-B Response: When UVR8 Meets MYBs. Trends Plant Sci. 2020, 25(6): 515-517.
Zhou LJ, Geng Z, Wang Y, et al. A novel transcription factor CmMYB012 inhibits flavone and anthocyanin biosynthesis in response to high temperatures in chrysanthemum. Hortic Res. 2021, 8(1): 248.
郭凯, 侯留迪, 张莹莹等. 植物MYB基因家族研究进展. 长江大学学报(自然科学版). 2020.