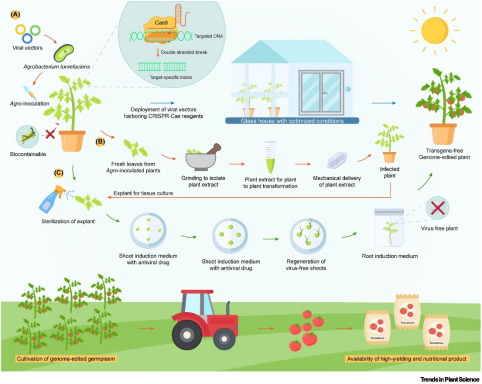
人口持续增长,耕地面积萎缩、植物病虫害和气候变化等不断对粮食生产提出新的挑战,通过常规手段进行作物改良耗时较久,现代育种技术的应用如CRISPR/Cas通过定向诱变可以对农作物进行快速改良大大加快了育种进程,为作物精准改良提供了前所未有的机遇。然而,在植物中进行基因编辑时,不仅受限于植物组织培养或转化技术,而且T-DNA随机整合到编辑植物的基因组中也带来了转基因监管和生物安全问题。因此,各种植物病毒已经被设计成可以容纳和传递CRISPR/Cas的微型载体来产生无转基因和基因组编辑的植物。
2023年5月24日,国际著名杂志Trends in Plant Science杂志在线发表了题为“Viral vectors as carriers of genome-editing reagents”的文章。
文章指出一些病毒载体,如烟草脆裂病毒(TRV)和马铃薯病毒X(PVX),由于其载货能力有限,只能传递sgRNA到Cas9-高表达(Cas9-0E)的转基因系中。最近报道的Liu等建立了高效的番茄斑萎病毒(TSWV)遗传操作系统, TSWV为一种负链、分节段、双义编码的RNA病毒,其寄主范围广泛,结合其病毒结构和复制特点,通过对病毒基因组进行解构,删除了对侵染植物寄主非必要的病毒基因元件,为搭载外源序列释放了病毒基因组空间。利用该策略,成功在本氏烟中实现了CRISPR/Cas12a (Cpf1)、CRISPR/Cas9的病毒递送,TSWV-Cas12a-crRNA载体在NbPDS,NbFucT和NbDCL2的基因中表现出靶向诱变的平均插入缺失频率分别为68.1%、46.4%和31.3%,TSWV-Cas9-sgRNA载体在NbPDS-76、NbRDR2-61和NbSGS5中的编辑频率分别为26.4%、2.6%和1.3%。利用该系统成功递送分子量更大的腺嘌呤、胞嘧啶碱基编辑器,研究发现TSWV-ABE编辑频率高达38%,TSWV-CBE编辑频率高达75%。相较之下,工程化的TSWV有可能在众多商业作物中以目标特定的方式产生体细胞基因组编辑。
文章来源:植物生物技术Pbj