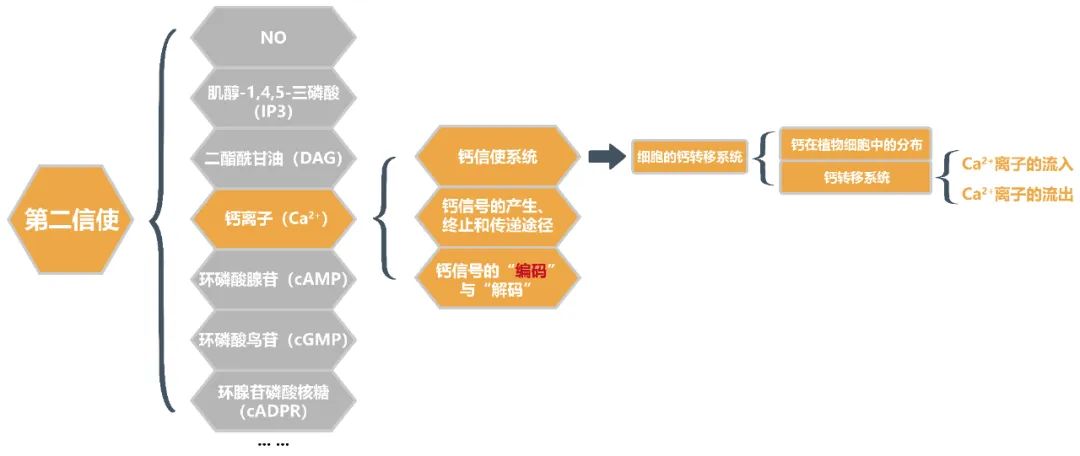
本文主要为大家介绍第二信使里面的Ca2+,主要围绕钙信使系统,钙信号的产生、终止和传递途径以及钙信号的“编码”与“解码”3个方面为大家讲解(图中橙色部分),感兴趣的童鞋可以好好阅读本文噢!
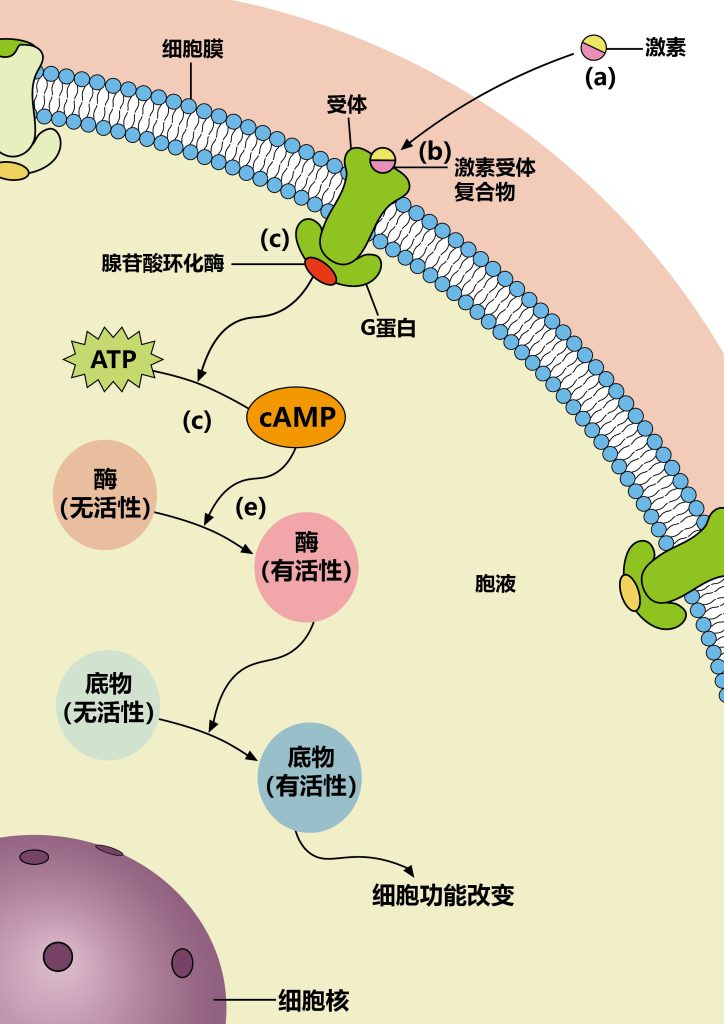
第二信使迅速、忠实、有效地传播细胞受体接收到的信息。它们是小的、非蛋白质的有机分子或离子,可以与特定的目标蛋白质结合,以各种方式改变其活动,使它们能够对受体接收到的信息作出适当的反应。
第二信使相对于蛋白质的一个关键优势是,与蛋白质不同,第二信使的水平是由快速动力学控制的。因此,尽管一个蛋白质的水平可能需要几十分钟才能显著增加,但大多数第二信使的水平在微秒(例如,离子)到秒(例如,DAG)内增加。它们通常是由细胞中丰富的前体产生的,或从含有高浓度第二信使的存储器中释放出,所以它们的生成不受速率限制。因此,当接收到适当的信号时,第二信使迅速产生,迅速扩散,并高效地改变靶蛋白功能。
钙离子(Ca2+)、肌醇-1,4,5-三磷酸(IP3)、二酯酰甘油(DAG)、环磷酸腺苷(cAMP)、环磷酸鸟苷(cGMP)、环腺苷磷酸核糖(cADPR)、NO等由胞内底物被效应器酶降解而来的一系列小分子物质及其代谢产物等都属于第二信使。
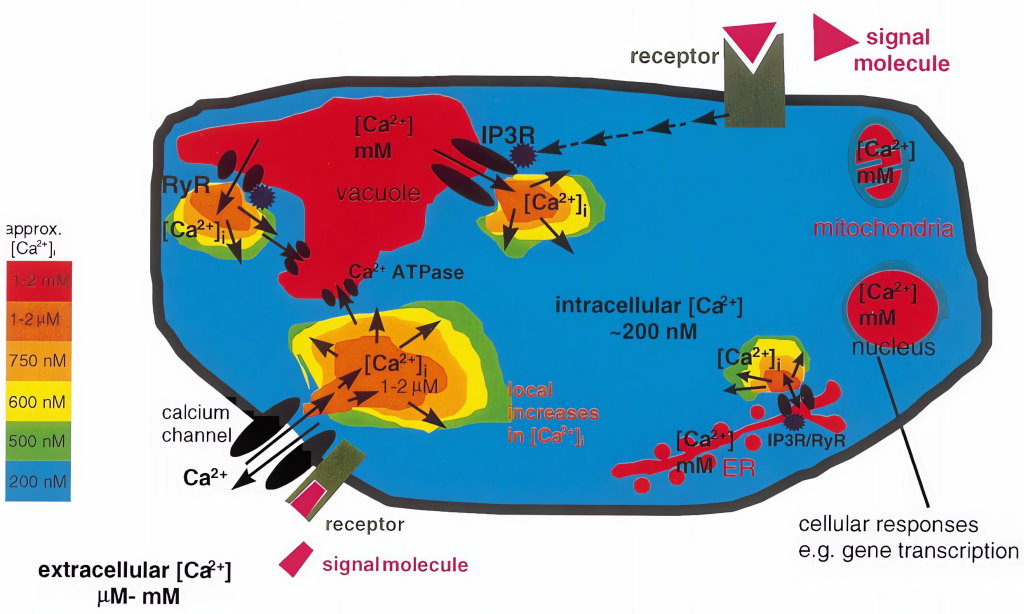
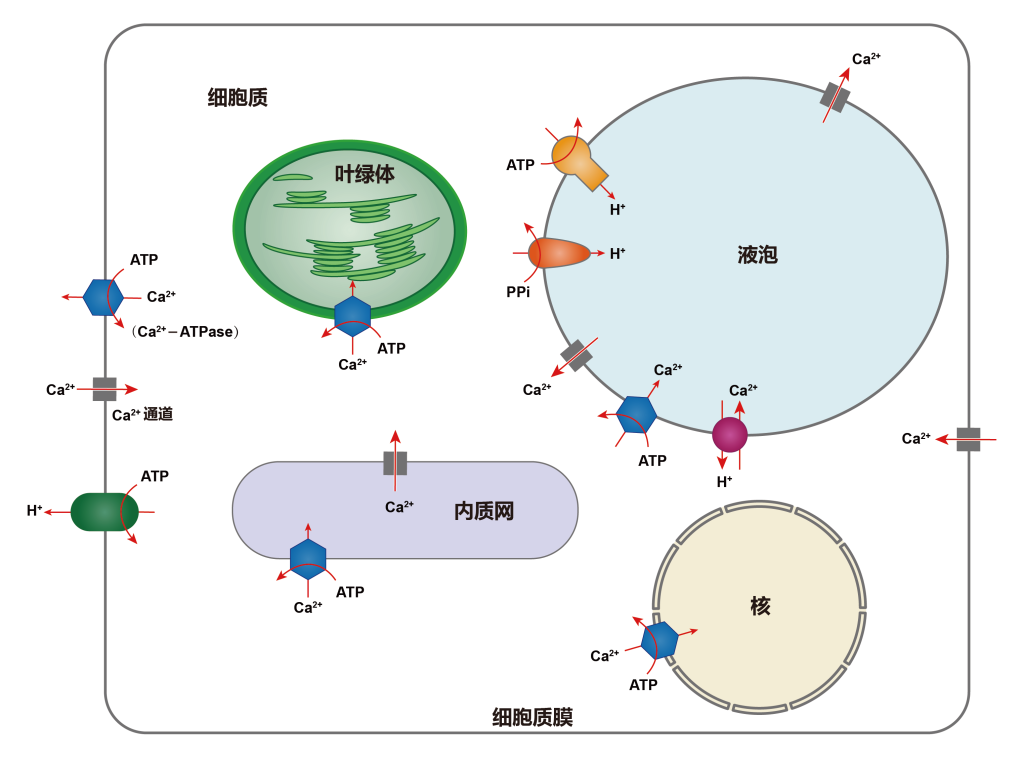
Ca2+平时以结合态的形式结合在这些细胞器上,它的迅速释放和螯合对维持细胞内Ca2+浓度的稳定平衡及Ca2+的信使作用起一个很大的钙缓冲作用(Bush Douglas S., 1995)。“钙库”中Ca2+的缓冲能力主要是与一类对Ca2+高容量、低亲和力的贮钙蛋白有关。由于它们对Ca2+的低亲和力,故当“钙库”中钙通道开放时,钙蛋白能迅速地和钙解离,将Ca2+释放到胞质中去,使Ca2+信号能准确、迅速的传递。
注:细胞内以及细胞外Ca2+浓度的检测可以参考上一期的文章“荧光蛋白的升级用法”中关于Ca2+的部分,这里就不再具体展开讲解了!
Ca2+从胞外内流是通过细胞质膜钙离子通道。钙离子通道是一种结合蛋白,它通过构象变化呈开放或关闭状态,从而控制Ca2+流动。在钙通道关闭时,胞外Ca2+以非特异性渗漏形式进入细胞内,数量甚微;钙离子通道开放时,Ca2+以扩散形式按一定的扩散差从胞外涌入胞内。植物细胞内,特别是在液泡膜和细胞质膜上的Ca2+离子通道具有可渗透性,属于配体门通道。钙离子通道主要位于质膜系统和内膜系统,下面详细介绍一下植物质膜系统和内膜系统上的钙离子通道。
(1)细胞质膜系统上的钙离子通道:在细胞质膜上至少有两种类型的钙离子通道(White P J., 1998),一是高亲和性低选择力的离子通道(White P J., 1994);二是选择性较高的单一性离子通道,一般它的亲和力较低。
(2)内膜系统上的钙离子通道:在液泡膜上至少有两种不同的钙离子通道(Allen G J and D. Sanders., 1997),其中有两个是受体门控钙离子通道,一是以1,4,5-三磷酸(InsP3)作为离子载体;二是以环ADP核糖体(cADPR)作为离子载体(Allen Gethyn J and Dale Sanders., 1994)。
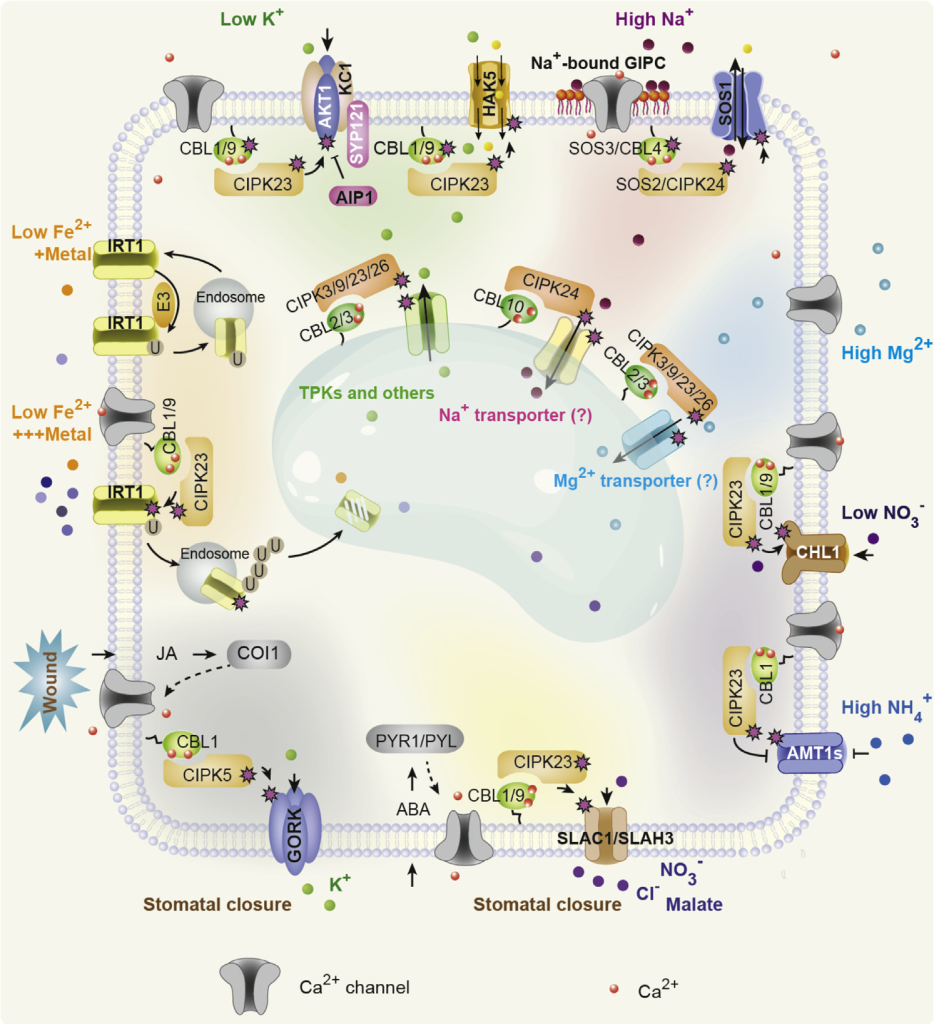
根据逻辑顺序应该先讲钙信号的“编码”,但是“编码”这个过程相对复杂,而多年来,钙信号是如何通过钙结合蛋白“解码”已经被广泛研究,钙信号的解码是通过各种Ca2+结合蛋白实现。在植物中,Ca2+结合蛋白主要分为响应元件(sensor responder)和传感元件(sensor relay)两类蛋白。前者通过与Ca2+的结合改变自身激酶活性或构象直接调控下游,主要包括钙依赖蛋白激酶(calcium dependent protein kinase,CDPK);后者与Ca2+结合后,还必须与目标蛋白相互作用才能调控下游信号,主要包括钙调素(CaM)和钙调磷酸酶B类似蛋白(calcineurin B-like,CBL)。这些蛋白通过与Ca2+的结合,改变自身或目标蛋白的活性,进而调控下游目的基因的表达,最终使细胞能够产生特异的信号响应(Batistič Oliver and Jörg Kudla., 2012)。
下面以栾升教授研究组20多年来对植物钙信号解码的研究,发现并构建了复杂的Ca2+-CBL-CIPK信号转导网络为例,带大家简单了解一下!
细胞钙(Ca2+)信号几乎调节着真核生物生理的各个方面。在所有情况下,Ca2+信号传导都具有一个复杂的传导链,包括一系列感知细胞外信号的受体和Ca2+可渗透通道,这些通道通过质膜将Ca2+输送到细胞内或从细胞内存储释放Ca2+,形成特定的Ca2+信号(Tang Ren-Jie and Sheng Luan., 2017)。细胞Ca2+标记的下游是Ca2+结合蛋白,它们与效应蛋白相互作用,触发特定的生化反应,导致细胞反应(Luan Sheng., 2009;DeFalco et al., 2010)。在植物中,Ca2+信号通路显得尤为重要,因为它为固着生物通过修改其灵活的发育程序来快速响应和适应不断变化的环境提供了不可或缺的机制(Luan Sheng., 2009;Dodd et al., 2010)。植物细胞中胞质Ca2+升高短暂而明确的模式被认为是下游反应所必需和充分的“第二信使”(Gilroy Simon and Anthony Trewavas., 2001;Luan et al., 2002;Sanders et al., 2002;Kudla et al., 2018)。
许多环境条件,如生物和非生物胁迫,往往会引起具有特定时空特征的Ca2+第二信使。这些不同的Ca2+信号可以以尖峰、波和振荡的形式编码,由Ca2+传感器和效应器解析,从而导致特定的响应。在高等植物中已经发现了一些Ca2+传感器家族,包括钙调素(CaM)和CaM样蛋白(CMLs)(Zielinski, Raymond E., 1998;Luan et al., 2002;McCormack et al., 2005)、Ca2+依赖蛋白激酶(CDPKs)(Harmon et al., 2000;Cheng et al., 2002;Harper et al., 2004)和更神秘的钙调神经磷酸酶B样蛋白(CBLs)(Kudla et al., 1999;Trewavas Anthony., 1999;Luan et al., 2002)。为了确定CBL家族Ca2+传感器的功能特性,一个新的植物特异性CBL相互作用蛋白激酶家族(CIPKs)作为主要的下游信号成分(Shi et al., 1999)。进一步的遗传研究已经确定了CBL-CIPK信号系统在调节植物对不利环境条件的适应性反应中的核心作用。自1999年CBL-CIPK网络被发现以来,近20年来的研究明确了CBL-CIPK模块在Ca2+信号转导过程中的分子机制,并揭示了该Ca2+信号网络促进植物对环境变化的响应和适应的各种生理过程,特别是在植物细胞的膜转运过程中。
然而,钙信号是如何编码出来的?这个问题很复杂,要研究钙信号的编码机制,其关键是发掘介导钙离子进出细胞或者细胞器的钙通道和转运蛋白,研究他们的“开”与“关”的机制。后面的推文我们再来讨论钙信号的编码机制。
Allen G J, Sanders D. Two voltage-gated, calcium release channels coreside in the vacuolar membrane of broad bean guard cells[J]. The Plant Cell, 1994, 6(5): 685-694.
Allen G J, Sanders D. Vacuolar ion channels of higher plants[M]//Advances in Botanical Research. Academic Press, 1997, 25: 217-252.
Bush D S. Calcium regulation in plant cells and its role in signaling[J]. Annual review of plant biology, 1995, 46(1): 95-122.
Batistič O, Kudla J. Analysis of calcium signaling pathways in plants[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2012, 1820(8): 1283-1293.
Cheng S H, Willmann M R, Chen H C, et al. Calcium signaling through protein kinases. The Arabidopsis calcium-dependent protein kinase gene family[J]. Plant physiology, 2002, 129(2): 469-485.
DeFalco T A, Bender K W, Snedden W A. Breaking the code: Ca2+ sensors in plant signalling[J]. Biochemical Journal, 2010, 425(1): 27-40.
Dodd A N, Kudla J, Sanders D. The language of calcium signaling[J]. Annual review of plant biology, 2010, 61: 593-620.
Gilroy S, Trewavas A. Signal processing and transduction in plant cells: the end of the beginning?[J]. Nature Reviews Molecular Cell Biology, 2001, 2(4): 307-314.
Harmon A C, Gribskov M, Harper J F. CDPKs–a kinase for every Ca2+ signal?[J]. Trends in plant science, 2000, 5(4): 154-159.
Harper J F, Breton G, Harmon A. Decoding Ca2+ signals through plant protein kinases[J]. Annu. Rev. Plant Biol., 2004, 55: 263-288.
Kudla J, Becker D, Grill E, et al. Advances and current challenges in calcium signaling[J]. New Phytologist, 2018, 218(2): 414-431.
Kudla J, Xu Q, Harter K, et al. Genes for calcineurin B-like proteins in Arabidopsis are differentially regulated by stress signals[J]. Proceedings of the National Academy of Sciences, 1999, 96(8): 4718-4723.
Luan S, Kudla J, Rodriguez-Concepcion M, et al. Calmodulins and calcineurin B–like proteins: Calcium sensors for specific signal response coupling in plants[J]. The Plant Cell, 2002, 14(suppl_1): S389-S400.
Luan S. The CBL–CIPK network in plant calcium signaling[J]. Trends in plant science, 2009, 14(1): 37-42.
McCormack E, Tsai Y C, Braam J. Handling calcium signaling: arabidopsis CaMs and CMLs[J]. Trends in plant science, 2005, 10(8): 383-389.
Rudd J J, Franklin-Tong V E. Calcium signaling in plants[J]. Cellular and Molecular Life Sciences CMLS, 1999, 55: 214-232.
Sanders D, Pelloux J, Brownlee C, et al. Calcium at the crossroads of signaling[J]. The Plant Cell, 2002, 14(suppl_1): S401-S417.
Santella L, Carafoli E. Calcium signaling in the cell nucleus[J]. The FASEB Journal, 1997, 11(13): 1091-1109.
Shi J, Kim K N, Ritz O, et al. Novel protein kinases associated with calcineurin B–like calcium sensors in Arabidopsis[J]. The Plant Cell, 1999, 11(12): 2393-2405.
Tang R J, Luan S. Regulation of calcium and magnesium homeostasis in plants: from transporters to signaling network[J]. Current Opinion in Plant Biology, 2017, 39: 97-105.
Tang R J, Wang C, Li K, et al. The CBL–CIPK calcium signaling network: Unified paradigm from 20 years of discoveries[J]. Trends in Plant Science, 2020, 25(6): 604-617.
Trewavas A. How plants learn[J]. Proceedings of the National Academy of Sciences, 1999, 96(8): 4216-4218.
White P J. Calcium channels in the plasma membrane of root cells[J]. Annals of Botany, 1998, 81(2): 173-183.
White P J. Characterization of a voltage-dependent cation-channel from the plasma membrane of rye (Secale cereale L.) roots in planar lipid bilayers[J]. Planta, 1994, 193(2): 186-193.
Zielinski R E. Calmodulin and calmodulin-binding proteins in plants[J]. Annual review of plant biology, 1998, 49(1): 697-725.