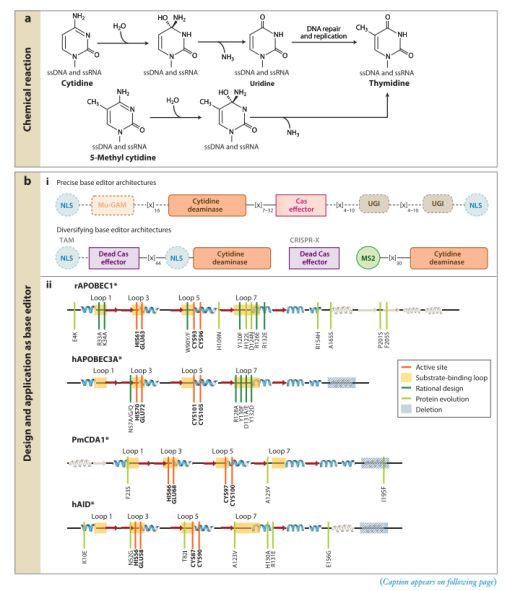
DNA和RNA中碱基的脱氨作用是由胞嘧啶脱氨基酶(CDA)超家族中的酶催化的。这些酶尽管整体结构相似,但该超家族的成员可以靶向单链DNA(ssDNA)、单链RNA(ssRNA)、双链RNA(dsRNA)、核苷酸、核苷或游离的嘌呤或嘧啶进行作用。
胞嘧啶脱氨基酶能够将单链DNA或单链RNA中的胞嘧啶催化脱氨基转化为尿嘧啶(图2)。尿嘧啶具有胸腺嘧啶的特性,因此DNA中的胞嘧啶脱氨基会导致C·G→T·A点突变,而RNA中的胞嘧啶脱氨基则直接重新编码转录本。Komor等人将小鼠rAPOBEC脱氨酶和Cas9蛋白融合,形成了第一个胞嘧啶碱基编辑器(CBE,cytidine base editor)。除了APOBECs家族的脱氨酶用于CBE,Nishida等人使用来自海丝鳠的PmCDA1,成功将CBE的编辑窗口拓宽至10nt。与APOBEC家族中的同源物不同,人类AID(hAID)酶只能编辑ssDNA,尽管它可以与RNA和DNA结合。此外,它表现出对靶胞嘧啶上游两个碱基的强烈偏好性,即偏好于5′-WRC-3′基序(W=dA或dT和R=dA或dG)。
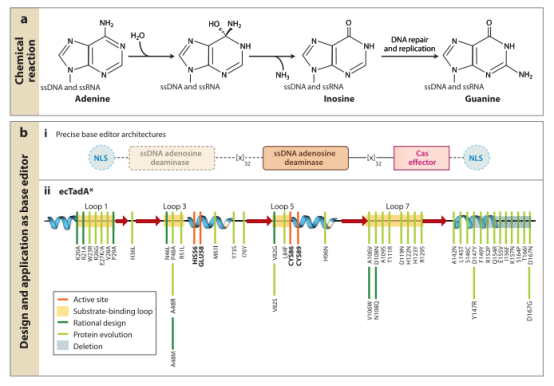
Tad/ADAT2、ADAR和ADAT1酶与APOBEC/AID家族有一定的亲缘关系,它们都属于脱氨酶超家族(deaminase superfamily),且具有类似的结构和催化机制。Tad/ADAT2、ADAR催化腺嘌呤脱氨基为次黄嘌呤,次黄嘌呤在DNA的修复和复制过程中被读为鸟嘌呤,从而完成A·T→G·C的点突变。然而,与APOBEC/AID酶不同,这些现存的腺嘌呤脱氨酶都只作用于ssRNA(主要是转移RNA(tRNA)内的环区)或dsRNA。将这些天然存在的脱氨酶与Cas9融合后没有检测到A·T→ G·C的编辑活性。因此,Gaudelli等人采用定向进化来产生ssDNA特异性腺嘌呤脱氨酶。从tRNA腺苷脱氨酶ecTadA开始,经过七轮定向进化后确定了14个氨基酸突变,最终将这种tRNA腺苷脱氨酶转化为可以高效得作用于ssDNA的腺嘌呤碱基编辑器(ABE,adenine base editor)。CBE和ABE7.10结构之间的一个重要区别是ABE7.10包含两个拷贝的TadA,一个野生型ecTadA亚基和一个进化的TadA(TadA*)亚基。因此,ABE7.10的最终构建是TadA–TadA*–Cas9n。后来发现野生型TadA亚基对于有效的编辑活性来说是不必要的,因为它的去除对编辑活性的影响很小。事实上,去除野生型TadA亚基是有益的,因为它降低了ABE7.10固有的残余RNA编辑活性,从而可以降级ABE7.10的RNA脱靶活性。
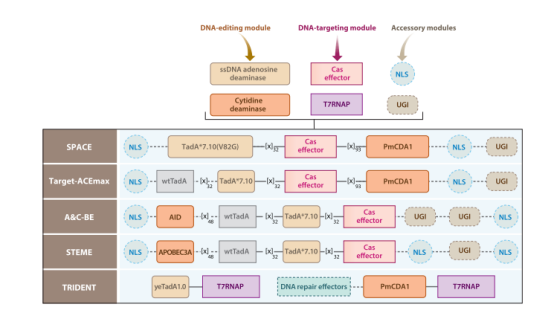
2020年,华东师范大学的李大力、日本东京大学Nozomu Yachie实验室以及美国麻省总医院Keith Joung实验室等几个课题组发表了一种全新的双碱基编辑器。他们将人类胞嘧啶脱氨酶、腺嘌呤脱氨酶和nCas9融合在一起,开发了腺嘌呤和胞嘧啶的双碱基编辑器,它可以在同一等位基因的靶序列上实现C→T和A→G的高效转换。
除了核DNA外,细胞中还含有线粒体DNA(mtDNA),这是一种多拷贝的环状dsDNA,编码呼吸链的13种必需蛋白,以及在线粒体内转录这些必需蛋白所需的tRNA和核糖体RNA。线粒体DNA的异常,就像细胞核DNA一样,与许多可遗传的疾病有关。然而,与核DNA编辑技术不同的是,精确有效的mtDNA编辑直到最近才可以实现。基于CRISPR的基因组编辑尚未被应用于线粒体DNA编辑,因为尚未实现可靠的核酸(如sgRNA)靶向递送到线粒体。由于蛋白质向线粒体的递送可以使用线粒体靶向信号(MTS)来实现,因此mtDNA编辑已经使用仅蛋白质的DNA结合模式来实现,如转录激活子样效应核酸酶(TALENs)和锌指核酸酶(ZFNs)。因此,使用线粒体靶向的TALEN和ZFN(称为mitotaLEN和mitoZFN)将DSBs引入mtDNA导致大序列缺失是以前唯一可行的mtDNA修饰方法。
表观遗传学调控通过抑制或增强基因表达水平而不改变遗传密码的初级序列,为潜在的基因组信息提供了第二层控制。多种基于CRISPR的靶向表观遗传调节剂早于碱基编辑器出现,包括使用CRISPRi的基因抑制,CRISPRa的转录激活。通过甲基化或去甲基化对DNA碱基进行共价修饰有助于稳定和可遗传的表观遗传编辑,是DNA编辑的一种形式。表观遗传编辑中最广泛研究的是胞嘧啶(5mC)5-C位置甲基的沉积和去除。作者综述了甲基转移酶、去甲基化酶的类型,结构以及在基因编辑中的应用。
最后,作者做了总结和展望。碱基编辑目前已经成为生物技术和医学领域的宝贵工具。首先,从载体构建和设计的角度来看,碱基编辑器的组成是模块化的。在这种设计模式下,不同的模块无缝地融合在一起,协同工作。这已经通过改变DNA编辑酶模块(脱氨酶、糖苷酶、甲基转移酶和去甲基酶)和DNA靶向模块(不同的Cas效应子、TALE和ZF)的性质或通过在结构中添加辅助模块来影响DNA修复结果得到证明。此外,双脱氨酶和糖苷酶碱基编辑器证明,促进不同化学反应的两个完全不同的DNA编辑模块可以组合在一起,以实现新的编辑结果。其次,可以独立地选择、设计或重新优化单个模块,以优化整体功能。驱动碱基编辑器的DNA编辑模块工程的动机是提高其靶向编辑效率,降低其脱靶编辑活性,或调节其底物范围和特异性。虽然在这篇综述中,作者主要关注DNA编辑模块,但类似的设计原则也被扩展到设计DNA靶向模块。无论采用何种蛋白质工程方法,已鉴定的突变主要存在于与底物相互作用的结构基序上。
文章来源:植物生物技术Pbj