CRISPR 干扰 (CRISPRi) 是一种基于 CRISPR 的系统。这种编辑使核糖核蛋白 (RNP) 复合物可以定向并结合靶 DNA 并干扰 RNA 聚合酶 (RNAP) 以抑制转录起始或延伸。 与CRISPR/Cas9系统不同,CRISPRi允许通过在诱导型启动子下表达dCas9或sgRNA来降低基因表达量,从而在基因调控中表现出更大的灵活性。CRISPRi 系统可以将目标基因有效沉默数百倍。此外,多重 CRISPRi 已在各种宿主中得到实践,使用多种方法稳定表达多个sgRNA。这些同时抑制多个基因的技术已被用于执行更复杂的任务,例如减少有毒中间物质或阻断细菌发酵中的竞争途径等。然而,完全抑制基因表达并不总是代谢工程所需要的。基因表达水平应得到精确控制,以实现生长和生产途径之间的最佳酶活性,平衡细胞内前体浓度,避免有毒中间体的积累。
近日,来自韩国首尔大学的Sang Woo Seo课题组在Nucleic Acids Research上发表题为“CRISPRi-mediated tunable control of gene expression level with engineered single-guide RNA in Escherichia coli”的文章,作者开发了一个可调的CRISPRi系统,可以高精度和可预测性的调节基因表达,为优化代谢途径提供了一个有力的工具。
当dCas9-sgRNA-DNA三元复合物结合在一起时,CRISPRi系统可以抑制基因表达。 作者假设可以通过调节RNP复合物的形成将CRISPRi系统的抑制效率改变到一定水平。为了量化CRISPRi系统的抑制效率,作者设计了一个基于遗传回路(genetic circuit)的荧光报告系统,其中链球菌的dCas9由无水四环素(aTc)诱导,报告基因(mCherry)和sgRNA变体均组成型表达(图1A)。一旦将aTc添加到培养基中,dCas9–sgRNA–DNA 三元复合物就会阻断报告基因的转录,荧光水平可以指示 CRISPRi 系统的抑制效率。
作者首先研究了每个区域的sgRNA突变如何影响CRIPSRi系统的抑制作用。先前的一项研究报告称,茎环1(sg_mut01和sg_mut02)中的突变导致Cas9核酸酶活性显着降低,而茎环2(sg_mut03)或茎环3(sg_mut04)中的突变不影响其核酸酶活性。 然而,在 CRISPRi 系统中,与野生型 sgRNA(sg_WT)相比,所有五种sgRNA变体对抑制效率的影响很小,与没有间隔区域的阳性对照(sg_PC)相比,每个变体显示出2%到4%的荧光水平(图1B)。 这些结果表明,与 CRISPR/Cas9 系统相比,dCas9-sgRNA 复合物的形成对 CRISPRi 系统中茎环 1 区域的序列修饰不太敏感。作者假设去除与复合体稳定性相关的区域可以作为进一步控制多个级别表达。为此,作者构建了一个缺少接头、茎环 2 和茎环 3 的截短 sgRNA (sg_trcSL1)。当在 CRISPRi 系统中进行测试时,与sg_PC相比,这个有缺陷的突变体表现出8%的荧光水平,这表明它仍然可以与 dCas9 结合并在一定水平上抑制感兴趣的基因,即使三元复合物稳定性降低(图1B)。该结果支持以下观察结果,即sg_trcSL1在 CRISPR/Cas9系统中表现出核酸酶活性的显着降低,而且仅轻微影响 CRISPRi 系统中的结合亲和力。
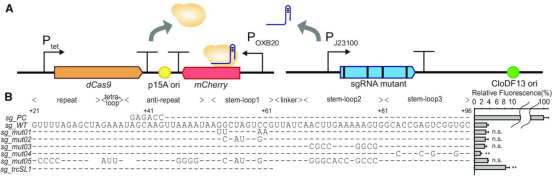 图1:系统构建及sgRNA突变对抑制效率的影响。
接下来,作者使用sg_trcSL1作为模板构建了一个随机文库(分别为四环区域的 4 nt 和 5′ 和 3′ 侧翼区域的 4 nt),进一步降低了sgRNA和dCas9之间的复合物形成效率(图2A)。作者应用两步策略来获得各种sgRNA突变体,涵盖sg_WT(完全抑制状态)和sg_PC(非抑制状态)之间所有的抑制效率。作者将原始文库分成具有不同荧光强度范围的较小文库,然后从较小文库中单独识别每个 sgRNA 变体的荧光。通过流式细胞术获得的原始库的荧光分布与 sg_PC 的荧光分布几乎相同(图 2B)。在三个连续的排序步骤之后,与 sg_PC 相比,每个库(高、中和低)分别具有 63%、24% 和 14% 的中值荧光水平(图 2B)。从这些较小的文库中分离出82个菌落,荧光水平在8%到104%之间(图 2C)。 这些结果表明,突变的四环及其 sgRNA 的侧翼区域可以调节dCas9和sgRNA之间的结合亲和力,以实现各种抑制效率。
图1:系统构建及sgRNA突变对抑制效率的影响。
接下来,作者使用sg_trcSL1作为模板构建了一个随机文库(分别为四环区域的 4 nt 和 5′ 和 3′ 侧翼区域的 4 nt),进一步降低了sgRNA和dCas9之间的复合物形成效率(图2A)。作者应用两步策略来获得各种sgRNA突变体,涵盖sg_WT(完全抑制状态)和sg_PC(非抑制状态)之间所有的抑制效率。作者将原始文库分成具有不同荧光强度范围的较小文库,然后从较小文库中单独识别每个 sgRNA 变体的荧光。通过流式细胞术获得的原始库的荧光分布与 sg_PC 的荧光分布几乎相同(图 2B)。在三个连续的排序步骤之后,与 sg_PC 相比,每个库(高、中和低)分别具有 63%、24% 和 14% 的中值荧光水平(图 2B)。从这些较小的文库中分离出82个菌落,荧光水平在8%到104%之间(图 2C)。 这些结果表明,突变的四环及其 sgRNA 的侧翼区域可以调节dCas9和sgRNA之间的结合亲和力,以实现各种抑制效率。
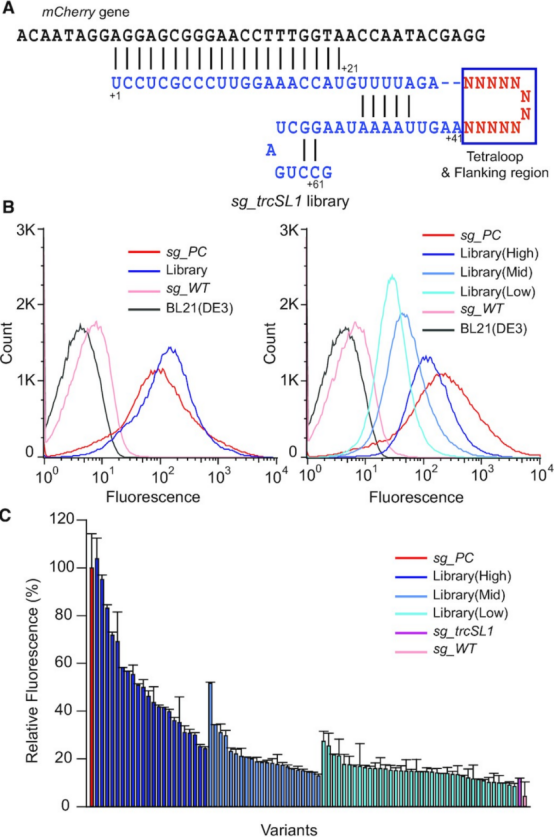
图2:sgRNA库的结构和库的筛选。
由于调节 dCas9或sgRNA 的数量可能会改变CRISPRi系统的抑制效率,因此作者检查了dCas9和sgRNA数量对抑制效率的影响。作者通过使用十个sgRNA突变体 (sg_trcSL1c1到sg_trcSL1c10) 改变 dCas9 和 sgRNA 的数量来测试系统在不同条件下的性能。当表达不同数量的 dCas9 时,抑制效率略有变化(图3A)。作者将诱导剂浓度设置为 500 ng/ml,以充分供应 dCas9 用于进一步的应用,例如多基因调控。 作者的可调 CRISPRi 系统允许通过sgRNA变体精确调节抑制效率。通过这种方法,可以同时靶向具有不同抑制水平的多个基因。
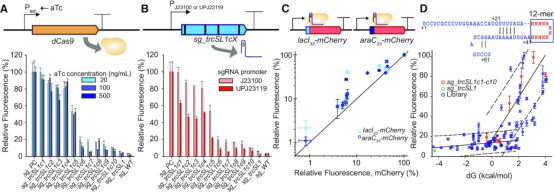 图3:可调节的CRISPRi系统特性。
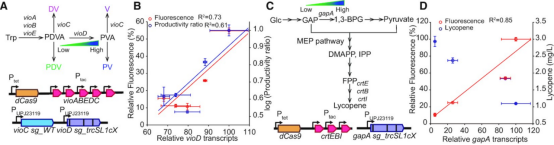
重新分配代谢通量是代谢工程中最大化目标产物产量的重要过程。作者的系统可以精确控制基因表达,所以作者选择紫罗兰素生物合成途径作为途径再分配的模型系统。紫色素是一种呈深紫色的吲哚衍生物化合物,最初由紫色色杆菌产生(图4A)。该化合物由 l-色氨酸通过 vioA、vioB、vioE、vioD和vioC 编码的五种酶合成。除了紫罗兰素,还可以生产其他吲哚衍生物,如紫罗兰素原、脱氧紫罗兰素和不同颜色的脱氧紫罗兰素原(图4A)。 作者在IPTG诱导型启动子下表达了紫罗兰素生物合成途径,并且设计了不同的 sg_trcSL1 变体来靶向vioD以重定向通量。它可以在转录水平上有效地调节 vioD 的表达(图4B)。 vioC 被 sg_WT 抑制并显示出高变异,但从标准曲线计算时,与其他基因相比,绝对拷贝数保持在较低水平(> 100 倍)。 相反,紫罗兰素途径中其他不受调节的酶(vioA、vioB 和 vioE)的表达保持不变。这些结果表明作者的系统可以特异性地靶向和调节单个基因的表达,而不影响通路中的其他基因。先前的研究表明,可以通过紫罗兰素生物合成途径中涉及的每个基因的启动子强度的线性组合来预测任意单位中每种产物的产量。这种对数线性回归模型在作者的系统中也有效,增加的vioD转录本与增加的PV产量相关(图4B)。
番茄红素是一种高价值的类胡萝卜素,具有强大的抗氧化特性,在各个行业都有不同的应用,它是由FPP通过来自 crtE、crtB 和 crtI 的一系列酶促反应合成的(图4C)。GAP前体不仅对 MEP途径而且对糖酵解途径都是必需的。研究表明可通过增加 GAP 库来增强番茄红素的产量。因此,作者针对gapA使用了五个系统,包括三个显示不同抑制效率的 sg_trcSL1系统(sg_trcSL1c2、sg_trcSL1c5 和 sg_trcSL1c6)、sg_PC 和 sg_WT。 然而,gapA 是一种无法完全敲除的必需基因。使用 sg_WT 的传统 CRISPRi 抑制 gapA是不成功的。 另一方面,使用可调节的 CRISPRi 系统实现了gapA基因表达的多级抑制而没有生长缺陷,并且与培养15小时后完全表达gapA基因的菌株相比,sg_trcSL1c6 的番茄红素产量增加了 2.7 倍(图4D)。总的来说,这些结果表明可调节CRISPRi 可以在多个水平上精确抑制基因表达。
图4:可调节CRISPRi系统在紫罗兰素生物合成途径中的应用。
总的来说,作者设计了一个可调节的 CRISPRi 系统,可以精确控制所需水平的基因表达。作者成功地应用该系统来重定向紫罗兰素生物合成途径中感兴趣的代谢通量,从而以可预测的比例生产吲哚衍生物。此外,研究表明,使用可调节的CRISPRi 可使番茄红素产量增加 2.7 倍,突显了作者的系统在提高其他有价值化合物产量方面的多功能性。
图3:可调节的CRISPRi系统特性。
重新分配代谢通量是代谢工程中最大化目标产物产量的重要过程。作者的系统可以精确控制基因表达,所以作者选择紫罗兰素生物合成途径作为途径再分配的模型系统。紫色素是一种呈深紫色的吲哚衍生物化合物,最初由紫色色杆菌产生(图4A)。该化合物由 l-色氨酸通过 vioA、vioB、vioE、vioD和vioC 编码的五种酶合成。除了紫罗兰素,还可以生产其他吲哚衍生物,如紫罗兰素原、脱氧紫罗兰素和不同颜色的脱氧紫罗兰素原(图4A)。 作者在IPTG诱导型启动子下表达了紫罗兰素生物合成途径,并且设计了不同的 sg_trcSL1 变体来靶向vioD以重定向通量。它可以在转录水平上有效地调节 vioD 的表达(图4B)。 vioC 被 sg_WT 抑制并显示出高变异,但从标准曲线计算时,与其他基因相比,绝对拷贝数保持在较低水平(> 100 倍)。 相反,紫罗兰素途径中其他不受调节的酶(vioA、vioB 和 vioE)的表达保持不变。这些结果表明作者的系统可以特异性地靶向和调节单个基因的表达,而不影响通路中的其他基因。先前的研究表明,可以通过紫罗兰素生物合成途径中涉及的每个基因的启动子强度的线性组合来预测任意单位中每种产物的产量。这种对数线性回归模型在作者的系统中也有效,增加的vioD转录本与增加的PV产量相关(图4B)。
番茄红素是一种高价值的类胡萝卜素,具有强大的抗氧化特性,在各个行业都有不同的应用,它是由FPP通过来自 crtE、crtB 和 crtI 的一系列酶促反应合成的(图4C)。GAP前体不仅对 MEP途径而且对糖酵解途径都是必需的。研究表明可通过增加 GAP 库来增强番茄红素的产量。因此,作者针对gapA使用了五个系统,包括三个显示不同抑制效率的 sg_trcSL1系统(sg_trcSL1c2、sg_trcSL1c5 和 sg_trcSL1c6)、sg_PC 和 sg_WT。 然而,gapA 是一种无法完全敲除的必需基因。使用 sg_WT 的传统 CRISPRi 抑制 gapA是不成功的。 另一方面,使用可调节的 CRISPRi 系统实现了gapA基因表达的多级抑制而没有生长缺陷,并且与培养15小时后完全表达gapA基因的菌株相比,sg_trcSL1c6 的番茄红素产量增加了 2.7 倍(图4D)。总的来说,这些结果表明可调节CRISPRi 可以在多个水平上精确抑制基因表达。
图4:可调节CRISPRi系统在紫罗兰素生物合成途径中的应用。
总的来说,作者设计了一个可调节的 CRISPRi 系统,可以精确控制所需水平的基因表达。作者成功地应用该系统来重定向紫罗兰素生物合成途径中感兴趣的代谢通量,从而以可预测的比例生产吲哚衍生物。此外,研究表明,使用可调节的CRISPRi 可使番茄红素产量增加 2.7 倍,突显了作者的系统在提高其他有价值化合物产量方面的多功能性。