CRISPR-Cas9引入了靶向DNA断裂,参与竞争的DNA修复途径,会产生一系列不精确的插入/删除突变(indels)或精确的模板突变。而这些修复发生的相对频率主要取决于基因组序列和细胞状态背景,限制了对突变结果的精确控制。为了控制特定修复途径的相对频率,尤其是HDR或MMEJ的编辑频率,理解修复途径之间竞争的基础是什么,并相应地设计策略来重定向DNA修复是相当重要的。
近日,Vikash P. Chauhan等在国际知名期刊PNAS上在线发表题为“Altered DNA repair pathway engagement by engineered CRISPR-Cas9 nucleases”的研究论文。该研究设计了一个Cas9变体( vCas9 )来抑制非同源末端连接( NHEJ )修复,促进微同源介导的末端连接(MMEJ)和精确的同源定向修复(HDR)。另外vCas9也可以在分裂和非分裂细胞中实现高效精确的模板突变。
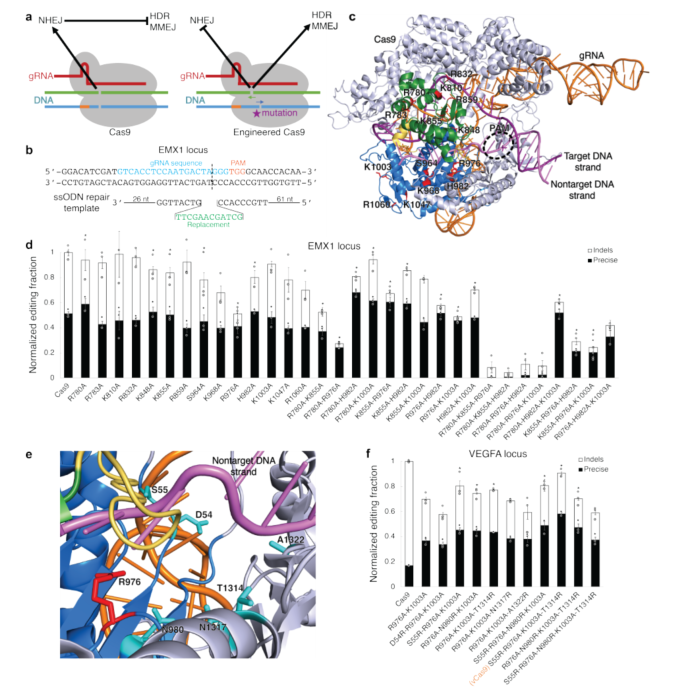
 首先该研究发现,精确编辑淘汰indel的程度与indel大小密切相关,通过不同途径生成的indel与精确编辑的竞争方式也存在差异。MMEJ删除比NHEJ删除可以更有效地被精确编辑淘汰,而NHEJ插入没有显著影响。由于Cas9生产的大多数indel是基于NHEJ产生的小型indel,这是HDR精确编辑的主要竞争来源。
随后该研究提出假设:通过提升MMEJ而不是NHEJ来产生更大indel的Cas9变种也将使HDR模板利用率更高。通过探索在DNA底物界面突变的Cas9残基是否会改变Cas9参与的不同修复途径的相对频率,该研究从中发现了一种变体,R976A- K1003A,可最有效地提高精确编辑频率,同时降低indel频率,但总编辑活动都低于野生型Cas9。为了解决这一问题,该研究对R976A-K1003A变种中的6个残基进行突变,产生了一系列三重、四重和五重突变体,其中一种变种,S55R-R976A-K1003A-T1314R,编辑活动接近野生型Cas9。重要的是,与野生型Cas9相比,该变种没有增加非特异性基因组活性,但出人意料地提高了靶上和脱靶编辑特异性,命名为vCas9(图1)。
图1.设计具有改变修复通路频率的Cas9变体。
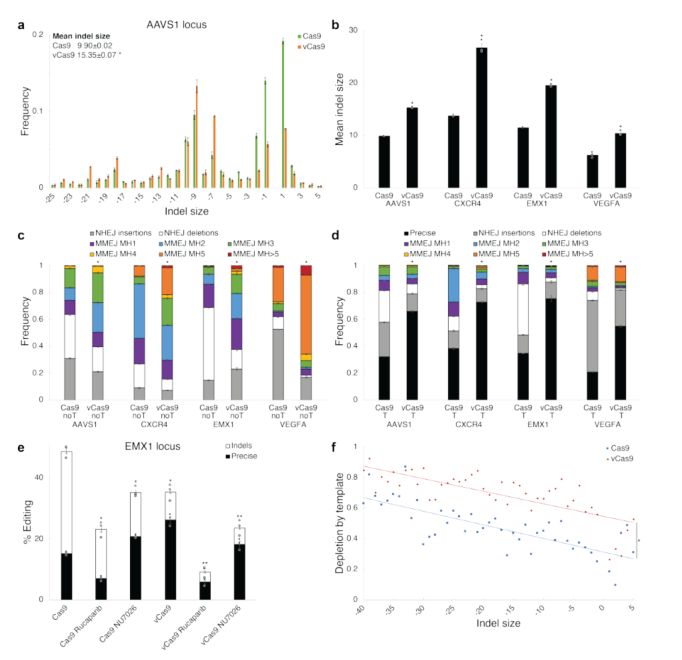
为了阐明上述变体改变DNA修复途径频率的机制,该研究研究了丙氨酸替代筛选中每个工程Cas9变体的编辑结果,发现vCas9利用更大的微同源性将indels从NHEJ修复转移到MMEJ修复,在HDR模板存在的情况下,vCas9始终以HDR为主,剩余的小修复结果主要由NHEJ插入和MMEJ缺失组成(图2)。
图2.vCas9抑制NHEJ,使MMEJ或HDR主导修复结果。
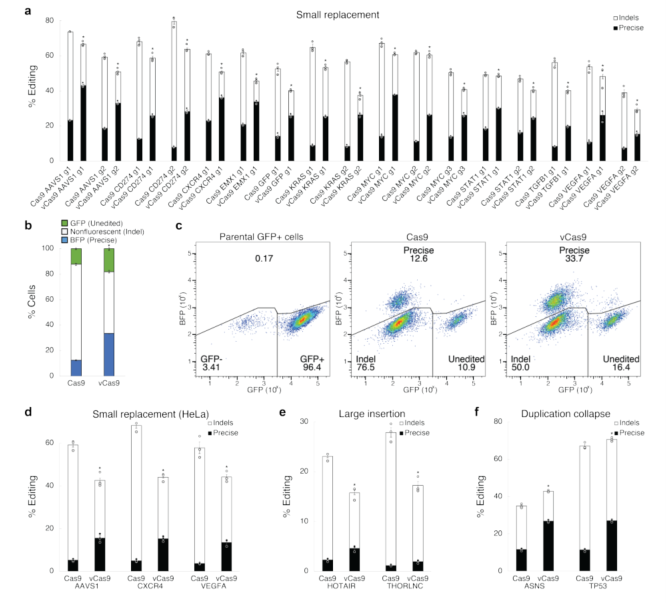
接下来,研究探讨了在不同的编辑环境下,vCas9对DNA修复途径频率的稳定性,发现vCas9稳定地抑制了indels,并促进了不同位点、细胞和编辑类型的精确编辑(图3)。
图3.vCas9增强了精确的编辑,并在不同的编辑条件下抑制indels
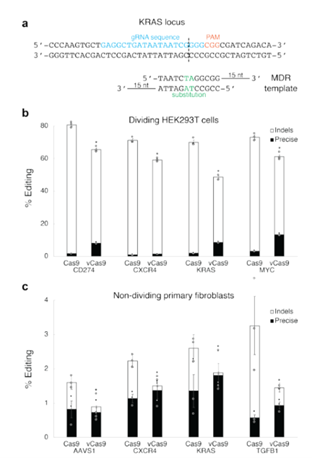
CRISPR技术用于精确编辑以生成遗传模型或治疗某些疾病的一个主要限制是在非分裂细胞中缺乏HDR。为了解决这个问题,该研究利用vCas9开发了MMEJ驱动的模板策略在非分裂细胞中产生精确的编辑,这种方法被称为微同源性定向重组(microhomology-directed recombination, MDR),利用了部分双链DNA模板,单链微同源臂与DSB末端的序列互补。这是针对特定突变应用定制的靶向核酸酶的新典范(图4)。
图4.vCas9可以通过MMEJ在分裂和非分裂细胞中进行高效的精确编辑。
首先该研究发现,精确编辑淘汰indel的程度与indel大小密切相关,通过不同途径生成的indel与精确编辑的竞争方式也存在差异。MMEJ删除比NHEJ删除可以更有效地被精确编辑淘汰,而NHEJ插入没有显著影响。由于Cas9生产的大多数indel是基于NHEJ产生的小型indel,这是HDR精确编辑的主要竞争来源。
随后该研究提出假设:通过提升MMEJ而不是NHEJ来产生更大indel的Cas9变种也将使HDR模板利用率更高。通过探索在DNA底物界面突变的Cas9残基是否会改变Cas9参与的不同修复途径的相对频率,该研究从中发现了一种变体,R976A- K1003A,可最有效地提高精确编辑频率,同时降低indel频率,但总编辑活动都低于野生型Cas9。为了解决这一问题,该研究对R976A-K1003A变种中的6个残基进行突变,产生了一系列三重、四重和五重突变体,其中一种变种,S55R-R976A-K1003A-T1314R,编辑活动接近野生型Cas9。重要的是,与野生型Cas9相比,该变种没有增加非特异性基因组活性,但出人意料地提高了靶上和脱靶编辑特异性,命名为vCas9(图1)。
图1.设计具有改变修复通路频率的Cas9变体。
为了阐明上述变体改变DNA修复途径频率的机制,该研究研究了丙氨酸替代筛选中每个工程Cas9变体的编辑结果,发现vCas9利用更大的微同源性将indels从NHEJ修复转移到MMEJ修复,在HDR模板存在的情况下,vCas9始终以HDR为主,剩余的小修复结果主要由NHEJ插入和MMEJ缺失组成(图2)。
图2.vCas9抑制NHEJ,使MMEJ或HDR主导修复结果。
接下来,研究探讨了在不同的编辑环境下,vCas9对DNA修复途径频率的稳定性,发现vCas9稳定地抑制了indels,并促进了不同位点、细胞和编辑类型的精确编辑(图3)。
图3.vCas9增强了精确的编辑,并在不同的编辑条件下抑制indels
CRISPR技术用于精确编辑以生成遗传模型或治疗某些疾病的一个主要限制是在非分裂细胞中缺乏HDR。为了解决这个问题,该研究利用vCas9开发了MMEJ驱动的模板策略在非分裂细胞中产生精确的编辑,这种方法被称为微同源性定向重组(microhomology-directed recombination, MDR),利用了部分双链DNA模板,单链微同源臂与DSB末端的序列互补。这是针对特定突变应用定制的靶向核酸酶的新典范(图4)。
图4.vCas9可以通过MMEJ在分裂和非分裂细胞中进行高效的精确编辑。