伯小远去年在“袁隆平爷爷心系的‘一系法’,能否实现?”这篇文章中,介绍了“无融合生殖”的概念、实现的路径以及研究进展,最近,这个领域又有了新进展,下面就和伯小远一起来了解一下吧。
首先,咱们先来回顾一下概念,无融合生殖(Apomixis),是一种无性生殖方式,其后代不需要经过有性生殖而是直接由母本产生,后代会与母本具有相同的遗传物质,能够继承母本的优良性状并稳定遗传。无融合生殖广泛存在于460科开花植物的至少78个科中 (Xiong et al., 2023),例如禾本科、菊科、芸香科、蔷薇科、野牡丹科、毛茛科等 (Fei et al., 2019)。
无融合生殖的发育过程又是怎样的呢,和有性生殖中的双受精有什么不同?
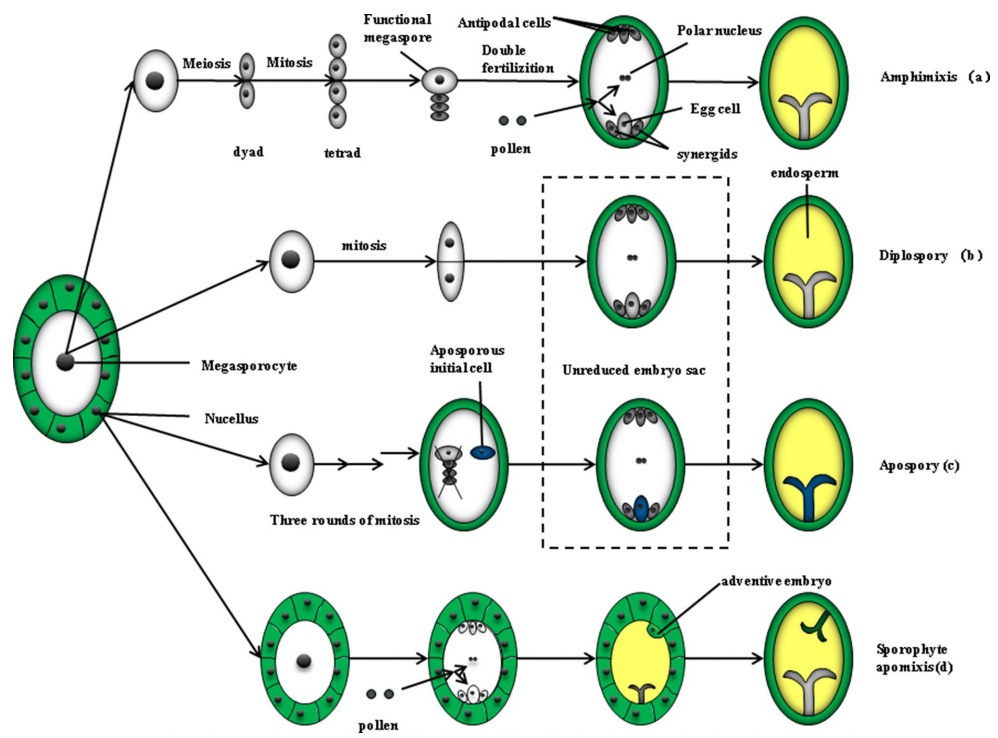
这个问题我们可以从它的分类来了解。根据胚胎发育的来源即它是通过配子体(胚囊)还是直接从胚珠内的二倍体体细胞(孢子体)发育而来,可以将无融合生殖分为配子体无融合生殖和孢子体无融合生殖(图1)。这部分知识比较难理解,大家了解即可,不影响理解后面的研究进展喔。
图1 有性生殖、无融合生殖的胚胎发育过程(Fei et al., 2019)。(a)有性生殖过程,即双受精过程,大孢子母细胞经过有丝分裂形成一个含有8个核的胚囊,然后在双受精后形成胚胎;(b)配子体无融合生殖中的二倍体孢子生殖,大孢子母细胞进行有丝分裂形成未减数的胚囊,无融合生殖起始细胞起源于大孢子母细胞所在位置,最终发育成胚胎;(c)配子体无融合生殖中的无孢子生殖,靠近大孢子母细胞的无孢子初始细胞,形成未减数的囊胚,经过三轮有丝分裂,最终发育成胚胎;(d)孢子体无融合生殖,无融合生殖的起始细胞来源于胚珠,胚珠迅速分裂然后侵入胚囊,产生单个胚甚至多胚,孢子体无性生殖可与有性生殖共存。
配子体无融合生殖指胚胎在未经减数分裂产生的胚囊内形成,根据胚囊的来源又可以分为二倍体孢子生殖和无孢子体无融合生殖。二倍体孢子生殖是由大孢子母细胞经有丝分裂形成胚囊,由二倍体的卵细胞直接发育成胚胎。无孢子体无融合生殖是由胚珠中的体细胞经过有丝分裂形成胚囊,由胚囊内的无孢子生殖初始细胞分化形成胚胎。在菊科、蔷薇科和禾本科中常见。
孢子体无融合生殖是胚珠中的生殖细胞经过减数分裂和有丝分裂形成胚囊,再由珠被或珠心的体细胞分化形成不定胚。在柑橘属、芒果属、苹果属中常见。
无融合生殖虽然广泛存在于自然界中,但主要的农作物中不存在天然的无融合生殖现象。国内外学者对无融合生殖现象涉及的基因、机制和胚胎发育等进行了深入研究,涉及到例如高粱、蒲公英、柑橘、苹果、甜菜、花椒等物种,早期培育无融合生殖材料的主要方式是将无融合生殖的关键基因导入到目标物种中,但在主要作物中一直未能成功导入。
对于拥有子代杂种优势的作物来说,无融合生殖可以固定杂种优势,相当于在生产时直接制造出克隆种子,可以免去杂交制种的繁琐步骤。这个设想在上世纪30年代就已经被提出,被誉为农业上的一大圣杯,然而,受限于技术的原因,直到最近十几年,这个领域才开始涌现出重要的研究成果。
那么,如果我们想通过无融合生殖技术来进行杂种一代制种,到底如何实现呢?
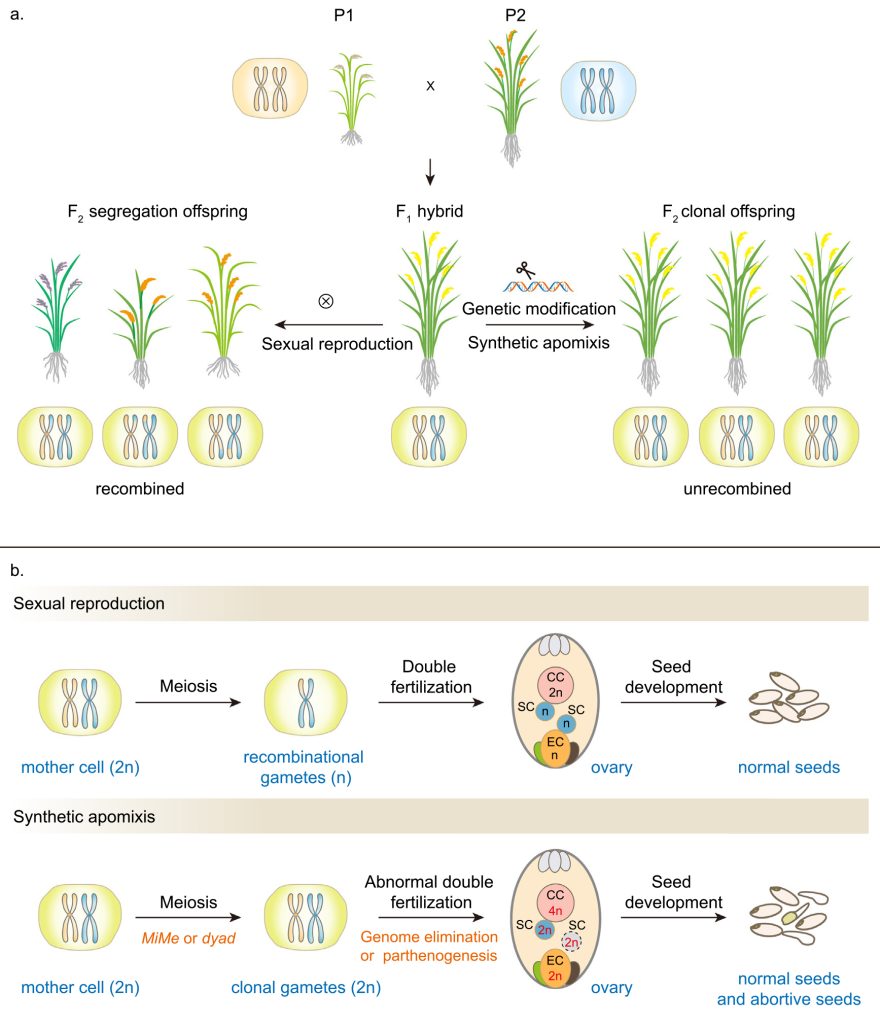
目前在作物中实现的工程化无融合生殖的路径可归类于将有性生殖转变为配子体无融合生殖过程:抑制大孢子母细胞减数分裂,诱导有丝分裂,通过调节基因诱导大孢子母细胞发育成二倍体孢子,从而绕过授粉并启动具有与母体相同基因组成的胚胎的直接发育(图2)。
下面,我们来具体看看进展吧。
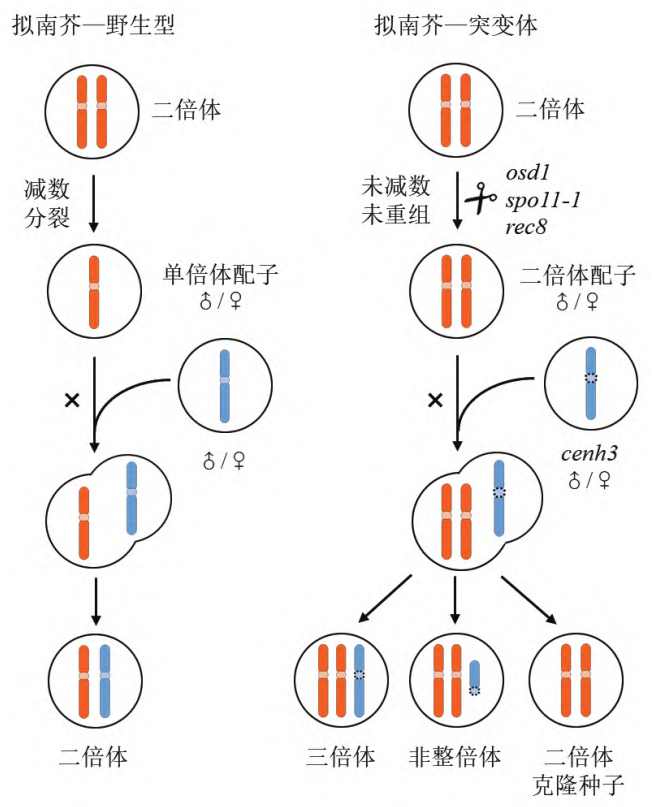
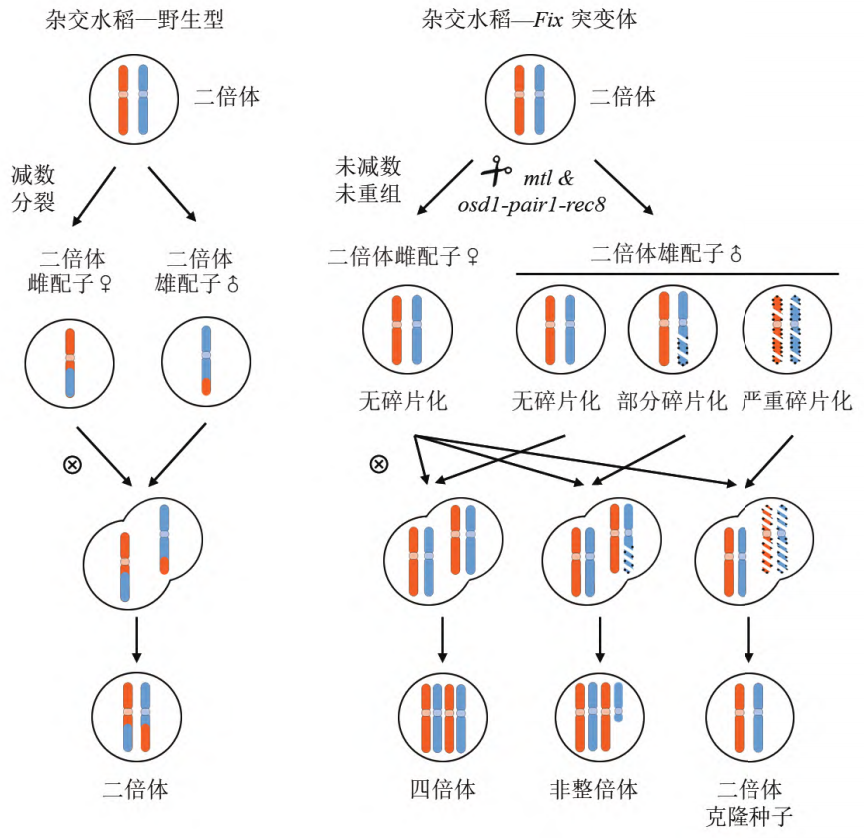
后来,在水稻中通过杂交的方式获得了OSD1、REC8、PAIR1三基因突变体材料OsMiMe,其也可以产生二倍体克隆配子 (Mieulet et al., 2016)。
但MiMe材料也存在一个问题,其双受精过程未受影响,因此其子代每繁殖一代就会增加一倍的染色体数量。
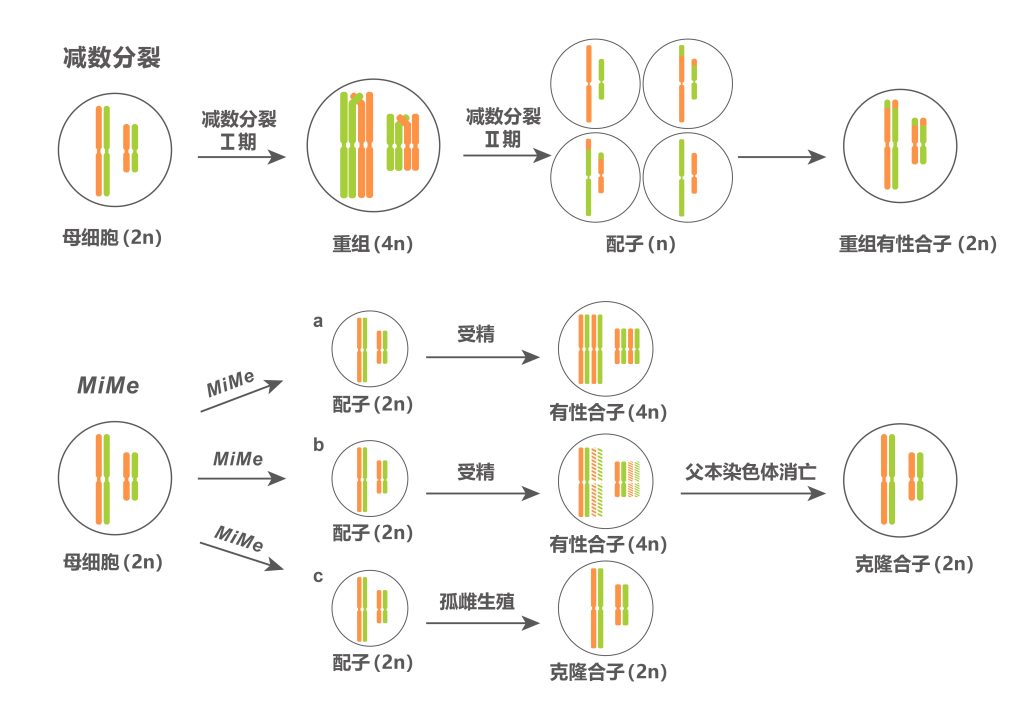
因此,如何让有丝分裂与后续发育过程配合默契,生产出染色体不再加倍的子代呢?目前有两种方式,一种是,让亲本一方的染色体在杂交之后消亡,这样就能使后代染色体不再加倍了;另一种是,由二倍体配子独自激活胚胎发育即孤雌生殖过程(图3)。
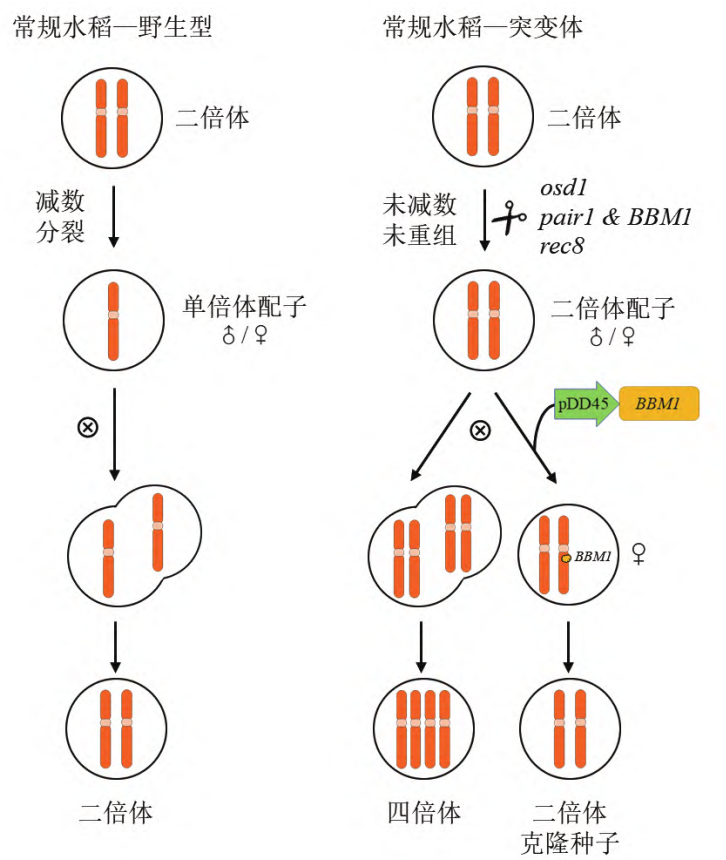
2019年,Venkatesan Sundaresan和Raphael Mercier团队在Nature杂志上发表了题为“A male-expressed rice embryogenic trigger redirected for asexual propagation through seeds”的文章,该团队发现,异位表达BBM1基因并且敲除MiMe相关的三个基因得到的材料可以诱导产生克隆种子(图6) (Khanday et al., 2019)。
BBM(BABY BOOM)基因,属于AP2/ERF(APETALA 2/ETHYLENE RESPONSE FACTOR)转录因子家族,之前的研究显示在拟南芥和油菜中异位表达BBM基因可以诱导体细胞胚,在本研究中,该团队在水稻中使用拟南芥卵母细胞特异性启动子pDD45驱动BBM1基因(此材料称为BBM1-ee),可实现未受精条件下合子的发育即孤雌生殖。基于此发现,该团队将BBM1-ee材料中的REC8、PAIR1及OSD1三个基因也敲除掉,结果显示,T0株系结实率显著下降,但得到了约11%-29%的二倍体子代,其余为四倍体子代。
备注:由于拟南芥特殊的浸花转化方法,拟南芥卵母细胞特异性启动子pDD45、pEC1.2等目前也常用作拟南芥基因敲除实验中,使用它们驱动Cas9蛋白,保证Cas9蛋白只在卵母细胞和合子早期表达,避免拟南芥敲除苗产生嵌合体。
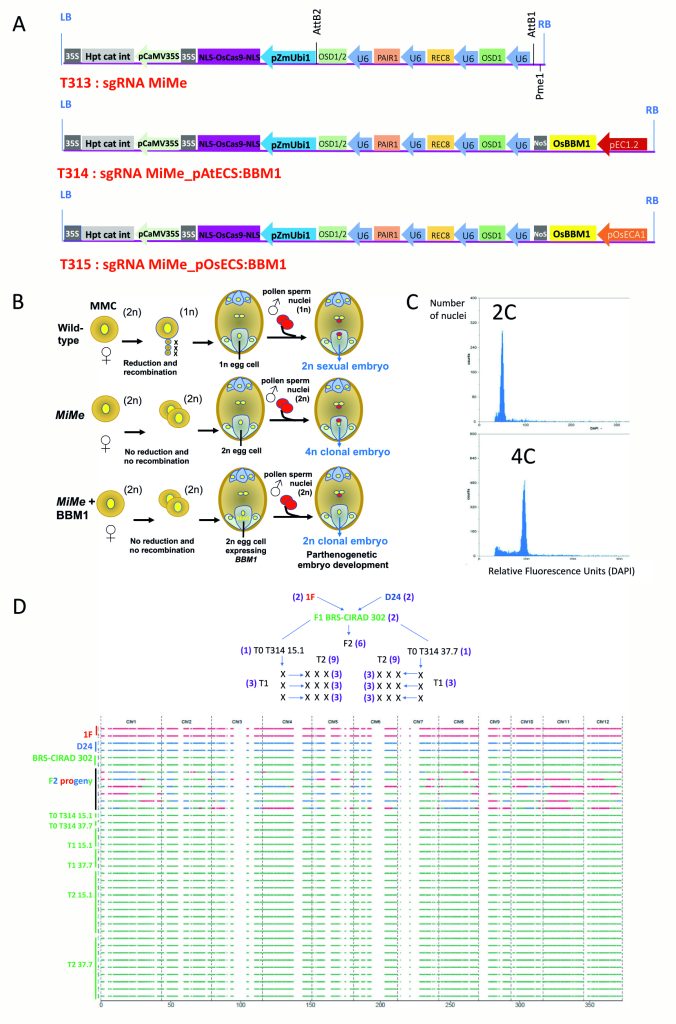
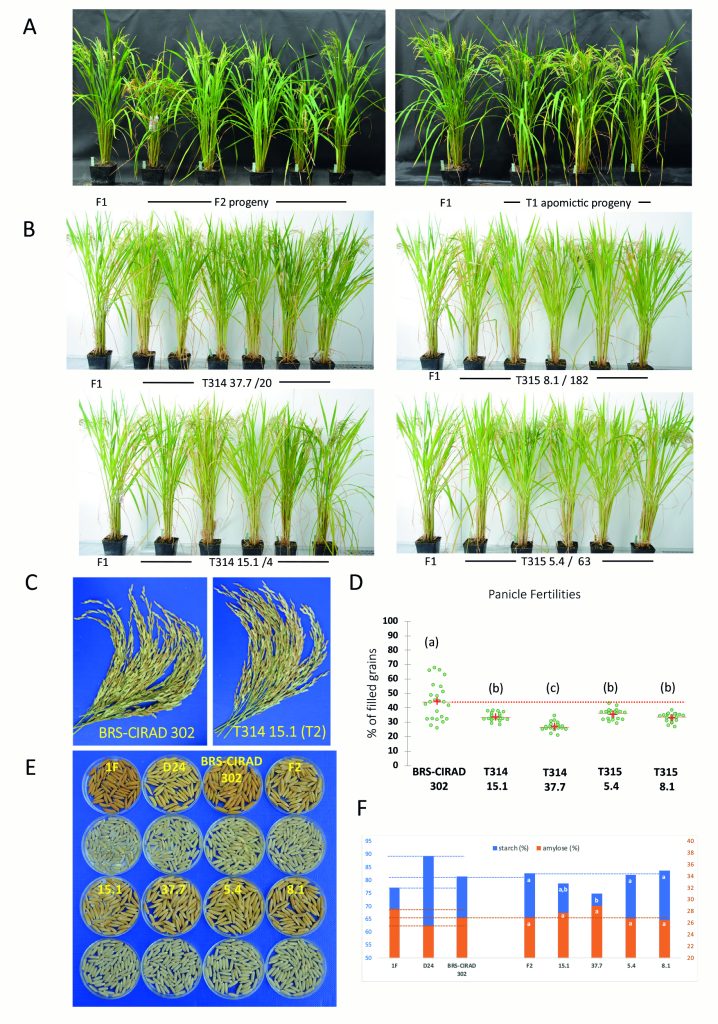
该团队选择商业F1杂交水稻BRS-CIRAD 302作为受体材料,设计了三种载体来分别进行转化:T313载体(sgMiMe)为基因敲除载体,敲除OSD1、REC8、PAIR1三个基因;T314载体(sgMiMe_pAtECS:BBM1 )除了含有敲除上述三个基因的转录单元,还另有一个使用卵母细胞特异性启动子pEC1.2驱动BBM1基因的转录单元;T315载体(sgMiMe_pOsECS:BBM1)与T314载体的区别在于驱动BBM1基因的卵母细胞特异性启动子被替换为了水稻中ECA1.1基因的启动子,而它是拟南芥EC1.2基因的同源基因(图7A)。
图7 转化T314和T315载体后,对植物倍性和基因型的检测 (Vernet et al., 2022)。(A)T313、T314、T315载体结构示意图;(B)在MiMe和MiMe+BBM1植物中形成四倍体和二倍体克隆后代的原理;(C)流式细胞仪检测倍性;(D)全基因组测序鉴定。
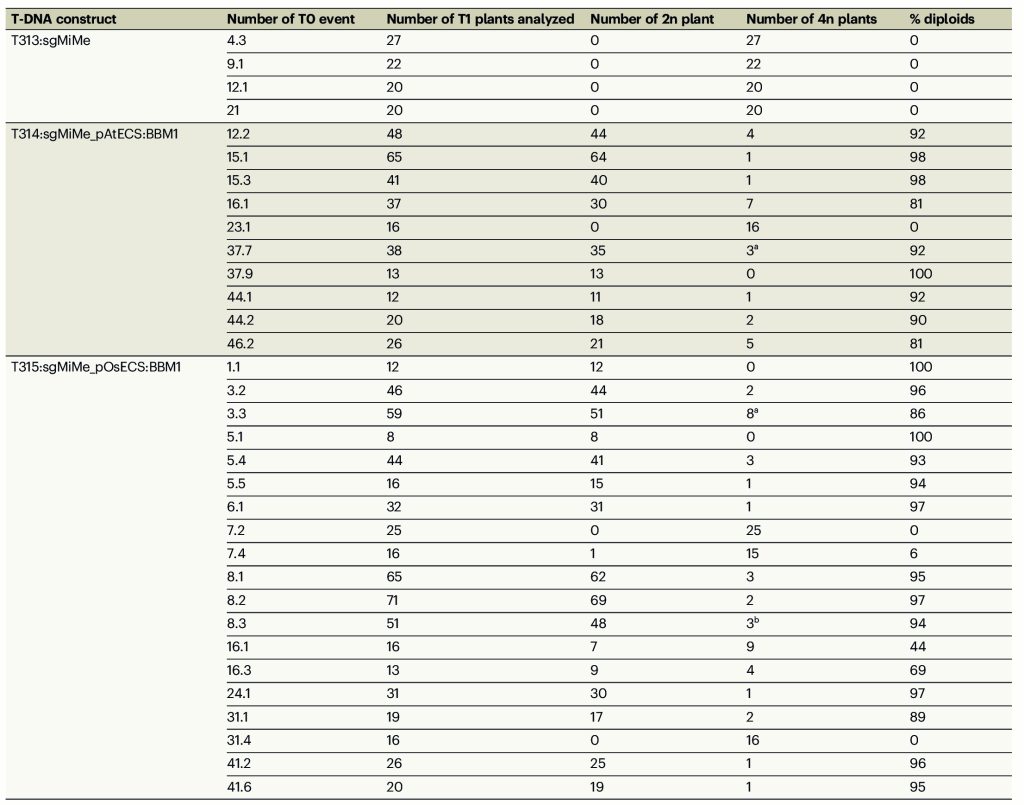
在T0代的T313、T314、T315中分别鉴定出了4、10、18株三纯合突变体:4株T313的后代均为四倍体;10株T314的后代中,有9株产生了超过80%的二倍体后代;在18株T315的后代中,有13株产生了超过80%的二倍体后代(表1)。其中,有几个株系的二倍体后代比率甚至超过了97%。这与上文中T0株系产生11%-29%的二倍体子代概率相比,有了极显著的提高,而这种效率的差异来自于载体结构的差异。
对这些二倍体的后代继续研究,结果显示,杂交性状在连续两代中都会得到保留,没有明显的负面影响(图8)。不可忽略的一点是,虽然二倍体子代占比很高,但无融合生殖植株的平均结实率为27%-35%,是对照BRS-CIRAD 302 F1的60-80%。
表1 检测筛选出的T0代T313、T314、T315的后代倍性 (Vernet et al., 2022)。
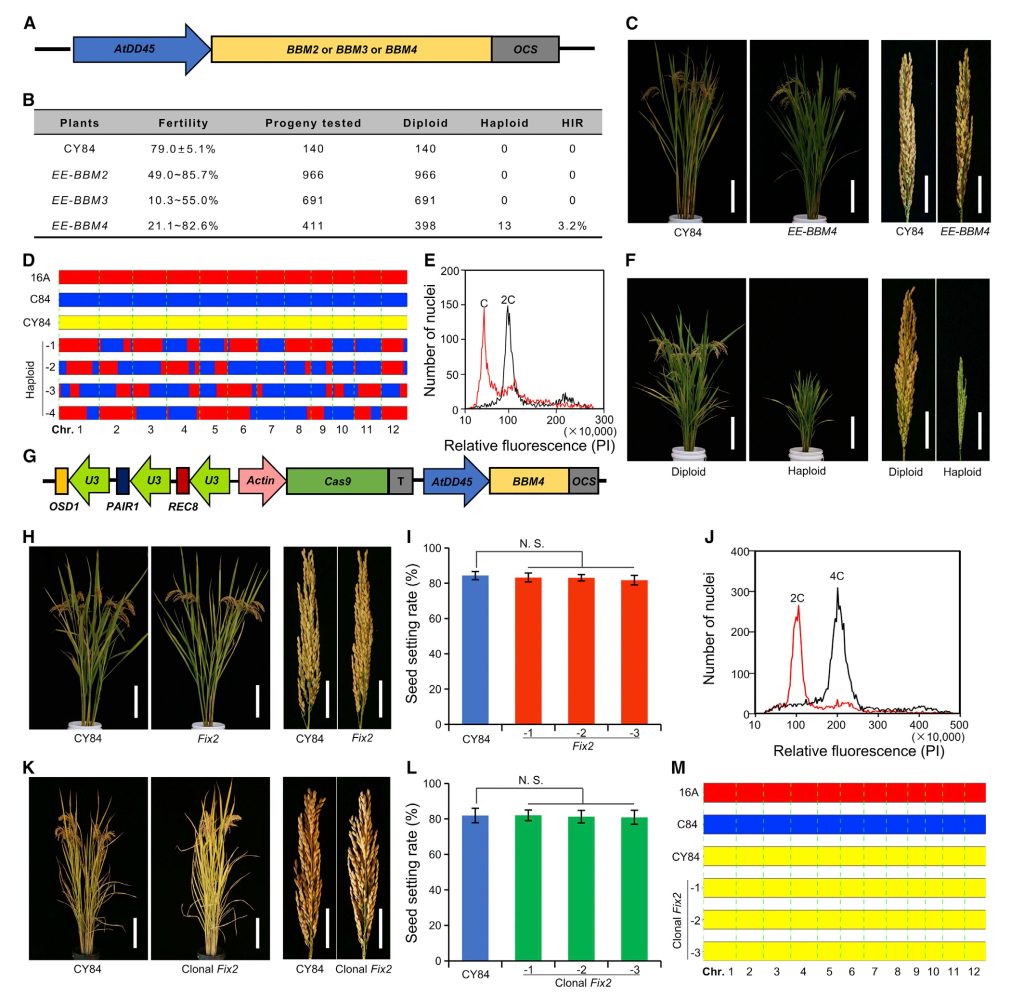
在水稻中,四个BBM基因具有不同的表达模式,除了BBM1之外,其他的三个基因是否可以诱导孤雌生殖呢?在本研究中,以杂交水稻春优84(CY84)为受体材料,使用拟南芥卵母细胞特异性启动子pDD45分别异位表达BBM2、BBM3、BBM4基因,发现只有异位表达BBM4基因可以诱导孤雌生殖(图9)。
之后,构建载体sgMiMe_pDD45:BBM4,即同时敲除OSD1、REC8、PAIR1三个基因并异位表达BBM4基因,转入CY84后,得到6株三基因纯合突变同时异位表达BBM4的材料Fix2,其表现出正常的形态和很高的结实率(80.9%-86.1%),来自Fix2植株的156、152和169个后代中,分别有2、2、4个被鉴定为二倍体植株,其余为四倍体植株。所以,该研究虽然使杂交水稻拥有很高的结实率,但不可忽略的是,其二倍体子代占比较低(1.3%、1.3%、2.4%)。
References:
胡风越, 黄勇, 王克剑, 2022. 无融合生殖固定杂种优势的研究进展和展望. 中国基础科学
D’erfurth I, Jolivet S, Froger N, Catrice O, Novatchkova M, Mercier R, 2009. Turning meiosis into mitosis. PLoS Biol 7, e1000124.
Khanday I, Skinner D, Yang B, Mercier R, Sundaresan V, 2019. A male-expressed rice embryogenic trigger redirected for asexual propagation through seeds. Nature 565, 91-5.
Fei X, Shi J, Liu Y, Niu J, Wei A. The steps from sexual reproduction to apomixis. Planta. 2019;249(6):1715-1730. doi:10.1007/s00425-019-03113-6
Marimuthu MP, Jolivet S, Ravi M, et al., 2011. Synthetic clonal reproduction through seeds. Science 331, 876.
Mieulet D, Jolivet S, Rivard M, et al. Turning rice meiosis into mitosis. Cell Res. 2016;26(11):1242-1254. doi:10.1038/cr.2016.117
Vernet A, Meynard D, Lian Q, et al. High-frequency synthetic apomixis in hybrid rice. Nat Commun. 2022;13(1):7963. Published 2022 Dec 27. doi:10.1038/s41467-022-35679-3
Wang C, Liu Q, Shen Y, et al., 2019. Clonal seeds from hybrid rice by simultaneous genome engineering of meiosis and fertilization genes. Nat Biotechnol 37, 283-6.
Wei X, Liu C, Chen X, et al. Synthetic apomixis with normal hybrid rice seed production [published online ahead of print, 2023 Jan 5]. Mol Plant. 2023;S1674-2052(23)00005-9. doi:10.1016/j.molp.2023.01.005
Xiong J, Hu F, Ren J, Huang Y, Liu C, Wang K. Synthetic apomixis: the beginning of a new era. Curr Opin Biotechnol. 2023;79:102877. doi:10.1016/j.copbio.2022.102877