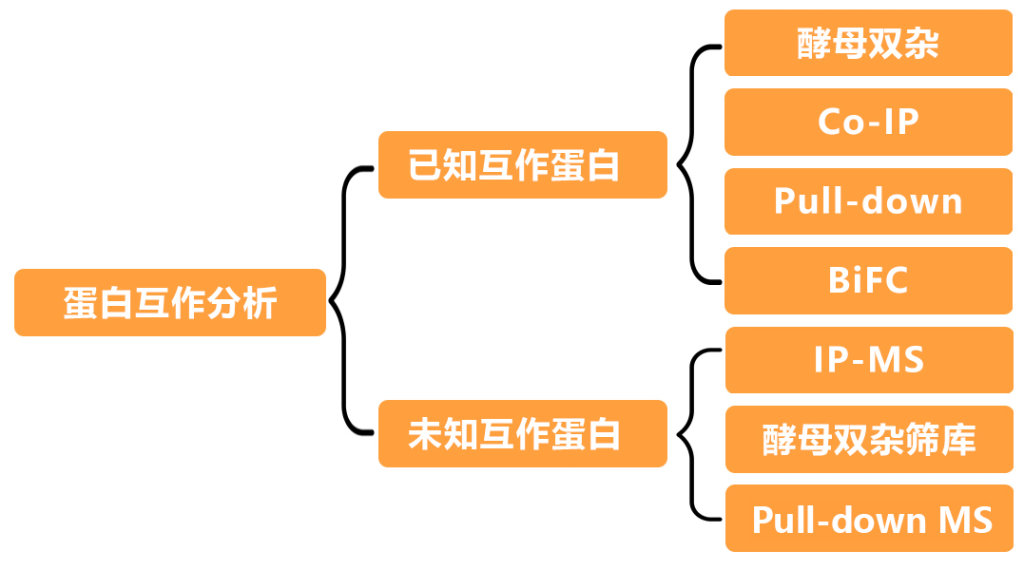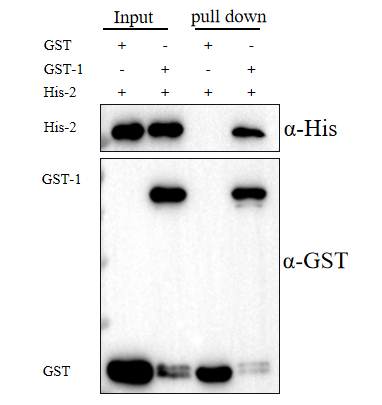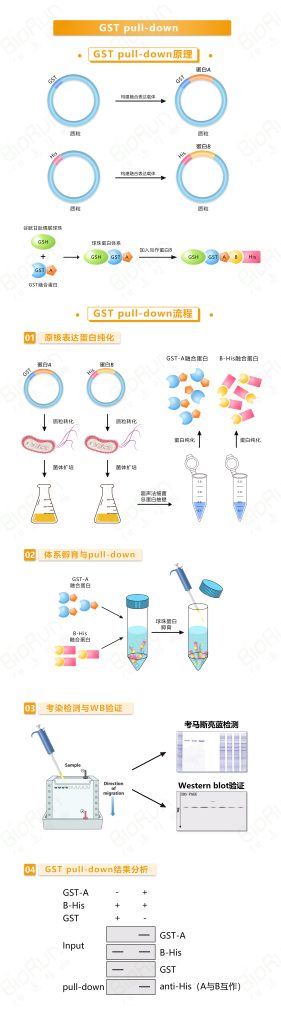
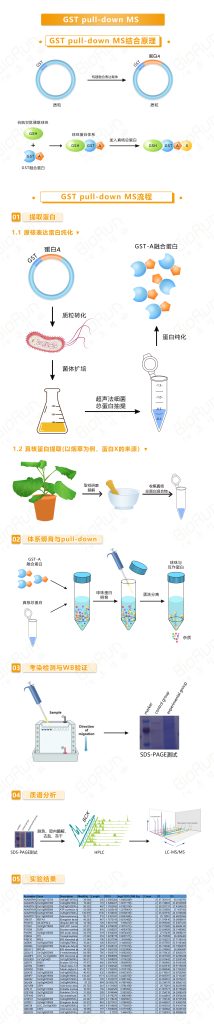
1.1 GST pull-down我司案例结果展示
1.2 GST pull-down文献案例展示
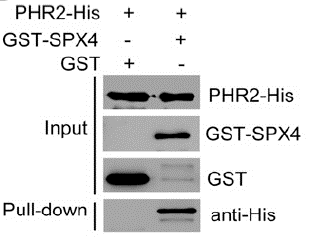
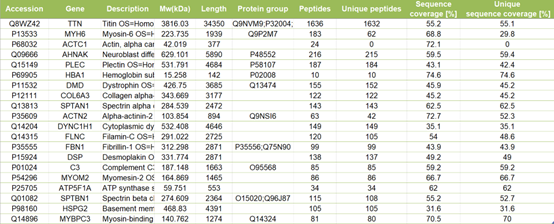
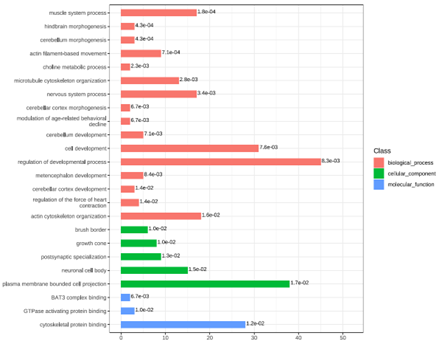
“SPX4 Negatively Regulates Phosphate Signaling and Homeostasis through its Interaction with PHR2 in Rice”一文解析了SPX4通过与PHR2的相互作用负调控水稻的磷酸盐信号和稳态的分子机制,作者首先使用Co-IP联合液相质谱的方法坚定了PHR2相互作用的蛋白质SPX4。为了验证这个结论,作者利用3种方法证明了PHR2与SPX4之间的相互作用,其中之一使用的是pull-down的方法,具体的结果如下图所示。
1、可验证蛋白质之间的直接相互作用;
2、步骤简单,操作方便;
3、GSH 谷胱甘肽偶联球珠亲和力强,洗脱纯度高。
References:
Lv Q, Zhong Y, Wang Y, et al. SPX4 Negatively Regulates Phosphate Signaling and Homeostasis through Its Interaction with PHR2 in Rice[J].The Plant Cell, 2014, 26:1586-1597.
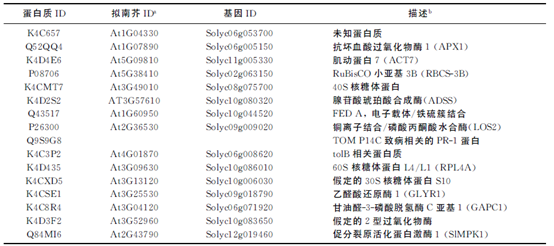
丁海东, 钱 莹, 谢其慧, 等. GST pull-down联合质谱分析筛选番茄SLSPRH1的相互作用蛋白 [J]. 扬州大学学报(农业与生命科学版), 2021, 42(6): 36-41.