由于腺相关病毒具有宿主范围广、安全性高、免疫原性低、表达稳定和物理性质稳定等优点,已被广泛地应用于基础研究和临床试验中,并且腺相关病毒载体已成为世界上最常用的基因治疗载体之一。
AAV2作为目前应用最广的AAV,呈现出对骨骼肌、神经元、血管平滑肌细胞和肝细胞的天然趋向性。AAV2具有三种细胞受体:硫酸乙酰肝素蛋白聚糖(HSPG)、aVβ5整合素和成纤维细胞生长因子受体1(FGFR-1)。HSPG作为主要受体发挥作用,后两个具有共受体活性,使AAV通过受体介导的内吞作用进入细胞,值得注意的是,HSPG在细胞外基质中的丰度可清除AAV颗粒并降低感染效率。
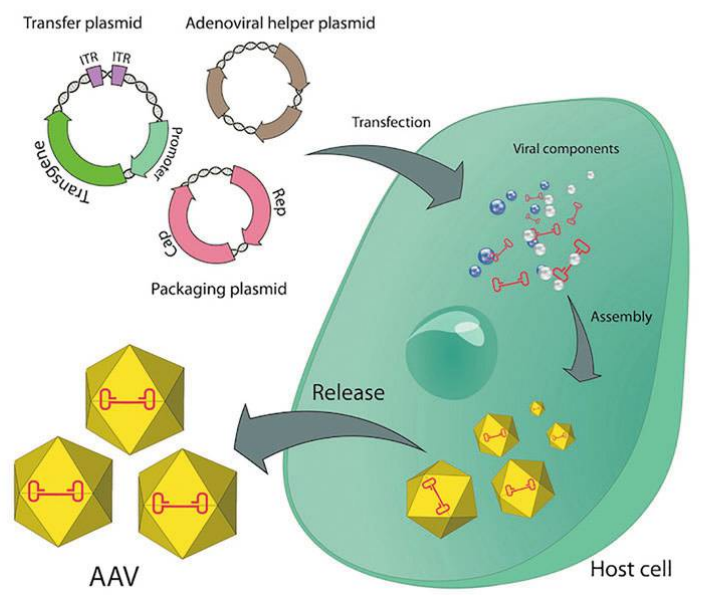
(3)载体质粒、辅助质粒和包装质粒共转染HEK293细胞;
(4)收集AAV粗病毒:离心分别收集细胞上清和细胞沉淀,反复冻融;
(5)AAV病毒浓缩纯化:PEG8000浓缩法/蔗糖密度梯度超速离心法;
(6)AAV质检:包括病毒滴度、质粒残留、宿主DNA残留、BSA残留、支原体检测、衣原体检测、内毒素检测、细菌及真菌检测等。
2、免疫原性低:AAV2的基因组仅4681个核苷酸,便于用常规的重组DNA技术进行操作,而且进行动物实验时造成的免疫反应小,AAV感染组织后很少会被免疫系统清除;
3、宿主范围广:可以感染广泛的哺乳动物并且成功应用于人类和非人类蛋白的表达,不仅可转染分裂细胞,也可转染非分裂细胞;
4、多种血清型:AAV1~AAV9以及DJ、DJ/8、Rh10等12种血清型,不同血清型的AAV可以靶向不同的细胞和组织;
5、表达稳定、持续时间长:不整合到宿主基因组,可长期稳定表达外源基因,在宿主细胞中形成附加体(episome)存在于细胞核中,体内可持续表达6个月以上;
6、扩散性强:与慢病毒和腺病毒相比,AAV可以穿透血脑屏障,是最适合用来感染神经元和胶质细胞的。
AAV缺点:
1、载体容量小:可插入序列比慢病毒要小很多,目前最多只能容纳不超过3kb的外源DNA片段;
2、体外实验表达水平较低:主要是因为rAAV病毒的基因组是单链DNA,在体外环境形成双链并转录翻译外源基因的效率非常低。可以在体外水平感染rAAV病毒的同时感染辅助病毒比如Ad5型腺病毒或者终浓度10~50mM的丁酸钠等方法提高细胞实验的rAAV表达量;
3、表达速度慢:相比较慢病毒和腺病毒而言,rAAV在感染后需要较长的时间来表达外源基因,一般在感染两周后才表达,因为需要从单链DNA变成双链DNA。
2、AAV的表达效果能维持多久?
AAV在细胞内主要是以环状的dsDNA附加体(Circularised dsDNA episomes)的形式存在,而不会像慢病毒那样整合到宿主细胞的基因组。对于分裂不旺盛的细胞,如神经元,AAV可持续表达1年以上甚至2年,对于分裂较旺盛的细胞,一般也可维持3~6个月或以上。
3、AAV作为一种体内常用的工具载体,可应用于哪些方面?
(1)基因过表达。将目的基因的CDS区构建到AAV载体,注射到动物体内实现过表达;
(2)基因干扰表达。将针对目的基因设计的shRNA构建到AAV载体,注射到动物体内实现干扰表达;
(3)目的基因敲除。将针对目的基因设计的sgRNA和Cas9编码序列分别构建到AAV载体中,注射到动物体内实现基因敲除;
(4)内源过表达。将针对目的基因设计的sgRNA和dCas9分别构建到AAV载体,实现内源过表达。
Wang D, Tai PWL, Gao G. Adeno-associated virus vector as a platform for gene therapy delivery.[J]. Nat Rev Drug Discov. 2019;18(5):358-378.