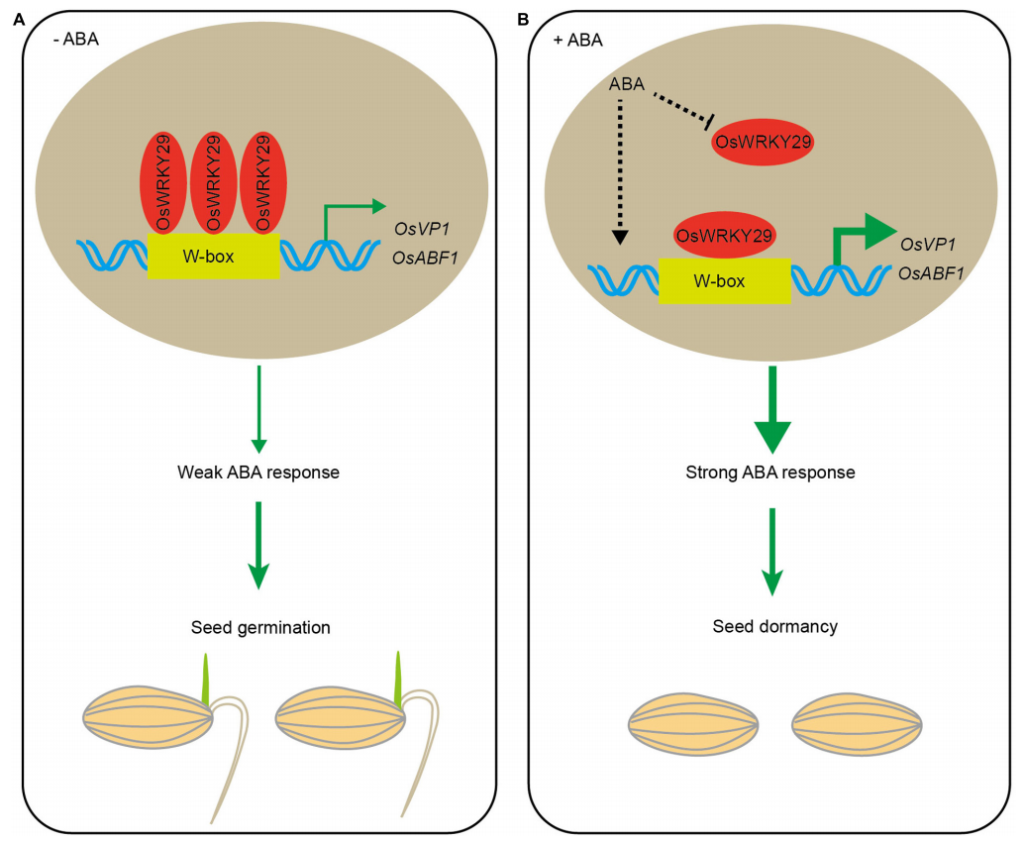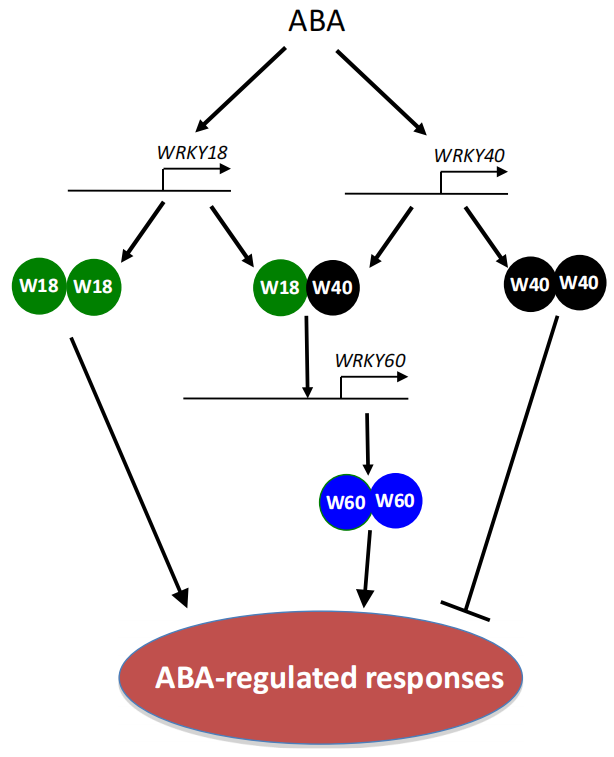
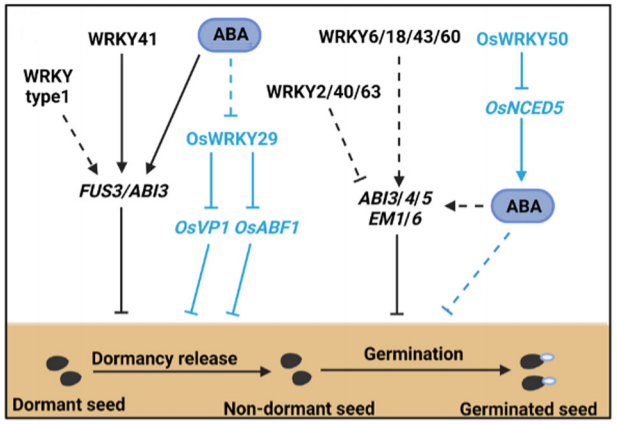
图3 WRKYs调控拟南芥、水稻和向日葵种子休眠和萌发的信号通路图(Wang et al., 2023)。
在拟南芥中,通过对种子休眠的主要调节因子FUS3和ABI3的研究表明,I型AtWRKY转录因子可能与AtFUS3启动子结合并正向调节该基因的表达,从而抑制种子休眠被打破的过程(图3)(Roscoe et al., 2019)。对AtWRKY41的研究进一步阐明了WRKY调控种子休眠的信号通路,结果表明AtWRKY41的沉默会导致种子休眠期缩短,并且导致成熟和吸水种子中AtABI3转录的下调。此外,AtWRKY4可以直接结合AtABI3启动子中的W-box元件从而正向调节其表达(图3)(Ding et al., 2014)。而在水稻中,OsWRKY29的缺失突变则增强了种子休眠。并且,在没有ABA的情况下,OsWRKY29可以与水稻ABA反应基因OsVP1以及脱落酸反应元件结合因子OsABF1的启动子结合以下调它们的表达从而缩短种子的休眠期(图3、图4)(Zhou et al., 2020)。
图4 OsWRKY29调节种子休眠的模式图(Zhou et al., 2020)。
种子休眠被打破之后,WRKY转录因子会通过调节转录、蛋白合成、ABA信号转导的抑制等来控制种子的萌发。例如,AtWRKY2、AtWRKY40和AtWRKY63通过下调ABA响应基因AtABI3、AtABI4、AtABI5、AtEM1和AtEM6的表达来减少ABA信号以促进种子萌发和萌发后生长(图3)(Jiang et al., 2009; Chen et al., 2010; Ren et al., 2010);而AtWRKY6、AtWRKY18、AtWRKY43和AtWRKY60,则通过激活ABA响应基因表达来抑制种子萌发(图3、图5)(Chen et al., 2010; Huang et al., 2016; Geilen et al., 2017)。此外,水稻OsWRKY50可以通过直接抑制ABA生物合成基因OsNCED5的表达来促进种子的萌发和幼苗的生长(图3)(Huang et al., 2021)。
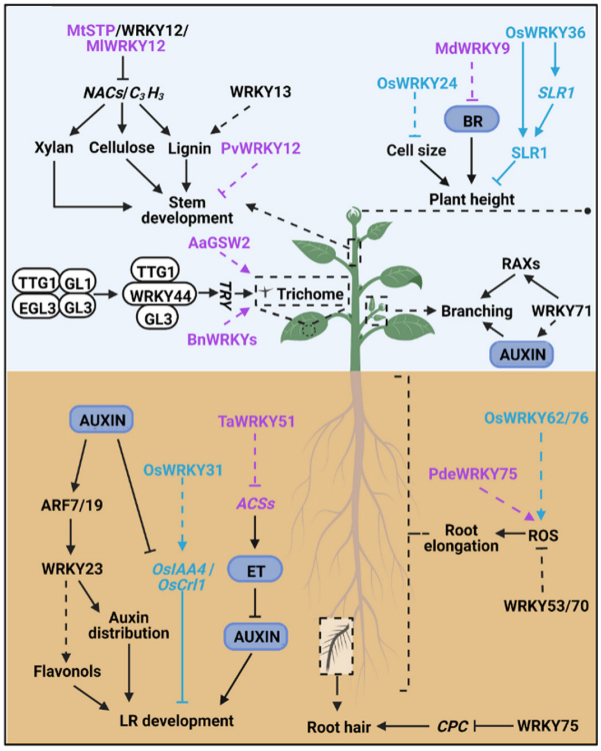
此外,WRKY转录因子还参与调节根毛的形态,在拟南芥中AtWRKY75可以通过直接结合AtCPC的启动子来抑制其表达,从而抑制根毛的发育(图7)(Rishmawi et al., 2014)。
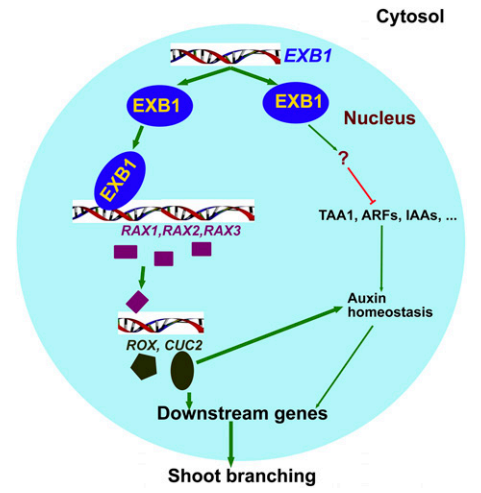
图8 WRKY71/EXB1调控植物分枝的模式图(Guo et al., 2015)。注:EXB1编码WRKY转录因子WRKY71,该因子具有反式激活活性。
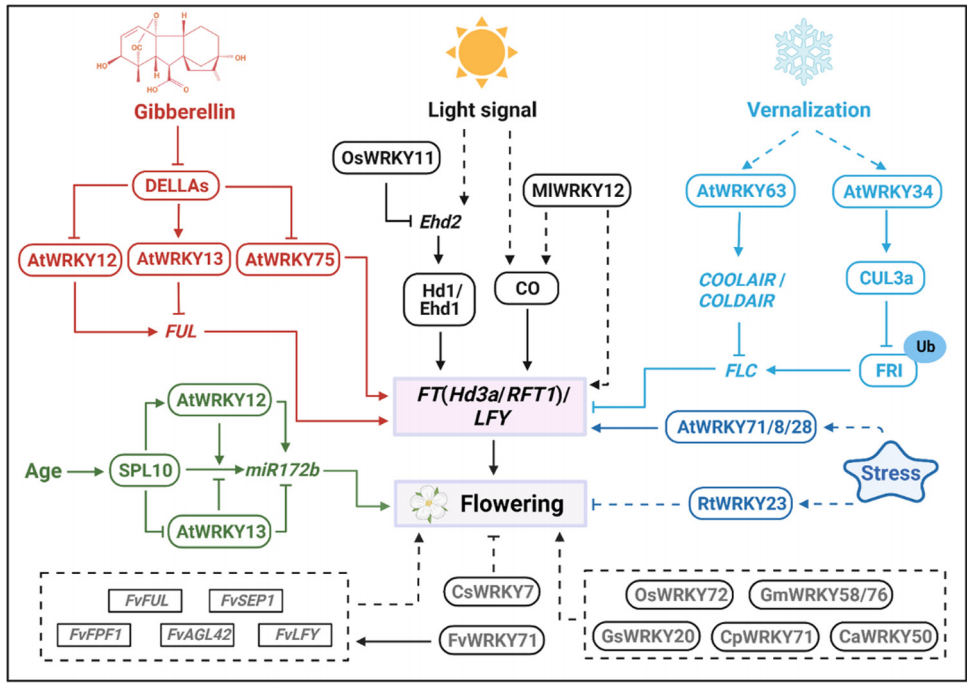
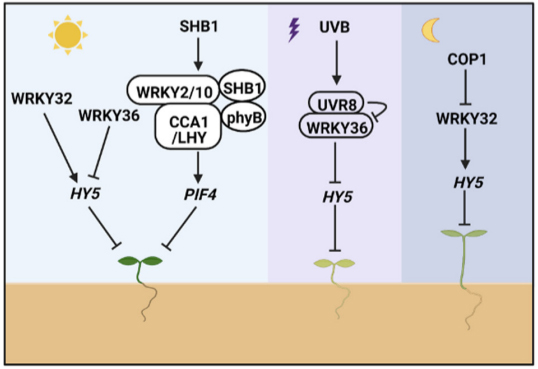
除了上述的信号途径之外,在某些胁迫条件下,植物通常会表现出延迟开花的表型来逃避持续的胁迫,或者加速开花以确保繁殖成功。而作为众所周知的胁迫反应因子,WRKY可以有效地帮助植物逃避胁迫,例如,RtWRKY23在拟南芥中过表达可以增强植株对盐胁迫的耐受性并延迟开花。而在严重胁迫条件下AtWRKY8、AtWRKY28以及AtWRKY71则可以通过激活AtFT和AtLFY的表达来介导盐响应开花,使植物能够快速完成其生命周期(Yu et al., 2018; Yu et al., 2016)。除此外,GsWRKY20、GmWRKY58、GmWRKY76、OsWRKY72以及CpWRKY71的异源表达可以导致拟南芥提早开花,而CsWRKY7则具有延迟开花的作用。
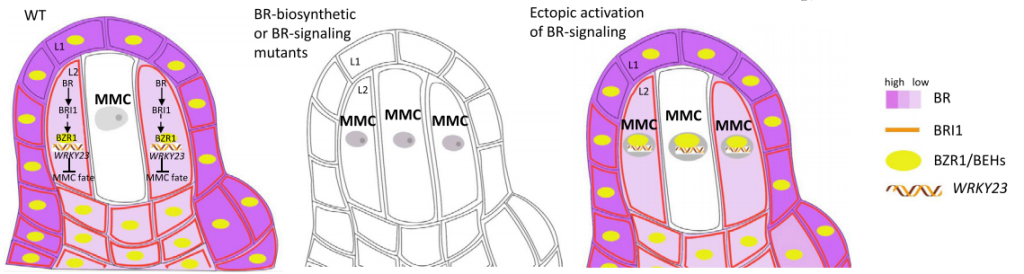
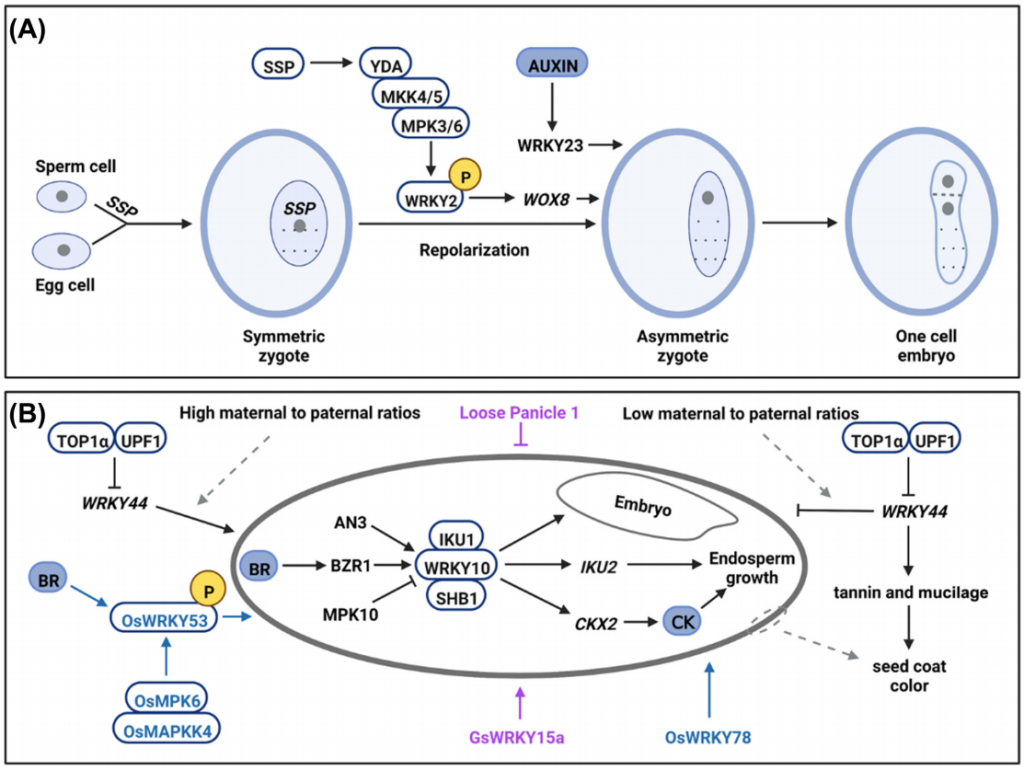
在调控种子生长方面,AtWRKY10可能与AtSHB1和AtIKU1形成复合物来促进AtIKU2的表达从而影响种子的生长。而除了作为AtIKU通路的核心调节因子外,AtWRKY10还可以通过其他信号通路控制种子发育。例如,AtAN3与AtWRKY10启动子结合并调节其表达,进而影响种子胚胎的发育。AtWRKY10通过直接结合细胞分裂素氧化酶基因AtCKX2的启动子来影响细胞分裂介导的种子发育。AtWRKY44对于种子发育同样很重要,与野生型相比该基因的突变会导致种子变小并且种子颜色较浅,种子生长受限以及异常的种皮着色分别是种皮细胞伸长受抑制以及种皮中单宁和粘液生成减少造成的(Garcia et al., 2005; Gonzalez et al., 2016)。此外,在水稻中,OsWRKY53的功能缺失突变会导致谷粒变小,而OsWRKY53的过表达会增加谷粒的大小。通过进一步的分析发现,OsWRKY53与OsMPK6相互作用并被OsMKK4-OsMPK6级联磷酸化,磷酸化的OsWRKY53能够调节油菜素内酯(BR)反应,表明OsWRKY53在调控水稻籽粒大小的过程中可能位于BR信号通路和MPK级联的关键节点(Tian et al., 2017)。
Chen H, Lai Z, Shi J, et al. Roles of arabidopsis WRKY18, WRKY40 and WRKY60 transcription factors in plant responses to abscisic acid and abiotic stress. BMC Plant Biol. 2010, 10:281.
Cai H, Liu L, Huang Y, et al. Brassinosteroid signaling regulates female germline specification in Arabidopsis. Curr Biol. 2022, 32(5): 1102-1114.e5.
Ding ZJ, Yan JY, Li GX, et al. WRKY41 controls Arabidopsis seed dormancy via direct regulation of ABI3 transcript levels not downstream of ABA. Plant J. 2014, 79(5): 810-23.
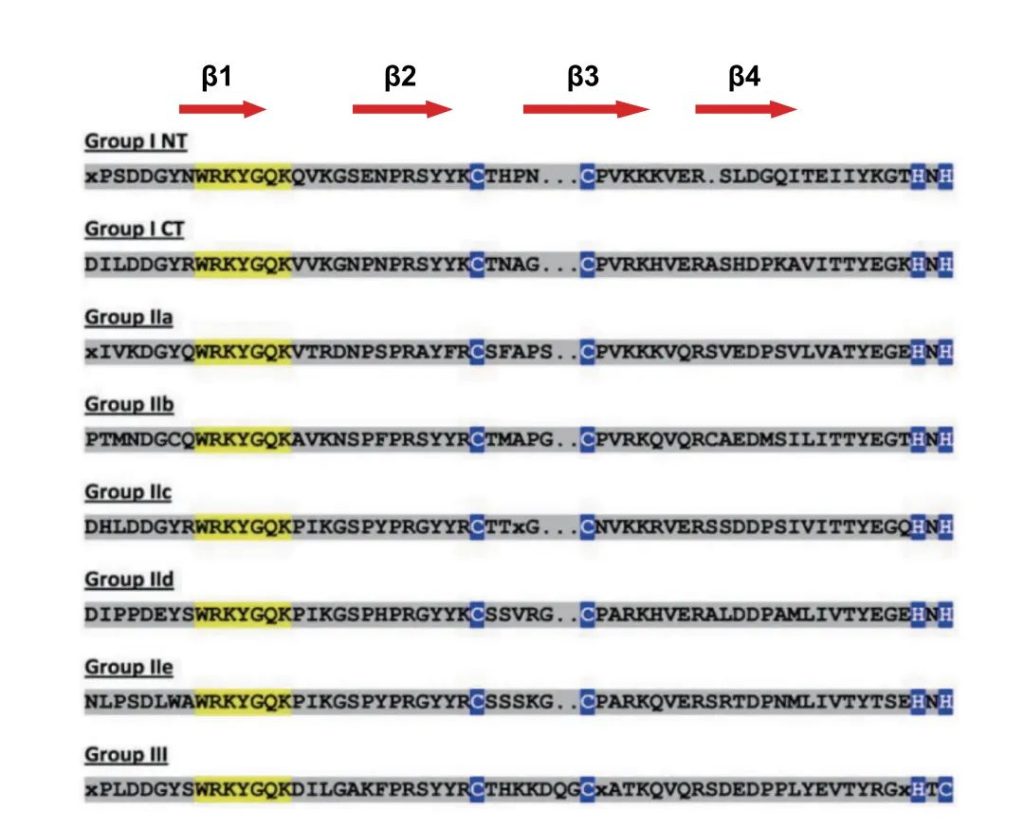
Eulgem T, Rushton PJ, Robatzek S, et al. The WRKY superfamily of plant transcription factors. Trends Plant Sci. 2000, 5(5): 199-206.
Garcia D, Fitz Gerald JN, Berger F. Maternal control of integument cell elongation and zygotic control of endosperm growth are coordinated to determine seed size in Arabidopsis. Plant Cell. 2005 17(1): 52-60.
Grunewald W, De Smet I, Lewis DR, et al. Transcription factor WRKY23 assists auxin distribution patterns during Arabidopsis root development through local control on flavonol biosynthesis. Proc Natl Acad Sci U S A. 2012, 109(5): 1554-9.
Grunewald W, De Smet I, De Rybel B, et al. Tightly controlled WRKY23 expression mediates Arabidopsis embryo development. EMBO Rep. 2013, 14(12): 1136-42.
Guo D, Zhang J, Wang X, et al. The WRKY Transcription Factor WRKY71/EXB1 Controls Shoot Branching by Transcriptionally Regulating RAX Genes in Arabidopsis. Plant Cell. 2015, 27(11): 3112-27.
Gonzalez A, Brown M, Hatlestad G, et al. TTG2 controls the developmental regulation of seed coat tannins in Arabidopsis by regulating vacuolar transport steps in the proanthocyanidin pathway. Dev Biol. 2016, 419(1): 54-63.
Geilen K, Heilmann M, Hillmer S, et al. WRKY43 regulates polyunsaturated fatty acid content and seed germination under unfavourable growth conditions. Sci Rep. 2017, 7(1): 14235.
Huang Y, Feng CZ, Ye Q, et al. Arabidopsis WRKY6 Transcription Factor Acts as a Positive Regulator of Abscisic Acid Signaling during Seed Germination and Early Seedling Development. PLoS Genet. 2016, 12(2): e1005833.
Hu Z, Wang R, Zheng M, et al. TaWRKY51 promotes lateral root formation through negative regulation of ethylene biosynthesis in wheat (Triticum aestivum L.). Plant J. 2018, 96(2): 372-388.
Huang S, Hu L, Zhang S, et al. Rice OsWRKY50 Mediates ABA-Dependent Seed Germination and Seedling Growth, and ABA-Independent Salt Stress Tolerance. Int J Mol Sci. 2021, 22(16): 8625.
Hung FY, Shih YH, Lin PY, et al. WRKY63 transcriptional activation of COOLAIR and COLDAIR regulates vernalization-induced flowering. Plant Physiol. 2022, 190(1): 532-547.
Ishiguro S, Nakamura K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5’ upstream regions of genes coding for sporamin and beta-amylase from sweet potato. Mol Gen Genet. 1994, 244(6): 563-571.
Jiang W, Yu D. Arabidopsis WRKY2 transcription factor mediates seed germination and postgermination arrest of development by abscisic acid. BMC Plant Biol. 2009, 9: 96.
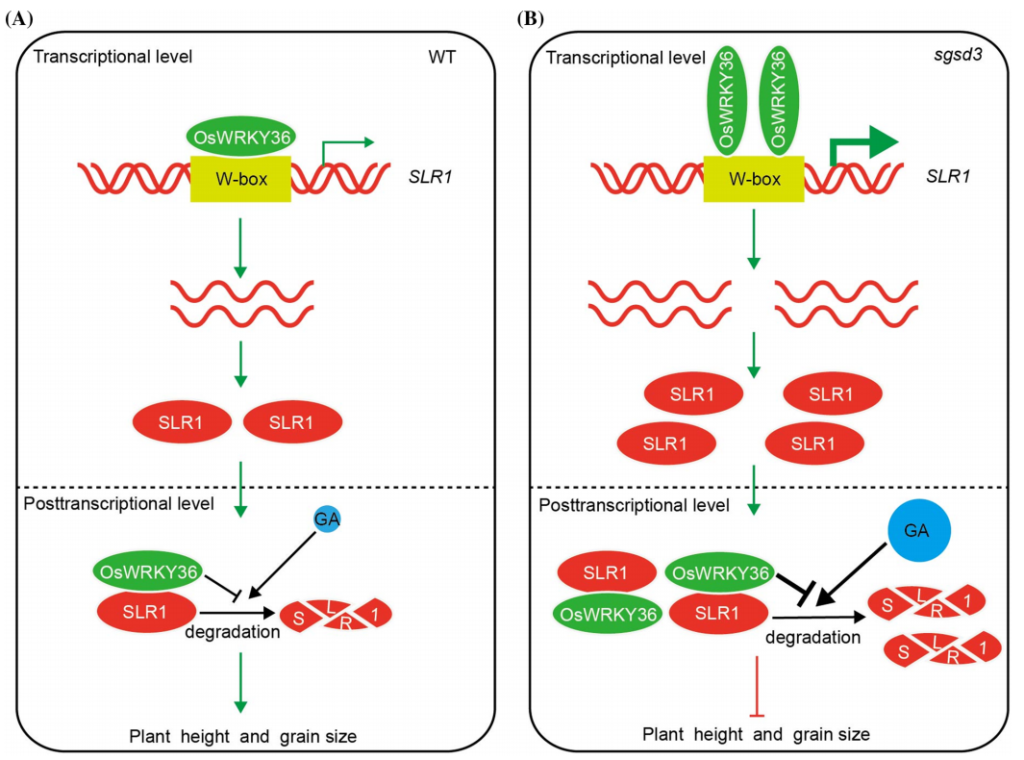
Lan J, Lin Q, Zhou C, et al. Small grain and semi-dwarf 3, a WRKY transcription factor, negatively regulates plant height and grain size by stabilizing SLR1 expression in rice. Plant Mol Biol. 2020, 104(4-5): 429-450.
Li S, Nayar S, Jia H, et al. The Arabidopsis Hypoxia Inducible AtR8 Long Non-Coding RNA also Contributes to Plant Defense and Root Elongation Coordinating with WRKY Genes under Low Levels of Salicylic Acid. Noncoding RNA. 2020, 6(1): 8.
Prát T, Hajný J, Grunewald W, et al. WRKY23 is a component of the transcriptional network mediating auxin feedback on PIN polarity. PLoS Genet. 2018, 14(1): e1007177.
Ren X, Chen Z, Liu Y, et al. ABO3, a WRKY transcription factor, mediates plant responses to abscisic acid and drought tolerance in Arabidopsis. Plant J. 2010, 63(3): 417-29.
Rishmawi L, Pesch M, Juengst C, et al. Non-cell-autonomous regulation of root hair patterning genes by WRKY75 in Arabidopsis. Plant Physiol. 2014, 165(1): 186-95.
Roscoe TJ, Vaissayre V, Paszkiewicz G, et al. Regulation of FUSCA3 Expression During Seed Development in Arabidopsis. Plant Cell Physiol. 2019, 60(2): 476-487.
Tamura K, Dudley J, Nei M, et al. MEGA4: Molecular Evolutionary Genetics Analysis (MEGA) software version 4.0. Mol Biol Evol. 2007, 24(8): 1596-9.
Tian X, Li X, Zhou W, et al. Transcription Factor OsWRKY53 Positively Regulates Brassinosteroid Signaling and Plant Architecture. Plant Physiol. 2017, 175(3): 1337-1349.
Wang H, Chen W, Xu Z, et al. Functions of WRKYs in plant growth and development. Trends Plant Sci. 2023, S1360-1385(22): 00335-1.
Xu L, Zhao H, Ruan W, et al. ABNORMAL INFLORESCENCE MERISTEM1 Functions in Salicylic Acid Biosynthesis to Maintain Proper Reactive Oxygen Species Levels for Root Meristem Activity in Rice. Plant Cell. 2017, 29(3): 560-574.
Yu Y, Liu Z, Wang L, et al. WRKY71 accelerates flowering via the direct activation of FLOWERING LOCUS T and LEAFY in Arabidopsis thaliana. Plant J. 2016, 85(1): 96-106.
Yang Y, Liang T, Zhang L, et al. UVR8 interacts with WRKY36 to regulate HY5 transcription and hypocotyl elongation in Arabidopsis. Nat Plants. 2018, 4(2): 98-107.
Yu Y, Wang L, Chen J, et al. WRKY71 Acts Antagonistically Against Salt-Delayed Flowering in Arabidopsis thaliana. Plant Cell Physiol. 2018, 59(2): 414-422.
Zhang Y, Wang L. The WRKY transcription factor superfamily: its origin in eukaryotes and expansion in plants. BMC Evol Biol. 2005, 5: 1.
Zhang J, Peng Y, Guo Z. Constitutive expression of pathogen-inducible OsWRKY31 enhances disease resistance and affects root growth and auxin response in transgenic rice plants. Cell Res. 2008, 18(4): 508-21.
Zhang L, Chen L, Yu D. Transcription Factor WRKY75 Interacts with DELLA Proteins to Affect Flowering. Plant Physiol. 2018, 176(1): 790-803.
Zhou C, Lin Q, Lan J, et al. WRKY Transcription Factor OsWRKY29 Represses Seed Dormancy in Rice by Weakening Abscisic Acid Response. Front Plant Sci. 2020, 11: 691.
Zhou H, Zhu W, Wang X, et al. A missense mutation in WRKY32 converts its function from a positive regulator to a repressor of photomorphogenesis. New Phytol. 2022, 235(1): 111-125.
Zhang Y, Yang X, Nvsvrot T, et al. The transcription factor WRKY75 regulates the development of adventitious roots, lateral buds and callus by modulating hydrogen peroxide content in poplar. J Exp Bot. 2022, 73(5): 1483-1498.
黄幸, 丁峰, 彭宏祥, 等.植物WRKY转录因子家族研究进展. 生物技术通报, 2019, 35(12): 129-143.