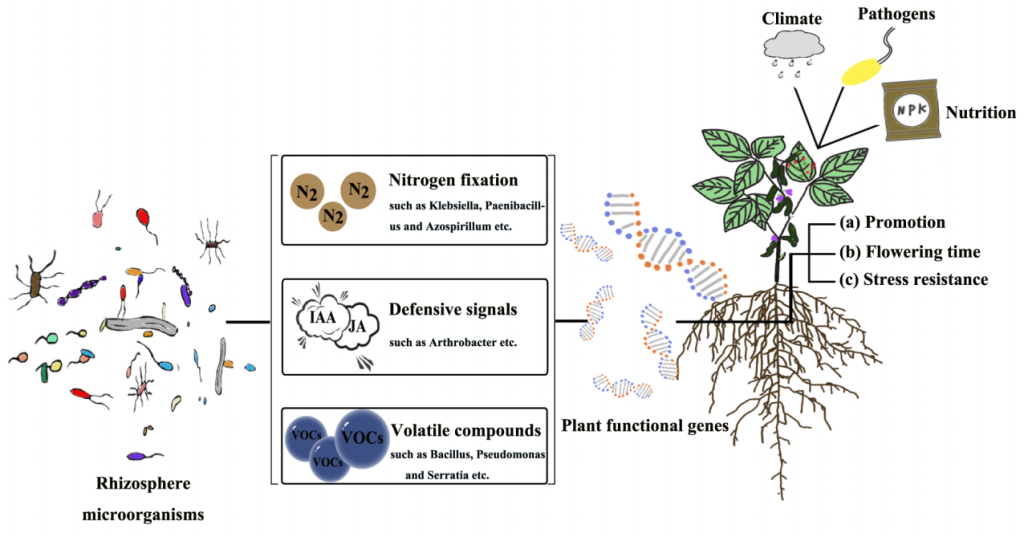
植物与其根系/际微生物的互作整体上是一个动态平衡的状态,微生物在受到植物调控的同时也会通过分泌次生代谢产物、产生挥发性化合物以及竞争养分等方式来调节植物功能基因的表达,从而对植物的生长、发育、抗病、抗逆等过程产生一定的影响。那么,微生物调控植物功能基因的具体机制有哪些呢?想必大家也和小远一样好奇吧,接下来就让我们一起去文中寻找答案吧!
了解完上述背景知识后,接下来我们就以具体的文章为例,深入学习微生物是如何调控植物的功能基因的以及这类研究应该如何具体开展?
图2 植物与根际微生物群落之间的相互作用示意图(Lu et al., 2018)。
实验流程及结果:
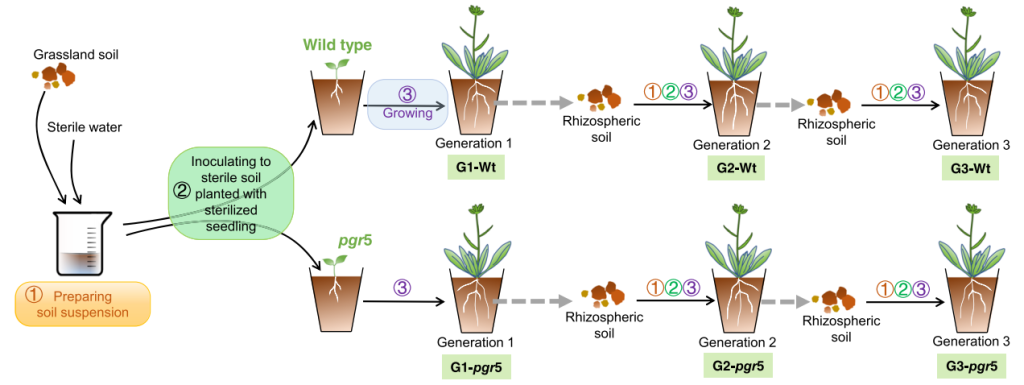
作者首先通过多代连续培养实验明确了在三代连续培养(G1、G2、G3)中植物最终富集的根际微生物在调控植物开花方面起着重要作用(图3)。结合微生物测序分析进一步发现pgr5突变体与野生型拟南芥的根际微生物存在显著差异,并且大多数显著富集的根际微生物是较为稀有的,这也表明这些稀有根际微生物可能对拟南芥的开花起着调节作用。由于在野生型植株根际显著富集的微生物主要与根际氮循环和维持植物健康生长方面有关,因此作者推测不同品种拟南芥的稀有根际微生物在土壤氮循环水平上的差异可能最终导致了开花时间的不同。
图3 多代连续培养实验示意图(Lu et al., 2018)。
为了明确拟南芥的开花时间与根际微生物群落直接相关。作者采用微生物回接实验对此进行了探究,将图3中WM(野生型拟南芥G3期根际微生物)和PM(pgr5突变株G3期根际微生物)分别接种到三个拟南芥品种中培养,WM处理延迟了所有品种拟南芥的开花时间,同时显著提高了所有品种的地上部鲜重,而将含有根际微生物的土悬液灭菌处理后,这些效果则会消失,以上结果表明拟南芥的开花时间会受到根际微生物群落的直接影响。通过对微生物氮循环相关基因丰度以及土壤中NH4+与NO3–含量的测定,作者进一步推测突变体的早花表型是由于生物可利用氮的缺乏而导致的。
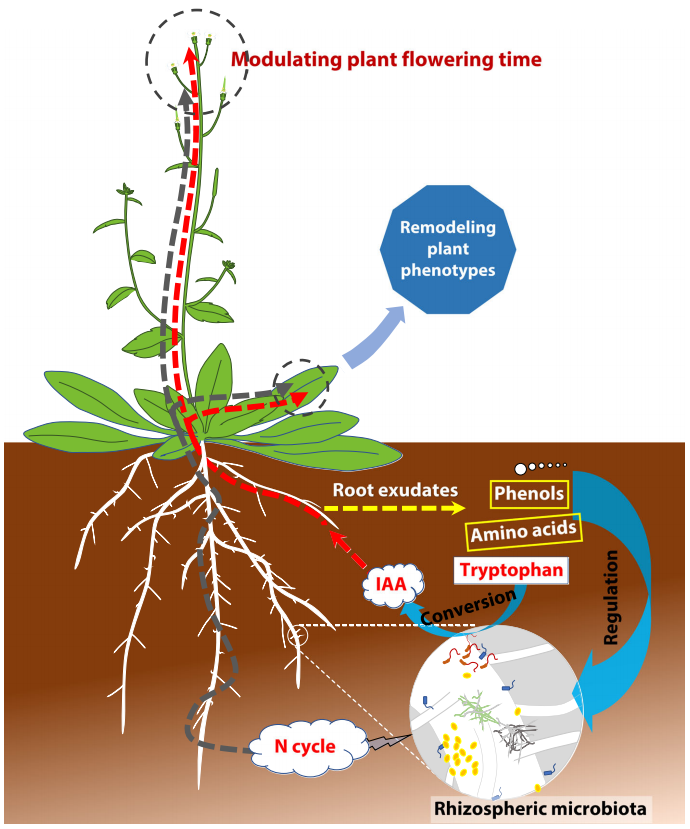
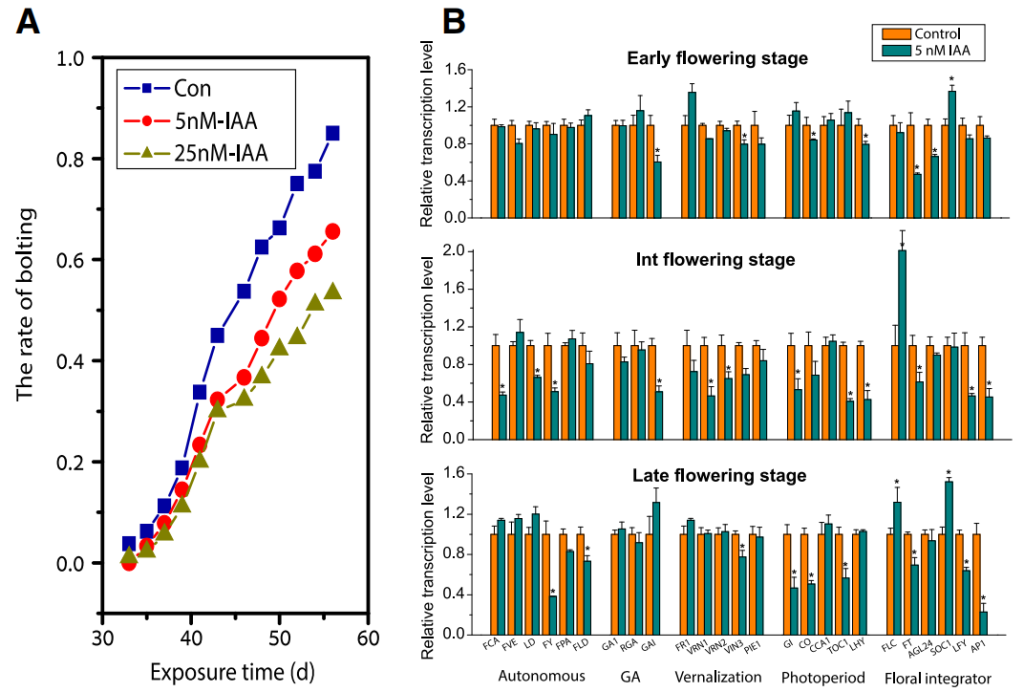
接下来,作者通过代谢组学分析明确了根系分泌物可以作为影响微生物组成的关键底物或信号分子。其中,色氨酸(Trp)及其衍生物以及酚类和部分羧酸在野生型的根系分泌物中显著富集。在先前的研究中有学者指出根际微生物可以将Trp转化为IAA从而促进植物生长。因此微生物产生的IAA可能通过一种新的分子网络模型控制拟南芥的开花时间。为了探究其中的机制,作者采用水培体系对此进行了探究,通过向水培体系中添加Trp、5-羟色氨酸(5-HTP)和IAA并记录不同处理的花期来验证拟南芥开花时间延迟是否是由微生物产的IAA导致的。结果显示,当80%的对照植株都产生花蕾时,向水培体系中添加5nM和25nM的IAA会导致WT的抽薹比例降低20-30%(图4A),这说明IAA是延迟拟南芥开花时间的直接因素。并且开花相关基因表达量的变化进一步证明了IAA在调控开花时间中的作用(图4B)。作者最终清晰的证明了微生物产生的IAA会延迟植物的开花。
总结:
回顾文章的整个实验思路,我们会发现,作者设计的多代连续培养实验巧妙地将拟南芥的开花差异进行了放大处理,并且从侧面明确了根际微生物对植物开花的影响,为整个实验的顺利开展打好了基础。由此可见,好的实验设计对于研究的顺利开展十分重要!因此,大家在阅读文献的过程中,除了学习最新的研究进展外,也要多多记录总结巧妙的实验设计,这对自己的研究也会有一定的启发哦!
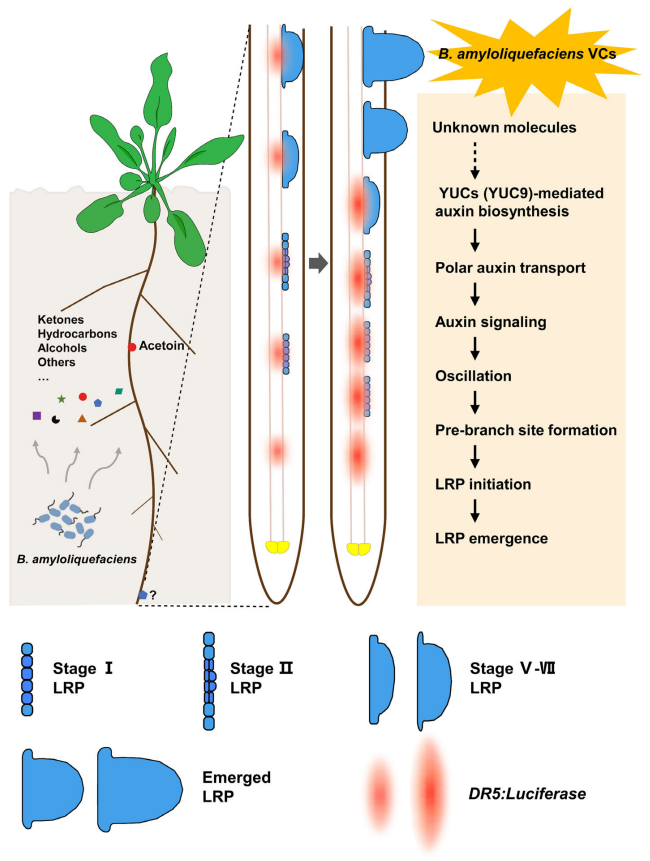
图5 解淀粉芽孢杆菌诱导拟南芥侧根发育的分子模型(Li et al., 2021)。
实验流程及结果:
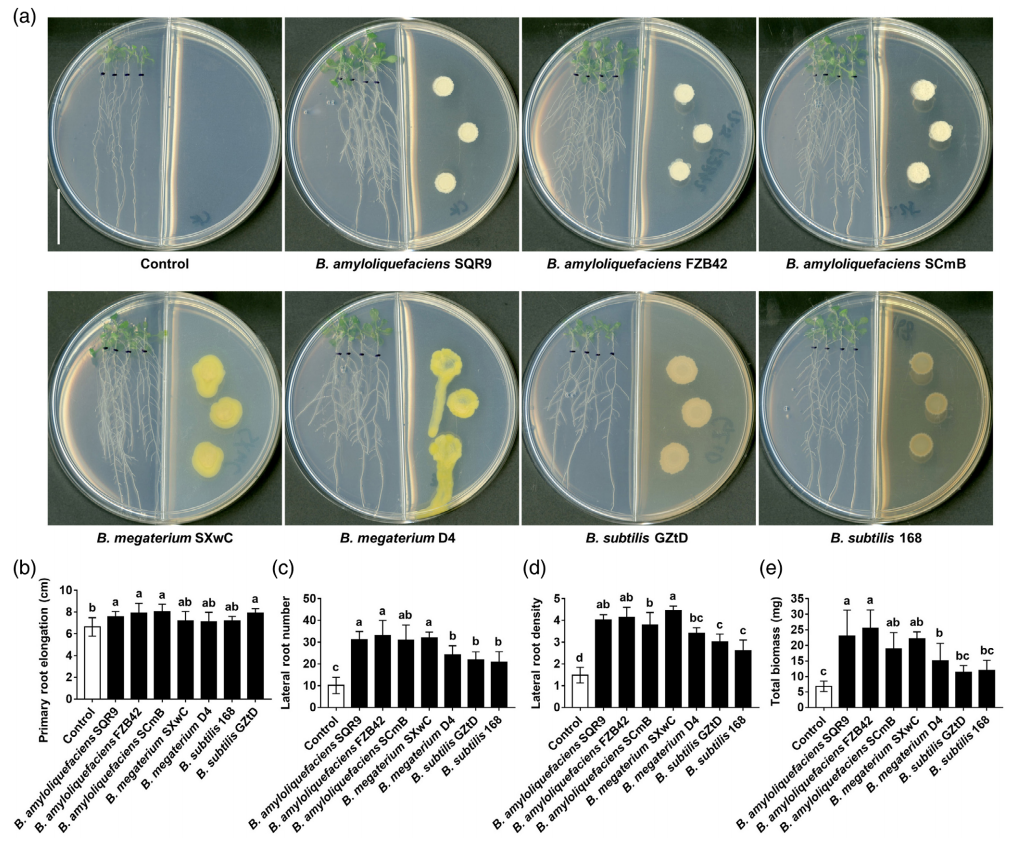
作者首先利用共培养的方法明确了芽孢杆菌产生的挥发性物质(VCs)对拟南芥侧根(LR)发育的促进作用(图5),并结合先前已有的研究报道选择了解淀粉芽孢杆菌SQR9作为后续研究的模式菌。
图5 芽孢杆菌属产生的挥发性化合物对拟南芥生长和根系发育的影响(Li et al., 2021)。
为了排除细菌产生的CO2或生长素对侧根发育的影响,作者使用Ba(OH)2来吸收培养皿中的CO2,结果显示Ba(OH)2的存在可以捕获CO2气体,并在一定程度上减少拟南芥侧根的形成。而用生长素合成缺陷型菌株与拟南芥共培养的结果则显示,生长素对拟南芥侧根的形成无直接的作用。以上结果表明CO2在解淀粉芽孢杆菌VCs促进侧根形成的过程中可能起次要作用,而起主要作用的是具有生物活性的VCs。
为了探究受解淀粉芽孢杆菌VCs影响的侧根发育阶段,作者使用GUS染色法观察到VCs可以诱导侧根原基的形成及发育从而增加侧根分支,并且VCs还可以促进根尖分生组织的细胞分裂。此外,由于侧根的启动需要生长素信号传导,因此作者使用pDR5:GUS标记系统检测了拟南芥根尖和侧根原基中的生长素反应,结果显示DR5在分生组织的原木质部以及侧根原基中表达增强。结合荧光素酶测定的结果,进一步证实了VCs能够显著增强DR5在根尖震荡区的表达强度并诱导侧根起始点在主根上的大量形成。
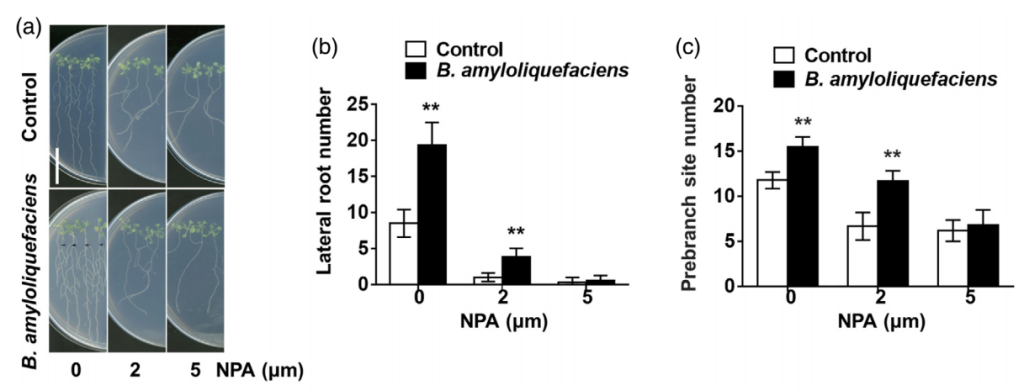
接下来,为了明确生长素在解淀粉芽孢杆菌VCs诱导的侧根形成过程中的作用,作者通过qRT-PCR检测、观察生长素相关突变体与SQR9共培养的表型以及向培养基中添加生长素外排抑制剂NPA等实验共同解析了生长素对于解淀粉芽孢杆菌VCs诱导的侧根形成是必不可少的。由于,吲哚-3-丙酮酸酯(IPA)可以通过YUCCA(YUC)基因编码的乙烯单加氧酶的催化转化为吲哚-3-乙酸(IAA)。因此作者分析了解淀粉芽孢杆菌VCs处理后YUCs的表达,并使用了Yucasin来抑制YUCs的功能。结果表明解淀粉芽孢杆菌VCs促进侧根形成需要YUCs介导的生长素生物合成(图6)。
最后,为了鉴定解淀粉芽孢杆菌VCs中调节侧根形成的主要活性化合物,作者使用固相微萃取(SPME)结合GC-MS非靶向代谢组学分析了解淀粉芽孢杆菌VCs的成分。其中,3-羟基-2-丁酮是VCs色谱图中含量最丰富的化合物,它可以促进植物生长。通过向培养基中添加3-羟基-2-丁酮,并在此实验中使用3-羟基-2-丁酮生物合成缺陷突变体来测试3-羟基-2-丁酮对拟南芥中侧根生长发育的影响。结果表明,3-羟基-2-丁酮在促进侧根发育方面活性较低,这表明未表征的VCs可能在解淀粉芽孢杆菌VCs介导的侧根形成中起到关键作用。
总结:
虽然在文章的最后,作者并没有解析出解淀粉芽孢杆菌VCs中调节侧根形成的关键活性化合物,但是本文为接下来的深入研究奠定了坚实的基础,并且该课题组很快就在Plant Cell & Environment上发表了另一篇研究论文。那么,回到这一篇文章中,大家会发现作者使用的双室培养皿为整个研究开了一个非常好的头,所以说巧妙的实验装置对整个研究的顺利开展真的非常重要!希望大家在研究过程中也能找到巧妙的实验装置,让自己的科研事半功倍。
了解完根际微生物对植物生长发育的影响之后,接下来让我们一起来学习一下微生物在植物抗病方面的调控作用吧。
图7 SR80对植物生长和防御的示意图(Liu et al., 2020)。
实验流程及结果:
作者首先利用qPCR对收集到的田间植物和土壤样品的Fusarium pseudograminearum(Fp)和菌落总数进行定量,结果证实了小麦冠腐病主要是由Fp引起的。并且几个防御相关的通路基因的表达量也与Fp的量呈现出正相关,说明在Fp侵染后植物的防御表达被正常的激活了。
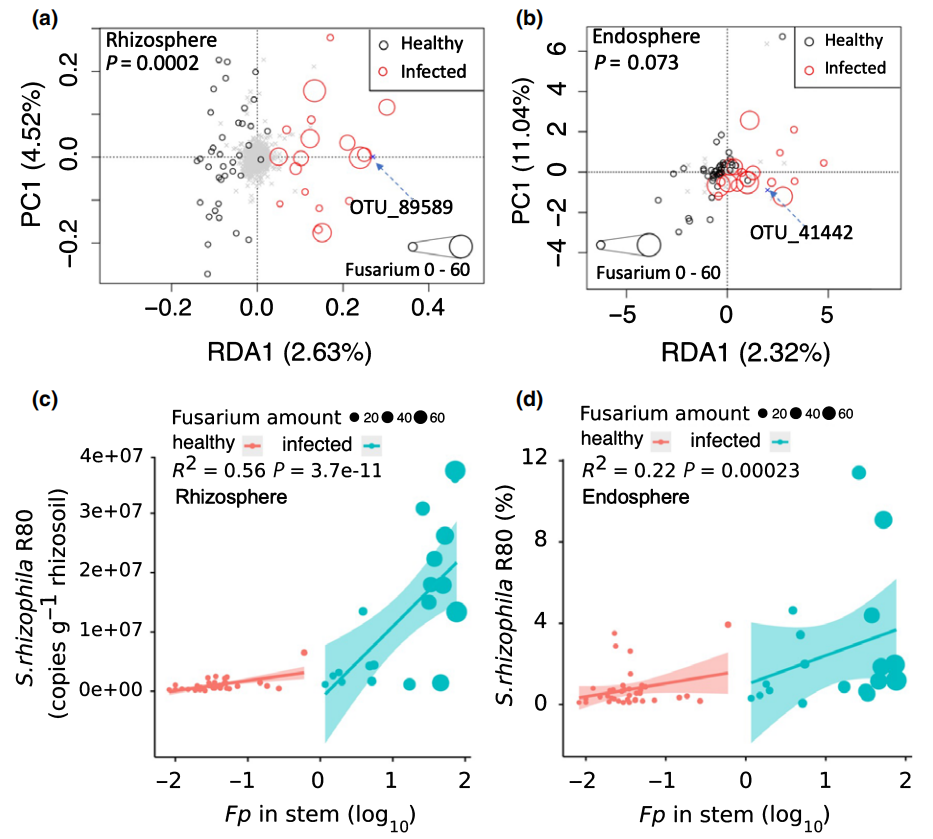
为了研究病原菌侵染对小麦根际和根内微生物群落的影响,作者通过RDA分析(冗余分析)比较了健康植株和感病植株的根际、根内的微生物差异。结果显示根际微生物中的OTU_89589、根内微生物中的OTU_41442和Fp有着强烈的相关性,而且经过比对发现这两个OUT均属于Stenotrophomonas spp.,进一步的分析表明这两个OUT(SR80)在感病植物中的丰度和Fp呈显著正相关(图8)。
图8 Fp感染后对小麦相关微生物群落的影响(Liu et al., 2020)。
接下来就是对目标菌株进行分离培养然后通过体外、体内试验验证它的生防功能。利用不同的微生物培养基从感病小麦的根部共分离到了179株菌株,其中Stenotrophomonas spp.R80的16S rRNA序列和RDA分析到的两个OTU有着100%的相似度。通过分析SR80的全基因组序列,再次证明SR80就是小麦被Fp侵染后特异性富集的优势微生物。
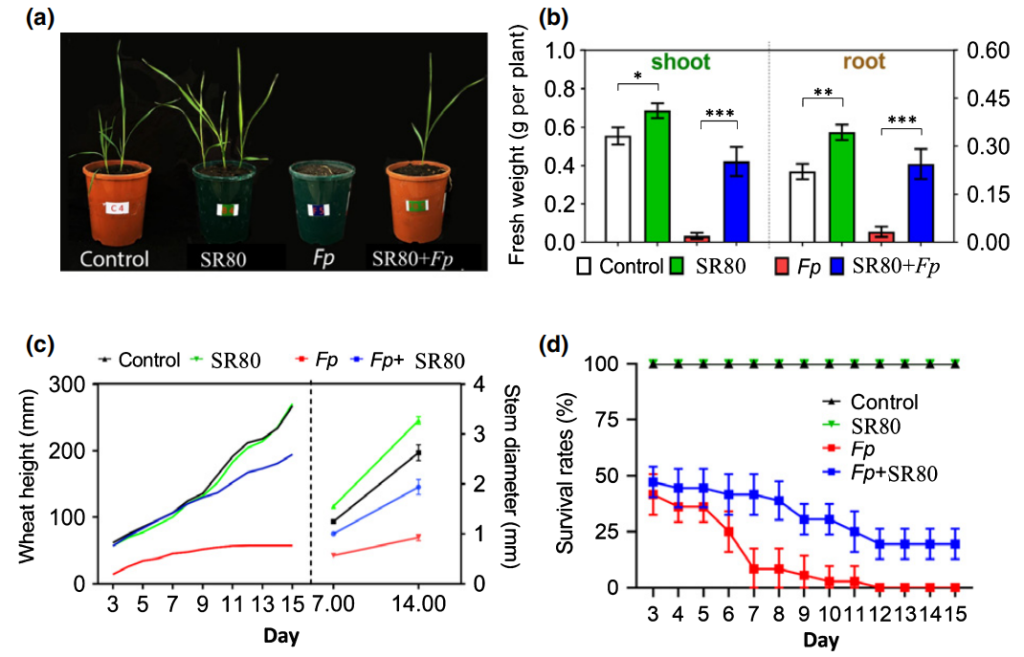
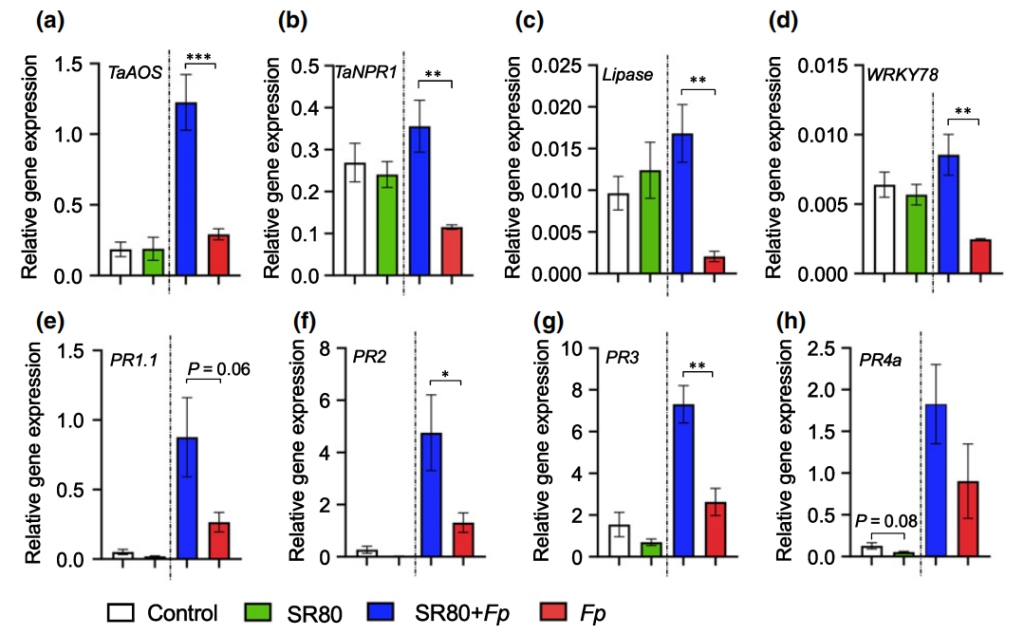
最后,作者通过回接实验验证了SR80对小麦生长和防御反应的影响,结果显示:在表型层面SR80能够促进小麦的生长,并且还能提高小麦对Fp的抗性(图9)。而在基因层面可以看到,在Fp侵染后,SR80的加入显著诱导了大多防御相关基因的表达,如TaNPR1、Lipase、WRKY78等(图10),说明SR80可以作为预警因子激活小麦的防御系统,以此来避免病害。
图9 SR80促进植物生长和防御病原菌(Liu et al., 2020)。
图10 不同处理条件下水杨酸、茉莉酸相关基因的表达情况(Liu et al., 2020)。
总结:
在这一篇文章中,作者从小麦的感病表型出发,首先明确了引起冠腐病的病原菌,接着通过微生物高通量测序分析,找到了潜在的功能微生物,这也再次说明,在做根系微生物相关研究时,大家一定要好好学习生信分析,毕竟关键性的实验结论都是需要通过分析获得的。与前两篇案例不同,作者在明确功能微生物的信息后,是采用微生物分离培养的方法,获得了单克隆菌株,并通过回接实验对其功能做了进一步的验证。总的来说,这篇文章的整体研究思路是属于非常经典的类型,值得大家学习借鉴哦,尤其是刚接触这方面研究的小伙伴们,一定要多读一些经典的研究案例,对于规划自己的后期的研究也是有帮助的。
References:
Liu H, Carvalhais LC, Kazan K, et al. Development of marker genes for jasmonic acid signaling in shoots and roots of wheat. Plant Signal Behav. 2016, 11(5): e1176654.
Lu T, Ke M, Lavoie M, et al. Rhizosphere microorganisms can influence the timing of plant flowering. Microbiome. 2018, 6(1): 231.
Liu H, Li J, Carvalhais LC, et al. Evidence for the plant recruitment of beneficial microbes to suppress soil-borne pathogens. New Phytol. 2020, 229(5): 2873-2885.
Li Y, Shao J, Xie Y, et al. Volatile compounds from beneficial rhizobacteria Bacillus spp. promote periodic lateral root development in Arabidopsis. Plant Cell Environ. 2021, 44(5): 1663-1678.
Liu Q, Cheng L, Nian H, et al. Linking plant functional genes to rhizosphere microbes: a review. Plant Biotechnol J. 2022.
Ruiz-Lozano JM, Porcel R, Aroca R. Does the enhanced tolerance of arbuscular mycorrhizal plants to water deficit involve modulation of drought-induced plant genes? New Phytol. 2006, 171(4): 693-8.
Rodriguez PA, Rothballer M, Chowdhury SP, et al. Systems Biology of Plant-Microbiome Interactions. Mol Plant. 2019, 12(6): 804-821.
Sun, L., Cao, M., Liu, F. et al. The volatile organic compounds of Floccularia luteovirens modulate plant growth and metabolism in Arabidopsis thaliana. Plant Soil, 2020, 456: 207-221.
Wang C, Li Y, Li M, et al. Functional assembly of root-associated microbial consortia improves nutrient efficiency and yield in soybean. J Integr Plant Biol. 2021, 63(6): 1021-1035.