近日,海军军医大学张磊教授团队挖掘鉴定得到黄花蒿中激素响应的miR160通过靶向下游转录因子ARF1负调控分泌型腺毛形成和青蒿素合成。本研究证明“miRNA-转录因子”模块深度参与黄花蒿活性倍半萜的合成与积累,为黄花蒿品质的分子改良提供了工程靶点。相关研究成果以“Profiling of phytohormone-specific microRNAs and characterization of the miR160-ARF module involved in glandular trichome development and artemisinin biosynthesis in Artemisia annua”为题在线发表在植物学知名期刊《Plant Biotechnology Journal》上。

以青蒿素为基础的联合疗法(artemisinin-based combination therapy, ACT)仍是世卫组织公认治疗疟疾最重要和最有效的手段。目前青蒿素主要依赖植物提取获得,其含量在黄花蒿中普遍较低(大多为干重0.1%-1.0%)。因此,挖掘黄花蒿优良性状靶点,通过代谢工程和分子育种手段,培育高含量黄花蒿种质,改良黄花蒿品种,将有效提升青蒿素的资源保障。青蒿素主要在叶片分泌型腺毛(glandular trichome)中合成和积累,受到植物激素的广泛调控,例如脱落酸(abscisic acid, ABA)、水杨酸(salicylic acid, SA)、茉莉酸甲酯(methyl jasmonate, MeJA)和赤霉素(gibberellins, GAs)等。前期,张磊教授团队通过挖掘黄花蒿转录组数据及共表达网络分析,获得在嫩叶、花芽及分泌型腺毛中特异表达的一个AP2/ERF家族转录因子AaTAR1(TRICHOME AND ARTEMISININ REGULATOR 1)(Mol Plant., 2015, 8: 1396)和一个R2R3 MYB转录因子AaTAR2(New Phytol., 2020, 228: 932),可以正调控分泌型腺毛发育及青蒿素合成。首次揭示水杨酸受体NPR1与碱性亮氨酸拉链家族转录因子AaTGA6互作正调控青蒿素合成(J Exp. Bot., 2019, 70: 3969)。通过全面解析和调控黄花蒿二萜生物合成途径,实现分泌型腺毛密度增加和个体合成能力提高,显著促进青蒿素合成,同时提高了对病原体的抗性(New Phytol., 2021, 230: 2387)。首次从黄花蒿中鉴定得到转录因子三元复合体TLR1和TLR2与WOX蛋白互作负调控青蒿素合成和分泌型腺毛发育(J Integr Plant Biol., 2022, 64: 1212)。以“发育-代谢”互作网络为核心的新型代谢工程策略(Sci Bull., 2016, 61: 26),丰富了调控青蒿素合成的路径。前述研究阐明了转录因子下游调控机制,但是其上游信号通路仍不清楚。小分子RNA(miRNA)参与转录后调控对植物器官和组织的生长发育至关重要,其是否在转录因子网络上游通过转录后调控参与青蒿素合成有待探索。
1、基于小RNA测序和降解组测序的候选miRNA筛选。
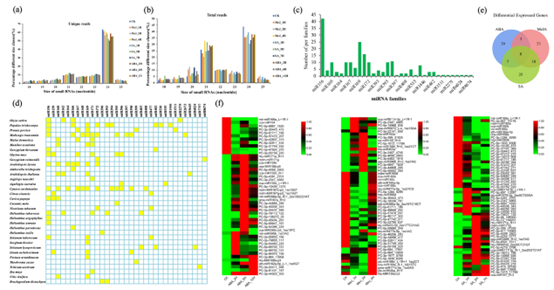
为了筛选和鉴定黄花蒿中可能参与青蒿素合成的激素响应miRNA,该团队对10个黄花蒿文库中miRNAs进行高通量测序和生物信息学分析,共鉴定出51个保守的miRNAs和52个新的miRNAs,其中miR160能够特异响应激素SA和MeJA的诱导,且诱导前后表达差异显著(图1)。
过表达miR160能够抑制拟南芥叶表毛状体以及黄花蒿分泌型腺毛的密度。采用短串联靶标模拟(Short tandem target mimic,STTM)技术介导miR160表达沉默,导致黄花蒿分泌型腺毛密度以及青蒿素含量显著增加。转录组测序发现青蒿素生物合成途径关键酶基因与miR160的表达水平呈负相关(图2)。以上结果说明miR160参与调控青蒿素的合成。
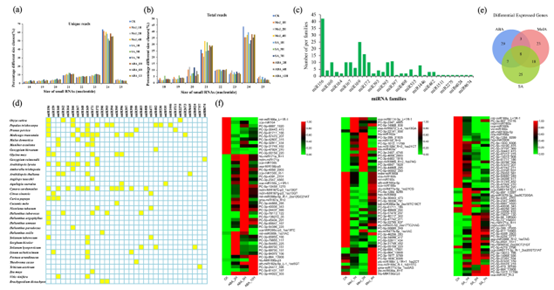
图2. MIR160转基因黄花蒿植株分析
2、miR160通过靶基因ARF1负调控青蒿素合成和分泌型腺毛形成
通过降解组测序对mRNA降解片段进行比对分析,结合5’ RACE和烟草瞬时转化等实验证明ARF1是miR160的主要靶基因。GO功能注释和KEGG分析提示ARF1是植物激素信号转导通路中的转录因子,影响着相关激素的调控信号传递。进而构建ARF1过表达、RNAi以及抗miR160剪切突变体ARFm1过表达载体并分别转化黄花蒿,结果显示ARF1可以提高黄花蒿叶片分泌型腺毛密度以及青蒿素含量。与ARF1相比,ARFm1的正向调控作用更显著(图3)。以上结果说明,miR160靶基因ARF1能够正调控黄花蒿分泌型腺毛形成和青蒿素合成。

图3. ARF1转基因黄花蒿植株分析
3、miR160-ARF1模块调控青蒿素合成的机制
进一步研究发现,ARF转录因子可以与生长素响应基因启动子区域中的生长素响应元件TGTCTC/GAGACA发生特异性结合,激活或抑制下游基因的表达。青蒿素合成途径关键基因AaDBR2启动子序列中含有两个生长素响应元件,通过体内外实验证实了ARF1直接结合AaDBR2启动子并激活AaDBR2的表达,从而提高青蒿素的合成水平(图4)。

图4. miR160-ARF1模块调控青蒿素合成的工作模型
综上所述,该研究以黄花蒿为模式药用植物揭示了分泌型腺毛发育和青蒿素合成的复杂调控网络,为基于“发育-代谢”互作网络开发腺毛细胞工厂,培育高青蒿素含量及抗病增强的黄花蒿新品种提供了潜在基因资源和全新思路。
福建技术师范学院食品与生物工程学院郭志英博士、海军军医大学郝锴硕士和上海中医药大学吕宗友副研究员为论文的共同第一作者,海军军医大学张磊教授、陈瑞兵副教授和上海市农业科学院张赫男副研究员为本文的共同通讯作者。本研究得到了国家自然科学基金和国家重点研发计划等项目的资助。
文章来源:植物生物技术Pbj







