在之前的推文中给大家介绍过表观组学、信号转导相关的知识,然后最近也有老师经常问到蛋白激酶相关的问题,小远非常幸运地发现了一篇文献,这篇文献涵盖了提到的所有内容,下面就让我们一起去看看这篇文献具体讲了些什么吧!
2022年8月在Nature上发表了一篇题为“Glucose-driven TOR-FIE-PRC2 signalling controls plant development”的研究文章。作者发现葡萄糖可以激活TOR激酶的活性,从而影响全基因组H3K27me3的水平,并且建立了TOR激酶和PRC2蛋白复合体之间的联系。此项研究为葡萄糖调控开花机理提供理论支持,有助于理解多细胞生物传递营养信息以重塑染色质状态和调控生长发育的功能。
染色质的表观遗传调控是细胞命运决定和发育转变的基础,是动植物中建立和维持细胞和器官特性的普遍机制。PRC2是一种多蛋白复合物,可以催化组蛋白H3K27me3,触发关键调控基因的表观遗传沉默,这些基因是细胞识别和可塑性所必需的,以促进各种发育程序的分化。尽管PRC2和TOR在植物的不同发育过程中都起着重要作用,但目前还没有发现PRC2介导的H3K27me3在器官发生中的全局调控与TOR相关的营养和能量动态信号网络之间存在直接的分子联系。
tor-es:作者设计的转基因拟南芥,这个转基因拟南芥的TOR激酶可以被雌二醇所抑制。
pS6K1:表示被TOR磷酸化的S6K1蛋白,用来观测TOR激酶的活性。
SAM:茎尖分生组织。
H3K27me3:H3组蛋白27号赖氨酸位点上存在3个甲基化修饰。
知识补充:
1、S6K磷酸化是TOR活性的一个进化保守指标;
2、较高浓度的Torin2(5-10μM)抑制DNA复制,因此需要定量掺入胸腺嘧啶类似物5-乙基-2′-脱氧尿苷(EdU)缓解抑制;
3、H3K27me3与发育转变和器官分化相关。
实验:
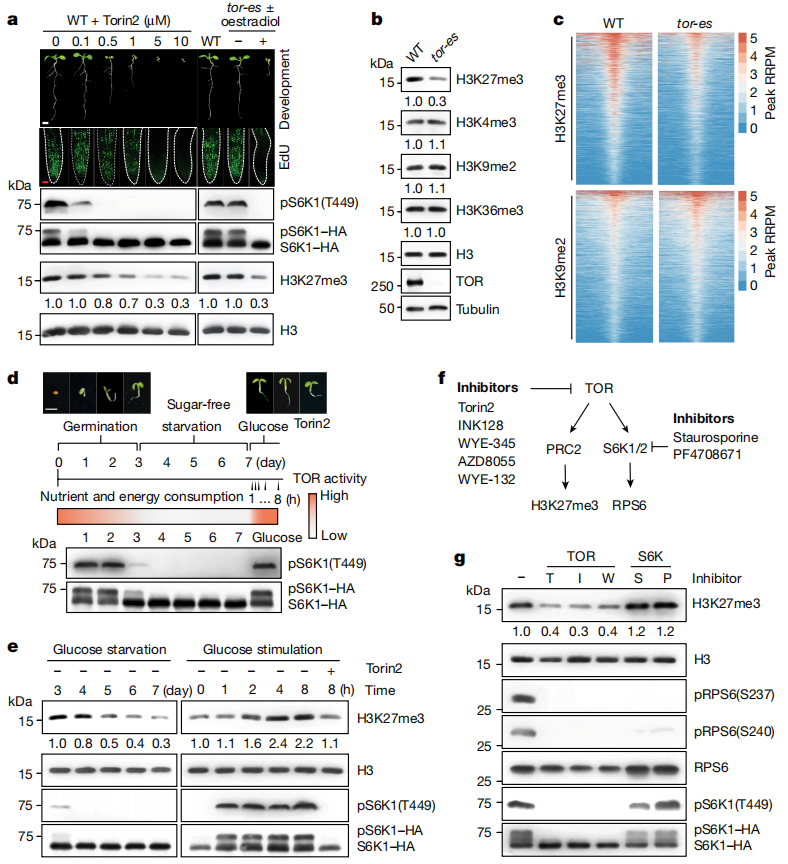
在胚后发育开始时,用不同浓度的强效ATP竞争性TOR抑制剂Torin2对液体营养培养基中发芽的种子进行系统处理。
结果:
1、Torin2从0.1μM开始强烈抑制;
2、较高浓度的Torin2延缓了地上部和根的发育。
3、用0.5-10μM Torin2处理使得拟南芥中TOR活性降低,从而逐渐降低了表观基因组标记H3K27me3的水平。
实验:
在雌二醇诱导的RNA介导的抑制TOR表达的突变株(tor-es)中对TOR信号在染色质调节中的功能进行验证。
结果:
发现tor-es表现出pS6K1(S449)、EdU染色、高H3K27me3和幼苗发育的抑制(图1a)。然而,H3K27me3的减少可能被低估了,部分原因是5-10μM Torin2或tor-es消除了DNA复制时的实验限制(图1a)。
接下来,作者为了确定TOR调控染色质修饰的特异性进行了以下两个实验。
实验:
作者通过免疫印迹分析7日龄野生型(WT)、tor-es拟南芥幼苗的主要组蛋白甲基化标记。
结果:
在tor-es突变体中H3K27me3,而不是H3K4me3,H3K9me2或H3K36me3被特异性还原(图1b)。
实验:
作者进一步用外源性参考基因组进行定量染色质免疫共沉淀,然后进行深度测序(ChIP-Rx-seq)。
结果:
平均密度图和热图显示,在tor-es突变体中H3K27me3的占用率整体下降,而H3K9me2水平不受影响。tor-es幼苗在整个基因组中检测到H3K27me3的减少(图1c)。
结论:
H3K27me3的积累或维持是由TOR调节的。
然后作者研究了TOR对H3K27me3的调控。
实验:
作者通过分析H3K27me3在拟南芥种子从异养向光自养过渡阶段(种子萌发后,种子储备的内源糖在发芽3天后会被消耗殆尽)的动态水平,研究在生理条件下H3K27me3的TOR调控。
知识补充:
光合作用或外源葡萄糖都可以激活TOR,通过pS6K1(T449)在光照下的磷酸化状态来监测TOR的激活情况(图1d,e)。
结果:
拟南芥幼苗在无糖液体培养基中萌发并生长,生长发育可自然进入可逆静止状态,萌发3~7后天拟南芥幼苗TOR活性下降(图1d)。在此期间,H3K27me3水平在含糖培养基中保持不变,但在糖饥饿阶段逐渐降低,这与TOR失活和幼苗发育停滞有关。添加葡萄糖的2小时内迅速激活了TOR活性和H3K27me3的重新积累,这表明染色质状态的重编程。而在葡萄糖刺激过程中,Torin2(10μM)会抑制H3K27me3水平的恢复(图1e)。
为了确保TOR激酶的特异性,将TOR对H3K27me3动态的调控与对pS6K1(T449)的作用区分开(图1a)。
实验:
作者用不同结构的针对TOR或S6K1的化学抑制剂处理幼苗(图1f)。
结果:
5种TOR抑制剂,但没有S6K1抑制剂,均导致H3K27me3的水平显著降低。
实验:
通过热图、平均密度图和基因组浏览器视图量化的ChIP-Rx-seq分析
结果:
Torin2或AZD8055对TOR激酶的抑制与tor-es突变体具有相似的效果,都导致了H3K27me3占用的全基因组减少(图1g)。
知识补充:
在7日龄葡萄糖缺乏的幼苗中,TOR复合物1(TORC1)、RAPTOR1(RAP1)和LST8-1的保守成分,介导的pRPS6(S237)和pRPS6(S240)的S6K磷酸化在rap1和lst8-1突变体中被差异阻断,而在rap2或lst8-2突变体中没有被阻断。
实验与结果:
rap1和lst8-1突变体用25mM葡萄糖刺激6h后仍能大幅恢复H3K27me3的水平(图1d-g)。这些结果与化学抑制剂筛选显示的调节pS6K1(T449)和H3K27me3的不同TOR活性阈值相一致(图1a、f、g),并表明在典型的TORC1之外,对于不同的底物TOR激酶激活存在差异。
知识补充:
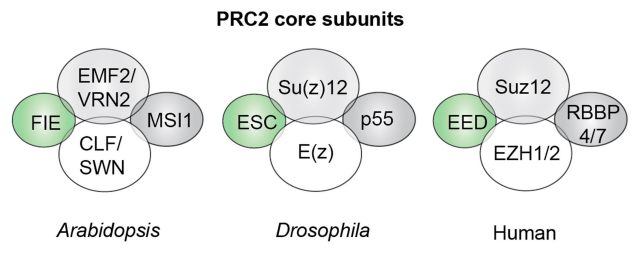
在胚胎发育过程中,拟南芥PRC2由四个进化上保守的核心亚基组成,包括甲基转移酶(CURLY LEAF(CLF)或SWINGER(SWN))、支架蛋白(EMBRYONIC FLOWER2(EMF2)或VERNALIZATION2(VRN2))、组蛋白结合蛋白MULTICOPY-SUPPRESSOR-OF-IRA1(MSI1)和FIE,其中FIE包含WD40结构折叠(图2)。
图2 拟南芥、果蝇和哺乳动物中进化保守的核心PRC2亚基。
FIE是PRC2复合体的一个重要而独特的组成部分,因为fie突变体消除了整体H3K27me3,并限制了萌发后的器官发生。
FIE被拟南芥的TOR激酶直接磷酸化。
实验:
作者首先在tor-es或Torin2处理的幼苗中检测了PRC2核心成分的转录物和蛋白质水平。
结果:
结果只有CLF转录本和EMF2蛋白部分减少。
根据这一结果作者推测TOR可能与核心成分相互作用并磷酸化激活PRC2。
实验:
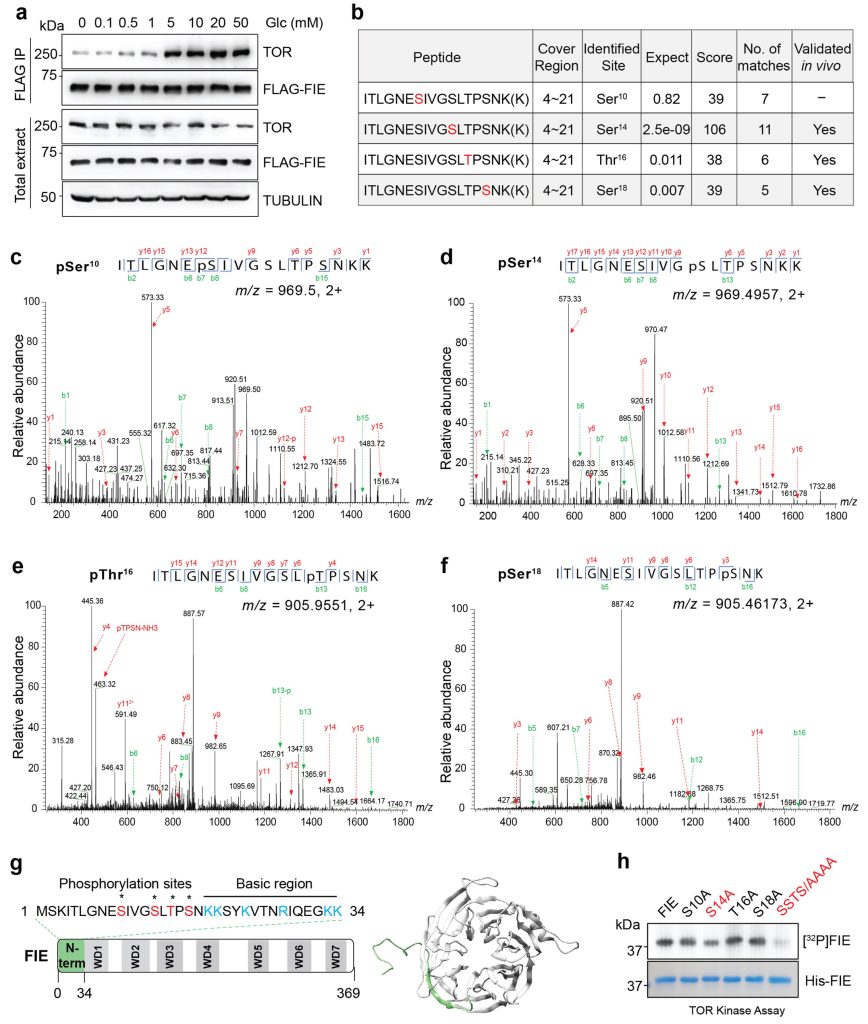
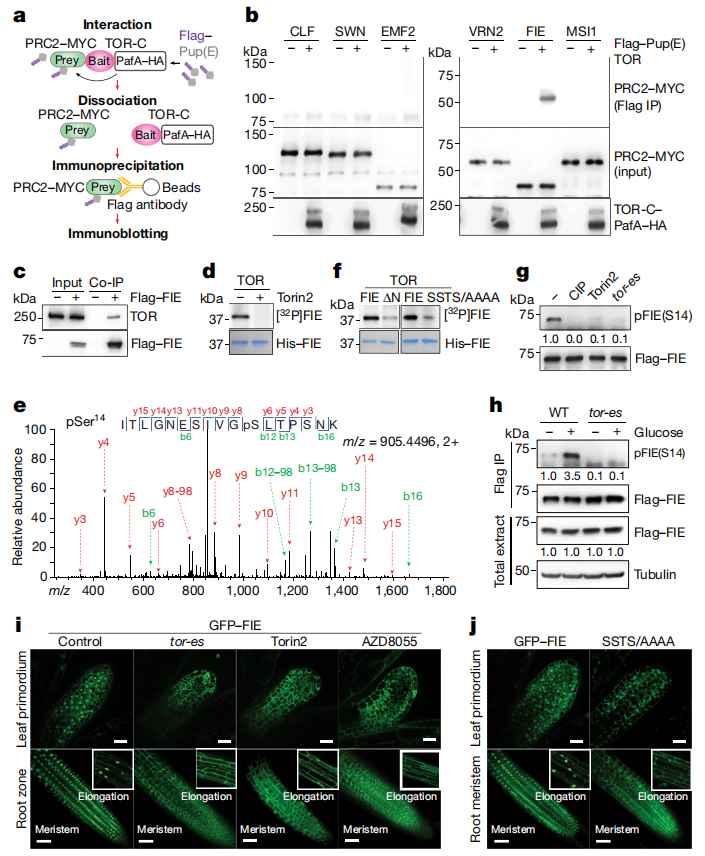
作者使用基于脉冲化的相互作用标记(PUP-IT),即邻近标记系统,来识别TOR的候选底物。作者生成了细菌Pup连接酶(PafA)和TOR的C端激酶结构域(TOR-C-PafA-HA)的血凝素标记蛋白融合,并在叶肉原生质体中与Flag标记的Pup(E)和MYC标记的PRC2成分共同表达(图3a)。
结果:
FIE与TOR特异性相互作用(图3b)。
实验:
免疫共沉淀实验与磷酸化实验。
结果:
通过免疫共沉淀证实了TOR和FIE在体内的特异性相互作用,在5-50mM葡萄糖刺激2h后,该相互作用显著增强(图3c);TOR对FIE的磷酸化反应被Torin2特异性且完全抑制(图3d)。
作者验证了TOR与FIE蛋白的互作之后,进一步确定了FIE中的TOR磷酸化位点。
实验:
作者通过液相色谱-串联质谱(LC-MS/MS)分析了体外TOR激酶的磷酸化位点。作者在FIE的N端结构域内确定了四个主要的磷酸化位点:S10,S14,T16和S18。基于胚胎外胚层发育蛋白(EED)(FIE的人类同源物)的FIE结构建模,确定了灵活且富含丝氨酸和苏氨酸的N端结构域作为磷酸化的潜在靶点。
图3 TOR直接与FIE相互作用并磷酸化。图 TOR直接与FIE相互作用并磷酸化。a,葡萄糖在体内增强了TOR和FIE之间的相互作用。Flag标记的FIE与饥饿(7 d)和葡萄糖刺激的植物的TOR共免疫共沉淀(Co-IP)。b,LC-MS/MS分析鉴定的FIE的TOR磷酸化位点的总结。列出了相应的磷酸肽及其覆盖区域。期望值,期望值表示肽随机匹配的概率。值越小,说明多肽鉴定越重要。c,体外TOR激酶检测pS10肽的质谱分析。d,体外TOR激酶法测定pS14肽的质谱分析。e,体外TOR激酶测定pT16肽的质谱分析。f,体内FLAG-FIE免疫沉淀中pS18肽的质谱分析。g,预测FIE结构。N端34 aa序列显示为通过质谱鉴定的磷酸化位点(红色)和碱性残基(蓝色)。通过建模预测的FIE的三维结构显示,灵活的N端域用绿色突出显(右)。h,通过体外激酶分析,FIE变体的TOR磷酸化。以FIE蛋白的单突变体或四突变体为底物。放射自显影显示了TOR对His-FIE的磷酸化(上)。考马斯亮蓝染色显示蛋白含量控制(底部)。
结果:
在葡萄糖刺激的幼苗中,通过LC-MS/MS分析验证了内源性FIE中pS14、pT16和pS18的磷酸化(图3e)。S14A是FIE中唯一一个在TOR激酶试验中表现出显著磷酸化降低的单一突变,其他磷酸化位点可能具有部分冗余和合作功能。FIE的N端34残基缺失(ΔN)或四重磷酸化位点突变(SSTS突变为AAAA)几乎没有被TOR磷酸化(图3f)。FIE蛋白的关键磷酸化位点在不同的开花植物中很大程度上是保守的,包括拟南芥、芸苔属、大豆、水稻、玉米和小麦,也可能在植物FIE的同源物果蝇(ESC)和人类(EED)中。
找到FIE中被TOR磷酸化的位点之后,为了从功能上验证和量化内源性FIE磷酸化,作者又进行了下面的实验。
实验与结果:
由于S14是体外和植物中通过LC-MS/MS分析验证的富集最多和最可信的位点,研究人员生成了一种针对FIE在S14位点的磷酸化肽特异性抗体(图3e)。该抗体特异性地识别TOR磷酸化的FIE,但不识别S14A突变体。用小牛肠磷酸酶处理后,幼苗的免疫沉淀未检测到体内FIE在S14位点的磷酸化(pFIE(S14))。此外,经Torin2处理的幼苗和tor-es突变体的pFIE(S14)基本消失(图3g)。免疫印迹分析显示,饥饿处理后,5-50mM葡萄糖在2h内显著诱导pFIE(S14);这种影响在7日龄的tor-es幼苗中则完全消失(图3h)。
结论:
FIE的N端在葡萄糖-TOR信号转导中被直接磷酸化。
接下来作者探讨了TOR磷酸化如何调节FIE的功能。
实验与结果:
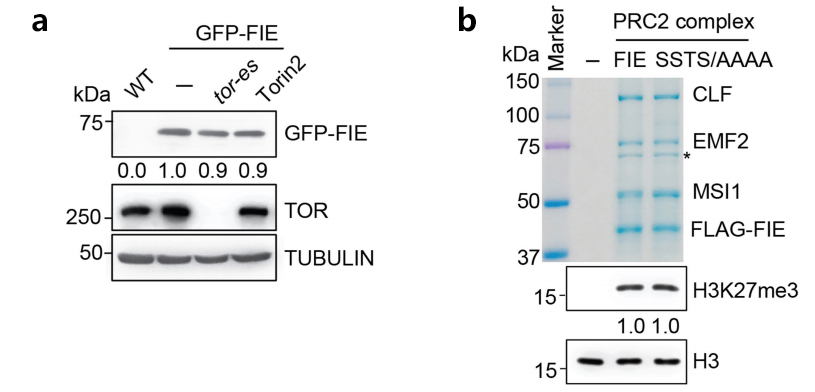
免疫印迹分析显示,在tor-es或Torin2处理的植株中,GFP-FIE的稳定性没有受到影响(图4a)。重组拟南芥PRC2与FIE的野生型或FIE磷酸化位点SSTS/AAAA突变体形成的复合物在体外表现出相似的H3K27me3甲基转移酶活性(图4b)。
图4 a,在tor-es或Torine2处理7d的幼苗中,GFP-FIE蛋白水平不受调控。利用特异性TOR抗体进行免疫印迹检测内源性TOR。Tubulin作为对照蛋白。b,利用来自昆虫Sf9细胞的H3底物和重组拟南芥PRC2复合物进行体外组蛋白甲基转移酶分析。考马斯亮蓝染色的复合物用Flag标记的WT或FIE的突变体(SSTS/AAAA)纯化。采用免疫印迹法检测H3K27me3,并与相应的H3对照进行定量。
知识补充:
据报道,细胞质中的FIE-GFP只与MEDEA(MEA)甲基转移酶相互作用,而不与花序中的CLF或SWN相互作用。据推测,细胞质中的FIE-GFP可能具有除染色质甲基化外的非核功能。
实验:
作者测试了TOR磷酸化促进GFP-FIE从细胞质到细胞核的易位以激活PRC2的可能性(图5)。
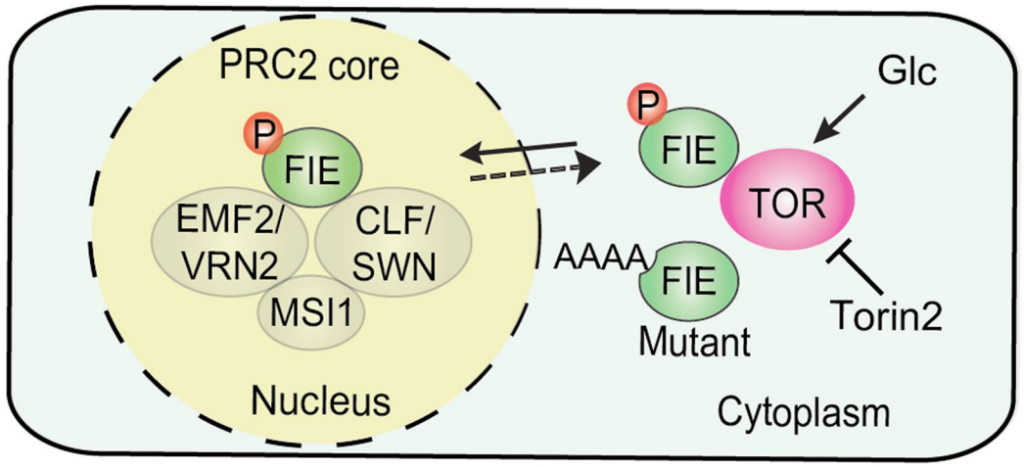
图5 一种由TOR调控的FIE细胞质-核易位模型。
结果:
与在含糖培养基中生长的对照植物的主要核定位不同,GFP-FIE主要在tor-es植物的叶原基、根伸长和分生组织区分化的细胞质中检测到,或者在Torin2或AZD8055处理5天幼苗后检测到(图6i)。然而,Torin2处理并未改变根中其他PRC2组分GFP-CLF、SWN-GFP、EMF2-GFP和MSI1-GFP的核定位。值得注意的是,4个TOR磷酸化位点(SSTS/AAAA)的突变影响了GFP-FIE在原生质体和转基因植物中的核易位,而不影响蛋白水平(图6j)。在糖饥饿阶段,根伸长区细胞质与核GFP-FIE的比值(C:N比值)在数量上增加,饥饿5天后经葡萄糖处理,该比值迅速下降。延时实时成像显示,葡萄糖在2-4h内迅速刺激GFP-FIE的实时核易位,与H3K27me3水平的升高相一致(图1e)。与传统观点不同的是,预先形成的核PRC2中FIE作为一个关键的静态成分与CLF或SWN相互作用,并与核中的H3K27me3结合,作者的研究结果显示FIE作为一个分子桥梁,直接将葡萄糖-TOR信号与PRC2调控的H3K27me3动态和基因沉默联系起来。
实验:
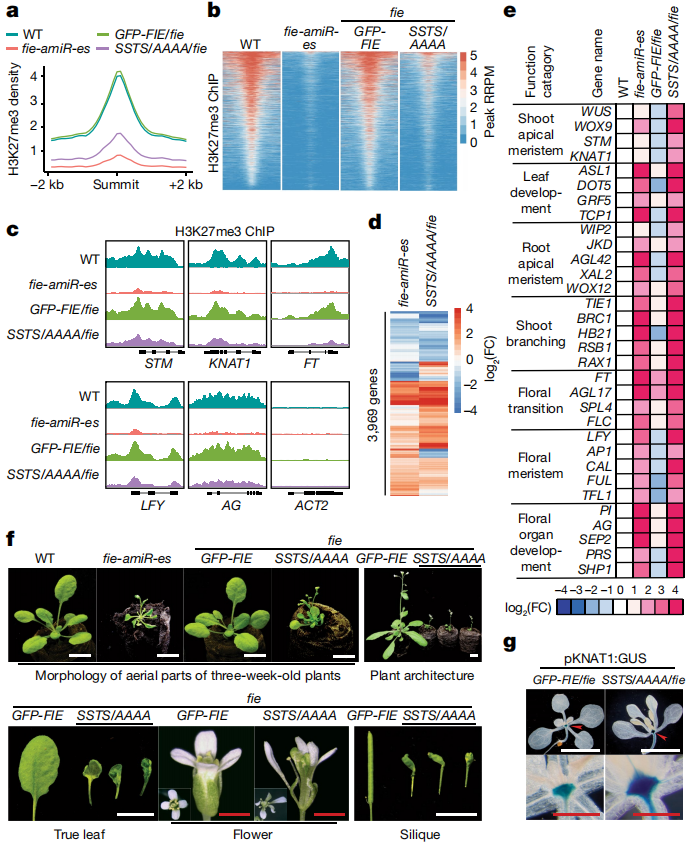
作者在FIE启动子的控制下,将具有或不具有磷酸化位点突变SSTS/AAAA的GFP-FIE引入杂合fie/+植物。选择纯合子植物GFP-FIE/fie和SSTS/AAAA/fie进行全基因组H3K27me3和转录组分析。作者还生成了绕过胚胎致死性的fie突变体,以与SSTS/AAAA/fie进行平行比较。
结果:
雌二醇诱导的fie-amiR-es转基因系没有了FIE蛋白,并表现出一致的异常小、狭窄而卷曲的真叶与偶尔出现的FIE共抑制植物有一些共同的特征。fie突变种子产生于杂合的fie/+cdka;1/+,其花粉在萌发后只形成未分化的愈伤组织样结构,并阻碍进一步的胚后发育。SSTS/AAAA/fie和fie-amiR-es突变体的作用较弱,但仍具有光合作用或外源葡萄糖驱动的胚胎后发育和器官发生,这些为研究葡萄糖-TOR-FIE-PRC2信号网络的生理功能提供了有价值的平台。
作者进一步完善TOR-FIE-PRC2信号网络,做了以下实验。
实验与结果:
通过RNA-seq转录组分析,共发现3969个基因(|log2倍数变化|≥1;q≤0.05,n=3)在SSTS/AAAA/fie和fie-amiR-es植株的14天地上部中存在调控异常(图7d)。为了揭示TOR-FIE-PRC2信号网络的生物学功能,作者定义了假定的直接靶基因,这些基因由H3K27me3标记,并且在SSTS/AAAA/fie突变体中上调。对1081个(log2倍数变化≥1;q≤0.05)TOR-FIE-PRC2靶基因进行基因本体分析,发现控制广泛发育程序的转录因子和调控因子显著富集。作者鉴定了192个转录因子基因,包括在干细胞身份、细胞命运决定、模式和发育转变中发挥重要作用的主调控基因,这些基因在SSTS/AAAA/fie和fie-aimR-es突变体中显著上调并与H3K27me3的减少相关(图7e)。特别是,在突变植株中,决定不确定细胞命运的茎尖分生组织(SAM)特异性转录因子的表达增加。在14天的幼苗中检测到根静止中心和干细胞调控因子的异常表达。控制营养到生殖过渡的关键花整合因子在营养苗期被提前抑制。作者还观察到了幼苗中花的分生组织和花的同源性基因的异位激活。在SSTS/AAAA/fie和fie–amiR–es突变体中,调控叶片发育的重要转录因子基因和枝条分枝的重要转录因子基因都被过表达(图7e)。
在饥饿和最佳葡萄糖条件下的液体培养基中培养7天的幼苗,以及在tor-es中进行RT-qPCR分析显示,TOR-FIE-PRC2-H3K27me3靶基因亚群表达上调,染色质免疫沉淀定量PCR(ChIP-qPCR)分析显示,这与H3K27me3的减少有关。一致地,在糖饥饿的7天幼苗中,葡萄糖启动了对这些基因的抑制,这与6h时H3K27me3的升高相关。尽管在7天幼苗中,tor-es或葡萄糖的靶基因调控比14天SSTS/AAAA/fie和fie–aimR–es突变株更为微妙(图7e),但作者的研究结果表明,葡萄糖-TOR-FIE-PRC2信号通路通过表观基因组机制控制编码关键转录因子的靶基因。在器官、组织和单细胞水平的胚胎后发育不同阶段的不同过程中,不同的TOR信号传导机制在表观基因组和转录组控制的时空调控中的详细整合将需要进一步的研究。
为了研究FIE的TOR磷酸化对植物发育的影响,作者进行了下面的实验。
实验与结果:
在SSTS/AAAA/fie植物中,H3K27me3和转录组重编程的结果明确表现为指导植物分化和发育的先天遗传程序的时间和空间顺序被严重破坏。值得注意的是,SSTS/AAAA/fie突变体在21~24日龄植株发育阶段较长的情况下,表现出严重异常的发育表型,与fie-aimR-es相似,包括开花早、叶片、花和角果的大小、形态和模式异常、微型植物结构减少和顶生花和不育(图7f),以及pKNAT1:GUS报告基因显示的SAM增大(图7g)。GFP-FIE在突变体中的表达完全恢复了器官的大小和形态、整株结构、发育时间和育性(图7f)。这些数据表明,FIE的TOR磷酸化在整个植物生命的不同胚后发育过程中,对PRC2介导的表观基因组重编程起着至关重要的作用。
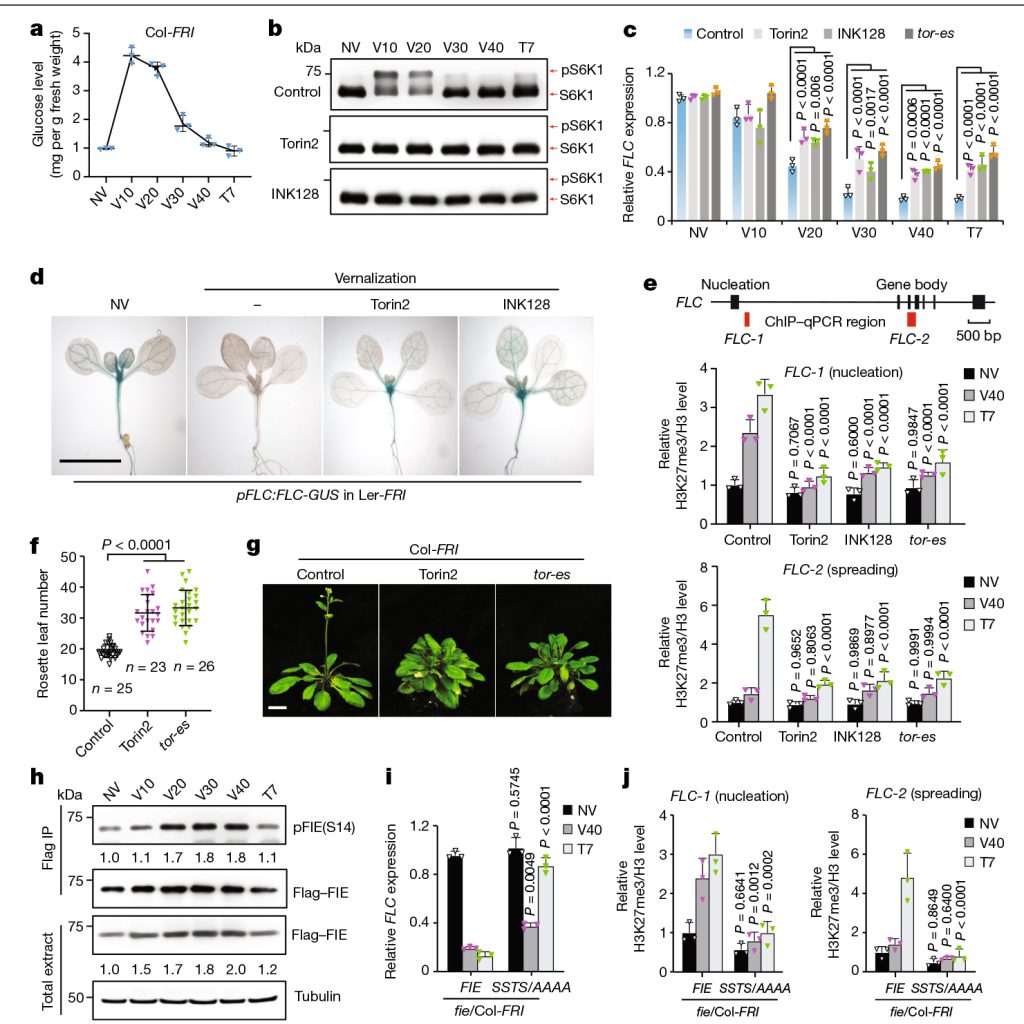
为了加强葡萄糖-TOR-FIE-PRC2信号传递与春化之间的分子联系,作者定量分析了FLC的表达、PRC2介导的FLC染色质上的H3K27me3标记和开花时间。将FRI引入tor-es、GFP-FIE/fie和SSTS/AAAA/fie突变体中进行比较分析。在特定的TOR抑制剂和tor-es突变体中,削弱了冷诱导的FLC抑制(图8c),而INSENSITIVE3(VIN3)的激活在相同的冷暴露中不受影响。为了监测FLC在完整植物中的表达动态和位置,作者通过组织化学染色观察了携带FLC启动子和GUS翻译融合的转基因pFLC:FLC-GUS(Ler-FRI)株系。与RNA表达结果一致,TOR抑制剂可抑制春化后SAM和维管系统中FLC报告基因表达的降低(图8d)。
PRC2对FLC的冷诱导沉默分为两个阶段:初始成核和H3K27me3在FLC位点上的传播。作者发现tor-es或TOR抑制剂对这两个阶段都有损害(图8e)。此外,春化过程中条件性TOR缺乏的植物在恢复到TOR活性充分的环境温度后,表现出开花时间延迟(图8f,g)。这些结果表明,FLC在春化过程中的抑制需要TOR的活性。长时间的冷处理显著增加了葡萄糖(图8a)、pS6K1(图8b)、pFIE(S14)、总FIE蛋白水平(图8h)和GFP-FIE的定量核定位的积累,从而导致了H3K27me3的初始成核。即使在春化30天后,葡萄糖大幅下降,FIE的磷酸化和核定位仍持续,这可能是由于冷处理下光合作用有限的持续能量消耗。在植物恢复到温暖温度后,稳态葡萄糖水平和TOR活性以及FIE磷酸化和定位恢复,支持正常和动态的光合作用驱动的葡萄糖-TOR-FIE信号通路,以维持和传播H3K27me3。春化过程中pS6K1和pFIE去磷酸化的差异动力学(图8b,h)表明,不同的葡萄糖-TOR底物对不同的下游信号传导过程可能表现出不同的动力学和调控。在SSTS/AAAA/fie突变体中,春化介导的FLC抑制在冷暴露期间减弱,但在冷暴露后恢复(图8i),类似于春化缺陷的vin3、vrn2和vrn5突变体。同样,在SSTS/AAAA/fie突变体植株中,H3K27me3在FLC位富集的成核和扩散被消除(图8j)。总之,这些数据表明,葡萄糖-TOR信号通路中特定的FIE磷酸化作用调节了春化介导的开花。
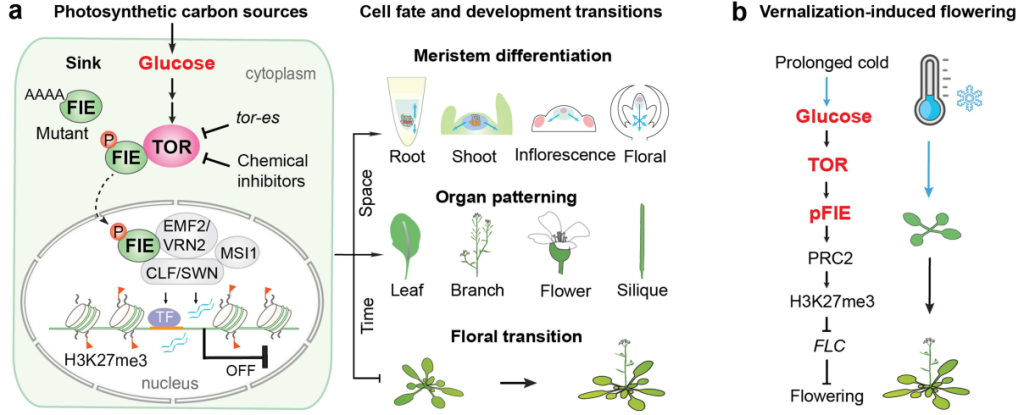
图9 葡萄糖-TOR-FIE-PCR2信号网络控制不同发育程序的模型。a,葡萄糖-TOR-FIE-PRC2信号网络。源叶的最佳光合作用产生糖,糖被运输到需要能量的汇,包括顶端和侧分生组织,发育的叶原基和幼叶、根、花、果实和种子,以支持它们的生长和发育。在碳汇中,来源于局部或全身碳源的葡萄糖被代谢激活TOR激酶,TOR激酶与细胞质中的FIE相互作用并磷酸化。磷酸化的FIE易位到细胞核以增强PRC2活性,PRC2被转录因子(TF)、顺式调节元件(橙色条)和非编码RNA(蓝色波浪线)招募到特定的染色质位点,沉积H3K27me3,沉默控制不同发育程序的主转录调控因子。这种分子机制协调植物的发育命运,器官发生,模式形成,并提供了葡萄糖-TOR信号与发育之间的直接和全面的机制联系。b,葡萄糖-TOR-FIE-PRC2-FLC中继替代默认的营养发育程序,以促进开花。这一分子机制可能是葡萄糖与长时间低温暴露刺激的春化介导的开花之间的联系。
小远已累晕,没有叨叨……
原文链接:https://doi.org/10.1038/s41586-022-05171-5