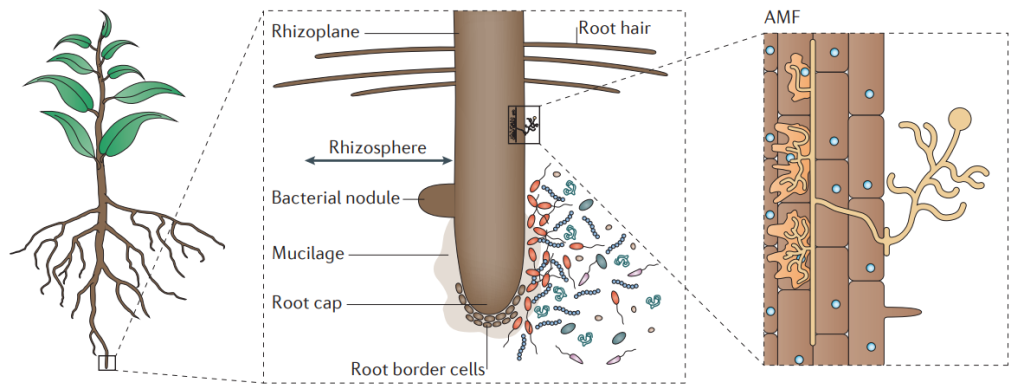
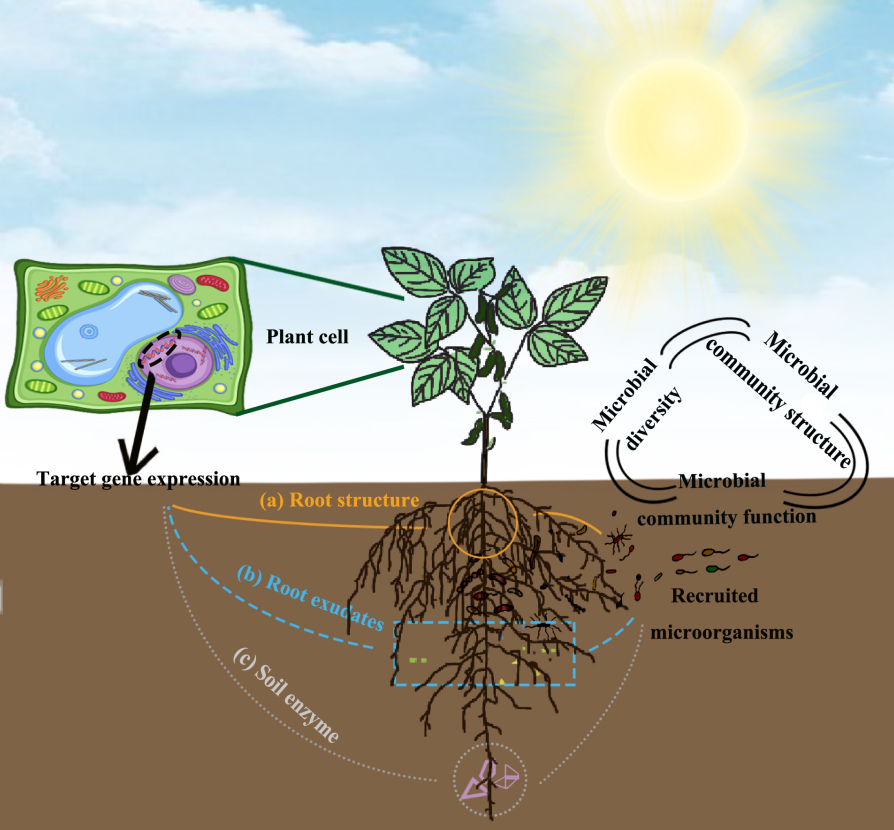
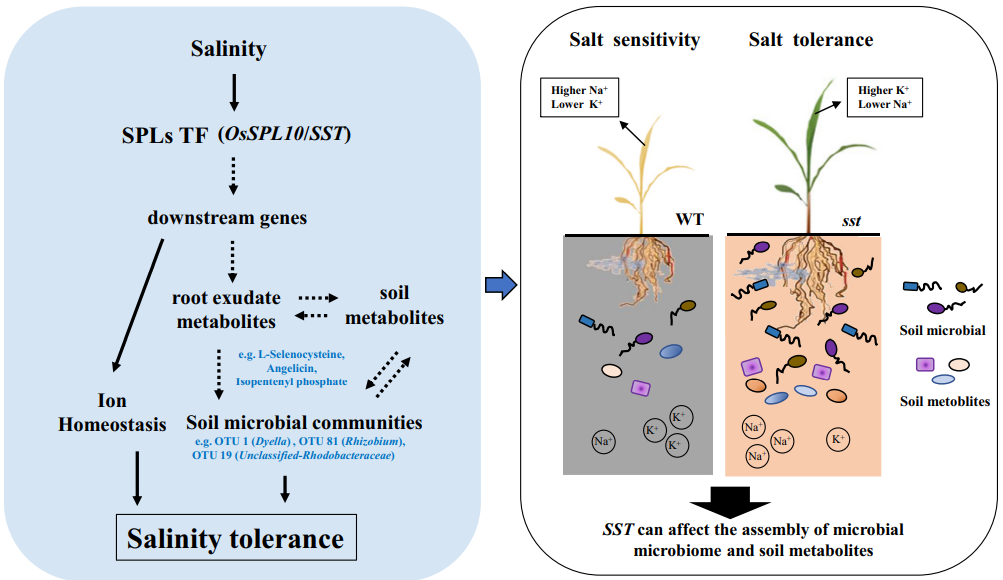
在研究植物发育、营养吸收、抗病抗逆等相关基因的功能时,一般都会用到转基因技术来进行验证。例如,通过对目的基因进行过表达,来增加目的蛋白的含量,进而增强或减弱其在生理生化过程中的作用,并通过比较过表达材料与野生型材料在表型、生理生化上的一系列差异来研究该基因的功能。同时,过表达材料也可以和基因敲除、敲低的突变体材料相互比较、互相印证,从而进一步确定基因的功能,再接着,大家可以做些蛋白实验,继续拓展基因调控网络,更多内容可参考文章“常规基因功能研究套路总结”。在整个研究过程中,大家会获得许多的转基因材料,它们除了能够完成上述的实验外,换一个研究角度,就可以继续在植物——微生物互作研究中发光发热。本期伯小远就带领大家一起看看,如何用我们手头的转基因材料,开启植物功能基因与根际微生物的互作研究~
长期以来,人们发现假单胞菌(Pseudomonas fluorescens)会在多种抑病土壤系统中富集,并且通过多种机制抑制土壤病害。微生物的高通量测序也证实了病原体感染后植物根际假单胞菌属会广泛富集。近期的研究表明,具有多种功能的受体激酶FERONIA(FER),通过调节鸟苷三磷酸酶ROP2(GTPase)维持根系内的基础活性氧(ROS)水平,进而负调控假单胞菌在根际的定殖(Song et al., 2021)。值得注意的是,ROP途径也参与调控大豆与根瘤菌共生,这表明该途径在植物进化及与共生微生物相互作用中起着关键作用。
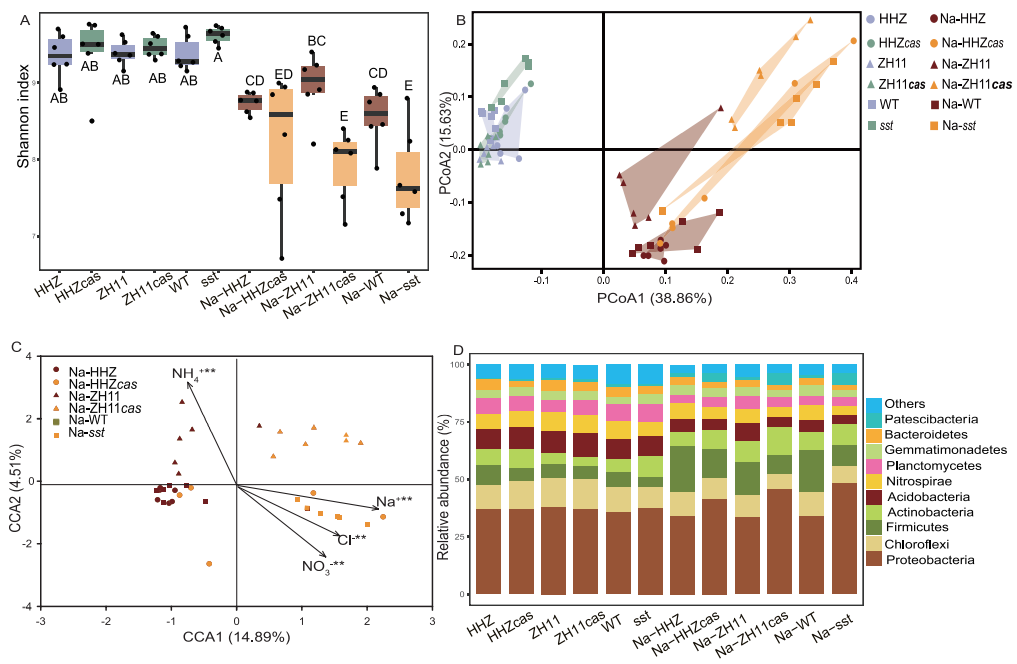
图4 (A)盐处理和SST基因对水稻根际细菌Shannon多样性指数的影响;(B)基于Bray-Curtis相似性的主坐标分析(PCoA);(C)典型对应分析(CCA);(D)细菌门水平的相对丰度分析(Lian et al., 2020)。
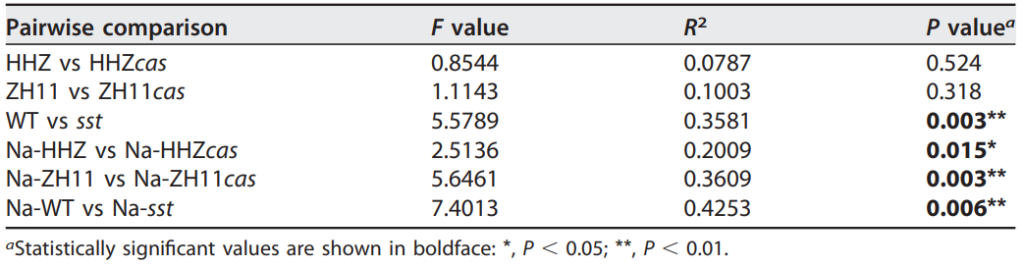
表1 用PERMANOVA评估水稻基因型对细菌群落结构的影响(Lian et al., 2020)。
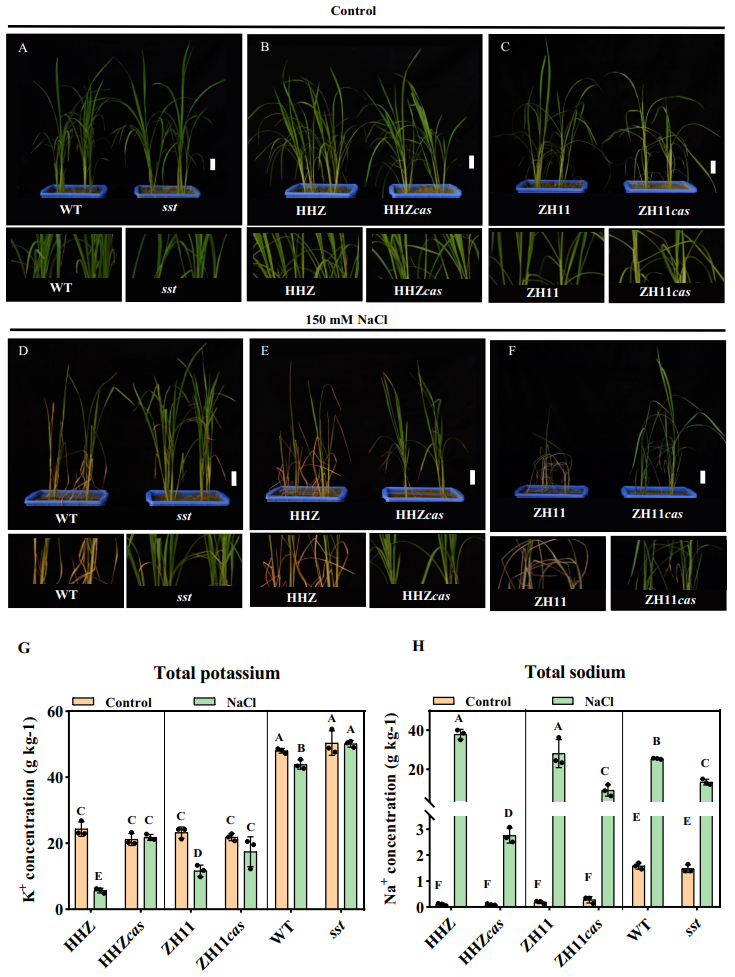
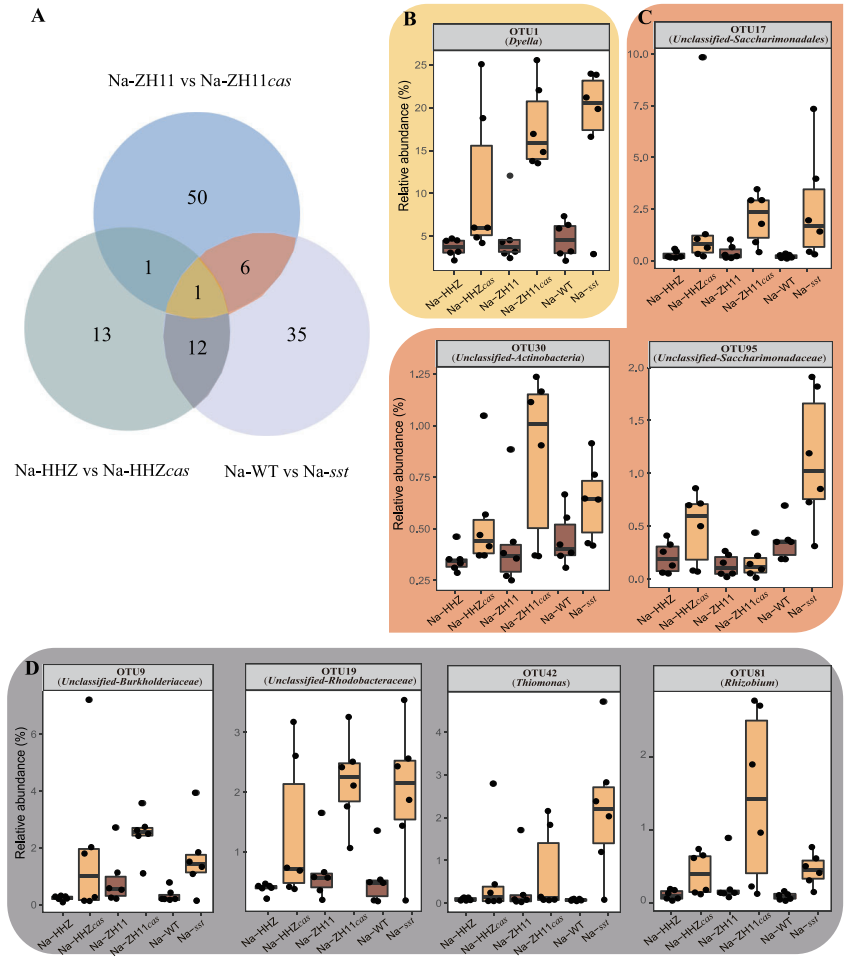
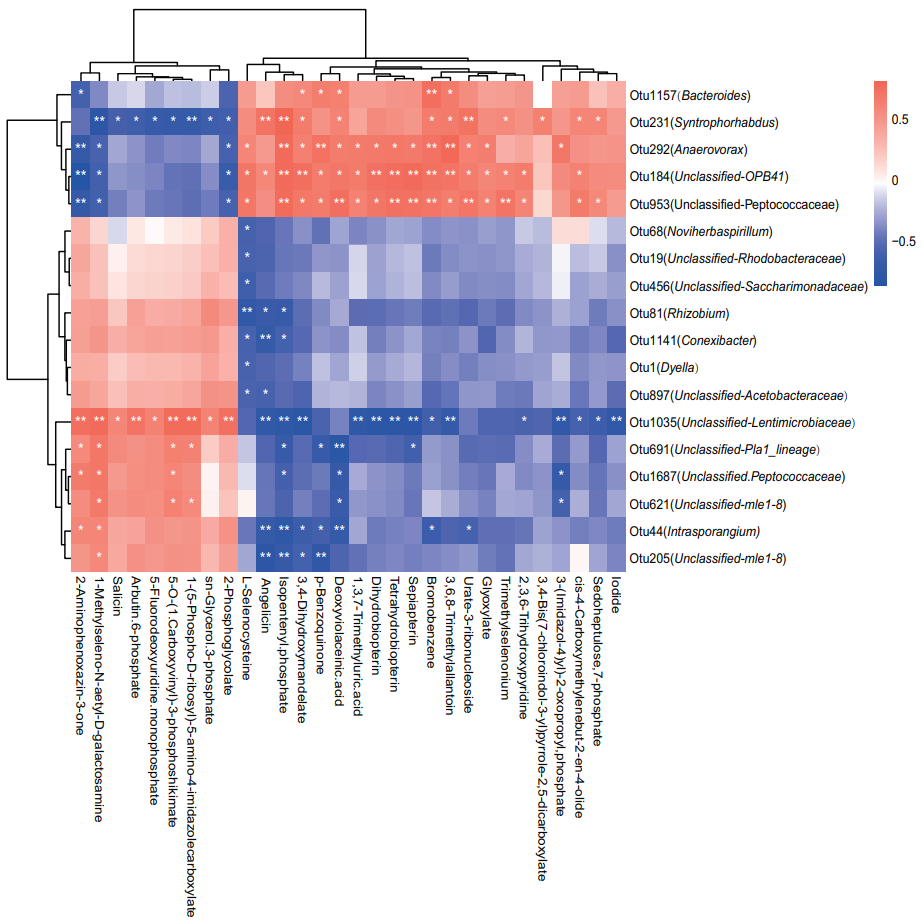
对盐胁迫条件下的根际细菌种类进一步分析发现,OTU1,OTU17,OTU19,OTU9,OTU81,OTU42,OTU30和OTU95在ZH11cas、HHZcas和sst基因型的根际的丰度分别比ZH11、HHZ和WT基因型的高(图5)。在先前的报道中了解到与OTU19同一类的一些红杆菌能够产生IAA,这类微生物或许能够提高水稻对盐胁迫的抗性。
[注:在细菌16S多样性研究中,目前主要按照序列97%的相似性进行OTU聚类,一个OUT代表属于同一类的微生物]
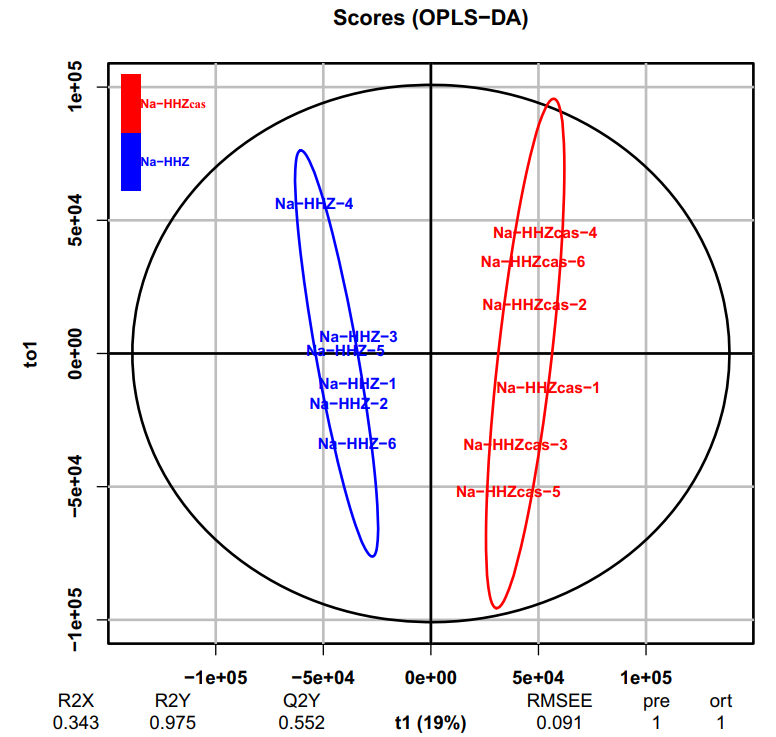
图6 正交偏最小二乘判别分析(OPLS-DA)结果(Lian et al., 2020)。
另外,在常规基因功能研究过程中,如果额外添加一些微生物数据分析也会给自己的文章添加不少亮点,具体的研究思路可以参考发表在Nature Plants上题为“Root-secreted bitter triterpene modulates the rhizosphere microbiota to improve plant fitness”的文章,除此之外,还有很多其它的文章,大家如果感兴趣的话可以通过检索关键词如“rhizosphere microbiota”来查看相关的文献,另外,大家也可以通过查看一些植物微生物领域的大课题组的研究成果来学习相关的研究思路。总之,小远想说大家手中的转基因材料研究完之后可以试着换一条思路,或许研究根际微生物也是不错的选择哦。
References:
Badri DV, Quintana N, El Kassis EG, et al. An ABC transporter mutation alters root exudation of phytochemicals that provoke an overhaul of natural soil microbiota. Plant Physiol. 2009, 151(4): 2006-17.
Chen ZC, Liao H. Organic acid anions: An effective defensive weapon for plants against aluminum toxicity and phosphorus deficiency in acidic soils. J Genet Genomics. 2016, 43(11): 631-638.
Cordovez V, Dini-Andreote F, Carrió n VJ, et al. Ecology and Evolution of Plant Microbiomes. Annu Rev Microbiol. 2019, 73: 69-88.
Liu J, Li Y, Wang W, et al. Genome-wide analysis of MATE transporters and expression patterns of a subgroup of MATE genes in response to aluminum toxicity in soybean. BMC Genomics. 2016, 17:223.
Li GZ, Wang ZQ, Yokosho K, et al. Transcription factor WRKY22 promotes aluminum tolerance via activation of OsFRDL4 expression and enhancement of citrate secretion in rice (Oryza sativa). New Phytol. 2018, 219(1): 149-162.
Lian T, Huang Y, Xie X, et al. Rice SST Variation Shapes the Rhizosphere Bacterial Community, Conferring Tolerance to Salt Stress through Regulating Soil Metabolites. mSystems. 2020, 5(6): e00721-20.
Liu Q, Cheng L, Nian H, et al. Linking plant functional genes to rhizosphere microbes: a review. Plant Biotechnol J. 2022.
Philippot L, Raaijmakers JM, Lemanceau P, et al. Going back to the roots: the microbial ecology of the rhizosphere. Nat Rev Microbiol. 2013, 11(11): 789-99.
Song Y, Wilson AJ, Zhang XC, et al. FERONIA restricts Pseudomonas in the rhizosphere microbiome via regulation of reactive oxygen species. Nat Plants. 2021, 7(5): 644-654.
Yu P, He X, Baer M, et al. Plant flavones enrich rhizosphere Oxalobacteraceae to improve maize performance under nitrogen deprivation. Nat Plants. 2021, 7(4): 481-499.
Zhou Y, Yang Z, Xu Y, et al. Soybean NADP-Malic Enzyme Functions in Malate and Citrate Metabolism and Contributes to Their Efflux under Al Stress. Front Plant Sci. 2018, 8: 2246.
Zhong Y, Xun W, Wang X, et al. Root-secreted bitter triterpene modulates the rhizosphere microbiota to improve plant fitness. Nat Plants. 2022, 8(8): 887-896.