植物在大多数的陆地生态系统中属于生产者,形成食物链的基本。微生物和动物依靠着植物作为其居所、以及氧气或食物的提供者。所以植物常常受到病毒、细菌和真菌以及蚜虫、毛虫和蚂蚱等小型食草动物的威胁,还会遭到马、牛和羊等大型动物的啃食。植物并非“坐以待毙”,而是形成了一系列外部和内部的防御机制。本期文章伯小远就为大家主要介绍植物内部的防御机制——植物免疫。
我国是农业大国,农作物种类丰富,但植物病害造成农作物减产、品质下降,依然是影响农业生产的重大威胁。比如,我国各地的水稻栽培区均经常发生稻瘟病,年均危害面积达400万hm2以上,导致的产量损失在20亿kg以上。为了控制这些农业病害,我国每年农药防治面积达5.6112亿公顷,为全国耕地面积的4.16倍,即平均每年每一块耕地上至少实施防治4次以上,对生态环境和人民健康造成巨大的压力。培育抗病害品种是农作物抗病绿色防控的重要手段,而植物免疫学研究是作物抗病害育种的理论基础(张杰等, 2019)。
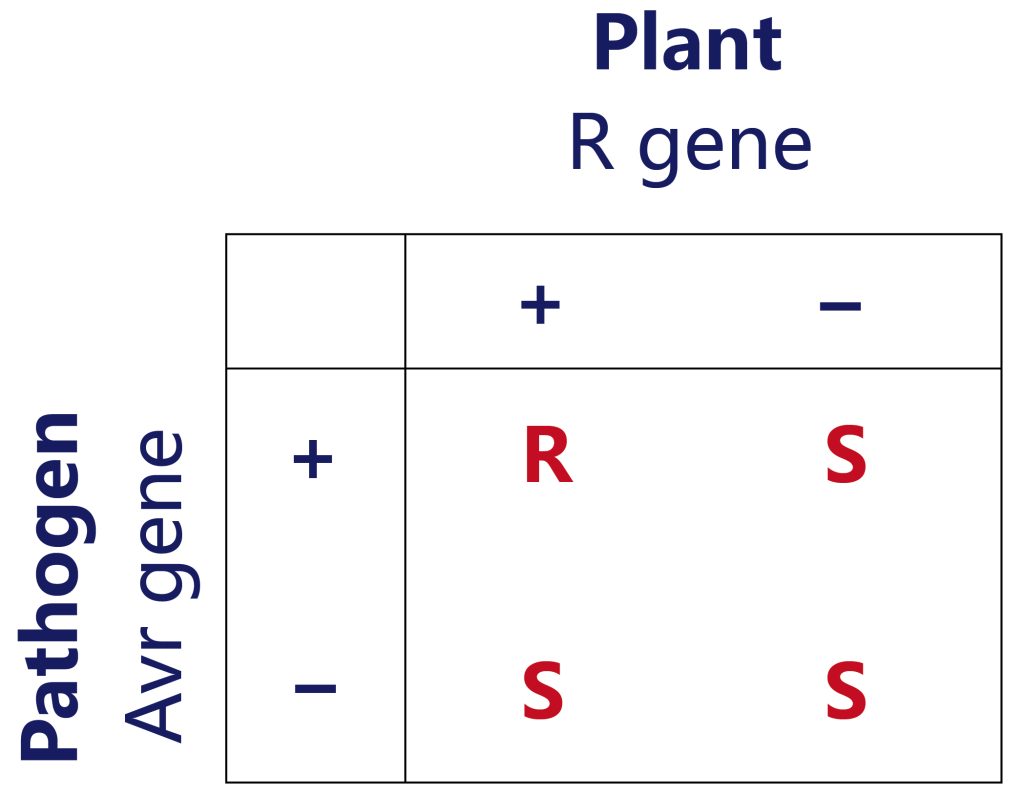
Staskawicz等人于1984年在大豆丁香假单胞杆菌(Pseudomonas syringae pv.glycinea)菌系克隆出第一个无毒基因avrA。而在1992年才成功地克隆出第一个植物抗病基因—玉米抗圆斑病基因Hm1。虽然有部分植物和病原体相互作用的研究证明基因对基因假说是正确的,但并不是所有的免疫机制都符合基因对基因假说,如玉米Hm1基因和大麦mlo基因,其抗性机制与病原菌的致病因子有关,而不是由病原菌无毒因子激活(王庆华等, 2013)。
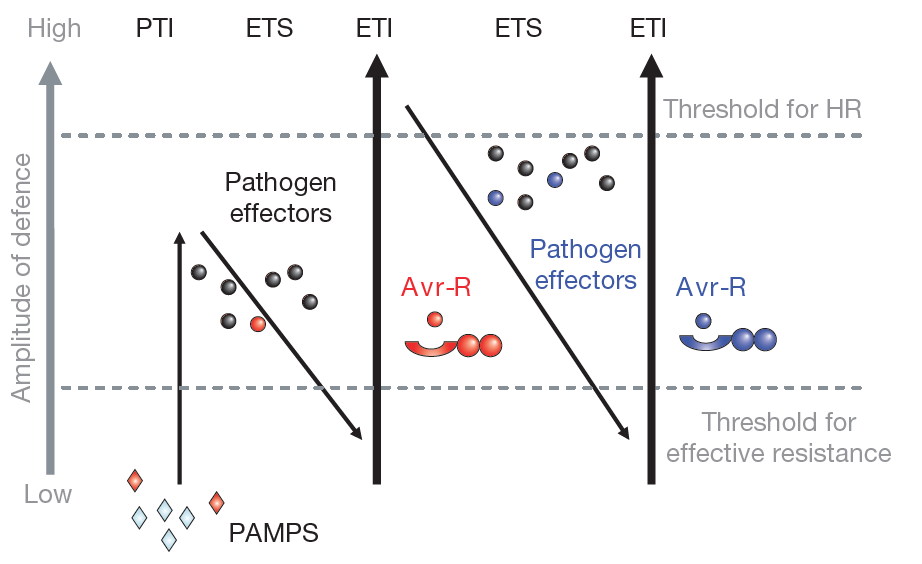
这两种受体是如何介导免疫的呢?Jones等人在2006年提出了植物免疫系统的“之字形”模型(“zig-zag-zig” model)(图3)。PRRs能够识别保守的病原体/损伤/微生物/食草动物相关分子模式(Pathogen-/damage-/microbe-/herbivore-associated molecular patterns,PAMPs/DAMPs/MAMPs/HAMPs)并激活模式触发免疫(Pattern-triggered immunity,PTI),从而限制致病性。PAMPs有很多种,比如细菌鞭毛蛋白、细菌延伸因子、真菌几丁质多糖、真菌木聚糖酶以及内源激发多肽等。病原体通过分泌效应分子来逃避或抑制PTI,这导致了效应触发易感性(Effector-triggered susceptibility,ETS)。反过来,植物进化出细胞内核苷酸结合和富亮氨酸重复序列受体(NLRs)能够感知效应因子,并激活效应因子触发免疫(Effector-triggered immunity,ETI)。病原体又可能通过进化去除效应因子或效应因子多样化,来逃避或抑制ETI。在漫长的进化史中,植物和病原体形成你争我躲的“拉锯战”(Jones et al., 2016)。
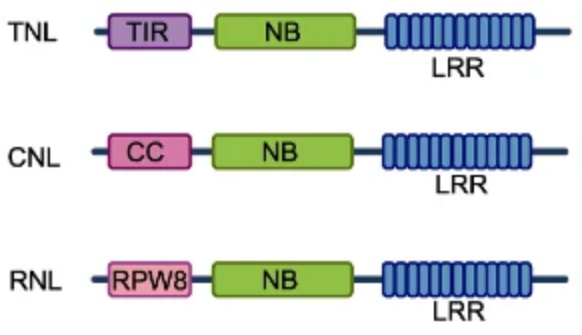
植物NLRs都包含中间的核苷酸结合(NB)域和C端的富含亮氨酸重复序列(LRR)结构域。NLRs根据其N端结构域的不同可分为三类(图5):1)含有卷曲螺旋结构域(Coiled-coil,CC)的NLRs(CNLs);2)Toll/白介素1受体/抗性(Toll/interleukin-1 receptor/Resistance,TIR)结构域的NLRs(TNLs);3)含类RPW8 CC(RPW8-like CC,RPW8)结构域的NLRs(RNLs)。LRR结构域与效应因子的直接或间接识别有关;NB结构域具有ATP结合活性,并作为NLRs激活的开关。CC、TIR和RPW8结构域在NLR激活时充当下游响应的信号结构。
图5 NLRs的结构组成(Duxbury et al., 2021)。
RLKs存在于疟原虫、植物和动物中,但不在真菌中。RLKs可能存在于这些生物的共同祖先中,但后来在真菌中丢失了(Shiu et al., 2003)。LRR-RLKs是RLKs中最大的亚家族,一项对33种植物的系统发育研究得出结论,被子植物中LRR-RLKs的平均数量约250个。LRR-RLKs进一步被分为20个亚群,其中第XII亚群的基因参与病原体识别,如FLS2、EFR和Xa21。LRR-RLK第XII亚群中的基因数量在植物物种中高度可变,表明这些基因在特定的物种谱系中经历了扩张或收缩(Dufayard et al., 2017)。同样,LRR-RLPs是植物中最大的RLPs亚家族,该基因家族的大小在植物物种中也有很大的差异(图6)。
NLR基因存在于所有陆生植物的基因组中。CNLs、TNLs和RNLs存在于基部被子植物(Basal angiosperms)物种中,如无油樟属(Amborrela)和睡莲目(Nymphaea)。基部被子植物是原始被子植物的第一个开花植物分支。由于从原始被子植物中分支较早,它们保留有一些原始的特征。尽管拥有两片子叶,它们的很多特征也并不能与双子叶植物吻合,甚至拥有一些单子叶植物的常见特征。在大多数单子叶植物基因组中不存在TNLs,这表明基因丢失可能发生在单子叶植物从双子叶植物分化之前。与LRR-RLK-XII和LRR-RLPs类似,NLRs的数量在被子植物中也有很大的变化。此外,LRR-RLK-XII、LRR-RLPs和NLRs基因家族经历了谱系特异性的共扩张或共收缩,这种现象的原因目前还不清楚(图6)。
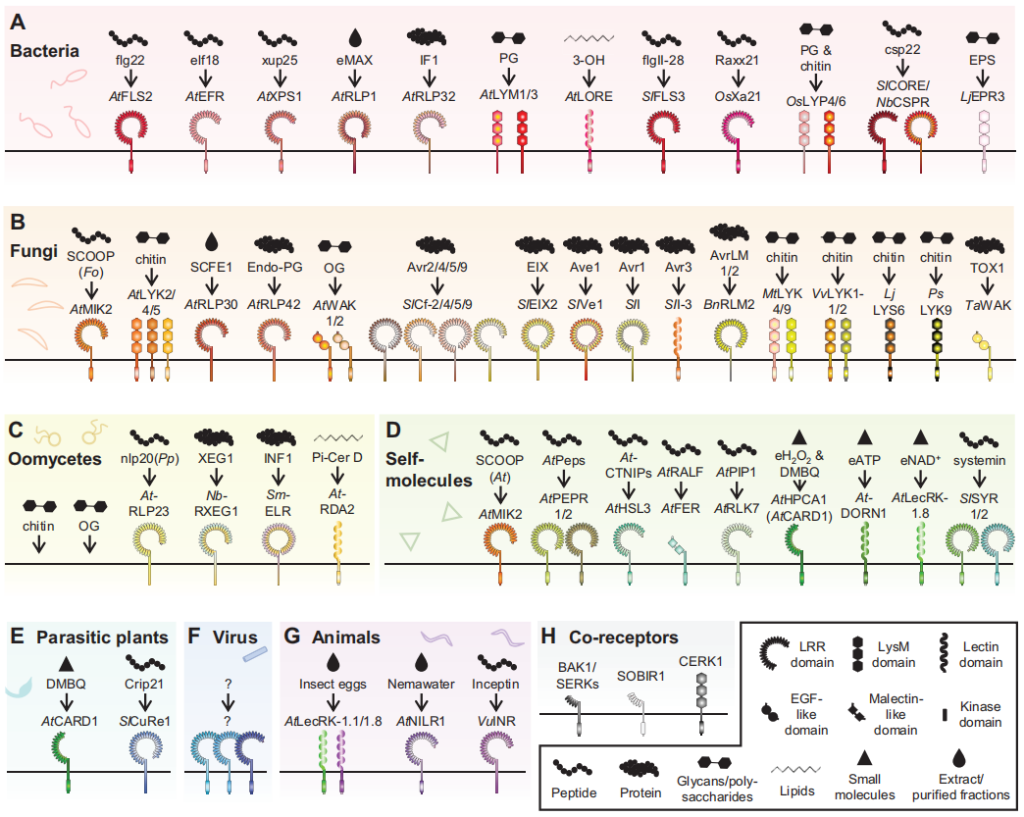
图7 参与植物免疫的PRRs(Bruno et al., 2022)。具有来自(A)细菌、(B)真菌、(C)卵菌、(D)自身分子、(E)寄生植物、(F)病毒和(G)食草动物的已知诱导免疫的PAMPs以及相应的PRRs。H,PRR共同受体。植物物种的缩写:A.thaliana,At;S.lycopersicum,Sl;O.sativa,Os;N.benthamiana,Nb;L.japonicus,Lj;B.napus,Bn;M.truncatula,Mt;V.vinifera,Vv;L.japonicus,Lj;P.sativum,Ps;T.aestivum,Ta;S.microdontum,Sm;P.japonicum,Pj;V.unguiculata,Vu;病原体缩写:F.oxysporum,Fo;P.parasitica,Pp。
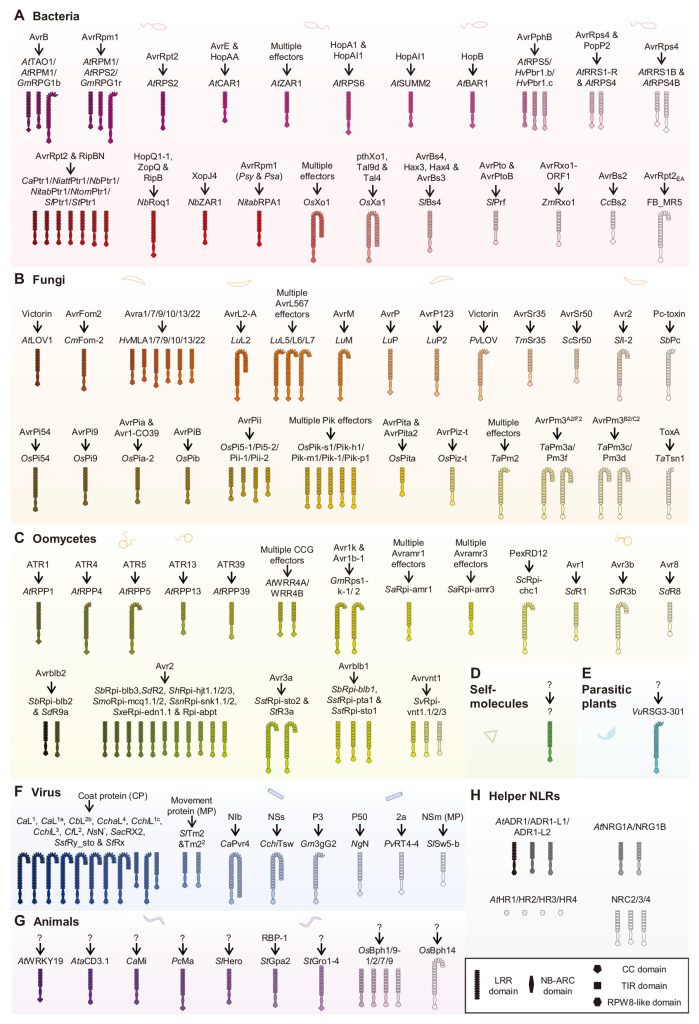
NLRs参与识别来自病毒、细菌、真菌、卵菌、寄生植物和食草动物的效应因子。一些NLRs作为辅助或共受体,在效应识别后转导传感器NLRs的免疫信号。目前,已有超过140种具有已知效应因子的NLRs(图8)。
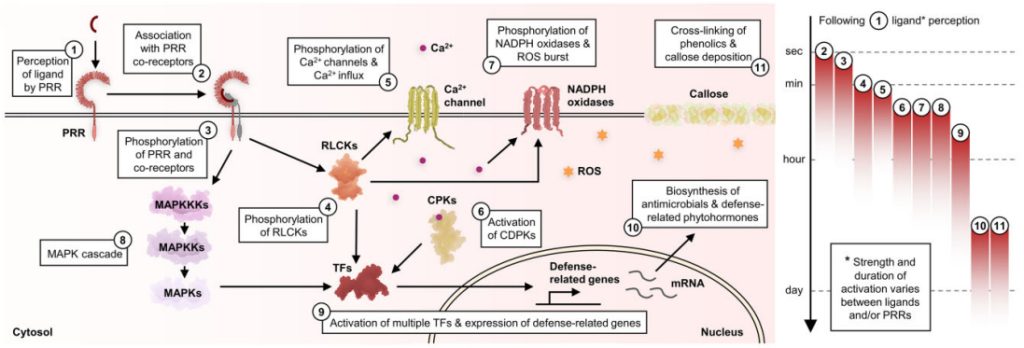
在拟南芥中,RLCKs在PRRs介导的免疫过程中发挥着特别重要的作用,它会对多种信号元件进行磷酸化,比如:对多个离子通道的磷酸化会导致气孔关闭,让病原体无法从气孔再次侵入;对NADPH氧化酶的磷酸化导致活性氧(ROS)爆发,促进蛋白质和酚交联,导致胼胝质沉积,限制真菌和卵菌感染;对多个钙通道的磷酸化导致细胞质钙离子流入,从而激活钙依赖性蛋白激酶(Calcium-dependent protein kinases,CPKs/CDPKs);引发MAPK级联反应激活MAPKs。RLCKs、CPKs和MAPKs磷酸化会激活多个与防御相关的转录因子如WRKY,导致防御相关基因的上调表达,在细胞中合成抗菌化合物和防御相关激素,如乙烯和水杨酸(图9)。
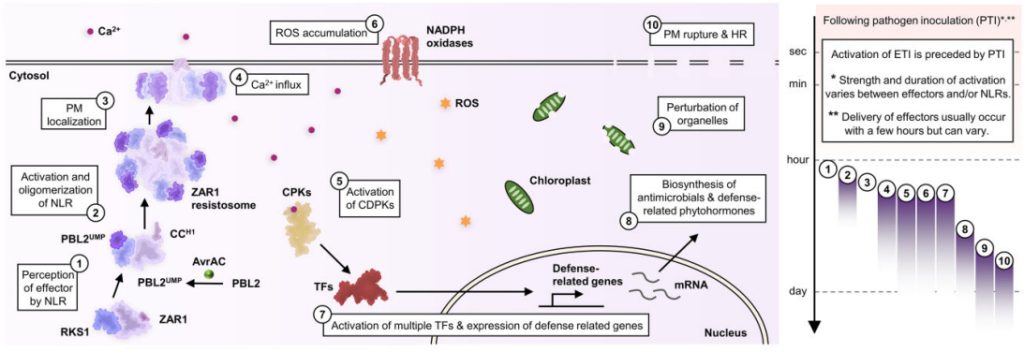
最近研究显示ZAR1抗病小体能表现出阳离子通道活性。ZAR1中的N端α-螺旋形成漏斗状结构,带有带负电荷的羧酸盐环,允许阳离子通过进入细胞质。导致钙内流、ROS积累以及叶绿体和液泡的扰动。而大量的ROS积累可能是由多个上游信号成分的激活引起的,例如CDPKs被细胞溶质钙内流激活,再激活NADPH氧化酶。与防御相关的转录因子可能被细胞质的钙内流激活。叶绿体和液泡的扰动很快就会导致过敏性坏死反应(Hypersensitive response,HR)和细胞破裂。这些过程如何受免疫信号成分的调节以及它们与转录重编程的关系目前尚不清楚。
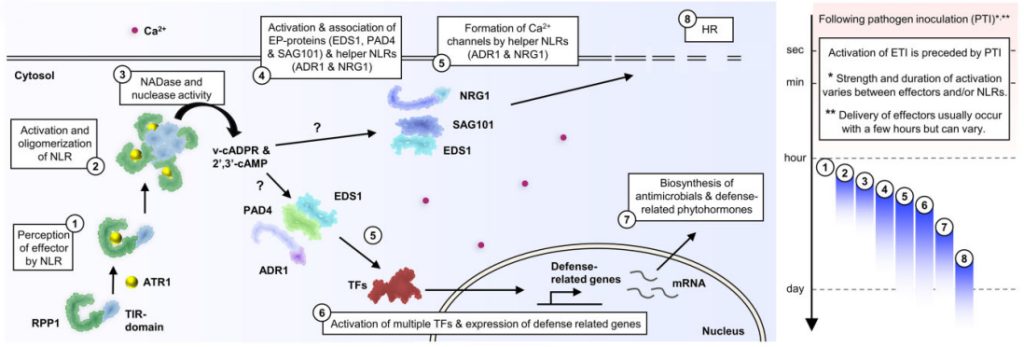
RPP1的TIR结构域在寡聚化后紧密靠近,激活NADase活性并产生v-cADPR。TIR结构域还能通过水解RNA或DNA表现出2′,3′-cAMP/cGMP合成酶活性,产生2′,3′-cAMP/cGMP。v-cADPR和2′,3′-cAMP/cGMP是激活下游信号组分的信号分子。接着会使两个含有EP结构域的蛋白质(EP蛋白)SAG101和EDS1与NRG1相关联。同样也导致EP蛋白PAD4和EDS1与ADR1的关联,这些关联均导致这些信号组分的激活,进而激活下游免疫反应,例如防御相关基因表达和HR。ADR1和NRG1最近也被证明能够形成钙离子通道来激活免疫。因此,可以推测辅助NLRs和EP蛋白的结合和激活会诱导钙内流并触发下游免疫反应。
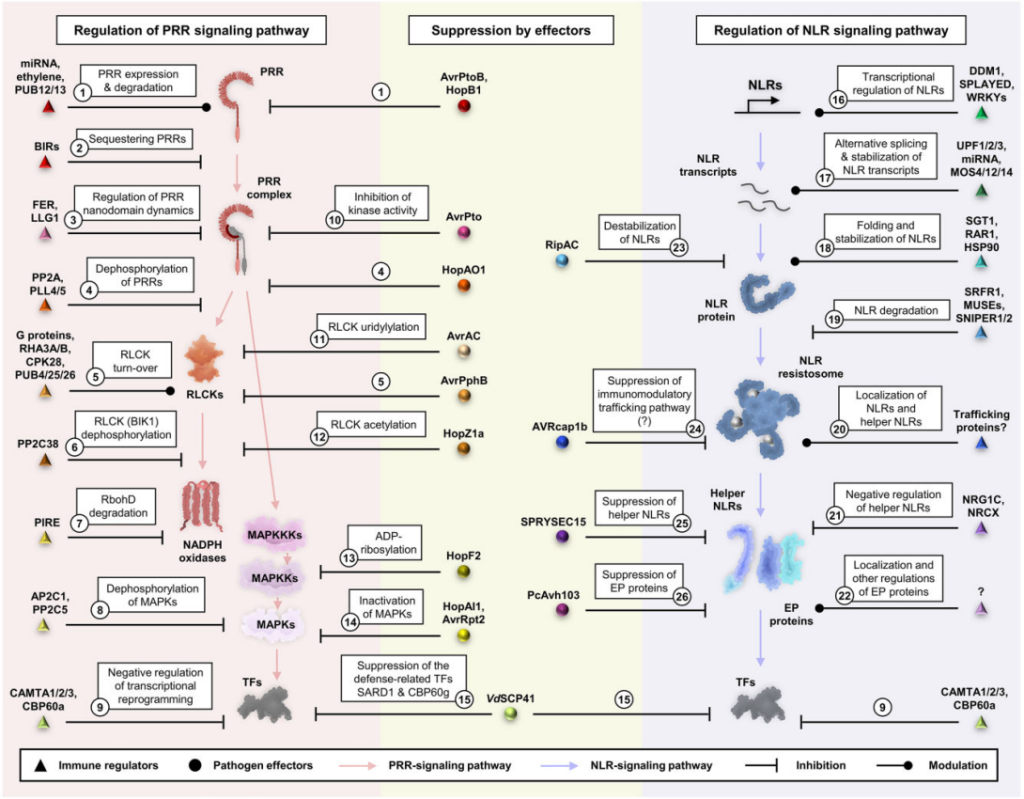
PRRs和NLPs介导的免疫反应发生的时间过长,对植物是十分不利的,会导致植物产生自身免疫而且生长会受到抑制,所以免疫反应处于严格的调控之中(图12)。PRRs本身及其信号转导途径中其他组分的转录和翻译水平受多种机制的调节。例如FLS2的表达受microRNA miR172b的调节,FLS2的表达也被ET上调,U-BOX域包含蛋白12(PUB12)和PUB13会使FLS2发生多泛素化,从而导致FLS2的内吞作用和降解。同样,NLRs的表达在多个层面受到调控。NLRs的转录受染色质重塑蛋白的调节,NLR转录本的稳定性也受microRNA和可变剪接过程的影响,一些蛋白质伴侣会共同发挥作用以调节NLRs的折叠、定位和转换。还有多种效应因子已被证明可以抑制免疫。
Jones JDG, Dangl JL (2006) The plant immune system. Nature 444:323–329
van der Burgh AM, Joosten MHAJ (2019) Plant immunity: thinking outside and inside the box. Trends Plant Sci 24: 587–601
Bruno Pok Man Ngou, Pingtao Ding (2022) Thirty years of resistance: Zig-zag through the plant immune system. The Plant Cell 34: 1447–1478
Boutrot F, Zipfel C (2017) Function, discovery, and exploitation of plant pattern recognition receptors for broad-spectrum disease resistance. Annu Rev Phytopathol 55: 257–286
Shiu SH, Bleecker AB (2003) Expansion of the receptor-like kinase/Pelle gene family and receptor-like proteins in Arabidopsis. Plant Physiol 132: 530–543
Dufayard JF, Bettembourg M (2017) New insights on leucine-rich repeats receptor-like kinase orthologous relationships in angiosperms. Front Plant Sci 8: 381
Fu ZQ, Dong X (2013) Systemic acquired resistance: turning local infection into global defense. Annu Rev Plant Biol 64:839-863.
王庆华,尹小燕,张举仁.植物的基因对基因抗病性学说[J].生命的化学,2003,(01):23-26.
张杰,董莎萌,王伟.植物免疫研究与抗病虫绿色防控:进展、机遇与挑战[J].中国科学:生命科学,2019(11):1479-1507.