缺乏细胞质激酶结构域的类受体蛋白(RLPs)在植物生长、发育和免疫中发挥着关键作用。然而,在很大程度上仍然难以捉摸的是RLP蛋白水平是否被E3泛素连接酶微调,而类受体激酶采用E3泛素连接酶进行信号传递的衰减。Nicotiana benthamiana NbEIX2是一个富含亮氨酸的重复RLP(LRR-RLP),介导真菌木聚糖酶触发的免疫。
2022年9月24日,国际权威学术期刊New Phytologist发表了江苏省农科院魏利辉和南京农业大学窦道龙(PLOS PATHOGENS | 南京农业大学窦道龙团队揭示大豆疫霉抑制植物宿主免疫信号的机制!Plant Journal | 南农窦道龙/景茂峰团队揭示疫霉侵染信号诱导内质网应激调节植物免疫的机制!)团队的最新相关研究成果,题为An F-box protein attenuates fungal xylanase-triggered immunity by destabilizing LRR-RLP NbEIX2 in a SOBIR1-dependent manner的研究论文。
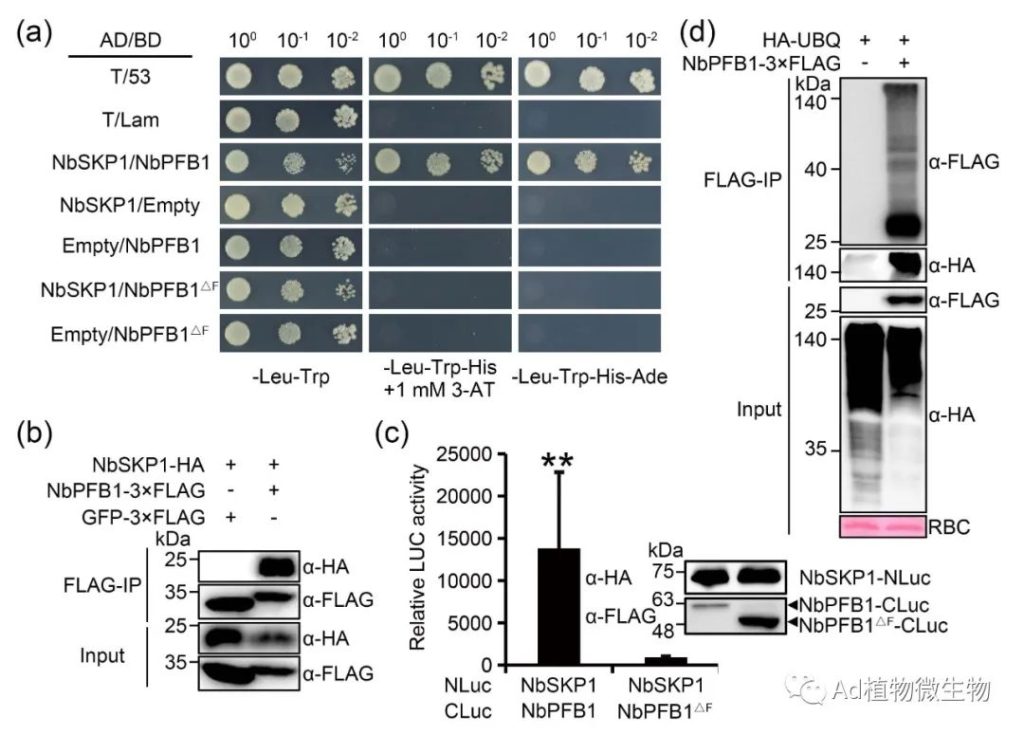
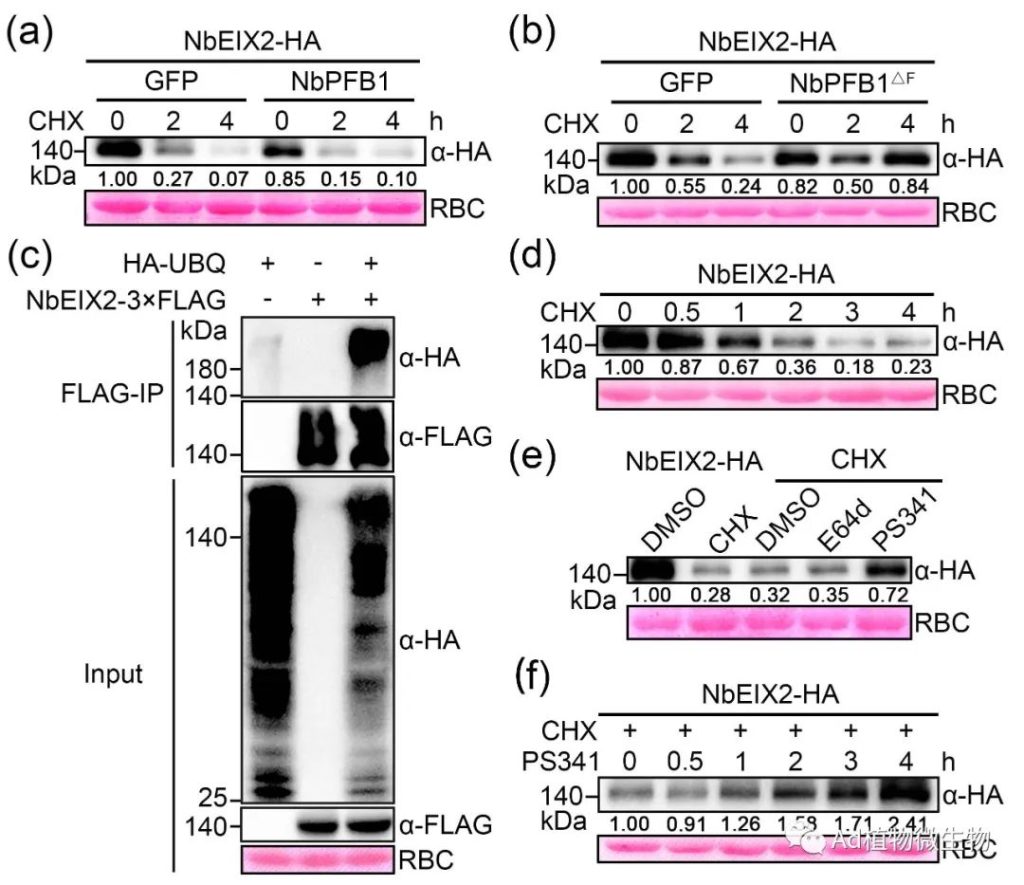
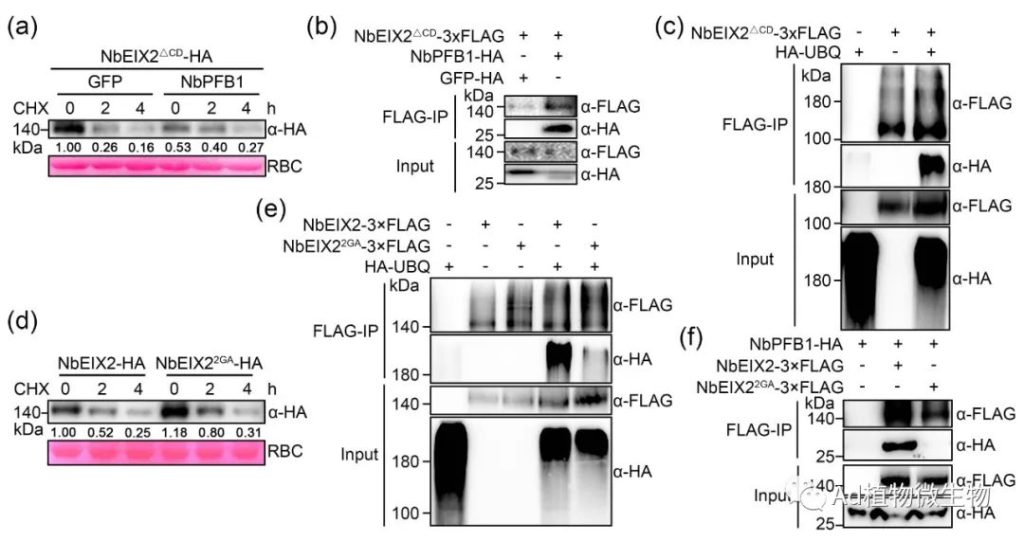
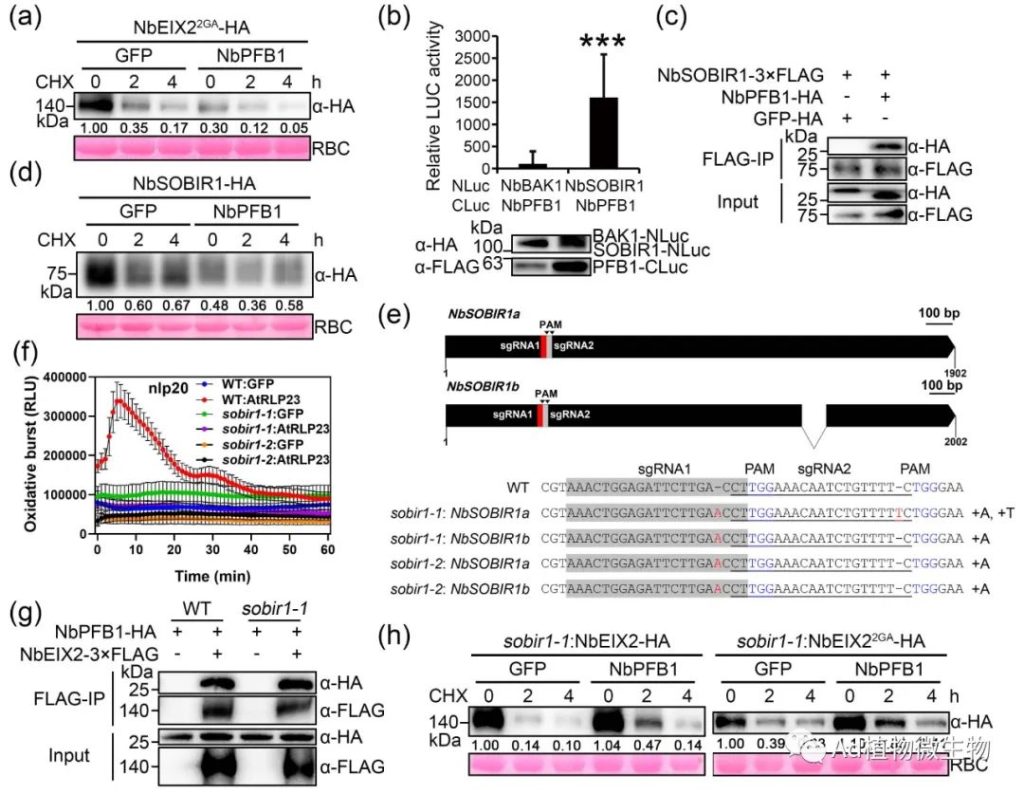
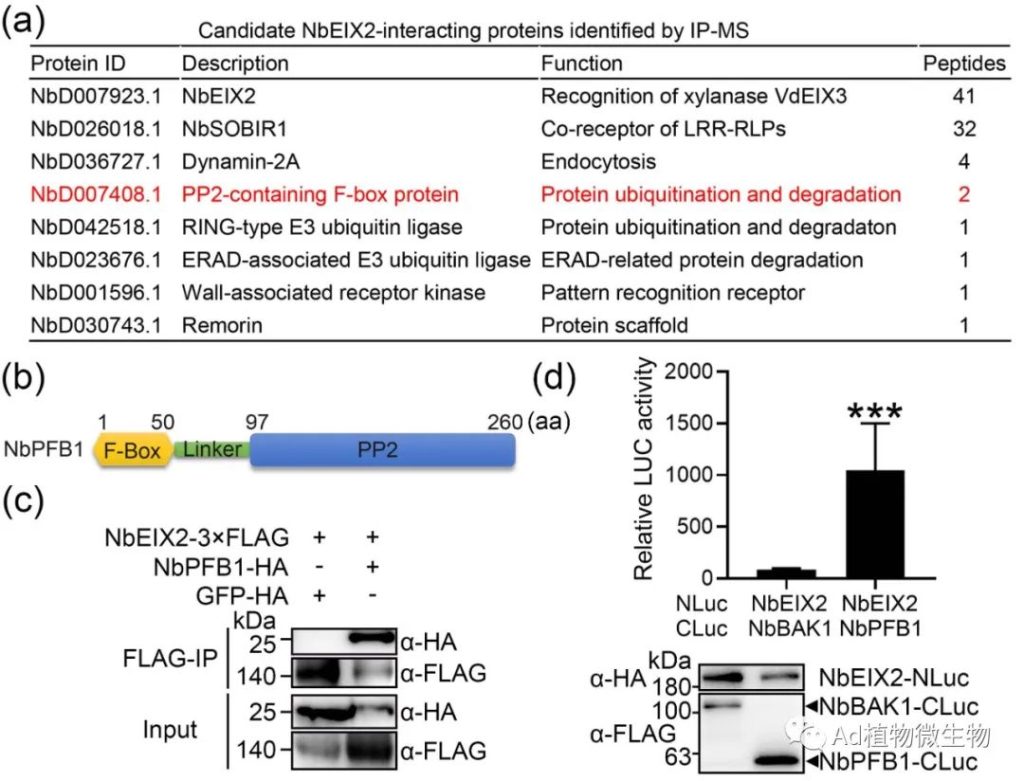
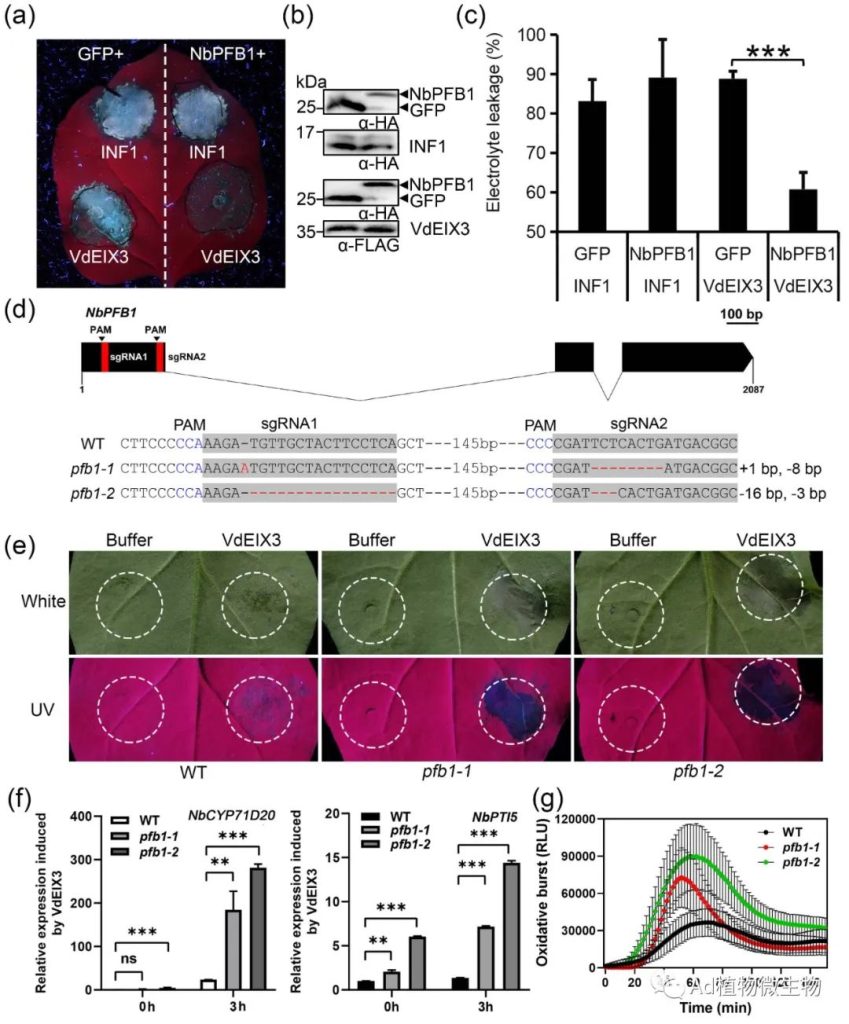
科研人员发现NbEIX2与F-box蛋白NbPFB1结合,后者可能通过形成SCF E3泛素连接酶复合物促进NbEIX2的降解,并负向调节NbEIX2介导的免疫反应。NbEIX2在植物体中进行泛素化和蛋白酶体降解。有趣的是,没有细胞质尾端片段的NbEIX2仍然与NbPFB1相关并被其破坏稳定。此外,NbPFB1还与LRR-RLPs的一个共同受体NbSOBIR1相关联并破坏其稳定性,并且在sobir1突变体中不能促进NbEIX2的降解。科研人员的研究结果揭示了一个独特的NbEIX2降解模型,其中一个F-box蛋白以SOBIR1依赖的方式间接地破坏NbEIX2的稳定性。
图1 NbEIX2与F-box蛋白NbPFB1结合