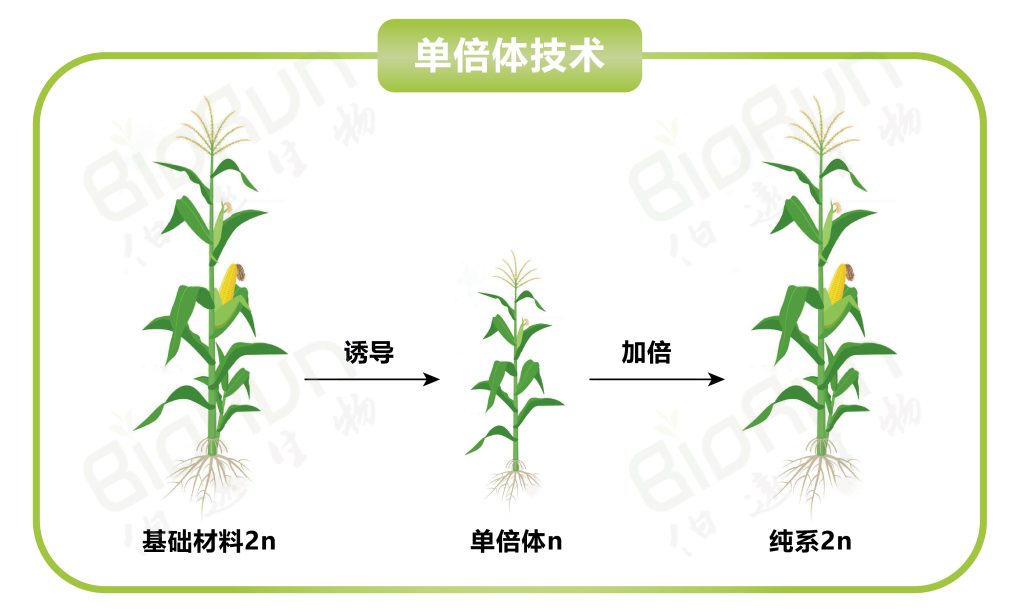
单倍体育种(Haploid breeding)是植物育种手段之一。通过单倍体诱导获得的单倍体植株经染色体加倍后即可出现纯系植株(2n),从中选出的优良纯系后代不分离,植株表型整齐一致,并且与传统育种(6-8代自交)相比可显著缩短育种年限,因此具有重要的意义。该技术不仅适合某些特定表型的纯合,例如,自交不亲和植物的育种,也可以应用于快速繁殖、突变育种和转基因育种等方面。随着单倍体技术的不断革新,目前该技术已经成为现代育种技术体系的三大核心技术之一。今天我们主要是以玉米单倍体育种为主线,结合单倍体育种在其他物种中的拓展应用来和大家一起探讨,单倍体育种的技术流程、最新进展以及应用现状,接下来,让我们一起进入今天的主题吧~
科学家们对单倍体诱导系的研究并没有因为取得上述成果而放慢脚步。近期,严建兵团队和李响团队通过深入解析玉米单倍体诱导关键基因ZmPLA1导致单倍体发生的分子机制,成功鉴定了一个诱导单倍体发生的新基因ZmPOD65,将该基因进行编辑后,在其后代中发现了高至7.7%的单倍体诱导率,并且该基因在双单子叶植物间的保守性,为其它作物上发展单倍体诱导技术提供了新的基因资源(Jiang et al., 2022)。
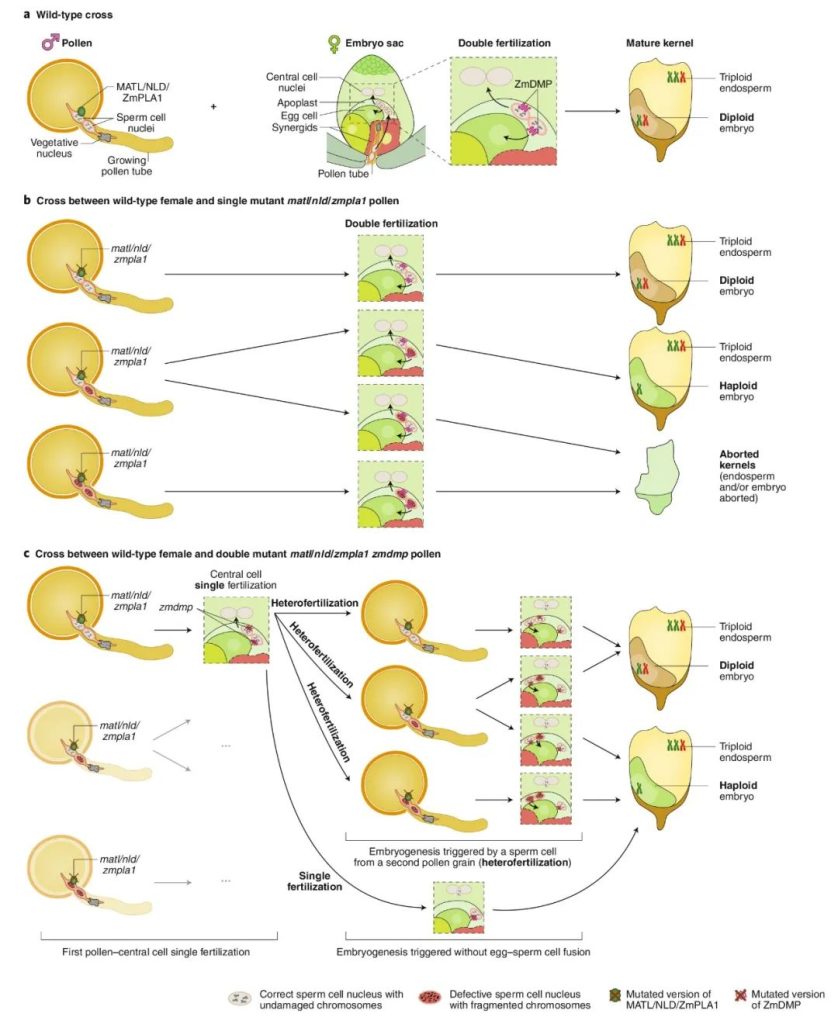
图2 玉米单倍体诱导机制模型(Jacquier et al., 2020)。(a)玉米种子发育是由双受精触发的,在双受精过程中,单倍体卵细胞和二倍体中央细胞分别与精子细胞融合,产生二倍体胚胎和三倍体胚乳;(b)matl/nld/zmpla1突变体与野生型杂交时,有三种类型的花粉粒,分别含有零个、一个或两个有缺陷的精细胞。因此,双受精后生成正常的籽粒、具有单倍体胚的籽粒或败育的籽粒;(c)与matl/nld/zmpla1 zmdmp双突变体花粉杂交的筛选结果表明zmdmp突变对单倍体诱导的促进作用。
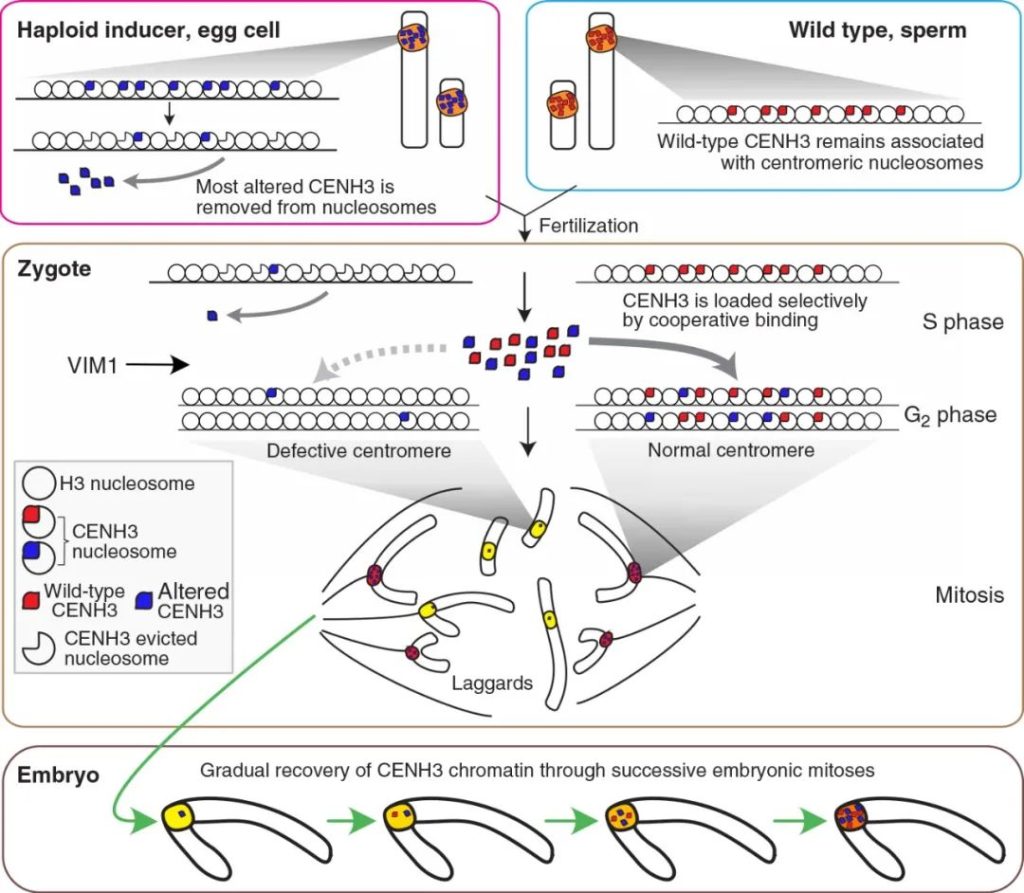
着丝粒组蛋白3基因(CENH3)是近几年报道的创制单倍体诱导系的关键基因。CENH3仅存在于真核生物的功能着丝粒中,其主要参与着丝粒复合蛋白的募集和稳定,是细胞分裂时染色体分离所必需的,对着丝粒在染色体上的定位起重要作用(Sullivan et al., 2001)。类似于其他组蛋白,CENH3由两个结构域组成,一个N端尾巴(从核小体伸出,是翻译后表观修饰的靶点)和一个C端组蛋白折叠结构域(c-terminal histone fold domain, HFD)(Britt and Kuppu, 2016)。CENH3在植物中广泛存在,并且其功能在各个物种中保守。以CENH3表达发生改变的基因型植株为母本与野生型杂交,可使其基因组在合子中消失,而只保留野生型基因组的单倍体植株(图3)。CENH3介导的单倍体诱导方法目前已经在拟南芥、玉米、小麦上取得了重要的进展,未来还将扩展到更多的植物中。有关这一部分的内容,小远在先前的推文中有详细的讲解,大家感兴趣的话可以查阅:纯系养成——单倍体诱导技术(二)。

图4 将单倍体(Haploid)与二倍体(Diploid)玉米进行表型比较(Wang et al., 2021)。(A)单倍体植物株型矮小;(B)单倍体植株不育,没有花药。
图5 将单倍体(H)与六倍体(HE)小麦进行表型比较,包括株型、叶、穗和花药(Liu et al., 2020)。
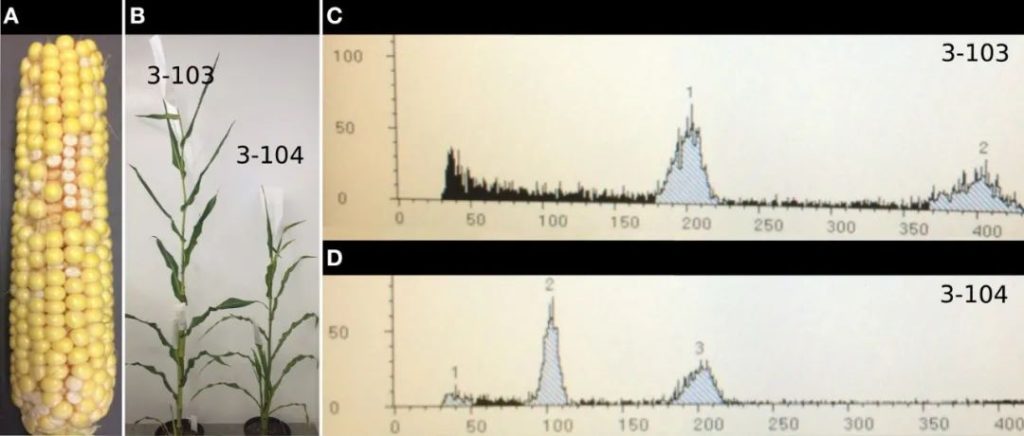
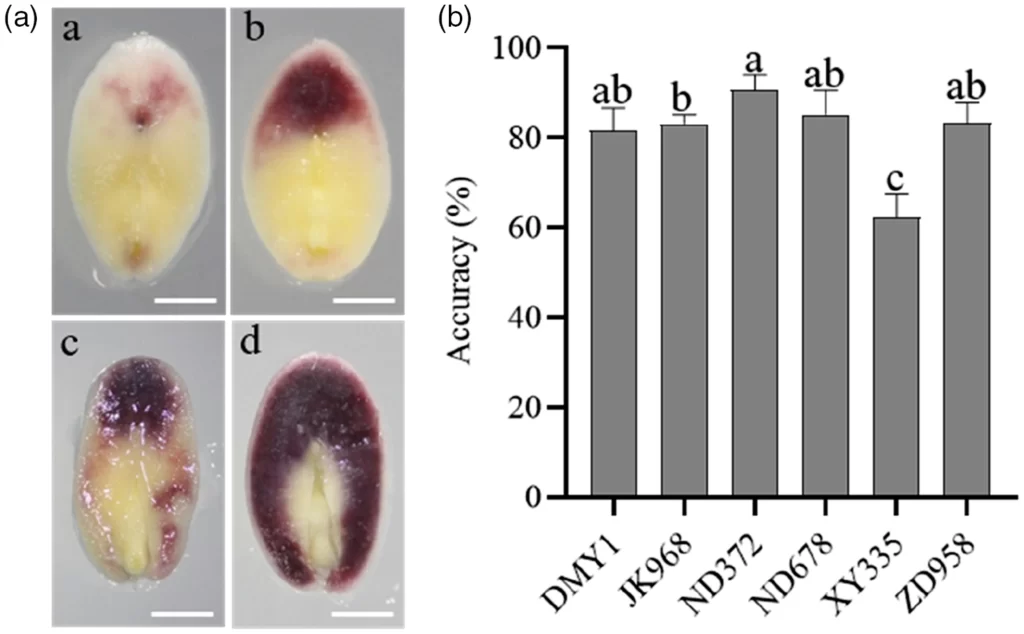
图8 不同杂交种中R1-nj色素沉着情况及单倍体识别的准确性(Chen et al., 2022)。
(2)MAGIC系统
MAGIC系统是近段时间陈绍江团队和陈茹梅团队共同利用优化的花青素标记物开发出的新型单倍体识别系统。与R1-nj标记相比,MAGIC1在鉴别单倍体方面的准确率达到了99.1%,并且在授粉后12天就可以鉴别单倍体,因此更适合大规模的单倍体筛选。
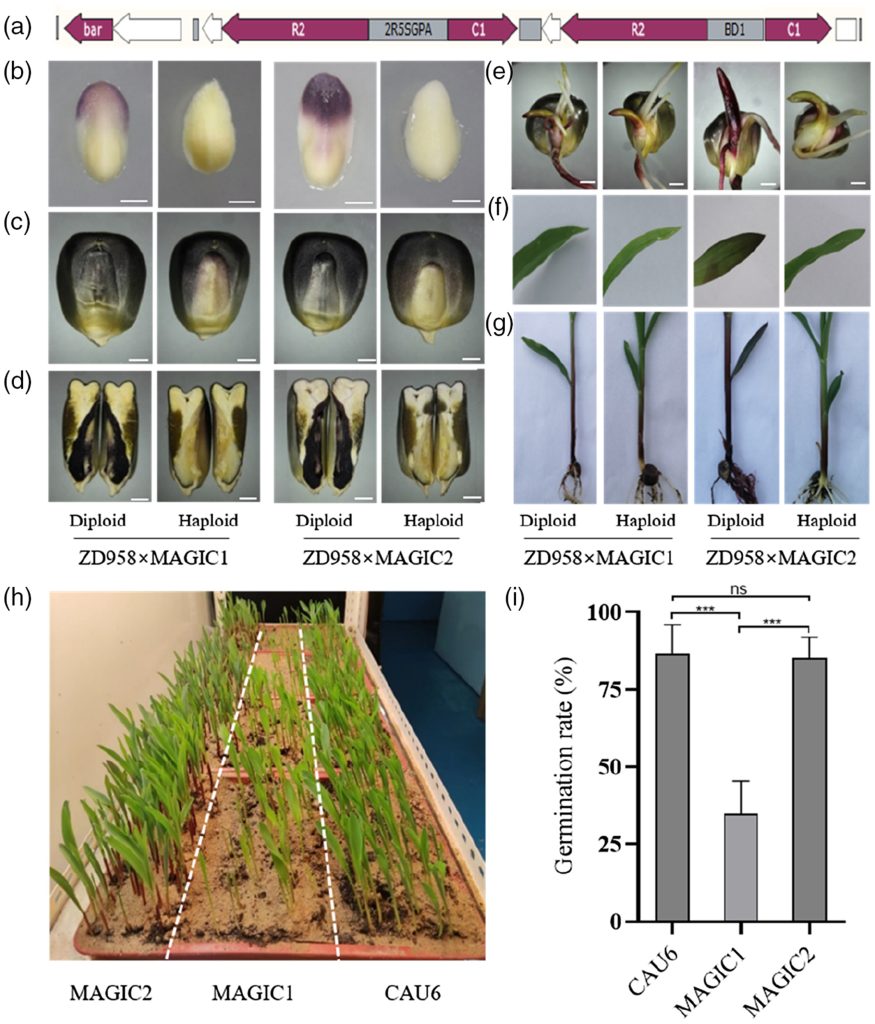
该团队在开发MAGIC系统之初,发现转录因子ZmC1和ZmR2的共表达足以使玉米产生紫色愈伤。通过瞬时转化分析发现,ZmC1和ZmR2共表达后在玉米胚和籽粒糊粉层中均有花青素产生。将含有ZmC1和ZmR2的稳定转基因株系与自交系杂交后,其后代也全部积累了花青素。这些结果均表明ZmC1和ZmR2可以作为稳定的遗传标记物。因此,他们将CAU6作为亲本与上述稳定转基因株系进行回交后,再进行四代自花授粉,最终筛选到了含有稳定遗传标记的单倍体诱导系MAGIC1。随后,该团队将含有ZmC1和ZmR2的表达载体中的启动子优化成胚胎特异性和种子特异性双向启动子,获得了单倍体鉴别率以及种子发芽率更高的升级版MAGIC2(图9)。
图9 MAGIC1和MAGIC2花青素积累和发芽率差异(Chen et al., 2022)。(a)p2Seed-C1R2载体的示意图,2R5SGPA:种子特异性双向启动子;(b)15DAP的未成熟胚胎;(c)籽粒;(d)籽粒的垂直切面;(e)胚芽鞘;(f)叶子;(g)鞘和根;(h)三种单倍体诱导系的发芽率表现;(i)三种单倍体诱导系的发芽率柱状图。
(3)高油性状标记
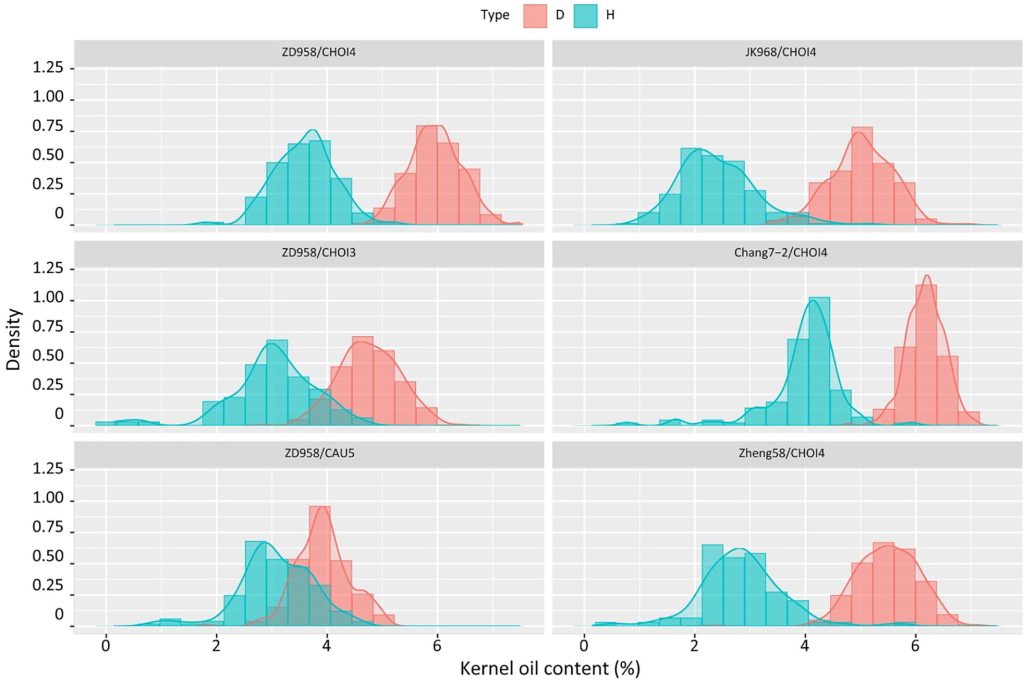
利用高油型诱导系与普通玉米杂交获得的杂合二倍体和单倍体子粒油分差异大。因此,采用核磁共振仪器或近红外仪器对单倍体籽粒进行检测,相较于人工鉴别会大大缩短检测时间(Li et al., 2009)。而进一步提高油型诱导系的诱导率和油分含量,不仅能够提高单倍体诱导效率,还能提高鉴别的效率和准确率,从而实现工程化的单倍体育种。陈绍江团队利用单倍体诱导系CAU2和北农大高油群体(BHO)作为供体亲本,培育出了新型高油高效玉米单倍体诱导系CHOI4,其平均单倍体诱导率为15.78%,籽粒平均油分含量达11%,这一成果大幅提高了单倍体的鉴别效率(图10)。
图10 来自不同杂交组合的单倍体(H)和二倍体(D)的含油量(KOC)比较(Liu et al., 2021)。左侧:来自ZD958×CHOI4(上)、ZD958×CHOI3(中)和ZD958×CAU5(下)的二倍体(粉红色)和单倍体(浅蓝色)的含油量。右侧:分别来自JK968×CHOI4、Zheng58×CHOI4和Chang7-2×CHOI4杂交的单倍体和二倍体种子的含油量。
(4)荧光蛋白标记
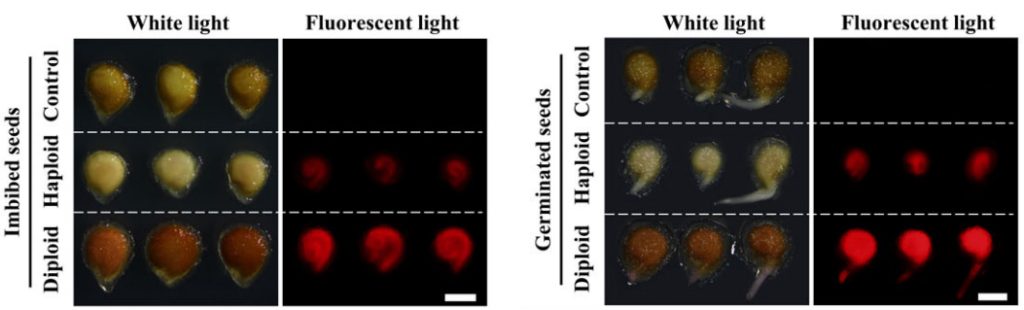
将含有荧光标记(YFP、GFP等)的转基因植株与创制的单倍体诱导系进行杂交,得到含有稳定荧光标记的单倍体诱导系后。这种诱导系获得的杂交种很容易借助荧光体式显微镜、激光共聚焦显微镜等荧光观察工具,来对其中的单倍体籽粒进行鉴别筛选。例如,谢传晓等人利用胚特异型启动子ZmESP和胚乳特异性启动子HvASP,构建了含有胚特异表达绿色荧光蛋白和胚乳特异表达红色荧光蛋白的双荧光标记单倍体诱导系,将其作为父本与三个受体品种ZD99、Zeyu7、Feng8进行杂交。通过相应的滤光片在不同波长的激发光下,可以观察到在二倍体和单倍体籽粒中的红色胚乳,而仅在二倍体籽粒中观察到绿色胚(图11F)。陈绍江团队为解决番茄单倍体的筛选难题,也建立起了基于FAST-Red的荧光快速鉴别方法,通过浸湿种子和刚萌发根尖荧光的两步观察,可实现番茄单倍体的快速精准鉴别(图12)。在花青素标记或油份含量筛选标记因遗传背景受到限制时,荧光标记法仍能实现快速、高效的单倍体籽粒鉴别。
浸种法操作简单,是诱导后比较常用的加倍方法。先用清水浸泡种子(24h),再用不同浓度梯度秋水仙素溶液进行处理,最后经流水冲洗一段时间,确保残留的秋水仙素洗净后进行播种即可。其加倍效率易受到秋水仙素浓度、浸泡时间的影响。
(2)浸根法
浸根法是指用秋水仙素浸泡单倍体植株根部的方法。将幼苗期的植株从土壤中拔出并洗净根部的泥土后,将其浸泡在秋水仙素溶液中一段时间,然后用流水洗净根部残留的秋水仙素,再将其种植于大田中。该方法耗费的秋水仙素剂量大,成本较高,同时涉及到育苗、处理、移栽等多个环节,幼苗会受到毒性和移栽损伤的双重影响,因此其成活率较低。
(3)浸芽法
浸芽法是指用秋水仙素浸泡幼芽的方法。当单倍体种子幼芽生长至2cm左右时,切掉部分顶端,将幼芽浸泡于秋水仙素溶液中一段时间,再移栽到育苗盘中,当幼苗长出4-5片叶子时可移栽到大田。由于该方法将整个幼芽浸泡在秋水仙素溶液中,幼芽吸收了大量的秋水仙素溶液,缓苗所需的时间较长,并且容易造成大量的幼苗死亡。
(4)滴心法
滴注心叶法是将单倍体幼苗移栽于营养皿后,将配比好的秋水仙素溶液滴注于三叶期或者五叶玉米单倍体幼苗的心叶内,经过缓苗处理后可移栽大田进行精细管理。
(5)注射法
注射法采用微量注射器,将一定浓度的秋水仙素溶液注入植株顶芽或侧芽中,来完成单倍体的加倍。注射法不需要育苗、移栽,操作简便且用量少,但需要对田间每一单倍体植株进行注射,劳动强度较大,由于田间植株长势不一致,对注射的技术要求很高。
(6)组培法
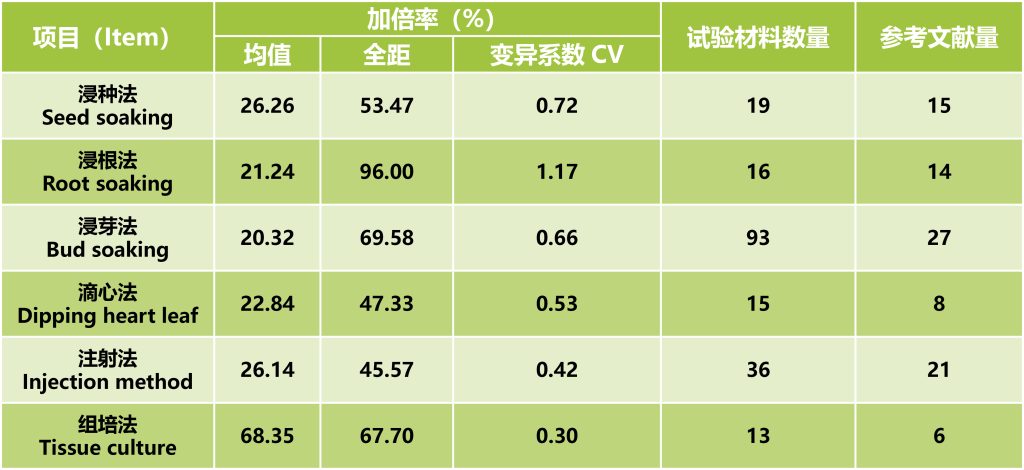
组织培养加倍是通过培养基渗入的途径,对单倍体幼胚等愈伤组织进行加倍处理。由于实验条件控制精确,使得实验结果重复性强。对国内外研究中利用秋水仙素对玉米加倍的不同方法进行统计发现,组培法的加倍率最高(表1)。但由于实验环境要求较高,操作程序复杂,使得组培加倍法在单倍体育种中的应用受到一定的限制。
表1 秋水仙素不同加倍方法加倍率统计(郭书磊等, 2020)。
References:
Britt AB, and Kuppu S. Cenh3: An emerging player in haploid induction technology. Front. Plant Sci. 2016, 7:357.
Coe, Jr. A Line of Maize with High Haploid Frequency. The American Naturalist. 1959, 93, 381.
Chen C, Liu X, Li S, et al. Co-expression of transcription factors ZmC1 and ZmR2 establishes an efficient and accurate haploid embryo identification system in maize. Plant J. 2022, 111(5): 1296-1307.
Dong L, Li L, Liu C, et al. Genome Editing and Double-Fluorescence Proteins Enable Robust Maternal Haploid Induction and Identification in Maize. Mol Plant. 2018, 11(9): 1214-1217.
Gilles LM, Khaled A, Laffaire JB, et al. Loss of pollen-specific phospholipase NOT LIKE DAD triggers gynogenesis in maize. EMBO J. 2017, 36, 707-17.
Jacquier NMA, Gilles LM, Pyott DE, et al. Puzzling out plant reproduction by haploid induction for innovations in plant breeding. Nat Plants. 2020, 6, 610-9.
Jiang C, Sun J, Li R, et al. A reactive oxygen species burst causes haploid induction in maize. Mol Plant. 2022, 15(6): 943-955.
Kelliher T, Starr D, Wang W, et al. Maternal Haploids Are Preferentially Induced by CENH3-tailswap Transgenic Complementation in Maize. Front Plant Sci. 2016, 7:414.
Kelliher T, Starr D, Richbourg L, et al. MATRILINEAL, a sperm-specific phospholipase, triggers maize haploid induction. Nature. 2017, 542, 105-9.
Li L, Xu X, Jin W, et al. Morphological and molecular evidences for DNA introgression in haploid induction via a high oil inducer CAUHOI in maize. Planta. 2009, 230, 367-376
Liu C, Li X, Meng D, et al. A 4-bp Insertion at ZmPLA1 Encoding a Putative Phospholipase A Generates Haploid Induction in Maize. Mol Plant. 2017, 10, 520-2.
Liu C, Zhong Y, Qi X, et al. Extension of the in vivo haploid induction system from diploid maize to hexaploid wheat. Plant Biotechnol J. 2020, 18, 316-8.
Liu CX, Li JL, Chen M, et al. Development of high-oil maize haploid inducer with a novel phenotyping strategy. The Crop Journal. 2021, 10(2): 524-531.
Marimuthu MPA, Maruthachalam R, Bondada R, et al. Epigenetically mismatched parental centromeres trigger genome elimination in hybrids. Sci Adv. 2021, 7(47):eabk1151.
Sullivan BA, Blower MD, and Karpen GH. Determining centromere identity: cyclical stories and forking paths. Nature Rev. Genet. 2001, 2(8):584-596.
Wang N, Gent JI, Dawe RK. Haploid induction by a maize cenh3 null mutant. Sci Adv. 2021, 7(4):eabe2299.
Zhong Y, Liu C, Qi X, et al. Mutation of ZmDMP enhances haploid induction in maize. Nat Plants. 2019, 5, 575-80.
Zhong Y, Chen B, Wang D, et al. In vivo maternal haploid induction in tomato. Plant Biotechnol J. 2022, 20(2): 250-252.
Zhang X, Zhang L, Zhang J, et al. Haploid induction in allotetraploid tobacco using DMPs mutation. Planta. 2022, 255(5): 98.
葛百一, 何璨. 玉米单倍体加倍技术研究进展. 热带农业工程, 2018, 42(3): 11-14.
郭书磊, 魏昕, 魏良明等. 玉米单倍体诱导、加倍技术及相关机理探讨. 玉米科学, 2020, 28(3): 52-59, 65.
姚丽娜, 高银祥, 祖元刚. 流式细胞仪在植物学研究中的应用. 安徽农学报, 2009, 15(9): 55-57.
| 官网链接:plant.biorun.com |