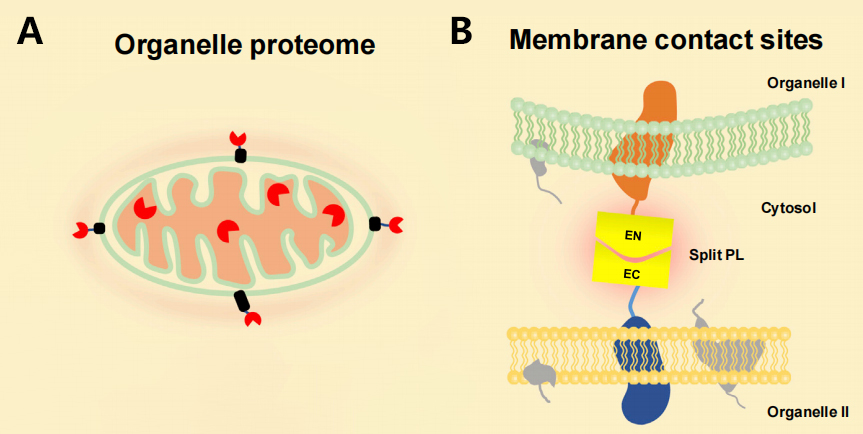
随后研发出来的APEX与ATP、H2O2以及生物素-苯酚一起供应时,APEX会在靶蛋白半径20nm的范围内生物素化邻近蛋白质,所有富含酪氨酸残基的相邻蛋白质都有可能在短短1分钟内被APEX生物素化(Rhee et al., 2013)。APEX虽然比BioID催化效率更高,但其发挥作用需要添加底物分子H2O2,但H2O2易对细胞产生毒性,引起细胞或组织的氧化应激。另外,与BioID一样,APEX催化温度也为37℃,这也限制了其在植物体系中的应用。
为了更好地在植物中应用邻近标记技术,斯坦福大学的Alice Ting课题组在2018年通过酵母表面展示技术对BirA进行定向进化,开发出了新的邻近标记酶TurboID(35kDa)及其截短突变体miniTurboID(28kDa)(Branon et al., 2018)。这两种新的邻近标记酶结合了BioID和APEX的优点,不仅催化效率高且不会对活细胞造成损害。除此之外,基于TurboID和miniTurboID的邻近标记还有一个显著的突破,就是可以在室温(25°C)下实现有效的生物素化,而不像BioID和APEX系统所需的温度为37°C。通过将TurboID与感兴趣的目的蛋白融合表达于细胞内,在ATP与生物素的参与下,可在活细胞中对约10nm范围内的邻近蛋白进行生物素标记,标记时间约10分钟左右。目前,基于TurboID的邻近标记技术已成功应用于植物体系。
除了上述邻近标记酶之外,近些年科学家们也陆续优化并开发出了许多其他的邻近标记酶,例如APEX系列的优化酶APEX2;BioID系列的优化酶BioID2、AirID、BASU等;以及一些小范围使用的工具酶如HRP、EXCELL、PUP-IT、NEDDylation,这些工具酶的开发使邻近标记技术的应用范围不断扩宽。
表1 目前用于蛋白质互作鉴定的邻近标记酶(Yang et al., 2021)。



作者利用在本氏烟中建立起的邻近标记体系(图7),对N蛋白介导的抗TMV免疫反应中可能与N蛋白发生互作的蛋白进行了分析。将TurboID融合在N蛋白的C端,同时设置Citrine融合的TurboID用作阴性对照(图8a)。在确定融合蛋白的功能及表达不受限制后,作者对存在/不存在TMV p50效应因子情况下与N蛋白相互作用的蛋白进行分析。为了量化邻近标记蛋白的相对丰度,作者制备并分析了没有p50的I组样品和有p50的II组样品(图8b),最终在I组和II组中分别鉴定了3198和3262种蛋白。
图7 本氏烟中基于TurboID的邻近标记技术实验流程示意图(Zhang et al., 2019)
图8 N NLR免疫受体的邻近和相互作用蛋白的鉴定(Zhang et al., 2019)。(a)用于鉴定N的邻近和相互作用蛋白的载体示意图,载体中的HA标签用于鉴定融合蛋白的表达是否正常。(b)实验设计和标记条件图。(c)I组和II组的分层聚类显著富集了相互作用的蛋白质。(d)维恩图描绘了在不存在或存在p50的情况下与gN(左)或N-TIR(右)相互作用的蛋白质。(e)维恩图描绘了在p50不存在(左)或存在(右)的情况下,与gN和/或N-TIR相互作用的蛋白质。
通过对质谱获得的蛋白数据进一步分析,作者最终选择了其中的一种蛋白UBR7,该蛋白在N-末端规则蛋白酶解途径中发挥作用,其在酵母、动物和植物中高度保守。通过双分子荧光互补和GST pull-down实验也进一步证实了UBR7可以和N蛋白互作,并且互作的区域是N蛋白的TIR结构域(图9)。
Branon T.C., Bosch J.A., Sanchez A.D., et al. Efficient proximity labeling in living cells and organisms with TurboID. Nat. Biotechnol. 2018, 36: 880-887.
Gupta G.D., Coyaud É., Gonçalves J., et al. A dynamic protein interaction landscape of the human centrosome-cilium interface. Cell. 2015, 163: 1484-1499.
Gao X.D., Rodriguez T.C., Sontheimer E.J. Adapting dCas9-APEX2 for subnuclear proteomic profiling. Methods Enzymol. 2019, 616: 365-383.
Hung V., Zou P., Rhee H.W., et al. Proteomic mapping of the human mitochondrial intermembrane space in live cells via ratiometric APEX tagging. Mol. Cell. 2014, 55: 332-341.
Hung V., Lam S.S., Udeshi N.D., et al. Proteomic mapping of cytosol-facing outer mitochondrial and ER membranes in living human cells by proximity biotinylation. eLife. 2017, 6: e24463.
Han S., Zhao B.S., Myers S.A., et al. RNA-protein interaction mapping via MS2- or Cas13-based APEX targeting. Proc Natl Acad Sci U S A. 2020, 117(36): 22068-22079.
Kwak C., Shin S., Park J.S., et al. Contact-ID, a tool for profiling organelle contact sites, reveals regulatory proteins of mitochondrial-associated membrane formation. Proc. Natl. Acad. Sci. U S A. 2020, 117: 12109-12120.
Lee S.Y., Kang M.G., Shin S., et al. Architecture mapping of the inner mitochondrial membrane proteome by chemical tools in live cells. J. Am. Chem. Soc. 2017, 139: 3651-3662.
Qi L.S., Larson M.H., Gilbert L.A., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 2013, 152: 1173-1183.
Roux K.J., Kim D.I., Raida M., et al. A promiscuous biotin ligase fusion protein identifies proximal and interacting proteins in mammalian cells. J. Cell Biol. 2012, 196: 801-810.
Rhee H.W., Zou P., Udeshi N.D., et al. Proteomic mapping of mitochondria in living cells via spatially restricted enzymatic tagging. Science. 2013, 339: 1328-1331.
Youn J.-Y., Dunham W.H., Hong S.J., et al. High-density proximity mapping reveals the subcellular organization of mRNA-associated granules and bodies. Mol. Cell. 2018, 69: 517-532.e11.
Yoo C.-M., Rhee H.-W. APEX, a master key to resolve membrane topology in live cells. Biochemistry. 2020, 59: 250-259.
Yang X., Wen Z., Zhang D., et al. Proximity labeling: an emerging tool for probing in planta molecular interactions. Plant Commun. 2021, 2(2): 100137.
Zhang Y., Song G., Lal N.K., et al. TurboID-based proximity labeling reveals that UBR7 is a regulator of N NLR immune receptor-mediated immunity. Nat Commun. 2019, 10(1): 3252.
苏田, 韩笑, 刘华东. 邻近标记在蛋白质组学中的发展及应用. 中国生物化学与分子生物学报, 2020, 36(01): 36-41.
| 官网链接:plant.biorun.com |