大多数真核生物mRNA的翻译是以典型的帽依赖方式进行的。为了启动翻译,三元复合体(eIF2-GTP-Met-tRNAi)被加载到40S核糖体亚单位上,形成43S预启动复合体(PIC),然后通过eIF4F复合体被招募到mRNA的m7G帽5′端,该复合体由帽结合蛋白eIF4E、支架蛋白eIF4G和RNA螺旋酶eIF4A组成。聚(A)结合蛋白(PABP)促进了43S PIC对5′帽的招募,PABP通过与eIF4F复合物中的eIF4G相互作用从mRNA的3′聚(A)尾部绕回来。在对胁迫的反应中,一般的翻译启动往往通过胁迫诱导的eIF2α的磷酸化而被抑制,这减少了活性三元复合物的可用性。某些胁迫反应的mRNA,如酵母中的一般控制非抑制性4(GCN4)和哺乳动物中的激活转录因子4(ATF4),其翻译通常被其mRNA中的上游开放阅读框(uORF)所抑制,优先在三元复合物的降低水平上翻译。然而,在植物中,虽然eIF2α磷酸化在许多胁迫反应中被注意到,包括模式触发免疫(PTI),但在GCN2突变体中阻断这一过程对生物和非生物胁迫反应没有影响。这就提出了一个问题:植物如何抑制生长相关蛋白的翻译,同时选择性地翻译防御蛋白以应对生物和非生物胁迫?
2022年7月30日,国际顶级权威学术期刊Cell发表了美国杜克大学董欣年团队的最新相关研究成果,题为PABP/purine-rich motif as an initiation module for cap-independent translation in pattern-triggered immunity的研究论文。
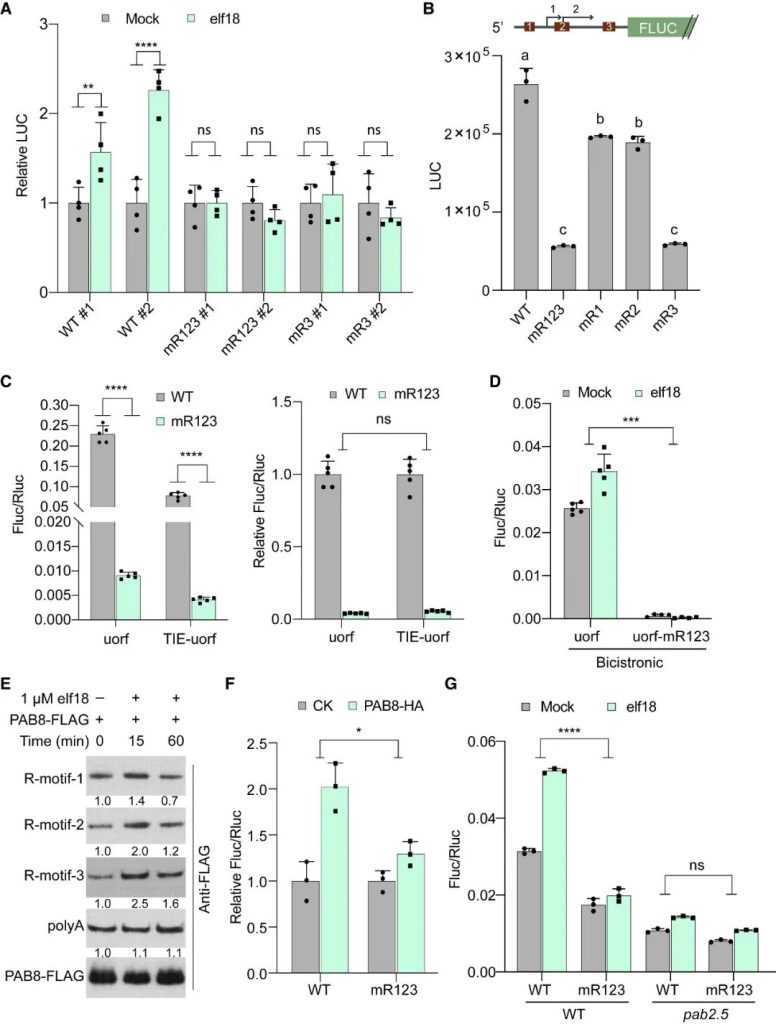
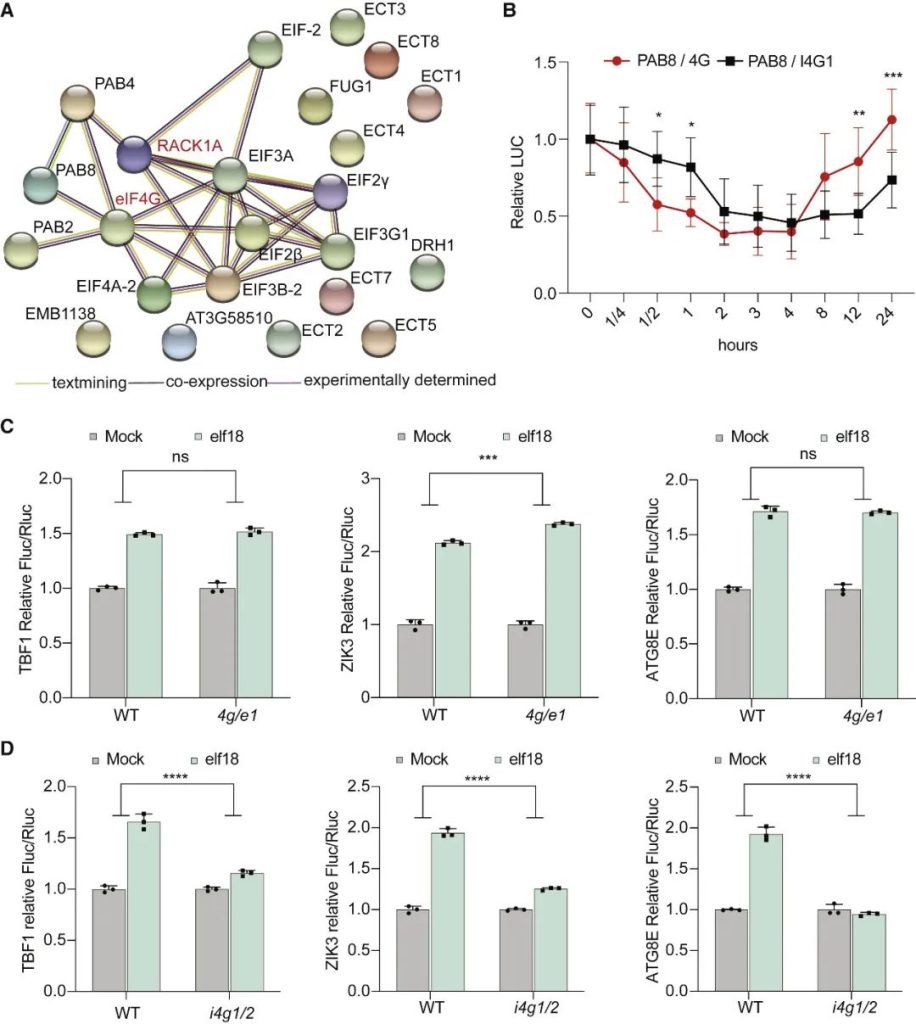
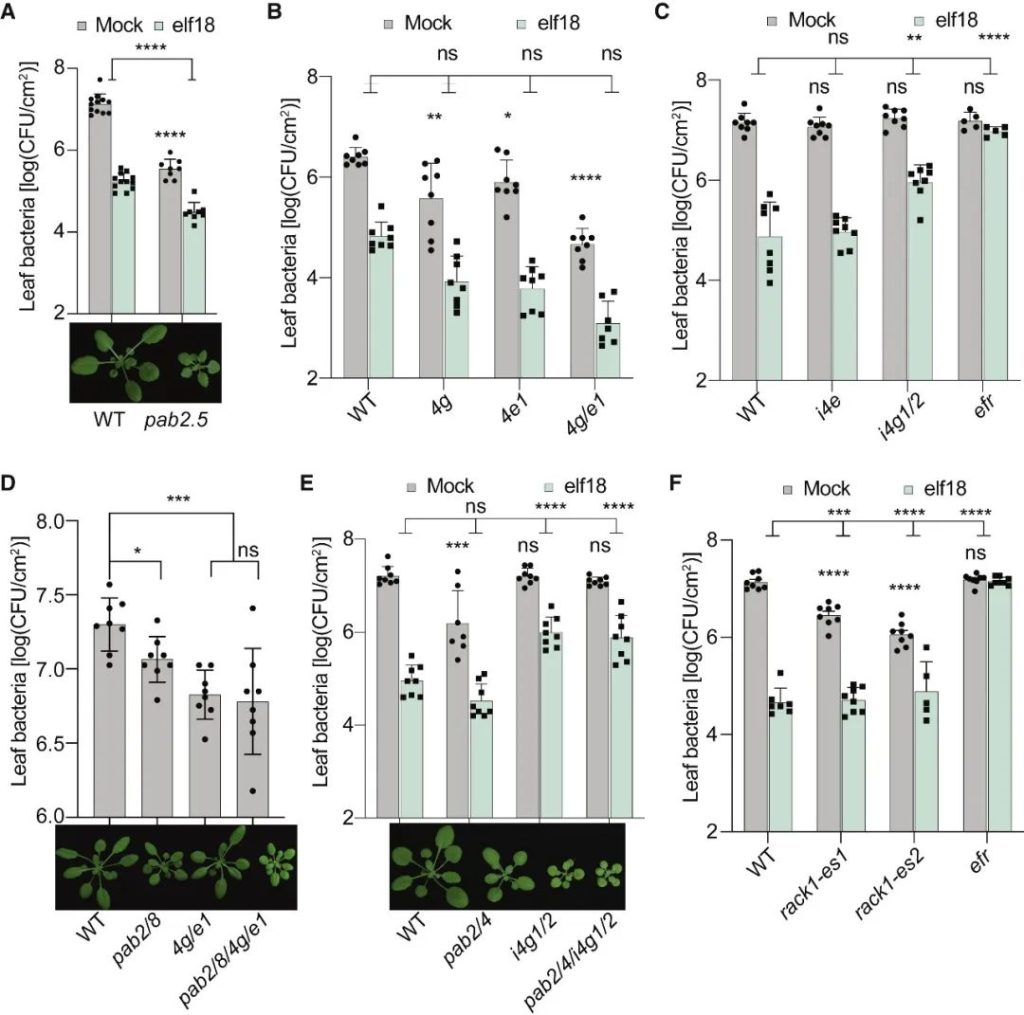
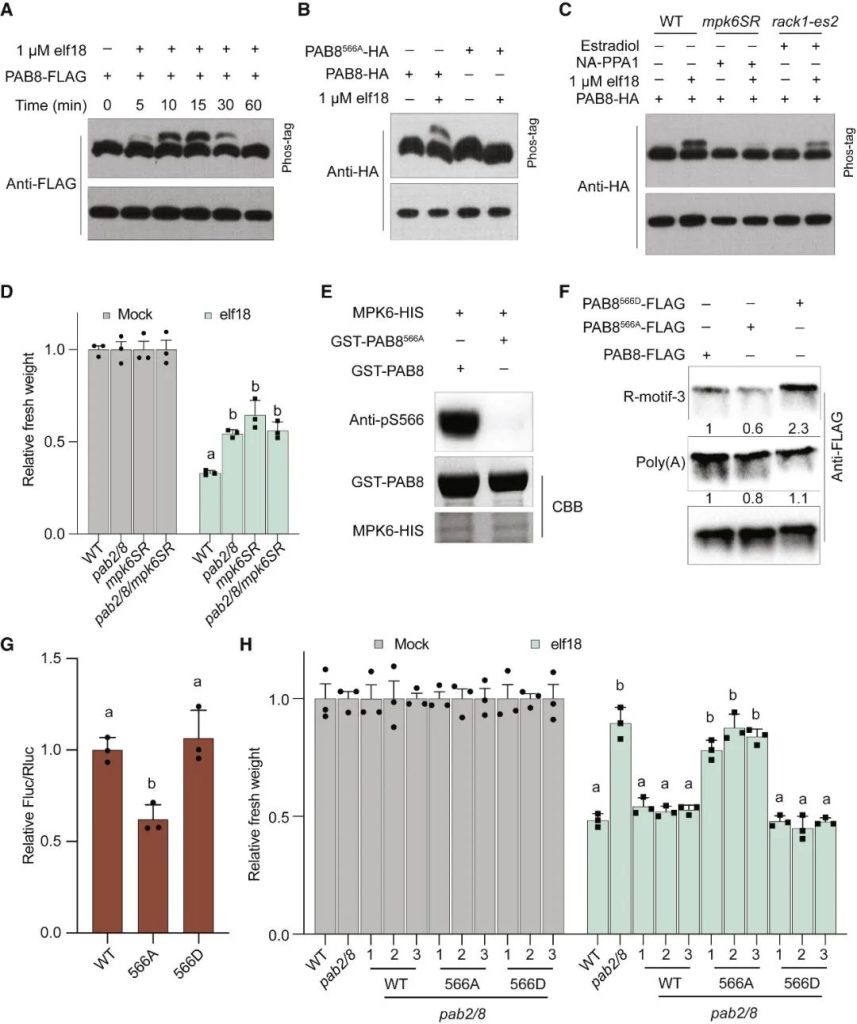
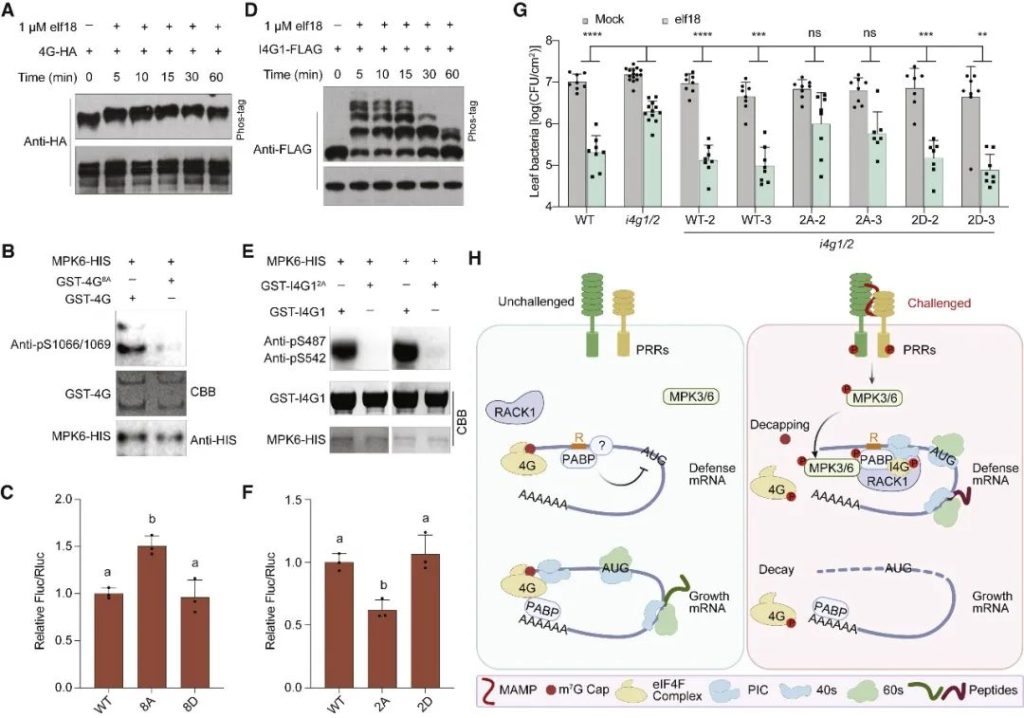
在胁迫下,真核生物通常通过GCN2介导的真核翻译启动因子eIF2α的磷酸化来重新规划其翻译组,以抑制一般的翻译启动,同时选择性地翻译基本的胁迫调节因子。意外的是,在植物中,模式触发免疫(PTI)和对其他环境胁迫的反应独立于GCN2/eIF2α途径。在这篇文章中,科研人员表明,虽然PTI诱导mRNA脱帽以抑制一般的翻译,但具有富含嘌呤元素(“R-motif”)的防御性mRNA是利用R-motif作为内部核糖体进入位点(IRES)进行选择性翻译的。R-motif依赖性翻译由聚(A)结合蛋白(PABPs)通过与PTI激活性eIFiso4G而非抑制性eIF4G的优先结合来执行。PTI调节因子丝裂原活化蛋白激酶3和6(MPK3/6)的磷酸化抑制了eIF4G的活性,同时增强了PABP与R-motif的结合,促进了eIFiso4G介导的防御性mRNA翻译,建立了PTI信号和蛋白合成之间的联系。鉴于其在植物和动物中的普遍性,PABP/R-motif翻译启动模块可能在重编程胁迫翻译组方面有更广泛的作用。