4.2.3亚细胞定位
4.2.4VIGS
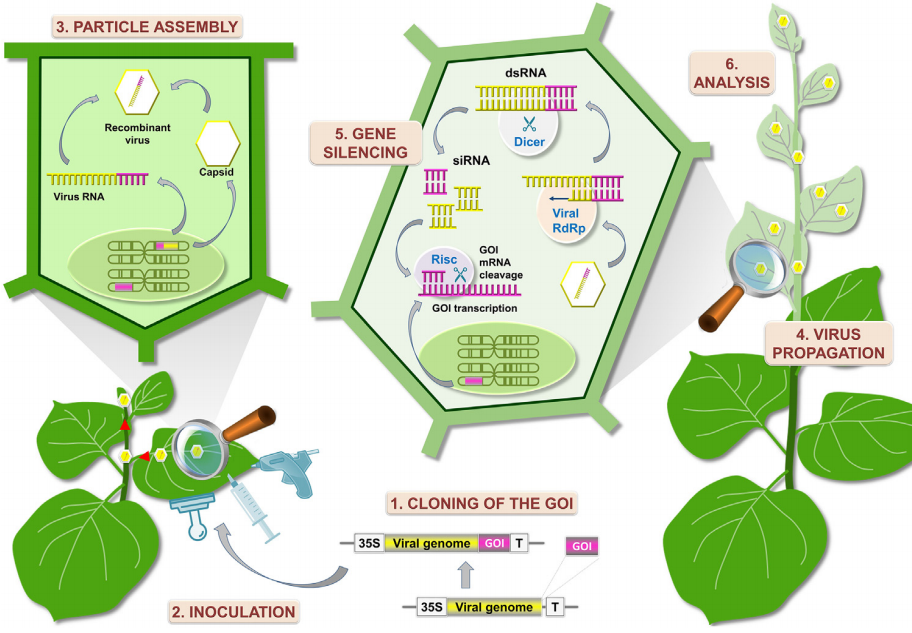 图1 VIGS技术原理 (Courdavault et al. 2020)。VIGS利用了病毒免疫应答机制和植物内部的RNA干扰机制。当病毒侵染植物后,病毒复制形成的dsRNA会被植物体内的Dicer酶识别并切割成siRNA,这些siRNA与AGO1及其相关蛋白质形成沉默效应复合体RISC,并特异性地结合并降解由目的基因转录出的mRNA,引发转录后基因沉默(PTGS),而病毒的侵染能力,会诱发全植株的目的基因沉默。
图1 VIGS技术原理 (Courdavault et al. 2020)。VIGS利用了病毒免疫应答机制和植物内部的RNA干扰机制。当病毒侵染植物后,病毒复制形成的dsRNA会被植物体内的Dicer酶识别并切割成siRNA,这些siRNA与AGO1及其相关蛋白质形成沉默效应复合体RISC,并特异性地结合并降解由目的基因转录出的mRNA,引发转录后基因沉默(PTGS),而病毒的侵染能力,会诱发全植株的目的基因沉默。
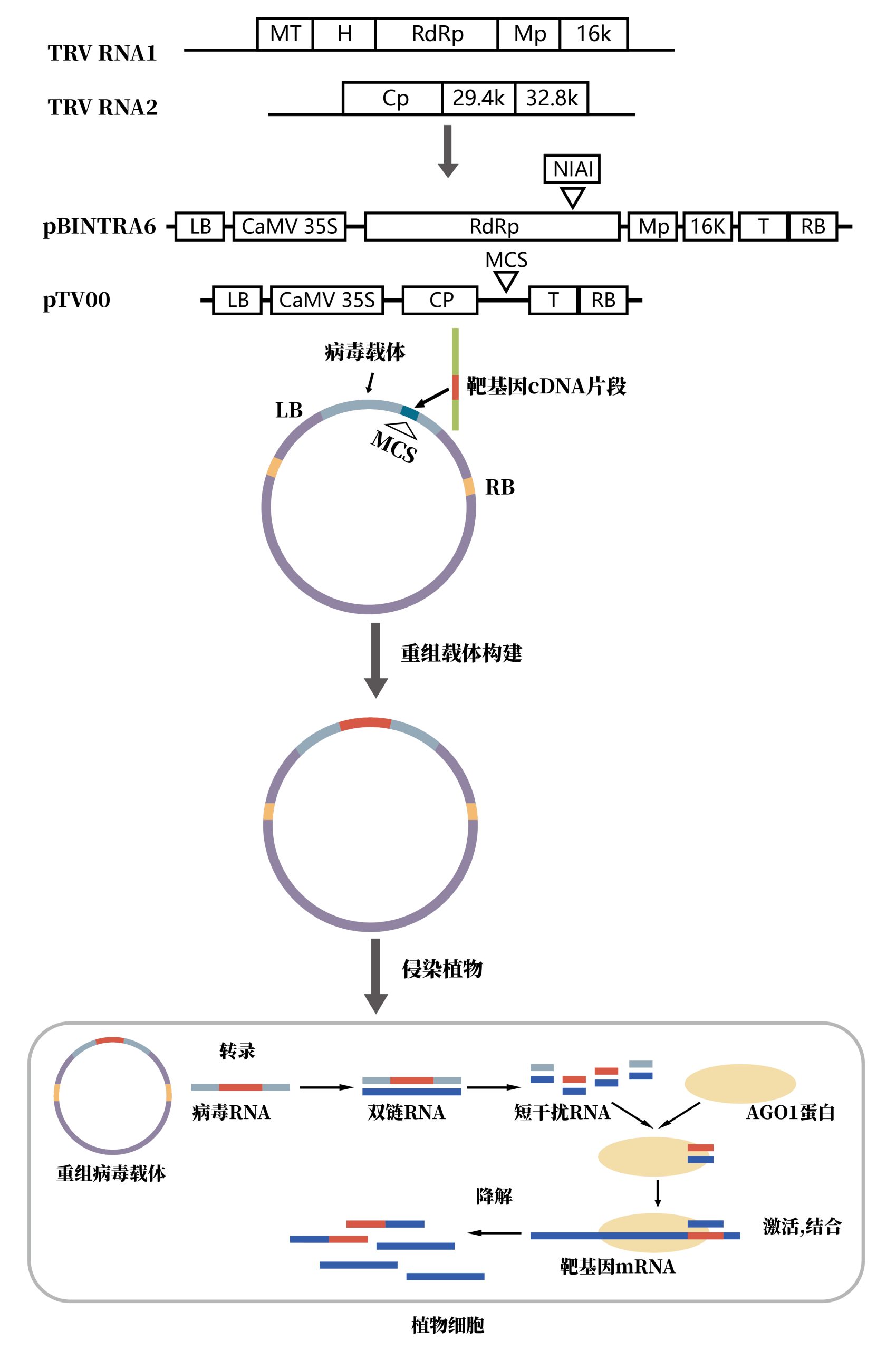
图2 TRV-VIGS的作用机制。
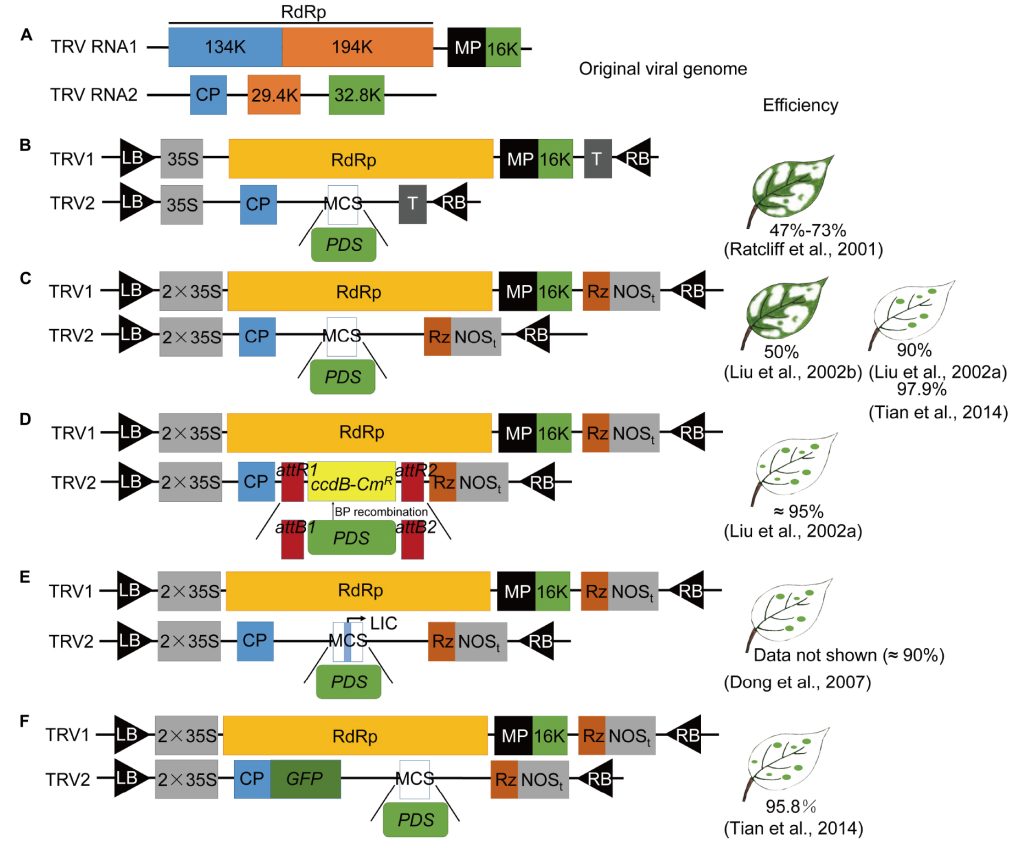
再后来,Liu等又将两个载体的启动子和终止子进行改良 (Liu et al. 2002a,b),启动子换为2*35S启动子,终止子换为NOS终止子(图3C),是目前最常使用的载体之一。
图3 TRV-VIGS载体的改良(Shi et al. 2021)。以八氢番茄红素脱氢酶(PDS)基因为例。(A)TRV RNA1和RNA2的基因组;(B)最初改造的TRV-VIGS载体(Ratcliff et al.2001),pBINTRA6(TRV1)和pTV00(TRV2),将RNA2序列中的29.4K和32.8K基因删除,替换为多克隆位点(MCS),用于目的基因片段的插入;(C)更改了(B)中两个裁体的启动子和终止子(Liu et al. 2002a,b),启动子换为2*35S启动子,终止子换为NOS终止子,Rz,自剪切型核酶;备注:此载体为目前常用载体之一;(D)将(C)中的载体改造为GATEWAY型载体(Liu et al. 2002a),将多克隆位点的两端加上重组位点;(E)TRV-LIC载体(Dong et al. 2007)在MCS中插入了一个包含接头和Pstl位点的序列,优化使用(D)载体进行载体构建的成本;(F)在(C)载体的基础上增加了报告基因GFP (Tian et al.2014)。
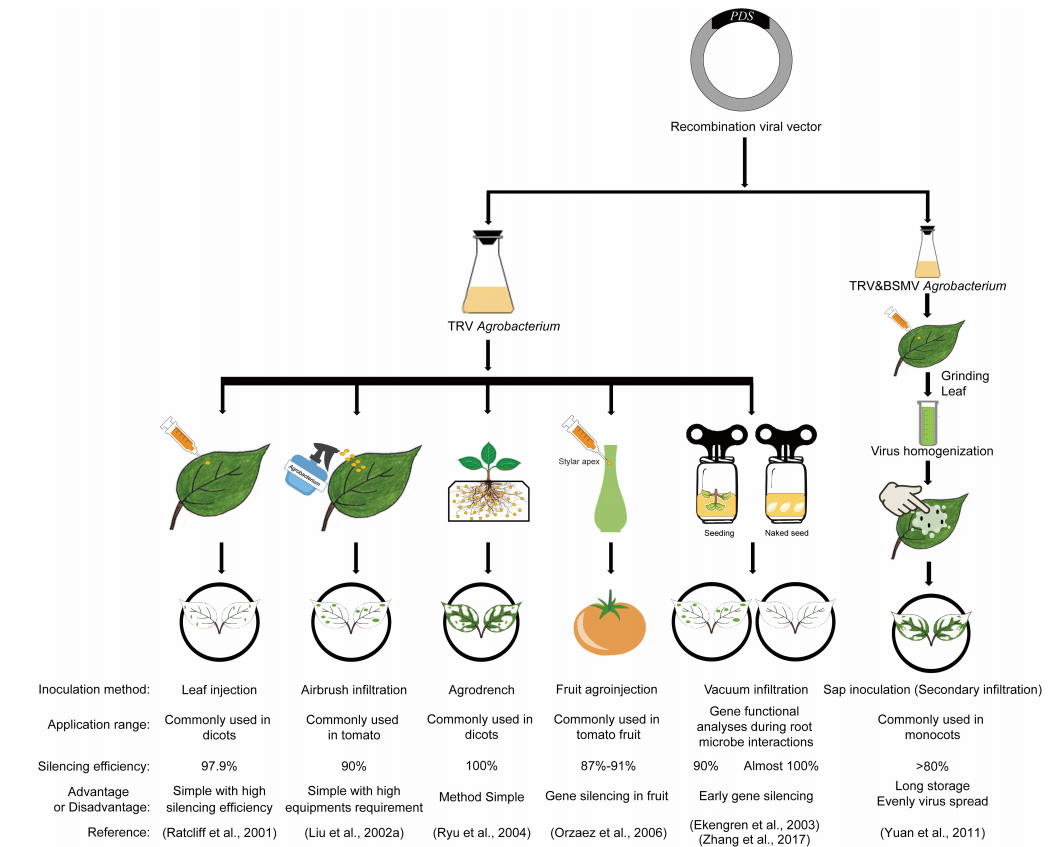
如何将构建好的携带目的基因部分cDNA序列的重组病毒载体递送到植物中进行基因沉默?最早,通常以体外转录的方式生产感染性病毒RNA,然后混合石英砂,使用摩擦接种法使植物叶片表面产生伤口以感染植物细胞 (Ruiz et al. 1998),这种方法操作困难且繁琐,而且效率较低。后来,科学家们又开发了许多其他递送方式,例如,叶片注射(注射器渗透)、农杆菌喷雾(喷枪渗透)、根吸收法、果实注射、真空渗透以及接种农杆菌培养物后用本氏烟叶片培养物进行二次接种(图4)。
图4 不同的VIGS接种方法示意图 (Shi et al. 2021)。以八氢番茄红素脱氢酶(PDS)基因为例。接种方法、应用范围、沉默效率、优缺点及相应的参考文献均包含在内。
2022年,北京林业大学戴思兰、黄河团队发表了题为“Functional analysis of the ScAG and ScAGL11 MADS-box transcription factors for anthocyanin biosynthesis and bicolour pattern formation in Senecio cruentus ray florets”的文章 (Qi et al. 2022),该团队以瓜叶菊Jester的纯色和双色品种为材料,研究MADS-box转录因子家族基因ScAG和ScAGL11在花青素合成途径和花斑形成过程中的作用。
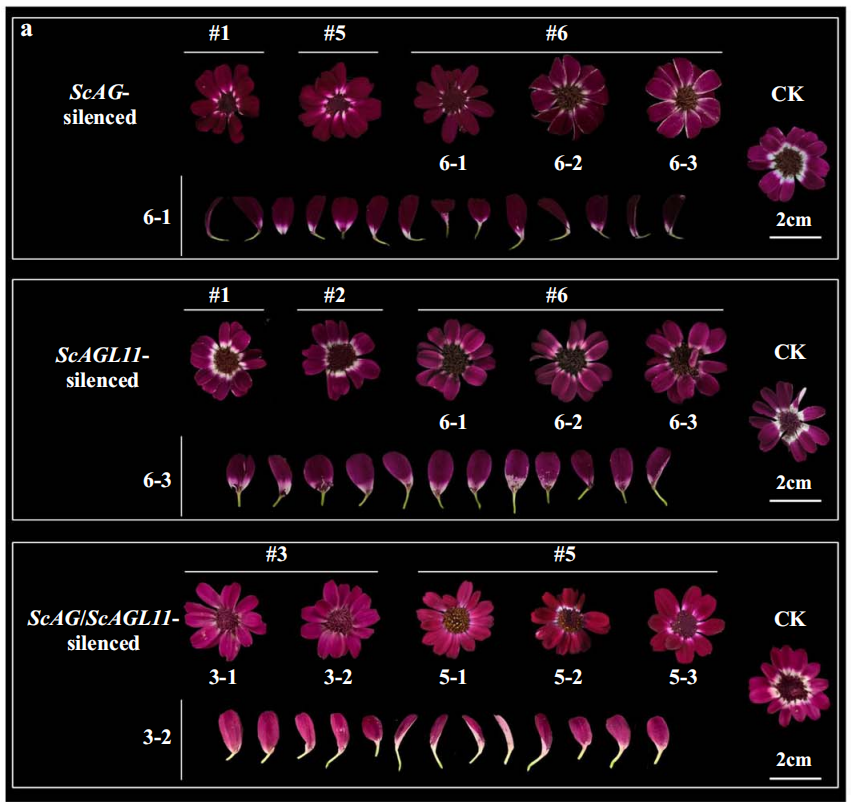
其中,利用VIGS技术在粉色花株系(JeP)的叶片中单独或共同沉默ScAG和ScAGL11基因,结果显示,与对照相比,沉默株系的叶片变紫,尤其是共同沉默ScAG和ScAGL11基因的株系中,表型改变更为明显(图5)。该VIGS实验确定了ScAG和ScAGL11基因在调节瓜叶菊花青素生物合成中的作用,即它们会抑制花青素的合成。
图5 在JeP叶片中利用VIGS技术沉默ScAG和ScAGL11基因 (Qi et al. 2022)。
在洋红白斑色花株系(JeCB)的花序中单独或共同沉默ScAG和ScAGL11后,白色区域面积出现不同程度的减少,并且在共同沉默ScAG和ScAGL11基因的株系中,表型改变更为明显(图6)。这说明ScAG和ScAGL11基因可抑制瓜叶菊双色图案的形成。
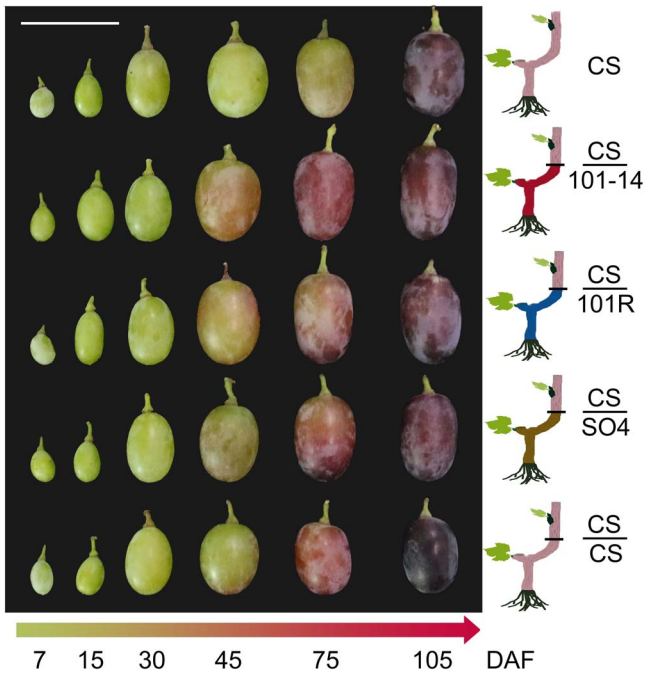
4.2.5嫁接
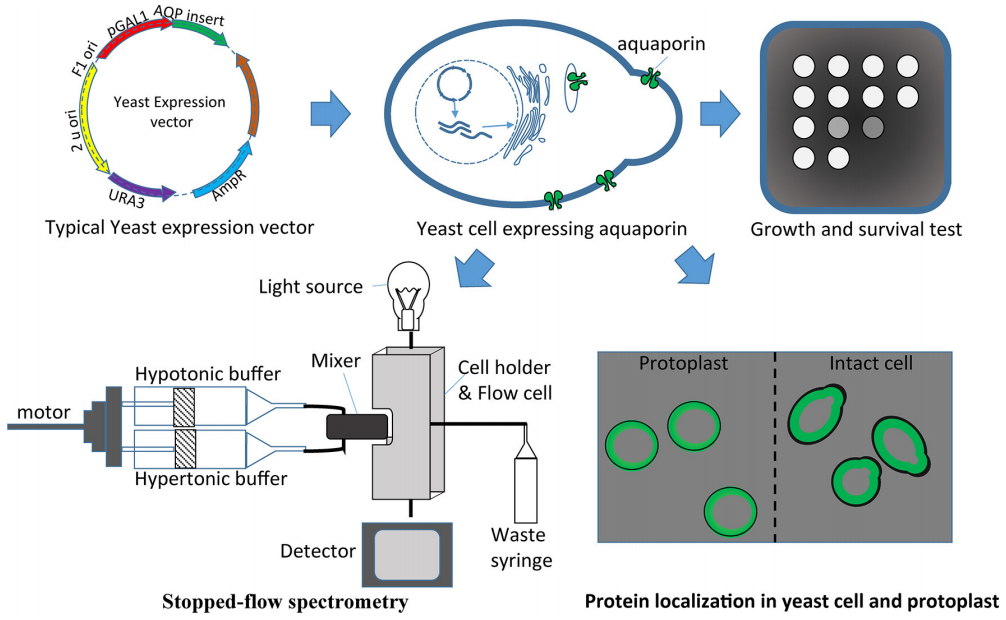
4.2.6酵母突变体株
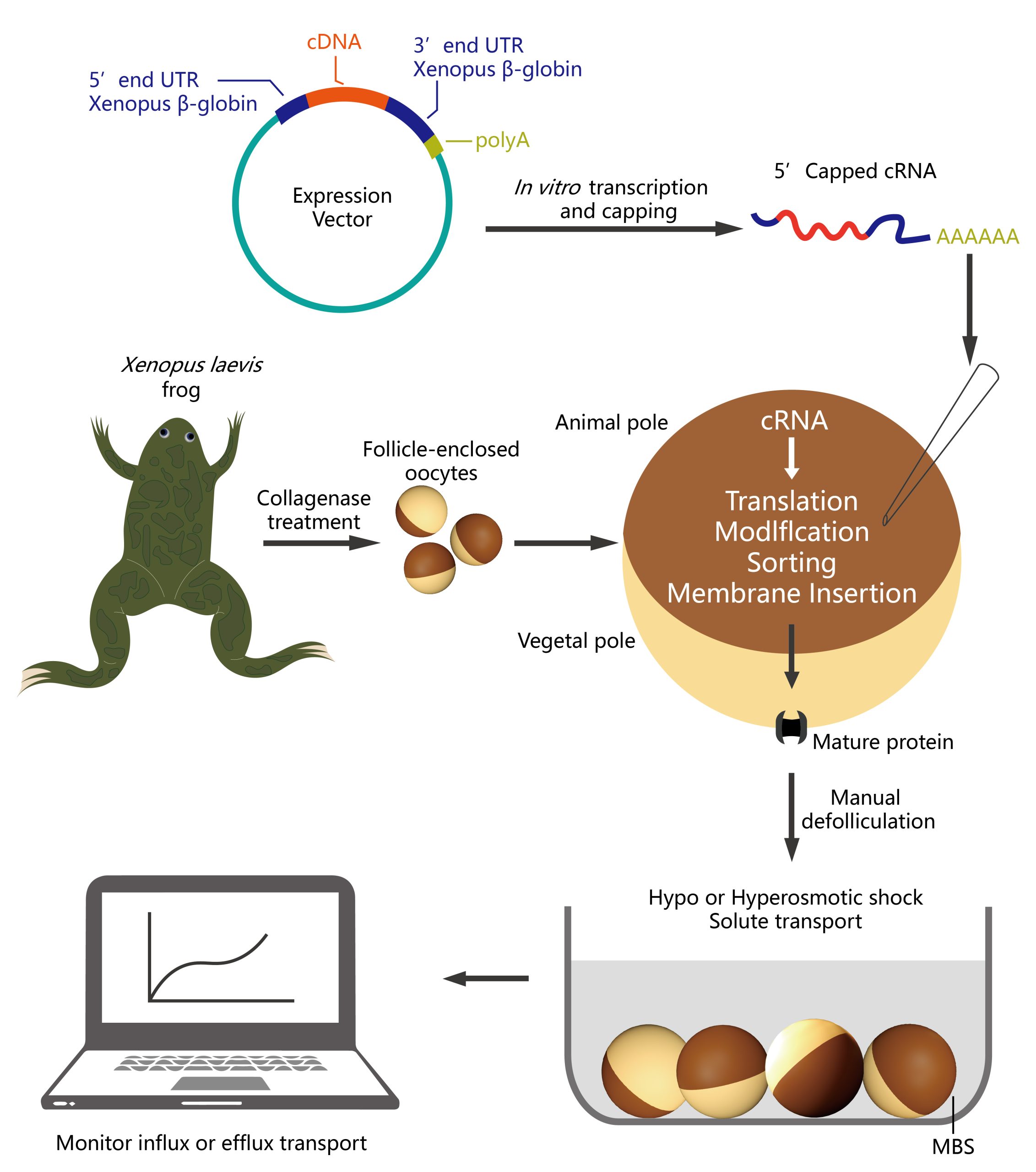
4.2.7爪蟾卵母细胞
4.2.8异源转化验证
研究方法还是比较多的,但具体选择哪种来进行实验还需结合不同的实验情况来设计。伯小远这次就写一个肯定不会出错的无转化体系的植物基因功能研究方法吧:
下面以两篇文献来举例。
2022年,华中农业大学产祝龙、王艳平、向林团队发表了题为“Jasmonic acid biosynthetic genes TgLOX4 and TgLOX5 are involved in daughter bulb development in tulip (Tulipa gesneriana)”的文章 (Sun et al. 2022),该团队以郁金香(Tulipa gesneriana)为材料,研究茉莉酸(JA)对其种球(鳞茎)发育的影响。
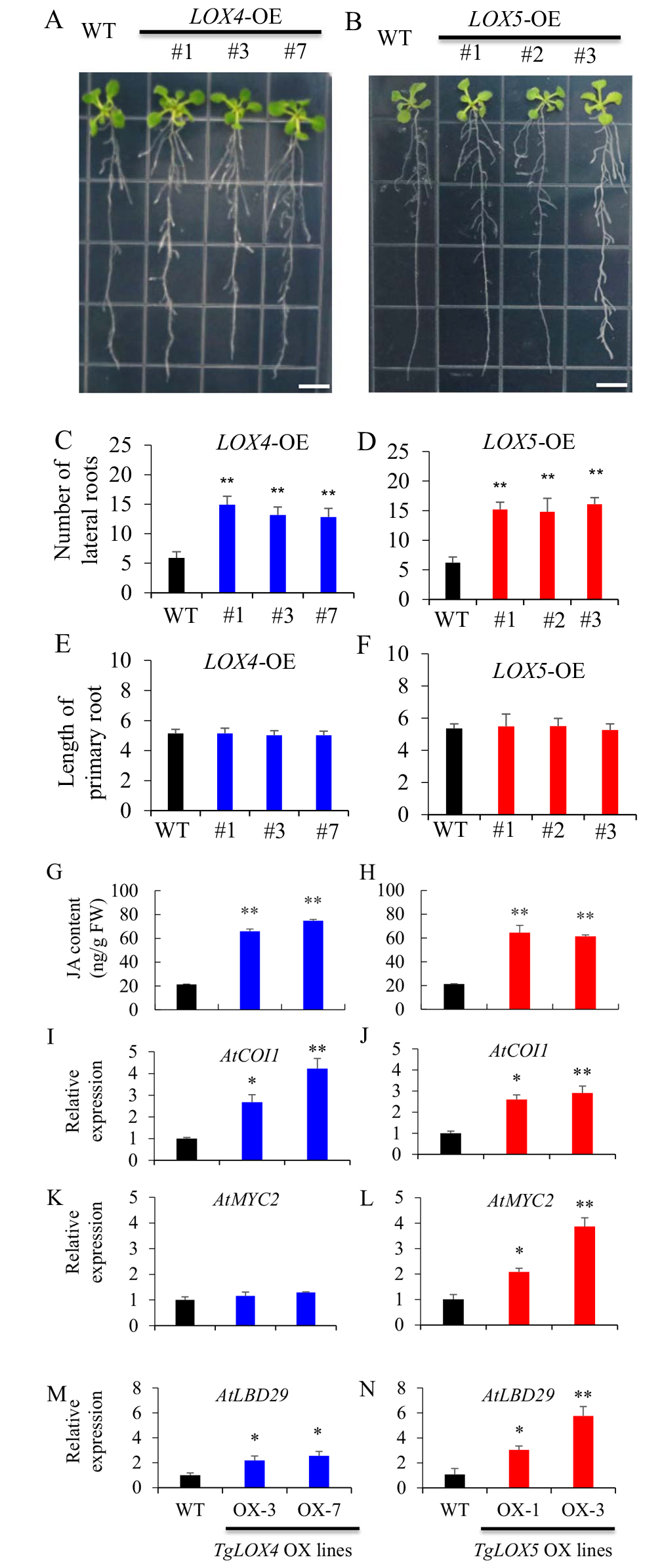
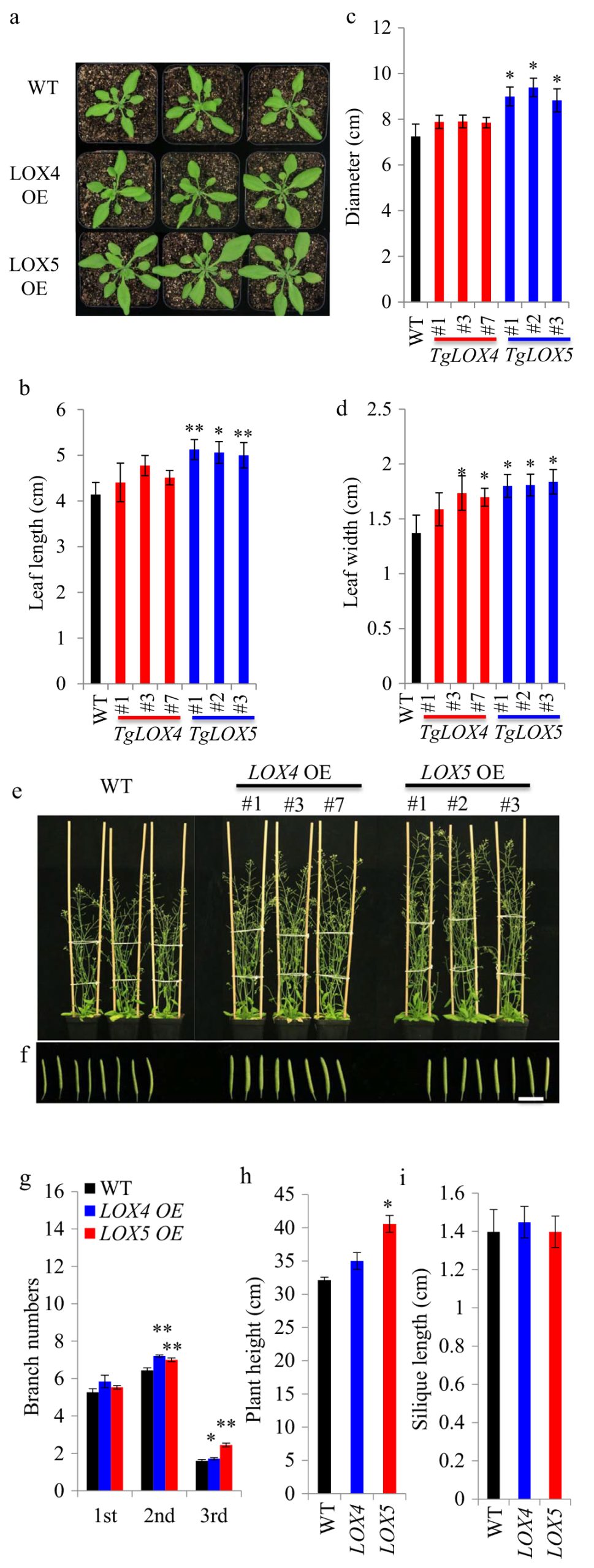
其中,为了研究郁金香TgLOX4和TgLOX5脂氧合酶基因的功能,将其与JA合成途径联系起来,作者团队将其异源过表达转化至拟南芥中,结果显示,拟南芥内源的JA含量增加,侧根数量增加,并促进了植株叶片生长、分枝。
图10 在拟南芥中过表达TgLOX4和TgLOX5基因,观察并检测萌发两周后对其根系生长和内源基因表达的影响 (Sun et al. 2022)。(A,B)35S::TgLOX4和35S::TgLOX5转基因拟南芥的表型变化;(C,D)35S::TgLOX4和35S::TgLOX5转基因拟南芥株系和野生型株系侧根数量的比较,结果显示,两种转基因株系的侧根数量显著增加;(E,F)初生根长度的比较,结果显示,无明显变化;(G,H)JA含量的比较,结果显示,两种转基因株系的JA含量显著升高;(I-M)检测过表达株系中与侧根发育有关的基因表达情况,结果显示,AtLBD13、AtLBD14、AtLBD16的表达量显著升高。以上结果显示,TgLOX4和TgLOX5基因的过表达使植株内JA含量显著升高,并激活了JA信号通路中与侧根发育相关基因的表达。
图11 在拟南芥中过表达TgLOX4和TgLOX5基因对植株地上部分的影响 (Sun et al. 2022)。(a)35S::TgLOX4和35S::TgLOX5转基因拟南芥种植3周的生长情况;(b-d)转基因拟南芥株系与野生型株系在种植3周后叶长、莲座直径、叶宽的比较,结果显示,35S::TgLOX4的叶长、莲座直径无显著变化,但其中两个株系的叶宽显著增加,35S::TgLOX5的叶长、莲座直径、叶宽均有显著增加;(e)35S::TgLOX4和35S::TgLOX5转基因拟南芥种植5周的生长情况;(f)种植5周的角果比较;(g-i)转基因拟南芥株系与野生型株系在种植5周后分枝数、株高、角果长度的变化,结果显示,两种转基因拟南芥株系具有显著更多的第二和第三分枝,35S::TgLOX5的植株高度显著更高,两种转基因拟南芥株系与野生型株系角果长度无显著差异。以上结果表明,TgLOX4和TgLOX5基因的过表达促进了拟南芥叶片的生长和分枝。
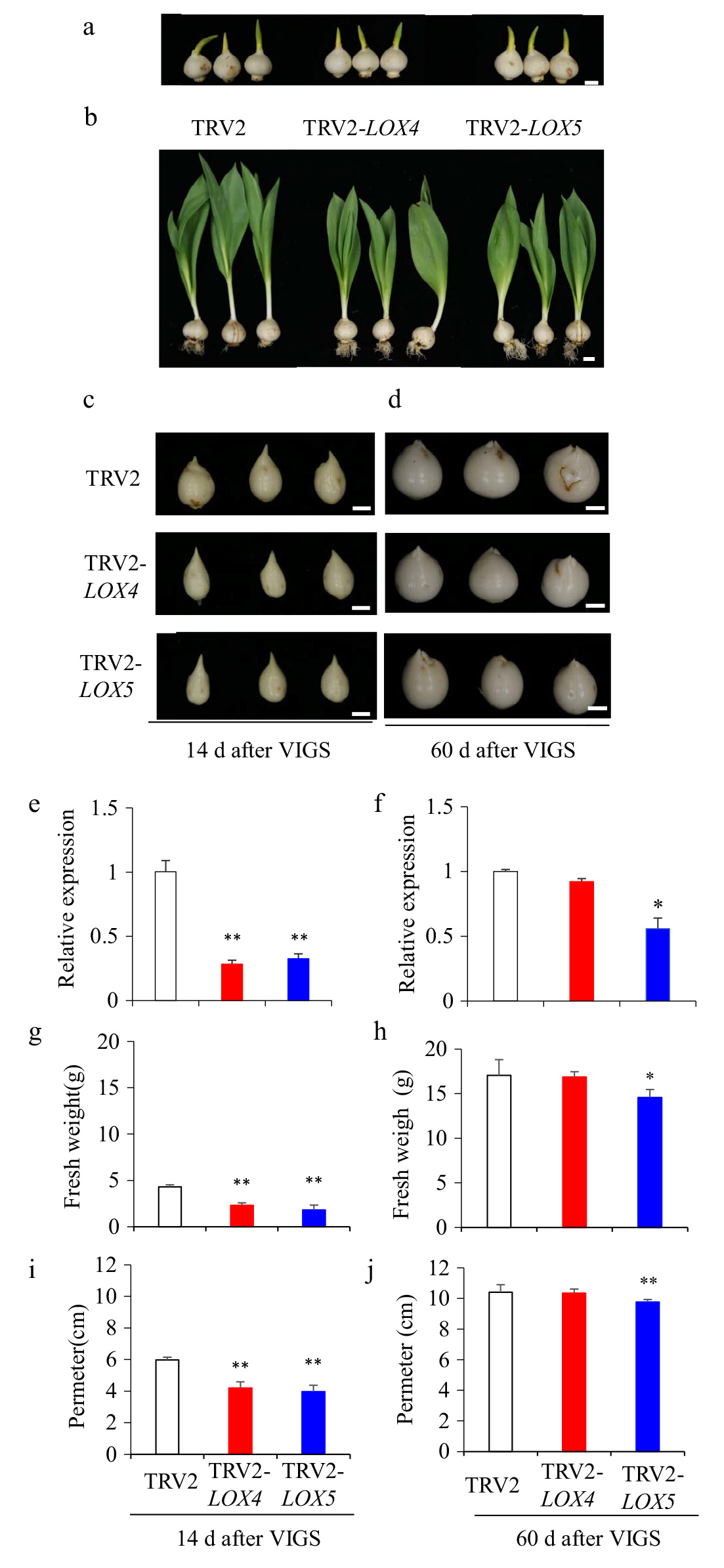
接着,作者团队在郁金香中利用VIGS技术沉默TgLOX4和TgLOX5基因,使用的是TRV2-TgLOX4和TRV2-TgLOX5载体,结果显示,这两个基因的沉默抑制了郁金香球茎的生长。
图12 利用VIGS技术沉默郁金香中的TgLOX4和TgLOX5基因 (Sun et al. 2022)。(a)用于VIGS实验的郁金香“Ad Rem”的球茎;(b)VIGS处理14天后的郁金香植株,TRV2-TgLOX4和TRV2-TgLOX5郁金香植株与空载对照TRV2郁金香植株相比,表现出较慢的生长;(c,d)VIGS处理14天、60天后的球茎;(e,f)VIGS处理14天、60天后TgLOX4和TgLOX5基因的表达情况,结果显示,处理14天后,TgLOX4和TgLOX5基因的表达分别下降72%和68%,处理60天后,TgLOX4和TgLOX5基因的表达分别下降8%和44%;(g-j)VIGS处理14天、60天后球茎的鲜重、周长,结果显示,TRV2-TgLOX4和TRV2-TgLOX5球茎的鲜重和周长在处理14天后显著低于对照,TRV2-TgLOX4球茎的鲜重和周长在处理60天后无显著差异,但TRV2-TgLOX5球茎的鲜重和周长在处理60天后显著低于对照。以上结果表明,TgLOX4和TgLOX5基因的沉默会抑制郁金香球茎的生长。
2022年,安徽农业大学王云生、夏涛团队发表了题为“Functional analysis of the dihydroflavonol 4-reductase family of Camellia sinensis: exploiting key amino acids to reconstruct reduction activity”的文章 (Ruan et al. 2022),该团队以茶树(Camellia sinensis)为材料,研究二氢黄酮醇4-还原酶(CsDFRs)基因在类黄酮代谢途径中的作用。
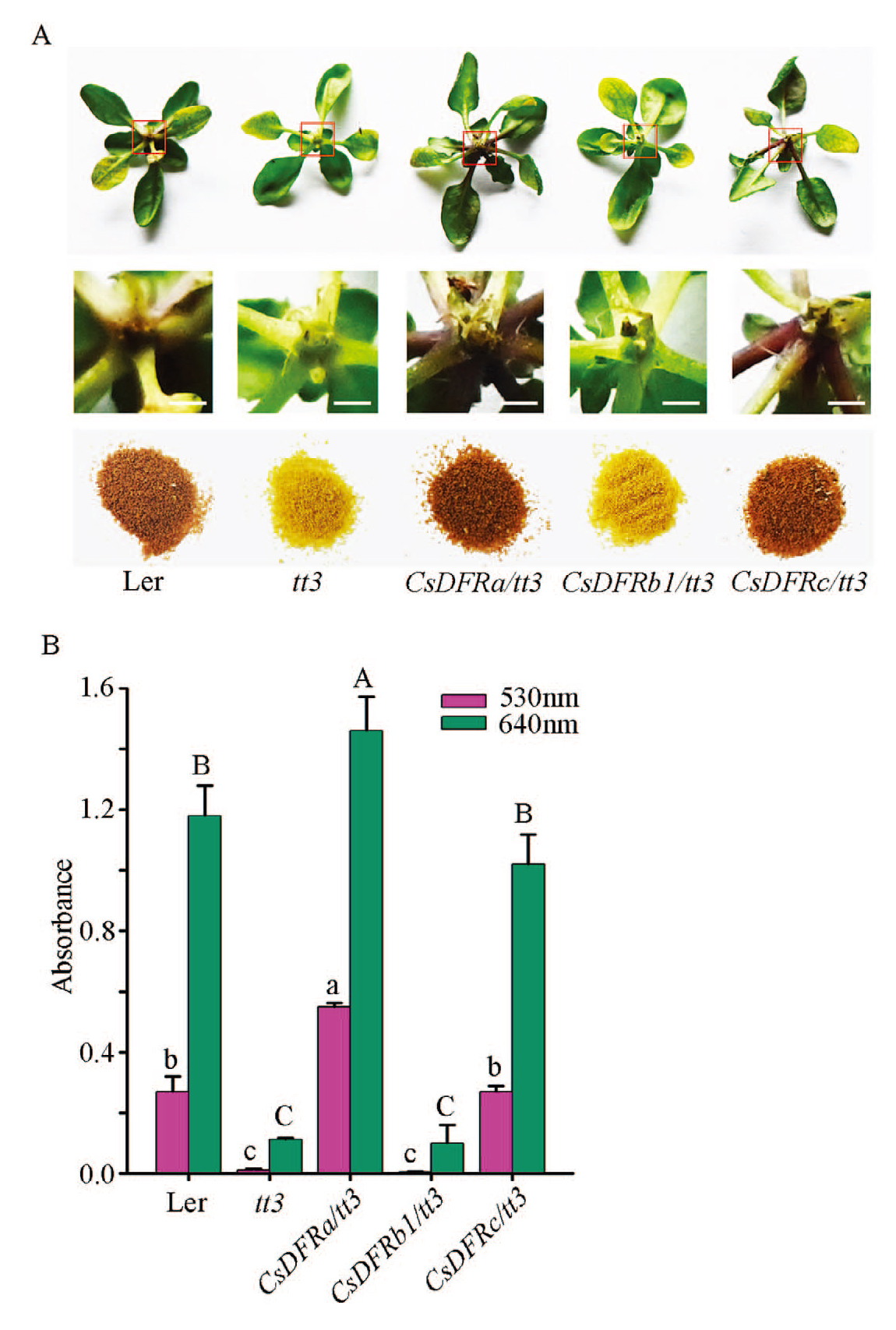
作者团队首先克隆了CsDFRs基因,基于转录组和代谢组分析,CsDFRs的表达与花青素和原花青素积累密切相关。体外酶活实验证明CsDFRa和CsDFRc具有DFR的还原酶活性,而CsDFRb1几乎没有还原酶活性,如何在体内实验中证明其功能呢?
拟南芥AtDFR突变体tt3表现出花青素合成不足,并且缺乏种皮色素。作者团队利用拟南芥tt3突变体作为受体材料,将茶树基因CsDFRa、CsDFRb1、CsDFRc回补至tt3中。结果显示,过表达CsDFRa和CsDFRc不仅恢复了植株紫色叶柄的表型,而且也恢复了种皮的颜色,而过表达CsDFRb1无此表型,该结果直接证实了CsDFRs参与了花青素和原花青素的生物合成。
4.2.9蛋白实验

Liu, Y., Schiff, M., & Dinesh-Kumar, S. P. (2002a). Virus-induced gene silencing in tomato. The Plant journal : for cell and molecular biology, 31(6), 777–786. https://doi.org/10.1046/j.1365-313x.2002.01394.x
Liu, Y., Schiff, M., Marathe, R., & Dinesh-Kumar, S. P. (2002b). Tobacco Rar1, EDS1 and NPR1/NIM1 like genes are required for N-mediated resistance to tobacco mosaic virus. The Plant journal : for cell and molecular biology, 30(4), 415–429. https://doi.org/10.1046/j.1365-313x.2002.01297.x
Qi, F., Liu, Y., Luo, Y., Cui, Y., Lu, C., Li, H., Huang, H., & Dai, S. (2022). Functional analysis of the ScAG and ScAGL11 MADS-box transcription factors for anthocyanin biosynthesis and bicolour pattern formation in Senecio cruentus ray florets. Horticulture research, 9, uhac071. https://doi.org/10.1093/hr/uhac071
Ratcliff, F. G., MacFarlane, S. A., & Baulcombe, D. C. (1999). Gene silencing without DNA. rna-mediated cross-protection between viruses. The Plant cell, 11(7), 1207–1216. https://doi.org/10.1105/tpc.11.7.1207
Ruan, H., Shi, X., Gao, L., Rashid, A., Li, Y., Lei, T., Dai, X., Xia, T., & Wang, Y. (2022). Functional analysis of the dihydroflavonol 4-reductase family of Camellia sinensis: exploiting key amino acids to reconstruct reduction activity. Horticulture research, 9, uhac098. https://doi.org/10.1093/hr/uhac098
Ruiz, M. T., Voinnet, O., & Baulcombe, D. C. (1998). Initiation and maintenance of virus-induced gene silencing. The Plant cell, 10(6), 937–946. https://doi.org/10.1105/tpc.10.6.937
Shi, G., Hao, M., Tian, B., Cao, G., Wei, F., & Xie, Z. (2021). A Methodological Advance of Tobacco Rattle Virus-Induced Gene Silencing for Functional Genomics in Plants. Frontiers in plant science, 12, 671091. https://doi.org/10.3389/fpls.2021.671091
Sun, Q., Zhang, B., Yang, C., Wang, W., Xiang, L., Wang, Y., & Chan, Z. (2022). Jasmonic acid biosynthetic genes TgLOX4 and TgLOX5 are involved in daughter bulb development in tulip (Tulipa gesneriana). Horticulture research, 9, uhac006. Advance online publication. https://doi.org/10.1093/hr/uhac006
Tian, J., Pei, H., Zhang, S., Chen, J., Chen, W., Yang, R., Meng, Y., You, J., Gao, J., & Ma, N. (2014). TRV-GFP: a modified Tobacco rattle virus vector for efficient and visualizable analysis of gene function. Journal of experimental botany, 65(1), 311–322. https://doi.org/10.1093/jxb/ert381
Zhong, H., Liu, Z., Zhang, F., Zhou, X., Sun, X., Li, Y., Liu, W., Xiao, H., Wang, N., Lu, H., Pan, M., Wu, X., & Zhou, Y. (2022). Metabolomic and transcriptomic analyses reveal the effects of self- and hetero-grafting on anthocyanin biosynthesis in grapevine. Horticulture research, 9, uhac103. https://doi.org/10.1093/hr/uhac103
官网链接:plant.biorun.com